
- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
3.2 Формирование больших периодов
Четвёртый период – первый большой период (18 элементов)
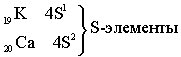

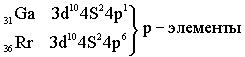
Пятый период. Длина и строение пятого периода в точности повторяет длину и строение четвёртого периода.
Шестой период.
55Cs |
6S1 |
56Ba |
6S2 |
57La |
5d16S2 |
Лантан принимает первый электрон на подуровень 5d, затем, в соответствии со вторым законом Клечковского, заполнение электронами подуровня 5d приостанавливается, и начинает заполнятся электронами подуровень 4f.
58Сe |
4S1 5S2 5p6 5d1 6S2 |
|
71Lu |
4f14 5S2 5p6 5d1 6S2 |
|
72Hf |
5d2 6S2 |
После заполнения электронами подуровня 4f продолжается заполнение подуровня 5d, снова появляются d-элементы. |
80Hg |
5d10 6S2 |
Заканчивается период шестью p-элементами. Таким образом, 6-й период имеет следующее строение:
S – элементы – 2 d – элементы – 1 f – элементы – 14 d – элементы – 9 p – элементы – 6 / Всего 32 элемента.
Седьмой период в точности повторяет длину и строение шестого периода. Все трансурановые элементы, начиная с 93Np, являются искусственными.
В больших периодах характер изменения свойств элементов тот же, что и в малых, только замедленный.
Все S – элементы, кроме Н и Не, - самые активные металлы. Все d и f – элементы тоже металлы. р – элементы частично металлы, частично неметаллы.
3.3 Группы таблицы Менделеева
Таблица Д.И. Менделеева состоит из 8 групп. Физический смысл номера группы заключается в том, что номер группы соответствует валентности входящих в него элементов.
Если элемент обладает переменной валентностью, то номер группы соответствует наивысшей валентности данного элемента.
Каждая группа делится на главную (А) и побочную (В) подгруппу. Главная подгруппа содержит элементы и малых, и больших периодов (S и p - элементы). Побочные подгруппы включают в себя d и f – элементы, т.е. элементы только больших периодов.
Элементы, составляющие одну подгруппу, имеют близкие химические свойства, т.к. имеют сходные валентные окончания. Химические свойства элементов обуславливаются их валентными окончаниями.
Валентное окончание элемента зависит от его положения в таблице Менделеева.
Все элементы одной подгруппы имеют одинаковую конфигурацию валентных окончаний, но разные квантовые числа.
С увеличением главного квантового числа у элементов данной подгруппы усиливаются металлические свойства, что обусловлено, в первую очередь, увеличением промежуточных электронных слоёв между ядром атома и его валентным слоем.
Элементы, составляющие одну группу, но разные подгруппы, имеют различные валентные окончания и различные химические свойства.
17Cl |
3S23p5 |
25Mn |
3d54S1 |
активный неметалл |
металл средней активности |
||
Элементы, составляющие одну группу, имеют одинаковую валентность. В случае переменности валентности общей является наивысшая валентность.
1, 3, 5, 7 |
2, 3, 4, 5,6, 7 |
+7 |
+7 |
HClO4 |
HMnO4 |
хлорная кислота |
марганцовая кислота |
Следующие свойства элементов являются периодическими:
металличность и связанная с ней восстановительная способность;
энергия ионизации;
неметалличность и связанная с ней окислительная способность;
сродство к электрону;
электроотрицательность;
атомные радиусы.
Свойства, не имеющие периодичности :
заряд ядра;
атомная масса.
Периодический характер изменения имеют не только элементы, но и их соединения. Оксиды элементов, расположенных в начале периодов ( Li2O; Na2O; MgO), имеют основный характер. Затем идут амфотерные оксиды (BeO, Al2O3). Элементы, расположенные во второй половине, имеют кислотный характер (CO2, NO2, SiO2).
