- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
2. Строение атомов
2.1 Электронная оболочка атома
Особенность микрочастиц
1. Микрочастицы изучают и поглощают энергию дискретно.
2. Любая микрочастица одновременно является и частицей, и волной.
Микрочастицы обладают массой и энергией, что является свойствами частиц, а при движении микрочастицы подчиняются волновым законам.
В 1924г. Де Бройль вывел уравнение:
![]()
- уравнение, связывающее массу микрочастицы с длиной волны.
3. Третья особенность микрочастиц - так называемый принцип неопределённости.
Этот принцип заключается в том, что невозможно точно указать координаты микрочастицы в пространстве и её скорость.
2.2 Система квантовых чисел
Первый постулат Н. Бора
В атоме водорода существуют стационарные орбиты, вращаясь по которым электрон не излучает и не поглощает энергию.
Н. Бор рассчитал радиусы стационарных орбит с помощью главного квантового числа.
n – главное квантовое число, n = 1,2,3,4,...+ ∞.
Второй постулат Н. Бора
Вращаясь по стационарным орбитам, электроны обладают определённым запасом потенциальной энергии
n1 = 1 |
r2 = 0,53 А0 |
Е = -13,6. 1/n2 эВ, |
n1 = 2 |
r2 = 2,12 А0 |
где n-главное квантовое число. |
|
|
по мере удаления от ядра потенциальная энергия электронов возрастает. |
Стационарные орбиты называются энергетическими уровнями.
Со временем на основании принципа неопределённости отказались от понятия плоских орбит, предложенных Бором, и перешли к понятию электронного облака, или орбитали.
Орбиталь (электронное облако) – это наиболее вероятное местонахождение электрона в каком-то объёме околоядерного пространства. За пределами этого пространства вероятность встретить электрон достаточно мала (менее 5%).
Радиусы орбиталей имеют значения, рассчитанные Бором для стационарных орбит.
Главное квантовое число имеет две функции:
определяет размер электронного облака;
определяет его энергетический запас.
Следующее квантовое число – орбитальное. Орбитальное число отвечает значению орбитального момента количества движения электрона.
l – орбитальное квантовое число. Оно тесно связано с главным и принимает значения 0…(n-1).
n |
l |
1 |
0(S) |
2 |
0(S) 1(p) |
3 |
0(S) 1(p) 2(d) |
4 |
0(S) 1(p) 2(d)3(f) |
Орбитальное квантовое число характеризует энергетические подуровни в электронной оболочке атома.
Орбитальное квантовое число определяет конфигурацию подуровней. Согласно квантовомеханическим расчётам
S-орбитали имеют форму шара,
p-орбитали - форму гантели,
d- и f-орбитали - более сложные формы.
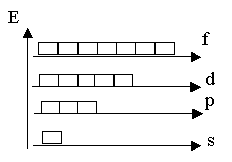
На одном уровне энергия подуровней возрастает в ряду:
ES < E p< Ed< Ef.
В атоме возникают магнитные поля, которые ориентируют подуровни в пространстве строго определённым образом.
Магнитное квантовое число принимает значение целых чисел: -l...0...+l.
l |
mI |
|
|
значение |
количество |
0(S) |
0 |
1 |
1(p) |
-1...+1 |
3 |
2(d) |
-2, …+2 |
5 |
3(f) |
-3, …+3 |
7 |
|
|
s – подуровень выражен единожды; p - подуровень выражен троекратно; d - подуровень выражен пятикратно; f - подуровень выражен семикратно. |
Для описания орбиталей используются три квантовых числа n, l , ml. Четвёртое квантовое число - спиновое - описывает собственный момент количества движения электрона и принимает значения:
S = ± 1/2.
Электроны могут вращаться только в двух взаимопротивоположных направлениях, условно обозначаемых
![]() .
.