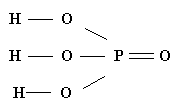- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
1.3. Основные понятия и законы химии
Способность атома присоединять или замещать определенное число других атомов называют валентностью. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭHn, ЭOm), при условии, что водород одно- , а кислород двухвалентен.
Элемент – определенный вид атомов, обладающих определёнными зарядами ядер.
Степень окисления – условный заряд атома элемента, полученный в предположении, что соединение состоит из ионов. Она может быть положительной, отрицательной, нулевой, дробной и обозначается арабской цифрой со знаком «+» или «–» в виде верхнего правого индекса символа элемента: Cl–, Cl7+, O2–, H+, Mg2+, N3–, N5+, Cr6+.
Для определения степени окисления (с. о.) элемента в соединении (ионе) пользуются следующими правилами:
В простых веществах (H2, S8, P4) с. о. равна нулю.
Постоянную с. о. имеют щелочные (Э+) и щелочно-земельные (Э2+) элементы, а также фтор F–.
Водород в большинстве соединений имеет с. о. H+ (H2O, CH4, HCl), в гидридах – H– (NaH, CaH2); с. о. кислорода, как правило, равна –2 (O2–), в пероксидах (–O–O–) – –1 (O–).
В бинарных соединениях неметаллов отрицательная с. о. приписывается элементу, расположенному справа).
Алгебраическая сумма с. о. молекулы равна нулю, иона – его заряду.
Радикалы – частицы, образующиеся при разрыве химической связи, и (или) содержащие нескомпенсированную валентность:
![]()
Электроотрицательность (ЭО) – способность атома оттягивать на себя электрон в химическом соединении.
Эмпирическая формула составляется из атомных символов элементов, записываемых в определенном порядке друг за другом.
Молекулярная формула соответствует истинному молекулярному составу соединения: S2Cl2, C6H6, а не SCl, CH. При изменении состава молекулы в зависимости от температуры берут самую простую формулу: S, P, NO2 вместо S8, P4, N2O4.
В структурной формуле указываются последовательность соединения атомов в молекуле (плоская структурная формула) и пространственное расположение атомов в соединении (проекционная структурная формула).
Химические свойства вещества характеризуют их способность участвовать в химических реакциях, т.е. превращениях одних веществ в другие. Для понимания этих свойств необходимо знать не только состав, но и строение веществ.
Например:
|
|
|
||
Н3РО4 |
|
|||
|
|
|||
|
|
|
||
NaHСО3 |
|
|||
|
|
|||
Количество вещества – число структур единиц молекул, атомов. ионов и т. д. в системе. Единицей количества вещества является моль.
Моль –количество вещества, содержащее столько же частиц или структурных единиц (атомов, ионов, молекул, радикалов, электронов, эквивалентов и др.), что и в 12 а. е. м. изотопа углерода-12. Количество структурных единиц равно 6,022•1023 (число Авогадро).
Рисунок 1.3.
Важнейшие классы неорганических соединений.
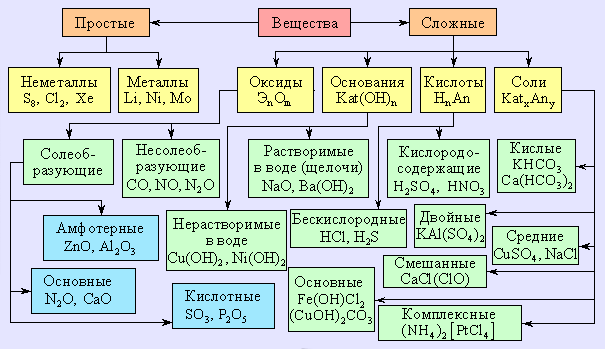
Катион в формулах солей всегда ставится на первое место: MgCl2, KMnO4, (NH4)2CO3.
Если соль содержит более одного катиона или более одного аниона, то в формуле они записываются в алфавитном порядке их символов: KCr(SO4)2, PtBr2Cl2.
Кислоты рассматриваются как соли протона H+: HCl, H2SO4, H3PO4.
Основания – соединения, у которых анионом служит гидроксил-ион OH–: KOH, Al(OH)3.
Основные количественные законы химии
1) Закон постоянства состава. Химически чистые вещества имеют один и тот же количественный состав независимо от того, каким способом они получены.
2) Закон кратных отношений. Если два элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
Например, массовые соотношения С:О в CO и CO2 равны 12:16 и 12:32. Следовательно, массовые соотношения углерода, связанные с постоянной массой кислорода в CO2 и CO, равно 2:1.
3) Закон эквивалентов. Все вещества реагируют между собой в эквивалентных количествах.
Понятие эквивалента:

Точно также химическим эквивалентом сложного соединения называют такое его количество, которое взаимодействует без остатка с 1 эквивалентом водорода.
Выражая концентрацию раствора через молярную концентрацию эквивалента (в нормалях), необходимо правильно вычислять эквивалент, так как он может быть различным у одного и того же вещества в зависимости от реакции, в которую оно вступает.
Так,
чтобы найти
эквивалент азотной кислоты в реакции
ее со щелочью
нужно молекулярный вес разделить на
единицу:
![]() (так
как реакция сводится только к
взаимодействию
одного однозарядного иона водорода с
ионом гидроксила).
(так
как реакция сводится только к
взаимодействию
одного однозарядного иона водорода с
ионом гидроксила).
Если
же азотная кислота действует как
окислитель,
восстанавливаясь до окиси азота, то
азот в ней из валентного
состояния 5+ переходит в валентное
состояние 2+
за счет присоединения трех электронов.
В этом случае эквивалент азотной кислоты
будет равен одной трети молекулярного
веса:
![]() .
.
Если азотная кислота в какой-то реакции восстанавливается до аммиака (в котором азот имеет валентность 3-), то эквивалент HNO3 будет равен молекулярному весу, деленному на 8.
Обычно эквивалент H2S04 принимают равным половине ее молекулярного веса, т. е. 49,04, так как серная кислота двухосновная. Но это справедливо только для химических реакций, в которых оба ее однозарядных иона водорода вступают во взаимодействие, например в реакции полной нейтрализации:
H2S04 + 2КОН = K2S04 + 2Н20
В реакции
H2S04 + КОН = KHS04 + Н20
у серной кислоты замещается только один ион водорода, и М(1/z) H2SO4 будет равен молекулярному весу кислоты, т. е. 98,08. И если мы для второй реакции приготовим, например, 10 н. раствор, содержащий 980,8 г кислоты в 1 л раствора, то этот же самый раствор в случае применения его для первой реакции будет являться уже 20 н.
Т аким
образом, нельзя говорить об эквиваленте
вещества
и нормальности раствора или молярной
концентрации эквивалента вообще, а
можно говорить об этом только
применительно к конкретной химической
реакции. Итак:
аким
образом, нельзя говорить об эквиваленте
вещества
и нормальности раствора или молярной
концентрации эквивалента вообще, а
можно говорить об этом только
применительно к конкретной химической
реакции. Итак:
Пример:
Н3РО4 + NaOH → Na Н2РО4 + Н2О М(1/z) (Н3РО4) = М/1;
(одноосновная кислота),
Н3РО4 + 2NaOH → Na2 НРО4 + 2Н2О М(1/z) (Н3РО4) = М/2;
(двухосновная кислота),
Н3РО4 + 3NaOH → Na3РО4 + 3Н2О М(1/z) (Н3РО4) = М/3
(трехосновная кислота),

Пример:
Са(ОН)2 + 2НСI → СаСI 2+ 2Н2О М (1/z) (Са(ОН)2 = М/2
Са(ОН)2 + НСI → Са(ОН)СI + Н2О М (1/z) (Са(ОН)2 = М/1

Пример: М(1/z) (Al2(SO4)3 = М/6;

Пример:
2FeCI3 + 2KI I2 + 2FeCI2 + 2KCI
Fe3+ + e- Fe2+
М(1/z) (FeCI3) = M/1