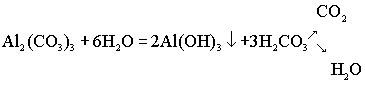- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
Количественные характеристики гидролиза
Количественно гидролиз солей может быть охарактеризован степенью гидролиза и константой гидролиза.
h - степень гидролиза показывает, какая часть соли прогидролизовалась, то - есть превратилась в свои составляющие. Измеряется в процентах или долях единицы.
Степень гидролиза не является константой.
|
Изменяется с температурой, зависит от концентрации солевого раствора. |
KГ - константа гидролиза - константа равновесия обратимой реакции.
|
Зависит от температуры, но не зависит от концентрации раствора. |
Рассмотрим соль гипохлорит натрия, образованную сильным основанием и слабой кислотой:
 .
.
Константа равновесия данной обратимой реакции равна:
 .
.
Поскольку вода - очень слабый электролит, её равновесную концентрацию можно считать константой:
Kp*[H2O]p=KГ.
В результате перемножения двух констант получается новая константа -
константа гидролиза соли.
 .
.
Константа гидролиза соли, образованной сильным гидроксидом и слабой кислотой, равна ионному произведению воды, деленному на Kg слабой кислоты.
KГ соли, образованной слабым годроксидом и сильной кислотой, равна ионному произведению воды, делённому на константу диссоциации гидроксида.

Константа гидролиза соли, образованной слабым основанием и слабой кислотой, равняется константе воды, делённой на произведение константы диссоциации основания на константу диссоциации кислоты.
Рассмотрим связь двух количественных характеристик - степени и константы гидролиза - между собой.
 .
.
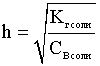 .
.
Для данной реакции:
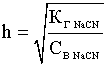 .
.
Ступенчатый гидролиз соли
Ступенчатому гидролизу подвергаются соли, образованные:
многоосновной слабой кислотой,
многоосновным слабым гидроксидом,
тем и другим одновременно.
Вариант1
Na2CO3
I ступень

По первой ступени гидролиза образуется кислая соль.
II ступень

По второй ступени образуется слабая кислота.
Рассмотрим взаимосвязь первой и второй константы диссоциации слабой кислоты с первой и второй константой гидролиза рассмотренной соли.
I ступень
![]()
II ступень
![]()
I ступень гидролиза
![]()
II ступень гидролиза
![]()
Из приведённых уравнений диссоциации слабой кислоты и гидролиза соли видно, что первая константа диссоциации связана со второй константой гидролиза соли, и наоборот.
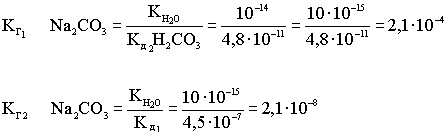
Вывод
По I ступени соли гидролизуются гораздо глубже, чем по второй ступени.
Кг по II ступени становится заметным при повышении температуры.
Кг1 > Кг2 > Кг3
Вариант2
MgCl2
I ступень
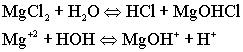
По первой ступени гидролиза образуется основная соль.
II ступень

По второй ступени гидролиза образуется слабый гидроксид.
Все остальные закономерности те же самые.
Случай полного, необратимого гидролиза солей
Соль гидролизуется полностью и необратимо при выполнении следующих условий:
Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
Рассмотрим реакцию взаимодействия двух солей, в результате которой образуется соль, отвечающая приведённым выше условиям.
![]() .
.