
- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
Гидролиз солей Определения
Слово "гидролиз" буквально означает "разложение водой".
Гидролиз солей - взаимодействие ионов солей с водой.
Ионное произведение воды Водородный показатель
Вода - самый слабый из существующих электролитов. Из 107 молекул воды диссоциирует на ионы только 1 молекула.
![]() .
.
Напишем выражение для константы диссоциации воды
 .
.
Принимая равновесную концентрацию воды константой, получаем:
![]() -
ионное
произведение воды
(новая константа ).
-
ионное
произведение воды
(новая константа ).
Отсюда получаем:
![]() .
.
При
комнатной температуре
![]() .
.
 .
.
В воде, т.е. в нейтральной среде, концентрация ионов водорода равна концентрации ионов гидроксида и равна 10-7 моль/дм3.
Физический смысл ионного произведения воды заключается в том, что оно справедливо не только для чистой воды, но и для растворов кислот, гидроксидов, солей.
![]() -
нейтрльная среда
-
нейтрльная среда
В H2O ввели кислоту, то есть Н+ [H+]>[OH- ]
 -
кислая
среда
-
кислая
среда

Если добавить к воде гидроксид, т.е. OH-, то [H+]<[OH- ].
 -щелочная
среда.
-щелочная
среда.
Чтобы избавится от отрицательной степени, для характеристики среды введено понятие водородный показатель PH.
PH = -lg[H+]
PH < 7- Кислая среда PH =7 - Нейтральная среда PH >7 - Щелочная среда |
|
Характер среды, то есть PH среды, определяют различными методами.
Самое точное определение с помощью PH - метра.
Наиболее простые методы измерения РН с помощью индикаторов.
У жидких индикаторов есть свои интервалы измерения РН. Наиболее универсальным из индикаторов является лакмус.
Три случая гидролиза солей
Чтобы написать реакцию гидролиза соли, необходимо предварительно провести анализ соли.
Первый случай гидролиза
![]()
Помимо растворения соли происходит ее гидролиз. Гидролиз всегда протекает по слабой составляющей.

PH >7 - щелочная среда.
Соль, образованная сильным гидроксидом и слабой кислотой, гидролизуется по аниону, в результате образуется слабо диссоциирующая кислота, а в растворе накапливаются гидроксид - ионы, создавая щелочную среду.
Рассмотрим, по какой причине гидролиз протекает незначительно, но с большим сдвигом в обратную сторону.

Гидролиз соли протекает до тех пор, пока происходит диссоциация воды. Диссоциация воды, в свою очередь, происходит до тех пор, пока не начнётся диссоциация слабого элемента.
![]()
Пока ионы Н2 связываются в слабую кислоту, происходит диссоциация воды.
H2O
![]() H+
+
OH-
H+
+
OH-
В соответствии со своей степенью диссоциации начинает диссоциировать слабая кислота. В реакцию вступают ионы водорода, и диссоциация воды прекращается.
Таким образом, гидролиз соли прекращается тогда, когда начинается диссоциация слабого электролита.
Вывод. Чем слабее составляющая соли, тем полнее протекает гидролиз.
Второй случай гидролиза
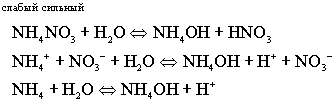
PH < 7 - кислая среда
Соль, образованная слабым гидроксидом и сильной кислотой, гидролизуется по катиону, образуя слабый гидроксид.
В ходе реакции накапливаются ионы водорода, создавая кислую среду.
Третий случай гидролиза

PH = 7 - характер среды слабо щелочной, слабокислый, нейтральный.
Соль образованная слабым гидроксидом и слабой кислотой, гидролизуется одновременно по катиону и аниону. Очевидно, что гидролиз протекает глубже, чем в первых двух случаях. Характер среды слабо щелочной, слабокислый, нейтральный.

Соль, образованная сильным гидроксидом и сильной кислотой, не гидролизуется. Нет взаимодействия ионов соли с водой, следовательно нет гидролиза. Процесс сводится к диссоциации воды.
Если соль образована слабым гидроксидом и слабой кислотой, то реакция раствора зависит от относительной силы образующихся в результате гидролиза кислоты и основания.

