- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
Степень диссоциации. Константа электролитической диссоциации
Рассмотрим количественные зависимости процесса диссоциации на примере водных растворов слабых кислот.
В водных растворах слабых электролитов происходит как процесс диссоциации, так и ассоциации молекул и ионов. По мере увеличения количества свободных ионов в растворе растет скорость образования молекул. В какой-то момент времени наступает равновесие : v1 = v2
при этом относительное количество недиссоциированных молекул и ионов остаются постоянными и характеризуются степенью электролитической диссоциации: a = Сд/Соб
Степень электролитической диссоциации a представляет собой отношения числа моль вещества диссоциированного на ионы (Сд) к общему числу моль растворенного вещества (С об).
Например, в 0,1 М растворе степень диссоциации уксусной кислоты aСН3СООН = 0,013, то есть 1,3% всех молекул распадается на ионы; aKCI = 0,86 - для 0,1 М раствора; - 0,94 для 0,01 М раствора.
Сильные электролиты: α >30%; слабые α <3%; средние α -30% - 3%.
Рассмотрим процесс диссоциации слабого электролита:
НА ↔ Н+ + А-;
В состоянии равновесия при v1 = v2, соответственно закону действия масс:
К = [Н+][А-] / [НА],
где K - константа диссоциации электролита - характеризует склонность к ионизации. Чем больше К, тем выше концентрация ионов в растворе.
Величина К для растворов слабых электролитов - есть постоянной при постоянных Р и t.
Пример: для одноосновной уксусной кислоты
CH3COOН « СН3СОО- + H+ , К = 1,8×10-5
Многоосновные кислоты диссоциируют по каждой ступени:
Н2СО3 « Н+ + НСО3- К1 = 4×10-7
НСО3- « Н+ + СО32- К2 = 4×10-11
Первая константа намного больше второй. Это говорит о том, что двухосновная кислота диссоциирует по первой ступени сильнее, чем по второй, или для нашего случая: Н2СО3 намного сильнее НСО3-.
Между степенью диссоциации a и const диссоциации К существует определенная зависимость. Рассмотрим диссоциацию бинарного электролита, который распадается на 2 иона:
НА ↔ Н+ + А-
Обозначим С = Соб , тогда a = Сдис/Соб. В соответствии с уравнением диссоциации:
[H+] = [A-] = C × a; [AH] = С - a × С = С(1 - a);
Запишем закон действующих масс для полученных величин:
К = αС.αС / С(1 - α );
Таким образом константа диссоциации равняется:
К = α2С / (1 – α);
Это выражение носит название – закон разведения Оствальда, который устанавливает зависимость между a и концентрацией слабого электролита.
Если учесть, что для слабых электролитов a<<1, то:
К = a2 × С;
a = √К/С);
то есть чем ниже концентрация, тем выше a- степень диссоциации, а, следовательно, и электропроводимость растворов.
Химическая активность. Ионная сила раствора
Закон действия масс можно применять для слабых электролитов. Для сильных – возникает большая ошибка.
Для точных расчетов на основе закона действия масс пользуются величиной химической активности. Эта величина введена для учета взаимного притяжения и отталкивания ионов, взаимодействия растворимого вещества с растворителем и других явлений, которые изменяют подвижность ионов и которые не учитываются теорией электролитической диссоциации.
Активность (обозначается аі) можно рассматривать как величина, которая характеризует степень связанности частиц электролита.
Т.о., активность есть действующей концентрацией, которая проявляет себя в химических процессах в качестве реально действующей массы, в отличие от общей концентрации вещества в растворе.
Численно а равняется концентрации, умноженной на коэффициент активности fі: а = f . C.
Коэффициент активности является величиной, отражающей все явления, которые вызовают изменение подвижности ионов.
В разбавленном растворе f = 1 и а = С.
В реальных условиях f < 1 и а < С.
Подстановка величин активностей вместо значений концентрации в уравнение закона действия масс, делает эти уравнения применимыми к реальным растворам сильных электролитов.
Так константа диссоциации соединения НА равняется:
КНА = аН+ . аА- / аНА.
Константы диссоциации, определенные с помощью активностей, называются истинными или термодинамическими константами диссоциации.
Коэффициент активности зависит не только от концентрации данного электролита, но также и от концентраций других ионов, присутствующих в растворе.
Мерой взаимодействия между всеми ионами в растворе есть ионная сила раствора - величина, которая зависит от концентрации и заряда ионов, присутствующих в растворе.
Ионная сила m равняется полусумме произведений концентраций ионов на квадраты их зарядов:

Условия необратимого протекания реакций между электролитами
Все электролиты диссоциируют на ионы, поэтому суть реакции между электролитами выражают кратким ионным уравнением.
Для того, чтобы реакция между электролитами протекла необратимо, необходимо, чтобы часть ионов оказалась связанной или в легко летучее соединение, или в трудно растворимый осадок, или в слабый электролит.
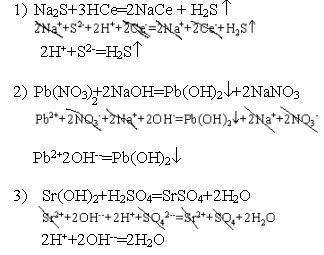
Условия выпадения осадков труднорастворимых электролитов. Произведение растворимости
|
|
Поскольку абсолютно нерастворимых веществ нет, какая - то часть AgCl перейдёт в раствор. Поскольку AgCl - сильный электролит, все молекулы, перешедшие в раствор, диссоциируют на ионы, и в растворе будут находится ионы. |
Любой раствор может быть насыщенным, ненасыщенным и перенасыщенным.
Ненасыщенным называют раствор, в котором при данной температуре можно растворить ещё какое - то количество данного вещества.
Насыщенным называют раствор, в котором скорость реакции растворения равна скорости реакции осаждения.
Концентрация насыщенного раствора для данного вещества при данной температуре есть величина постоянная, следовательно в насыщенном растворе концентрации ионов данного электролита являются константами.
Перенасыщенными называют растворы, которые содержат осадок.
Насыщенные растворы трудно растворимых электролитов характеризуется величиной, называемой произведением растворимости.
AB - трудно растворимый электролит
AB=A++B- ПРАВ = [A+]*[B-] - насыщенный раствор,
ПРАВ > [A+]*[B-] - ненасыщенный раствор,
ПРАВ < [Ag+]*[B-] - перенасыщенный раствор.
Be(OH)3
![]() Bi3++3OH-
Bi3++3OH-
ПРBi(OH)3 = [Bi3+]*[OH--]3.
Добавление в раствор одноимённых ионов труднорастворимого электролита способствует выпадению в осадок иона противоположного знака
PbSO4 = Pb2+ + SO42-
ПРPbSO4 = [Pb2+]*[ SO42-] = 2,2*10-1
Na2SO4 = 2Na+ + SO42-
[Pb2+]
![]() .
.