
- •1.1.2. Термодинамические факторы мицеллообразования
- •1.1.3. Количественные характеристики состояния поверхности, адсорбции и мицеллообразования
- •1.1.4. Геометрия мицелл
- •1.1.5. Фазовая диаграмма конденсированных состояний двойных систем «пав-вода».
- •1.2.2. Пенообразование и пены
- •1.2.3. Эмульсии «жидкость - жидкость»
1.1.4. Геометрия мицелл
В широком интервале концентраций выше ККМ молекулы ПАВ объединяются в сферические мицеллы, так называемые мицеллы Гартли (рис. 2) с некоторым оптимальным числом агрегации т. Радиус такой мицеллы имеет значение, близкое к длине углеводородной цепи. Например, радиус устойчивой сферической мицеллы олеата натрия С17Н3зСООNа составляет ≈ 2,5 нм, что соответствует т, равному нескольким десяткам (от 20 до 100). Образование мицелл с большими числами агрегации с сохранением сферической формы становится термодинамически невыгодным, поскольку неизбежно должно сопровождаться включением полярной группы в объем мицеллы. Поэтому с ростом содержания ПАВ в системе при с0>>ККМ наряду с увеличением концентрации сферических мицелл постепенно происходит изменение их формы. Сферические мицеллы переходят в эллипсоидальные, цилиндрические, палочкообразные, ленточные, пластинчатые мицеллы (последние получили название мицелл Мак-Бена). На рис.7 приведена структура мицеллы Мак-Бена.
Рис. 7. Схематическое изображение
пластинчатой мицеллы.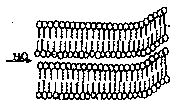
1.1.5. Фазовая диаграмма конденсированных состояний двойных систем «пав-вода».
При достижении ККМ резко увеличивается растворимость ПАВ, и температура фазового перехода очень слабо зависит от концентрации (рис. 5, кривая 1). На рис. 8 схематично приведен полный вид типичной диаграммы растворимости (кристаллизации) кристаллических ПАВ при температурах выше 0°С в воде. Кривая абв есть кривая растворимости, пунктирная линия ККМ - зависимость критической концентрации мицеллообразования от температуры. Её наклон свидетельствует о слабой зависимости ККМ от температуры. Так как величина ККМ связана с равновесным процессом (1) и его константой равновесия, то такая температурная зависимость есть следствие невысокого значения энтальпийного фактора в функции Гиббса мицеллообразования. Пересечение линии ККМ с кривой растворимости называют точкой Крафта (Ткр). Участок кривой аб соответствует равновесию «раствор ПАВ молекулярной дисперсии - кристаллы ПАВ», участок бв - мицеллярной растворимости; при более высоких концентрациях ПАВ растворимость их резко падает и система до высоких температур находится в состоянии жидких кристаллов (ЖК) (область, обозначенная ЖК). Причем, в этой области составов в системе образуются кристаллогидраты, о чём свидетельствуют точки максимума на кривой растворимости. Область «А» на диаграмме соответствует гомогенным состояниям раствора ПАВ молекулярной дисперсии, область «М»- мицеллярному раствору. При температурах ниже 7жк справа от кривой абв находится гетерогенная область существования раствора и кристаллов. Мицеллообразование может происходить только выше температуры ТКр, ниже точки Крафта растворимость ПАВ мала, меньше, чем ККМ , поэтому в растворах ПАВ, для которых точка Крафта лежит в области повышенных температур (выше 50-80° С), в обычных условиях мицеллообразование не наблюдается.
Рис. 8. Типичный вид диаграммы состояния
«твердая фаза-раствор» в системе
«ПАВ-вода».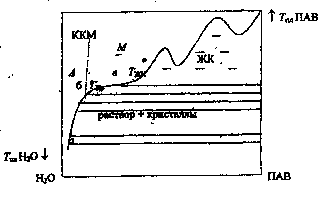
Для многих неионогенных ПАВ, являющихся жидкостями при температурах жидкой воды, точка Крафта отсутствует. Для них характерной является другая температурная граница - точка помутнения. Усиленное помутнение связано с увеличением размера мицелл и расслоением системы на две фазы из-за дегидратации полярных групп мицелл при повышении температуры.
1.2. Эмульгирующее действие растворов поверхностно-активных веществ
1.2.1. Эмульсии
Эмульсии - это гетерогенные системы, в которых одна фаза находится в дисперсном (раздробленном) состоянии и называется дисперсной фазой. Другая фаза, сплошная, называется дисперсионной средой. При образовании дисперсной фазы сильно увеличивается межфазная поверхность, на что необходимо совершить работу (одним из способов получения эмульсий и является механическое диспергирование одной подсистемы в другой). Поэтому, в принципе, эмульсии являются неустойчивыми термодинамическими системами, склонными к разрушению, хотя время их существования может сильно различаться.
Согласно уравнению (2), работу образования поверхности можно уменьшить за счет снижения межфазного натяжения. Значение последнего, в свою очередь, может существенно понизить адсорбция ПАВ на границе раздела дисперсной фазы и дисперсионной среды. Поэтому, различные поверхностно-активные вещества играют важную роль в стабилизации эмульсий, которые широко используются в практической деятельности человека.
По типу агрегатных состояний отдельных фаз эмульсии бывают разнообразны. В данной работе исследуются стабилизирующие свойства ПАВ в отношении эмульсий, у которых дисперсионной средой является жидкая фаза, а дисперсной фазой - газ или другая жидкость.
