- •1.1.2. Термодинамические факторы мицеллообразования
- •1.1.3. Количественные характеристики состояния поверхности, адсорбции и мицеллообразования
- •1.1.4. Геометрия мицелл
- •1.1.5. Фазовая диаграмма конденсированных состояний двойных систем «пав-вода».
- •1.2.2. Пенообразование и пены
- •1.2.3. Эмульсии «жидкость - жидкость»
1.1. Мицеллообразование
1.1.1. Общая характеристика поверхностно-активных веществ и явления ми ценообразования
Энергетическое состояние молекул (или других частиц) жидкости в объемной фазе и на границе раздела фаз неэквивалентно. Внутри фазы частица со всех сторон окружена равно вероятно по химической природе другими частицами, в чистой жидкости, например, - себе подобными частицами. Силы межмолекулярных взаимодействий, одинаково действующих во всех направлениях, дают суммарную силу F2= 0 (рис 1). На границе раздела фаз «жидкость-воздух» или «жидкость - насыщенный пар» силы межмолекулярных взаимодействий частиц с молекулами газовой фазы и с молекулами со стороны объёма жидкой фазы не равны. В этом случае на частицу в поверхностном слое действует суммарная сила межмолекулярных взаимодействий F1, направленная по нормали к поверхности вглубь объемной фазы (рис.1).
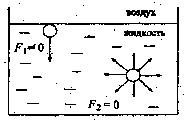
Рис.1. Схема энергетического состояния молекулы в поверхностном слое и объемной фазе.
В результате этого явления молекулы поверхностного слоя «втягиваются» внутрь жидкости, уменьшая площадь поверхности. При этом число частиц в единице объёма в приповерхностном слое может быть иным по сравнению с их числом в единичном объёме внутри фазы. Например, плотность воды в поверхностном монослое ниже плотности воды на 15 %, для других жидкостей это понижение составляет 3-7%. Если жидкость представляет собою раствор, то концентрация растворённого вещества в поверхностном слое также может отличаться от его объёмной концентрации. Изменение концентрации вещества в поверхностном слое по сравнению с объёмной называется адсорбцией. Адсорбция может быть положительной и отрицательной в зависимости от свойств растворенного вещества и растворителя. Например, неорганические кислоты, соли, сильные основания не только хорошо растворяются в воде, но и подвергаются электролитической диссоциации, что является следствием сильных межмолекулярных взаимодействий растворённого вещества и растворителя. Такие вещества проявляют отрицательную адсорбцию - их концентрация в поверхностном слое ниже, чем в объёме. Понижение плотности чистой жидкости в поверхностном слое есть следствие отрицательной автоадсорбции.
Существует обширный круг соединений, молекулярное строение которых является дифильным (их называют также амфифильными ). Это вещества, состоящие из функциональных частей разной природы - неполярного углеводородного фрагмента (радикалы R) и какой-либо полярной группы. Полярными могут являться группы СООН, COO", ОН", сульфатная (-OS03"), сульфонатная (-S03"), группы, содержащие азот (-NH2 и другие). В отношении воды полярный фрагмент амфифильного вещества является гидрофильным (любящим воду), а неполярный - гидрофобным. Из-за особенности структуры такие вещества в воде растворяются ограниченно и в растворе обладают способностью концентрироваться в поверхностном слое, для них характерна положительная адсорбция, а сами они называются поверхностно-активными веществами (ПАВ).
Количественно адсорбция ПАВ определяется избытком /-го вещества в поверхностном слое, отнесенным к единице площади поверхности:
Гi =nis/S
где Гi -адсорбция Гиббса; nis - избыток ПАВ в поверхностном слое, определенный методом Гиббса (рассмотрение метода выходит за рамки настоящей работы); S— площадь межфазной поверхности.
Чтобы подчеркнуть структурную особенность ПАВ, их принято схематично обозначать следующим образом:
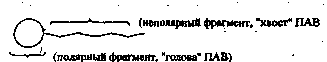
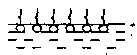
Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии погружения гидрофильных групп в водную фазу, а гидрофобных углеводородных цепей - в воздух или менее полярную фазу. При малой концентрации адсорбированных молекул в поверхностном слое тепловое движение нарушает их ориентацию, и молекулы в основном лежат на поверхности. Повышение концентрации ПАВ и насыщение адсорбционного слоя (Гmax) приводит к вертикальной ориентации углеводородных групп и образованию «молекулярного частокола» (рис.2). В этом состоянии площадь, занимаемая молекулой (So=l/Гmax), определяется лишь площадью полярной группы, общей для всех членов гомологического ряда.
Д
Рис.2. Ориентация молекул ПАВ в насыщенном
адсорбционном слое
Число молекул в мицелле, т, называют числом агрегации. Оно может иметь значения от 20 до 100 и более. Равновесие между мицеллами, содержащими т молекул ПАВ, и раствором ПАВ молекулярной дисперсии можно описать подобно химической реакции с константой равновесия К

mПАВ = (ПАВ)m,
K
Рис.3. Схема образования сферической
мицеллы ПАВ в воде
Образование мицелл обратимо, так как они распадаются при разбавлении мицеллярных растворов на молекулы или ионы диссоциируемого ПАВ.
1.1.2. Термодинамические факторы мицеллообразования
Рассмотрим более подробно причины, вызывающие самопроизвольную агрегацию молекул ПАВ в мицеллярные структуры. С точки зрения термодинамики движущей силой мицсллообразования является увеличение энтропии системы в целом (термодинамическая система включает растворитель и растворенное вещество).
Основным фактором, приводящим к стабилизации мицелл, являются гидрофобные взаимодействия. Под их действием система принимает такую структурную организацию, при которой сводятся к минимуму контакты между неполярными участками ПАВ и водой. Эти силы имеют в основном энтропийную природу и связаны с ограничениями, налагаемыми на упаковку молекул воды вокруг неполярных фрагментов. Рассмотрим это более подробно.
Структура чистой воды стабилизирована, прежде всего, водородными связями. Когда какой-либо ион, например Сl- , попадает в воду, происходит его сольватация, при этом молекулы воды образуют вокруг него гидратную оболочку. С точки зрения энтропии любое упорядочение молекул невыгодно, но этот фактор с избытком компенсируется сильными электростатическими взаимодействиями между ионом и молекулой воды. Поэтому изменение энергии Гиббса в процессе растворения соли в воде отрицательно.
Когда в воде растворяется неполярное вещество, структура воды вокруг каждой молекулы также нарушается. Молекулы воды стремятся ориентироваться таким образом, чтобы сохранились межмолекулярные водородные связи. Те молекулы воды, которые непосредственно контактируют с молекулами растворенного неполярного вещества, соседствуют с меньшим числом себе подобных молекул, и в системе возникают значительные структурные напряжения. При этом в данном случае компенсирующие электростатические взаимодействия отсутствуют. Невыгодные взаимодействия между неполярным растворяемым веществом и водой - это и есть те гидрофобные взаимодействия, под действием которых неполярные вещества стремятся свести к минимуму контакты с водой. Рассмотрим теперь, что произойдет при растворении в воде дифильной молекулы ПАВ. Под влиянием гидрофобного эффекта углеводородная часть молекулы ПАВ выталкивается из воды, чтобы насколько возможно избежать с ней контакта, и в результате образуются мицеллы (рис.3). Удаление из воды углеводородных цепей дифильных ПАВ в мицеллы снижает структурные напряжения в воде. Организация углеводородной части мицеллы сопровождается уменьшением энтропии, но изменение структуры воды связано с увеличением энтропии, в результате чего энтропия системы в целом увеличивается. Изменение функции Гиббса за счет роста энтропийной составляющей становится отрицательным, что и определяет самопроизвольность мицеллообразования:
ΔG=(ΔH - TΔS)<0.
Определяющая роль энтропийного фактора следует из экспериментальных зависимостей констант равновесия мицеллообразования (1). Например, вклад энтропийной составляющей (- TΔS°) в стандартное значение функции Гиббса мицеллообразования бромида н-додецилтриметиламмония в воде равен -16,5 кДж/моль, в то время как ΔH°=-1,38 кДж/моль. Аналогичные соотношения функций получены для мицеллообразования н-нодецилсульфата натрия: ΔH °= + 0,38 кДж/моль, (- TΔS °)= - 21,5 кДж/моль.
Следует отметить, что способностью к мицеллообразованию обладают не все дифильные ПАВ. Это явление зависит от двух факторов. Один из них - длина гидрофобной части молекулы. Поскольку гидрофобность пропорциональна площади поверхности контакта между водой и неполярным фрагментом, то чем длиннее углеводородная цепь ПАВ, тем значительнее нарушения структуры воды из-за увеличения площади контакта, тем больше склонность ПАВ к мицеллообразованию. С другой стороны, для образования мицелляр-ных систем ПАВ существенную роль играет способность полярных групп экранировать углеводородное ядро от контакта с водой. Эта способность определяется собственными размерами полярных групп и их характером взаимодействия с растворителем, в частности гидратируемостью. Такие полярные группы, как –СОО-, -S03\ -OS03-, [(R)4 N]+, хорошо гидратируются и обладают большой экранирующей способностью, а дифильные вещества с одной небольшой полярной группой, например, спирты жирного ряда, не способны к мицеллообразованию, даже при наличии длинной углеводородной цепи. Другими словами, способностью к мицеллообразованию обладают лишь те дифильные вещества, которые имеют оптимальные соотношения между гидрофильной и гидрофобной частями молекулы. В научной литературе это называют гидрофильно-липофильиым балансом (ГЛБ).
По природе гидрофильной группы дифильные вещества различают на иоиогенные ПАВ, диссоциирующие в водных растворах с образованием ионов, и неионогенные, то есть не склонные к диссоциации. Иоиогенные ПАВ классифицируют:
на а) анионоактивные, которые при диссоциации образуют поверхностно-активные анионы с углеводородными группами, например, соли карбоновых
кислот (мыла) CH3(CH2)nCH2COONa = CH3(CH2)nCH2COO- + Na+, соли алкилсульфокислот CH3(CH2)nCH2OS03 Na = CH3(CH2)nCH2OS03-+ Na+;
б) катионоактивные, образующие ПАВ катионного характера, например соли алкиламмония, которые диссоциируют по схеме:
[R1R2R3R4N]+A- = [R1R2R3N] + + А-, где А - какой-либо анион;
в) амфолитные (амфотерные) ПАВ, которые в зависимости от среды проявляют катионоактивные, анионоактивные или неионогенные свойства, например аминокислоты
кислая среда щелочная среда
N+H3CHRCOOH = N+ H3CHRCOO- = NH2CHRCOO-
катионные свойства неионогенные свойства анионные свойства
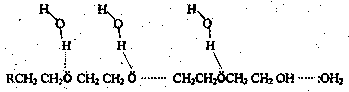
Среди неионогенных ПАВ к мицеллообразованию склонны такие вещества, в молекулах которых содержится значительное число полярных фрагментов в углеводородной цепи (полиоксиэтилированные вещества, производные сахаридов, глюкозидов). Растворимость таких веществ в воде обуславливают их межмолекулярные взаимодействия с растворителем посредством полярных групп, как, например, это показано для алкилполиэтиленгликолей: