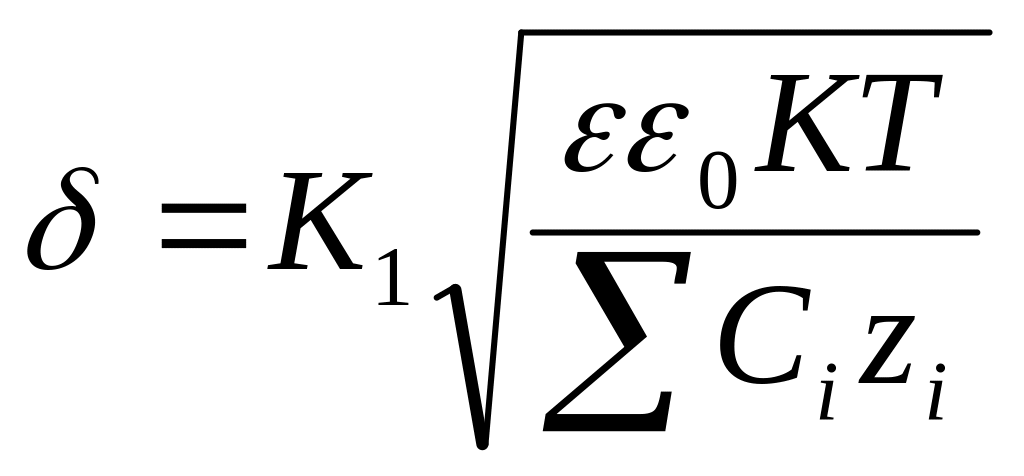- •1. Коллоидная химия. Свойства коллоидных систем. Признаки объектов коллоидной химии.
- •2. Классификация коллоидных систем.
- •5.Очистка коллоидных систем: диализ, ультрафильтрация.
- •12. Изотермы адсорбции и поверхностного натяжения растворов пав. Уравнение Шишковского.
- •16. Представления о полимолеку-
- •17. Получение, классификация твердых пористых адсорбентов.
- •18. Понятия о капиллярных явлениях. Теория капиллярной конденсации.
- •23. Избирательное смачивание. Способы определения краевого угла смачивания. Инверсия смачиваемости поверхности.
- •25. Седиментация суспензий и седиментационный анализ дисперсных систем.
- •30Агрегативная устойчивость дисп сист.Факторы агрег устойчив:
- •29Электрокинетич потенциал.Влияние разл факторов на вел электрокин потенциала.
- •32. Коагуляция дисперсных систем. Факторы, влияющие на электролитную коагуляцию дисперсных систем. Быстрая и медленная коагуляция.
- •22Адгезия.Когезия.Смачивание,Краевые углы смачивания и работа адгезии.
23. Избирательное смачивание. Способы определения краевого угла смачивания. Инверсия смачиваемости поверхности.
при
нанесении на пов-ть 2х жид нераств друг
в друге, м/у ними обр краевой угол, хар-й
относ. спос-ть этих жид.смач-ть данное
тело. Для сравнит.оценки смач.пов.сопост-е
проводят по ср-ю с водой (с пол.жид-ми)

инверсия: закл.в качеств-м измен-и смач-ти пов-ти за счет адс-и ПАВ
Избир-е см-е: добыча нефти, офсетная печать,изгот-е пигментов для масл.красок, флотация (обогащение руд, цв.Ме)
24.
Молекулярно-кинитические свойства
дисперсных систем: броуновское движение,
диффузия.Броуновское
движение проявляется в хаотическом
движении частиц дисперсной фазы под
действием ударов молекул растворителя,
находящихся в состоянии интенсивного
молекулярно-теплового движения.
Смещением или сдвигом частицы
называется расстояние между проекциями
начальной и конечной точек траектории
на оси смещения. Диффузия – это процесс
самопроизвольного выравнивания
концентрац. В сис-ме, приводящий к
установлению равенства хим. Потенциала
во всех точках системы. Движущая сила
- броуновское движение.Количеств
хар-ка диффузии-диффузион поток-это
колво моль вещества,переносимого
диффузиейза ед времени через ед
площади пов-ти, перпенд располож
к поверхности. 1 закон Фика![]() [D]=м2\с
[D]=м2\с
![]()
![]() ,
,
![]()
25. Седиментация суспензий и седиментационный анализ дисперсных систем.
Процесс оседания частиц дисперсной фазы в жидкой или газовой дисперсионной среде под действием силы тяжести есть седиментация суспензий . По мере увеличения ск-ти оседания возникает сила трения пропор. Ск-ти частицы.Fтр=BU. Частица движется с постоянной скоростью, если сила трения уравновешена силой тяжести. V=2g(p-p0)r2/9η-закон седиментации, условия соблюдения данного закона:
1)Независимость оседания частиц(разб.системы)
2)Ламинарность
3) Дисперсность r=10-7/10-5
4) Сферическая форма частиц
Седиментационный анализ основан на различных скоростях оседания частиц разного размера, с помощью его можно найти средний радиус частицы, описывается ур-ями: m=(Q/H)*Uτ, где Q-общая масса, H-первоначальная высота столба суспензнии m=2Qд(p-p0)r2τ/9ηH, а также уравнением Сведберга-Одена m=qi+(dm/dτ)τ СМОТРЕТЬ ГРАФИК ТЕМА 3.5!!! Дифференциальные кривые распределения показывают распределение масс частиц по их размерам,а функция распределения представляет собой долю частиц в интервале(r+dr)
26. Седиментационно-диффузионное равновесие. Седиментационная устойчивость.
![]() ,
, ![]() ,
где -плотность частицы,
,
где -плотность частицы, ![]() -
плотность дисп.среды,
-
плотность дисп.среды,![]() концентрация
частич у дна сосуда, когда h=0,
концентрация
частич у дна сосуда, когда h=0,
![]() -концентрация
частиц на высоте h
от дна сосуда, V-объем
частицы. Седим.устойчивость- способность
системы протоивостоять действию
силы тяжести. Чем больше размеры
частицы,тем быстрее скорости оседания
частиц.
-концентрация
частиц на высоте h
от дна сосуда, V-объем
частицы. Седим.устойчивость- способность
системы протоивостоять действию
силы тяжести. Чем больше размеры
частицы,тем быстрее скорости оседания
частиц.
30Агрегативная устойчивость дисп сист.Факторы агрег устойчив:
1ТД факторы(уменьш ):а)электростатический(ДЭС) связан с образ ДЭС (уменьш ) и возникновением потенц барьера отталкивания.б)адсорб-сольватный - уменьш из-за взаимод частиц с растворителем. Пов-ть частиц лиофильна по своей природе или из-за адсорбции стабилиз неэлектролитов.Для эмульсий-порошки.
в)энтропийный-большую роль играет в высокодисперсных сист SU
2Кинетич факторы (Vкоагуляции):а)структурно-меж-возник при адсорбции ПАВ и ВМС на пов-ти частиц, что приводит к образ слоев,облад высокими структ-мех св-вами.Длинноцепочечные ПАВ.б)гидродинамическийфактор-за счет увеличения вязкости среды.
31
Ионный фактор стбилиз ДС.Теория ДЛФО.
При
сближ одноименных заряженных частиц
золей их диф слои перекрыв. Это взаимодейств
протек в тонкой прослойке дисперсн
среды. Устойчивость лиофобных золей
определ особыми св-ми этих слоев.
Утончение этого слоя заканчивается
либо его разрывом либо достиж некоторой
равновесной толщины,которая далее
не уменишается. Утончение тонкого слоя
происходит путем вытекания из него
жидк. Когда жидк слой стан тонким,св-ва
жидкости в нем начинают сильно отлич
от св-в жидк в V.В слое возник доп
давление-расклинивающее. Положит
расклинив давление препятств сближ
частиц,а отриц-наоборот. Расклин
давл-
параметр, учитыв как силу притяж, так и
силу отталкивания между частицами
дисперс фазы.1Электростатич силы взаимод:
а)силы оттралкивания

![]()
![]() ,Еотт
Z,Cпротивоинов;
0,
.
б)Ванд-Вальдовские притяж,Е(h),
Eкин=кТ.
Состояние колл сист зав-т от б
,Еотт
Z,Cпротивоинов;
0,
.
б)Ванд-Вальдовские притяж,Е(h),
Eкин=кТ.
Состояние колл сист зав-т от б![]() аланса
энергии притяж и Еотт. Прео
аланса
энергии притяж и Еотт. Прео![]() блад
Еотт приводит к устойчивости сист,
преоблад Епритяж вызывает коагуляцию.
Частицы дисперс фазы облад опред Екин,
зав-т от Т, ха счет котор они могут
сближаться. Екин=кТ. В зав-ти от соотнош
Ебар и глубины потенц минимумов
возможны след сост-иядисп сист,а именно:1
Ебар>>кТ, Емин2<<кТ- неглубокийcистем
агрегативно устойчивая.2 Еб~Емин2кТброун
движ может сблизить частицы до таких
размеров, что они попадут в первичн
потенц мин, возможна коагуляция.3 при
умеренно глуб вторичн мин Емин2>>кТ,
Еб ~5-10кТвозник
дальнее взаимод ,образ флуокулы, возможно
структурообраз.
блад
Еотт приводит к устойчивости сист,
преоблад Епритяж вызывает коагуляцию.
Частицы дисперс фазы облад опред Екин,
зав-т от Т, ха счет котор они могут
сближаться. Екин=кТ. В зав-ти от соотнош
Ебар и глубины потенц минимумов
возможны след сост-иядисп сист,а именно:1
Ебар>>кТ, Емин2<<кТ- неглубокийcистем
агрегативно устойчивая.2 Еб~Емин2кТброун
движ может сблизить частицы до таких
размеров, что они попадут в первичн
потенц мин, возможна коагуляция.3 при
умеренно глуб вторичн мин Емин2>>кТ,
Еб ~5-10кТвозник
дальнее взаимод ,образ флуокулы, возможно
структурообраз.
2![]() 7-28.
Электрокинетические свойства дисперсных
систем. Механизм образования ДЭС.
Строение ДЭС. Примеры образования
ДЭС.
Электрокинетические явления. Прямые:
- электрофорез(перемещение дисперсной
фазы под действием внешн.электрич.поля)
– электроосмос (перенос дисп.среды
через неподвижн.капиляр –пористую
перегородку под действием внешн.электрич
поля). Обратные – потениальное
оседание,потенциальное течение.Явл.
основаны на ДЭС на границе ТВ. И жидк.фаз.
Механизм
образования.
Возникает из-за пространственного
разделения зарядов, которые могут
возникать разными путями.1)поверхностная
ионизация(переход ионов из одной
фазы в другую)2)ионизация молекул в-ва
ТВ. Фазы за счет диссоциации поверхностных
функциональных групп 3)адсорбция ионов
(молекул)а)не входящих в кристалл.решетку:
органич ионн;с большой адсорбционной
способностью б)избирательная ад-ция
по правилу Панета-Фаенса 4)поляризация
поверхности за счет внешн
Эл.поля.Строение.
На
поверхности частиц дисперсной фазы
врзникае заряд из-за ад-ции потенциал.
– определ ионов, или поверхн.ионизации
цепи.Величина и знак полного термодин
потенциала φ0
на поверхности частицы зависит от колва
и знака адс-ныхх ионов, этот потенциал
притяг противоположно заряж ионы
раствора, часть из них сразу примыкает
к заряж.поверхности, частично ослабляя
ее заряд -> адсорбционный слой.Его
можно считать плоск. Конденсатором,
в котором потенц смягчается линейно.Др.часть
противоионов под действ теплового
движения распространяется в глубь
фазы,обазуя диф.слой.Ионы там
распред.неравномерно-потенц.смягчается
по экспоненте.
7-28.
Электрокинетические свойства дисперсных
систем. Механизм образования ДЭС.
Строение ДЭС. Примеры образования
ДЭС.
Электрокинетические явления. Прямые:
- электрофорез(перемещение дисперсной
фазы под действием внешн.электрич.поля)
– электроосмос (перенос дисп.среды
через неподвижн.капиляр –пористую
перегородку под действием внешн.электрич
поля). Обратные – потениальное
оседание,потенциальное течение.Явл.
основаны на ДЭС на границе ТВ. И жидк.фаз.
Механизм
образования.
Возникает из-за пространственного
разделения зарядов, которые могут
возникать разными путями.1)поверхностная
ионизация(переход ионов из одной
фазы в другую)2)ионизация молекул в-ва
ТВ. Фазы за счет диссоциации поверхностных
функциональных групп 3)адсорбция ионов
(молекул)а)не входящих в кристалл.решетку:
органич ионн;с большой адсорбционной
способностью б)избирательная ад-ция
по правилу Панета-Фаенса 4)поляризация
поверхности за счет внешн
Эл.поля.Строение.
На
поверхности частиц дисперсной фазы
врзникае заряд из-за ад-ции потенциал.
– определ ионов, или поверхн.ионизации
цепи.Величина и знак полного термодин
потенциала φ0
на поверхности частицы зависит от колва
и знака адс-ныхх ионов, этот потенциал
притяг противоположно заряж ионы
раствора, часть из них сразу примыкает
к заряж.поверхности, частично ослабляя
ее заряд -> адсорбционный слой.Его
можно считать плоск. Конденсатором,
в котором потенц смягчается линейно.Др.часть
противоионов под действ теплового
движения распространяется в глубь
фазы,обазуя диф.слой.Ионы там
распред.неравномерно-потенц.смягчается
по экспоненте.![]() За
толщ. Диф. Слоя принято считать расстояниена
кот потенциал φ0
уменьшится
в е раз.
За
толщ. Диф. Слоя принято считать расстояниена
кот потенциал φ0
уменьшится
в е раз.