
- •2. Основное уравнение молекулярно-кинетической теории идеального газа
- •3.Внутренняя энергия идеального газа. Закон равномерного распределения энергии по степеням свободы.
- •4.Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам
- •5.Адиабатический процесс. Уравнение адиабаты. Политропические процессы.
- •6.Круговой процесс и его кпд. Обратимые и необратимые процессы. Цикл карно. Первая и вторая теоремы карно.
- •7.Энтропия. Второе и третье начала термодинамики. Изменение энтропии в процессах идеального газа.
- •8. Термодинамические потенциалы. Химический потенциал системы, энтальпия, свободная энергия гельмгольца, потенциал гиббса.
- •9.Распределение максвелла по скоростям для молекул идеального газа. Опыт штерна
- •Наиболее вероятная скорость
- •Средняя скорость
- •Среднеквадратичная скорость
- •10.Барометрическая формула. Распределение больцмана.
- •11.Явления переноса (закон фика, закон фурье, закон ньютона). Средняя длина свободного пробега молекулы.
- •12.Реальные газы. Уравнение ван-дер-ваальса и его изотермы.
- •13.Внутренняя энергия реального газа. Эффект джоуля - томсона.
- •14.Фазы вещества. Фазовое равновесие и фазовые переходы 1-го и 2-го рода. Фазовые диаграммы состояния вещества. Тройная точка
- •15.Явления на границе жидкости и твёрдого тела. Капиллярный явления.
- •16.Кристаллические и аморфные твердые тела. Строение и симметрия кристаллов.
- •17.Классическая теория теплоемкости твердых тел. Закон дюлонга и пти.
- •18.Типы кристаллических решеток. Виды связей атомов в кристаллах. Модель эйнштейна и модель дебая.
- •19.Электрический заряд. Свойства электрического заряда. Взаимодействие электрических зарядов. Электрическое поле. Закон кулона.
- •20.Напряженность электрического поля. Силовые линии. Принцип суперпозиции. Напряженность поля точечного заряда и системы точечных зарядов.
- •21.Напряженность электрического поля. Силовые линии. Принцип суперпозиции. Напряженность поля точечного заряда и системы точечных зарядов.
- •22.Поток вектора напряженности электрического поля. Эквипотенциальные поверхности. Теорема гаусса для электростатического поля.
- •23.Применение теоремы гаусса к расчету напряженности электрических полей. Электрическое поле равномерно заряженной сферической поверхности и объемно заряженного шара.
- •25.Связь между напряженностью и потенциалом электростатического поля
- •26.Работа по перемещению заряда в электрическом поле. Разность потенциалов.
- •28.Свободные и связанные заряды в веществе. Электрический диполь. Потенциал и напряженность электрического поля на продолжении оси диполя.
- •28.Свободные и связанные заряды в веществе. Электрический диполь. Потенциал и напряженность электрического поля на продолжении оси диполя.
- •30.Типы диэлектриков. Поляризация диэлектриков. Поляризационные заряды. Вектор поляризации. Напряженность электрического поля в диэлектрике. Диэлектрическая восприимчивость.
- •31.Поляризация полярных и неполярных диэлектриков. Поляризуемость молекулы. Диэлектрическая восприимчивость полярных и неполярных диэлектриков. Ионная поляризация.
- •32.Теорема гаусса для диэлектрического поля в диэлектрике. Вектор электрического смещения.
- •33.Условия на границе двух однородных изотропных диэлектриков. Вектор электрического смещения. Относительная диэлектрическая проницаемость.
- •34.Спонтанная поляризация кристаллических диэлектриков. Сегнетоэлектрики. Пироэлектрики. Пьезоэлектрики.
- •36.Электростатическое поле внутри заряженного проводника и вблизи его поверхности. Проводники во внешнем электростатическом поле. Электроемкость уединенного проводника.
- •37.Конденсаторы. Типы конденсаторов. Соединение конденсаторов. Емкость плоского конденсатора.
- •38.Энергия заряженных проводника и конденсатора энергия электрического поля. Объемная плотность энергии.
- •39.Электрический ток проводимости в металлах, его характеристики и условия существования. Сторонние силы. Электродвижущая сила и напряжение.
- •40.Сопротивление проводников. Закон ома для однородного и неоднородного участков цепи, для замкнутой цепи. Правила кирхгофа.
- •41.Работа и мощность тока. Закон джоуля-ленца в интегральной и дифференциальной формах.
- •42. Основы классической электронной теории электропроводности металлов. Удельная электропроводность. Подвижносъ носителей тока.
- •43.Закон джоуля-ленца, закон видемана-франца и закон ома на основе классической теории электропроводности
- •44.Электрический ток в жидкостях и газах. Законы фарадея для электролиза. Ионизация молекул газов. Электрический ток в газах. Газовые разряды. Электропроводность газов. Плазма.
- •45. Электрический ток в вакууме. Работа выхода электронов из металла. Контактная разность потенциалов. Термоэлектродвижущая сила. Эффекты пельтье и томсона.
- •46. Электрический ток в вакууме. Электронная эмиссия. Виды эмиссий и их применение. Формула
12.Реальные газы. Уравнение ван-дер-ваальса и его изотермы.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М —молярная масса; R — газовая постоянная.
Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vVm, уравнение Ван-дер-Ваальса примет вид

13.Внутренняя энергия реального газа. Эффект джоуля - томсона.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул, которая определяет внутреннюю энергию идеального газа и потенциальную энергию межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ
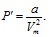
Эффе́ктом Джо́уля — То́мсона называется изменение температуры газа при адиабатическом дросселировании — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Данный эффект является одним из методов получения низких температур.
Изменение
энергии газа в ходе этого процесса будет
равно работе: ![]() .
.
14.Фазы вещества. Фазовое равновесие и фазовые переходы 1-го и 2-го рода. Фазовые диаграммы состояния вещества. Тройная точка
Термодинами́ческая фа́за —термодинамически однородная по свойствам часть термодинамической системы, отделенная от других фаз поверхностями раздела, на которых скачком изменяются некоторые свойства системы.
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механическогои химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Фазовые переходы первого рода — фазовые переходы, при которых скачком изменяются первые производные термодинамических потенциалов по интенсивным параметрамсистемы (температуре или давлению). Переходы первого рода реализуются как при переходе системы из одного агрегатного состояния в другое, так и в пределах одного агрегатного состояния (в отличие от фазовых переходов второго рода, которые происходят в пределах одного агрегатного состояния).
Ф азовые
переходы второго рода — фазовые
переходы,
при которых первые производные термодинамических
потенциалов по
давлению и температуре изменяются
непрерывно, тогда как их вторые производные
испытывают скачок. Отсюда следует, в
частности, что энергия и
объём вещества при фазовом переходе
второго рода не изменяются, но изменяются
его теплоёмкость, сжимаемость,
различные восприимчивости и т. д.
азовые
переходы второго рода — фазовые
переходы,
при которых первые производные термодинамических
потенциалов по
давлению и температуре изменяются
непрерывно, тогда как их вторые производные
испытывают скачок. Отсюда следует, в
частности, что энергия и
объём вещества при фазовом переходе
второго рода не изменяются, но изменяются
его теплоёмкость, сжимаемость,
различные восприимчивости и т. д.
Агрегатное
состояние вещества зависит от его
давления ![]() и
температуры
и
температуры ![]() .
Кривые фазового равновесия на диаграмме
состояния показывают значения давления
и температуры, при которых возможно
равновесие двух фаз.
.
Кривые фазового равновесия на диаграмме
состояния показывают значения давления
и температуры, при которых возможно
равновесие двух фаз.
Т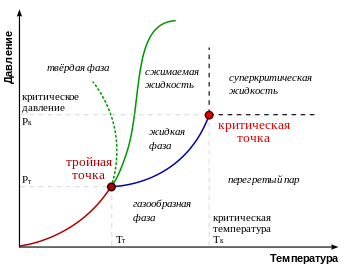 ройна́я
то́чка —
точка на фазовой
диаграмме, где сходятся три линии фазовых
переходов. Тройная точка — это
одна из характеристик химического
вещества. Обычно тройная точка определяется
значением температуры и давления, при
котором вещество может равновесно
находиться в трёх (отсюда и название)
агрегатных состояниях — твёрдом,
жидком и газообразном. В этой точке
сходятся линии плавления, кипения и сублимации.
ройна́я
то́чка —
точка на фазовой
диаграмме, где сходятся три линии фазовых
переходов. Тройная точка — это
одна из характеристик химического
вещества. Обычно тройная точка определяется
значением температуры и давления, при
котором вещество может равновесно
находиться в трёх (отсюда и название)
агрегатных состояниях — твёрдом,
жидком и газообразном. В этой точке
сходятся линии плавления, кипения и сублимации.
