
- •2. Основное уравнение молекулярно-кинетической теории идеального газа
- •3.Внутренняя энергия идеального газа. Закон равномерного распределения энергии по степеням свободы.
- •4.Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам
- •5.Адиабатический процесс. Уравнение адиабаты. Политропические процессы.
- •6.Круговой процесс и его кпд. Обратимые и необратимые процессы. Цикл карно. Первая и вторая теоремы карно.
- •7.Энтропия. Второе и третье начала термодинамики. Изменение энтропии в процессах идеального газа.
- •8. Термодинамические потенциалы. Химический потенциал системы, энтальпия, свободная энергия гельмгольца, потенциал гиббса.
- •9.Распределение максвелла по скоростям для молекул идеального газа. Опыт штерна
- •Наиболее вероятная скорость
- •Средняя скорость
- •Среднеквадратичная скорость
- •10.Барометрическая формула. Распределение больцмана.
- •11.Явления переноса (закон фика, закон фурье, закон ньютона). Средняя длина свободного пробега молекулы.
- •12.Реальные газы. Уравнение ван-дер-ваальса и его изотермы.
- •13.Внутренняя энергия реального газа. Эффект джоуля - томсона.
- •14.Фазы вещества. Фазовое равновесие и фазовые переходы 1-го и 2-го рода. Фазовые диаграммы состояния вещества. Тройная точка
- •15.Явления на границе жидкости и твёрдого тела. Капиллярный явления.
- •16.Кристаллические и аморфные твердые тела. Строение и симметрия кристаллов.
- •17.Классическая теория теплоемкости твердых тел. Закон дюлонга и пти.
- •18.Типы кристаллических решеток. Виды связей атомов в кристаллах. Модель эйнштейна и модель дебая.
- •19.Электрический заряд. Свойства электрического заряда. Взаимодействие электрических зарядов. Электрическое поле. Закон кулона.
- •20.Напряженность электрического поля. Силовые линии. Принцип суперпозиции. Напряженность поля точечного заряда и системы точечных зарядов.
- •21.Напряженность электрического поля. Силовые линии. Принцип суперпозиции. Напряженность поля точечного заряда и системы точечных зарядов.
- •22.Поток вектора напряженности электрического поля. Эквипотенциальные поверхности. Теорема гаусса для электростатического поля.
- •23.Применение теоремы гаусса к расчету напряженности электрических полей. Электрическое поле равномерно заряженной сферической поверхности и объемно заряженного шара.
- •25.Связь между напряженностью и потенциалом электростатического поля
- •26.Работа по перемещению заряда в электрическом поле. Разность потенциалов.
- •28.Свободные и связанные заряды в веществе. Электрический диполь. Потенциал и напряженность электрического поля на продолжении оси диполя.
- •28.Свободные и связанные заряды в веществе. Электрический диполь. Потенциал и напряженность электрического поля на продолжении оси диполя.
- •30.Типы диэлектриков. Поляризация диэлектриков. Поляризационные заряды. Вектор поляризации. Напряженность электрического поля в диэлектрике. Диэлектрическая восприимчивость.
- •31.Поляризация полярных и неполярных диэлектриков. Поляризуемость молекулы. Диэлектрическая восприимчивость полярных и неполярных диэлектриков. Ионная поляризация.
- •32.Теорема гаусса для диэлектрического поля в диэлектрике. Вектор электрического смещения.
- •33.Условия на границе двух однородных изотропных диэлектриков. Вектор электрического смещения. Относительная диэлектрическая проницаемость.
- •34.Спонтанная поляризация кристаллических диэлектриков. Сегнетоэлектрики. Пироэлектрики. Пьезоэлектрики.
- •36.Электростатическое поле внутри заряженного проводника и вблизи его поверхности. Проводники во внешнем электростатическом поле. Электроемкость уединенного проводника.
- •37.Конденсаторы. Типы конденсаторов. Соединение конденсаторов. Емкость плоского конденсатора.
- •38.Энергия заряженных проводника и конденсатора энергия электрического поля. Объемная плотность энергии.
- •39.Электрический ток проводимости в металлах, его характеристики и условия существования. Сторонние силы. Электродвижущая сила и напряжение.
- •40.Сопротивление проводников. Закон ома для однородного и неоднородного участков цепи, для замкнутой цепи. Правила кирхгофа.
- •41.Работа и мощность тока. Закон джоуля-ленца в интегральной и дифференциальной формах.
- •42. Основы классической электронной теории электропроводности металлов. Удельная электропроводность. Подвижносъ носителей тока.
- •43.Закон джоуля-ленца, закон видемана-франца и закон ома на основе классической теории электропроводности
- •44.Электрический ток в жидкостях и газах. Законы фарадея для электролиза. Ионизация молекул газов. Электрический ток в газах. Газовые разряды. Электропроводность газов. Плазма.
- •45. Электрический ток в вакууме. Работа выхода электронов из металла. Контактная разность потенциалов. Термоэлектродвижущая сила. Эффекты пельтье и томсона.
- •46. Электрический ток в вакууме. Электронная эмиссия. Виды эмиссий и их применение. Формула
8. Термодинамические потенциалы. Химический потенциал системы, энтальпия, свободная энергия гельмгольца, потенциал гиббса.
Термодинами́ческие потенциа́лы — характеристические функции в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Хими́ческий
потенциа́л ![]() — термодинамическая функция,
применяемая при описании состояния
систем с переменным числом частиц.
Определяет изменение термодинамических
потенциалов (энергии Гиббса, внутренней
энергии, энтальпии и т. д.) при изменении
числа частиц в системе. Представляет
собой энергию добавления
одной частицы в систему без совершения
работы. Определение химического
потенциала можно записать в виде:
— термодинамическая функция,
применяемая при описании состояния
систем с переменным числом частиц.
Определяет изменение термодинамических
потенциалов (энергии Гиббса, внутренней
энергии, энтальпии и т. д.) при изменении
числа частиц в системе. Представляет
собой энергию добавления
одной частицы в систему без совершения
работы. Определение химического
потенциала можно записать в виде:
![]()
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.Эта формула определяет, кроме химического потенциала , также давление P и температуру T.
Энтальпи́я— термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Определяется
следующим образом:
![]()
где ![]() — давление,
а
— объём.
— давление,
а
— объём.
Поскольку
в изобарном
процессе работа
равна ![]() приращение энтальпии
в квазистатическом изобарном
процессе равно количеству теплоты,
полученному системой.
приращение энтальпии
в квазистатическом изобарном
процессе равно количеству теплоты,
полученному системой.
Свободная энергия Гельмгольца
Также
часто называемый просто свободной
энергией.
Определяется следующим образом:
![]()
где
— температура и ![]() — энтропия.
— энтропия.
Поскольку
в изотермическом процессе количество
теплоты, полученное системой, равно ![]() ,
то убыль свободной
энергии в квазистатическом изотермическом
процессе равна работе, совершённой
системой над внешними
телами.
,
то убыль свободной
энергии в квазистатическом изотермическом
процессе равна работе, совершённой
системой над внешними
телами.
Потенциал Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
где ![]() — внутренняя
энергия,
— давление,
— внутренняя
энергия,
— давление, ![]() — объём,
— объём, ![]() —
абсолютная температура,
—
абсолютная температура, ![]() — энтропия.
— энтропия.
9.Распределение максвелла по скоростям для молекул идеального газа. Опыт штерна
Распределение по модулю скоростей
Модуль скорости, v определяется как:
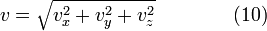
Наиболее вероятная скорость
наиболее
вероятная скорость, ![]() —
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению
—
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению ![]() .
Чтобы найти её, необходимо вычислить
.
Чтобы найти её, необходимо вычислить ![]() ,
приравнять её нулю и решить относительно
,
приравнять её нулю и решить относительно ![]() :
:
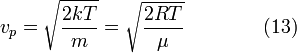
Средняя скорость
Подставляя и интегрируя, мы получим
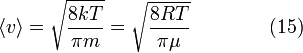
Среднеквадратичная скорость
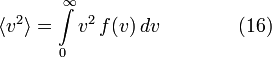
Подставляя и интегрируя, мы получим
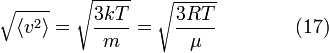
ОПЫТ ШТЕРНА
Был
подготовлен прибор, состоящий из
двух цилиндров разного
радиуса, ось которых совпадала и на ней
располагалась платиновая проволока
с нанесённым слоем серебра.
В пространстве внутри цилиндров
посредством непрерывной откачки воздуха
поддерживалось достаточно низкое давление.
При пропускании электрического
тока через
проволоку достигалась температура
плавления серебра,
из-за чего атомы начинали
испаряться и летели к внутренней
поверхности малого цилиндра равномерно
и прямолинейно со
скоростью v,
соответствующей подаваемому на концы
нити напряжению.
Во внутреннем цилиндре была проделана
узкая щель, через которую атомы могли
беспрепятственно п
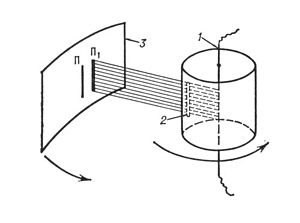 ролетать
далее. Стенки цилиндров специально
охлаждались, что
ролетать
далее. Стенки цилиндров специально
охлаждались, что
1 — платиновая проволока с нанесённым на неё слоем серебра; 2 — щель, формирующая пучок атомов серебра; 3 — пластинка, на которой осаждаются атомы серебра; П и П1 — положения полосок осажденного серебра при неподвижном приборе и при вращении прибора.
способствовало оседанию попадающих на них атомов. В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра. Затем всю систему начинали вращать с некой достаточно большой угловой скоростью ω. При этом полоса налёта смещалась в сторону, противоположную направлению вращения, и теряла чёткость. Измерив смещение sнаиболее тёмной части полосы от её положения, когда система покоилась, Штерн определил время полёта, через которое нашёл скорость движения молекул:
Т.о. скорость движения атомов серебра совпала со скоростью, рассчитанной по законам молекулярно-кинетической теории, а тот факт, что получившаяся полоска была размытой, свидетельствовал в пользу того, что скорости атомов различны и распределены по некоторому закону — закону распределения Максвелла: атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее.
