
- •2. Основное уравнение молекулярно-кинетической теории идеального газа
- •3.Внутренняя энергия идеального газа. Закон равномерного распределения энергии по степеням свободы.
- •4.Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам
- •5.Адиабатический процесс. Уравнение адиабаты. Политропические процессы.
- •6.Круговой процесс и его кпд. Обратимые и необратимые процессы. Цикл карно. Первая и вторая теоремы карно.
- •7.Энтропия. Второе и третье начала термодинамики. Изменение энтропии в процессах идеального газа.
- •8. Термодинамические потенциалы. Химический потенциал системы, энтальпия, свободная энергия гельмгольца, потенциал гиббса.
- •9.Распределение максвелла по скоростям для молекул идеального газа. Опыт штерна
- •Наиболее вероятная скорость
- •Средняя скорость
- •Среднеквадратичная скорость
- •10.Барометрическая формула. Распределение больцмана.
- •11.Явления переноса (закон фика, закон фурье, закон ньютона). Средняя длина свободного пробега молекулы.
- •12.Реальные газы. Уравнение ван-дер-ваальса и его изотермы.
- •13.Внутренняя энергия реального газа. Эффект джоуля - томсона.
- •14.Фазы вещества. Фазовое равновесие и фазовые переходы 1-го и 2-го рода. Фазовые диаграммы состояния вещества. Тройная точка
- •15.Явления на границе жидкости и твёрдого тела. Капиллярный явления.
- •16.Кристаллические и аморфные твердые тела. Строение и симметрия кристаллов.
- •17.Классическая теория теплоемкости твердых тел. Закон дюлонга и пти.
- •18.Типы кристаллических решеток. Виды связей атомов в кристаллах. Модель эйнштейна и модель дебая.
- •19.Электрический заряд. Свойства электрического заряда. Взаимодействие электрических зарядов. Электрическое поле. Закон кулона.
- •20.Напряженность электрического поля. Силовые линии. Принцип суперпозиции. Напряженность поля точечного заряда и системы точечных зарядов.
- •21.Напряженность электрического поля. Силовые линии. Принцип суперпозиции. Напряженность поля точечного заряда и системы точечных зарядов.
- •22.Поток вектора напряженности электрического поля. Эквипотенциальные поверхности. Теорема гаусса для электростатического поля.
- •23.Применение теоремы гаусса к расчету напряженности электрических полей. Электрическое поле равномерно заряженной сферической поверхности и объемно заряженного шара.
- •25.Связь между напряженностью и потенциалом электростатического поля
- •26.Работа по перемещению заряда в электрическом поле. Разность потенциалов.
- •28.Свободные и связанные заряды в веществе. Электрический диполь. Потенциал и напряженность электрического поля на продолжении оси диполя.
- •28.Свободные и связанные заряды в веществе. Электрический диполь. Потенциал и напряженность электрического поля на продолжении оси диполя.
- •30.Типы диэлектриков. Поляризация диэлектриков. Поляризационные заряды. Вектор поляризации. Напряженность электрического поля в диэлектрике. Диэлектрическая восприимчивость.
- •31.Поляризация полярных и неполярных диэлектриков. Поляризуемость молекулы. Диэлектрическая восприимчивость полярных и неполярных диэлектриков. Ионная поляризация.
- •32.Теорема гаусса для диэлектрического поля в диэлектрике. Вектор электрического смещения.
- •33.Условия на границе двух однородных изотропных диэлектриков. Вектор электрического смещения. Относительная диэлектрическая проницаемость.
- •34.Спонтанная поляризация кристаллических диэлектриков. Сегнетоэлектрики. Пироэлектрики. Пьезоэлектрики.
- •36.Электростатическое поле внутри заряженного проводника и вблизи его поверхности. Проводники во внешнем электростатическом поле. Электроемкость уединенного проводника.
- •37.Конденсаторы. Типы конденсаторов. Соединение конденсаторов. Емкость плоского конденсатора.
- •38.Энергия заряженных проводника и конденсатора энергия электрического поля. Объемная плотность энергии.
- •39.Электрический ток проводимости в металлах, его характеристики и условия существования. Сторонние силы. Электродвижущая сила и напряжение.
- •40.Сопротивление проводников. Закон ома для однородного и неоднородного участков цепи, для замкнутой цепи. Правила кирхгофа.
- •41.Работа и мощность тока. Закон джоуля-ленца в интегральной и дифференциальной формах.
- •42. Основы классической электронной теории электропроводности металлов. Удельная электропроводность. Подвижносъ носителей тока.
- •43.Закон джоуля-ленца, закон видемана-франца и закон ома на основе классической теории электропроводности
- •44.Электрический ток в жидкостях и газах. Законы фарадея для электролиза. Ионизация молекул газов. Электрический ток в газах. Газовые разряды. Электропроводность газов. Плазма.
- •45. Электрический ток в вакууме. Работа выхода электронов из металла. Контактная разность потенциалов. Термоэлектродвижущая сила. Эффекты пельтье и томсона.
- •46. Электрический ток в вакууме. Электронная эмиссия. Виды эмиссий и их применение. Формула
1. СПОСОБЫ ОПИСАНИЯ СОСТОЯНИЯ МИКРОСКОПИЧЕСКОЙ СИСТЕМЫ. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СИСТЕМЫ. ИДЕАЛЬНЫЙ ГАЗ, ЗАКОНЫ ИДЕАЛЬНОГО ГАЗА.
Термодинамической системой называется совокупность макроскопических тел, состоящих из огромного числа независимо движущихся молекул (материальных точек). Под телом может подразумеваться и жидкость, и газ, и кристалл, и плазма и т.д.
Следовательно, термодинамическая система --- это система с огромным числом степеней свободы. Описать ее можно с помощью микроскопических параметров, т.е. скоростей, координат, масс отдельных молекул. Тогда изменение состояния системы, т.е. процесс, протекающий в ней, будет суммарным результатом движения всех молекул. Такой способ описания называется молекулярно--кинетическим или статистическим
Но
можно описать термодинамическую систему,
не интересуясь движением отдельных
молекул, т.е. с
помощью макроскопических или термодинамических
параметров, характеризующих
состояние системы в целом.
Такими параметрами являются: объем V,
давление p, температура T, поляризованность ![]() ,
намагниченность
,
намагниченность ![]() и
т.п. Этот способ описания
называется термодинамическим и
изучается в термодинамике.
и
т.п. Этот способ описания
называется термодинамическим и
изучается в термодинамике.
Если значения всех термодинамических параметров одинаковы во всех точках термодинамической системы и неизменны во времени, то она называется равновесной, а состояние такой системы - равновесным состоянием. Если же значения хотя бы одного термодинамического параметра различны в разных точках системы или он изменяется во времени, то ее состояние называется неравновесным. Процесс перехода системы из неравновесного в равновесное состояние называется релаксацией, а время, за которое устанавливаются равновесные значения всех параметров системы, - временем релаксации t
Равновесное состояние системы можно изобразить точкой на диаграмме состояний в координатах p, V; p, T или T, V (неравновесное состояние задать на диаграмме состояний нельзя, так как термодинамические параметры для системы различны в разных точках).
Идеальный
газ — математическая
модель газа,
в которой предполагается, что потенциальной
энергией взаимодействия молекул можно
пренебречь по сравнению с их кинетической
энергией
 .Уравнение
состояния в этой форме называют уравнением
Клапейрона–Менделеева.
.Уравнение
состояния в этой форме называют уравнением
Клапейрона–Менделеева.
где М – масса газа, а μ – масса одного моля (молярная масса).
При постоянной температуре и массе из следует, что
 ,
т.е. при постоянной температуре и массе
газа его давление обратно пропорционально
объему. Этот закон называется законом
Бойля и Мариотта,
а процесс, при котором температура
постоянна, называется изотермическим.
,
т.е. при постоянной температуре и массе
газа его давление обратно пропорционально
объему. Этот закон называется законом
Бойля и Мариотта,
а процесс, при котором температура
постоянна, называется изотермическим.Для изобарного процесса, происходящего при постоянном давлении,
 ,
т.е. объем пропорционален абсолютной
температуре. Этот закон называют законом
Гей-Люссака.
,
т.е. объем пропорционален абсолютной
температуре. Этот закон называют законом
Гей-Люссака.Для изохорного процесса, происходящего при постоянном объеме
 ,
т.е. давление пропорционально абсолютной
температуре. Этот закон называют законом
Шарля.
,
т.е. давление пропорционально абсолютной
температуре. Этот закон называют законом
Шарля.
2. Основное уравнение молекулярно-кинетической теории идеального газа
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
-все тела состоят из частиц: атомов, молекул и ионов;
-частицы находятся в непрерывном хаотическом движении (тепловом);
-частицы взаимодействуют друг с другом путём абсолютно упругих столкновений. Основное уравнение МКТ
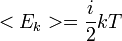 ,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i — число степеней
свободы молекул (
,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i — число степеней
свободы молекул (![]() в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура.
в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Уравнение
состояния идеального
газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) ![]()
где![]() — давление,
— давление,![]() — молярный
объём,
— молярный
объём,![]() — универсальная
газовая постоянная
— универсальная
газовая постоянная
![]() — абсолютная
температура,К.
— абсолютная
температура,К.
Так
как 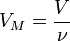 ,
где
,
где ![]() — количество
вещества, а
— количество
вещества, а 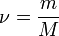 ,
где
,
где ![]() —
масса,
—
масса, ![]() — молярная
масса, уравнение состояния можно
записать:
— молярная
масса, уравнение состояния можно
записать:
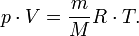
Изопроцессы — равновесные процессы, в которых один из основных параметров сохраняется.
И

 ЗОБАРНЫЙ
ПРОЦЕСС
(
ЗОБАРНЫЙ
ПРОЦЕСС
(![]() )
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
)
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
 или
или  .
ИЗОХОРНЫЙ
ПРОЦЕСС
(
.
ИЗОХОРНЫЙ
ПРОЦЕСС
(![]() )
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
)
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
 или
или  .
ИЗОТЕРМИЧЕСКИЙ
ПРОЦЕСС
(
.
ИЗОТЕРМИЧЕСКИЙ
ПРОЦЕСС
(![]() )
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
)
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
![]() или
или ![]() .
.
3.Внутренняя энергия идеального газа. Закон равномерного распределения энергии по степеням свободы.
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
 ,
,
Средняя
энергия приходящаяся на одну степень
свободы:

У
одноатомной молекулы i =
3, тогда для одноатомных молекул

для
двухатомных молекул
для
трёхатомных молекул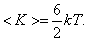
Таким образом, на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы, приходится
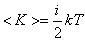
Это и есть закон Больцмана о равномерном распределении средней кинетической энергии по степеням свободы.
4.Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам
Тепло ![]() ,
полученное системой, идет на изменение
ее внутренней
энергии
,
полученное системой, идет на изменение
ее внутренней
энергии ![]() и совершение работы над внешними
телами
и совершение работы над внешними
телами ![]() :
:
![]() .
Первое
начало термодинамики — это закон
сохранения и превращения энергии
применительно к термодинамическим
процессам.
Работа внешних тел над
системой
.
Первое
начало термодинамики — это закон
сохранения и превращения энергии
применительно к термодинамическим
процессам.
Работа внешних тел над
системой  связана
с работой системы над внешними телами
соотношением:
связана
с работой системы над внешними телами
соотношением: ![]() .
.
Работа
газа при изобарическом расширении (при
расширении с постоянным давлением):
![]() .
.
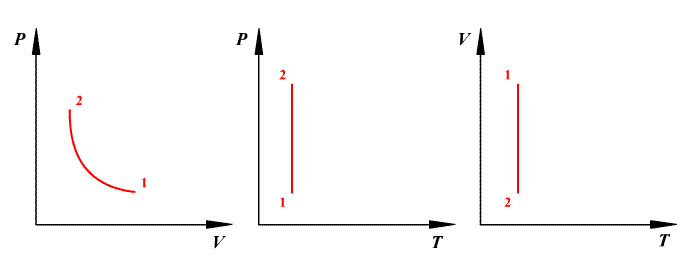
Изохорный
процесс (V=const).
Диаграмма этого процесса (изохора, где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е. ![]() Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии: ![]()
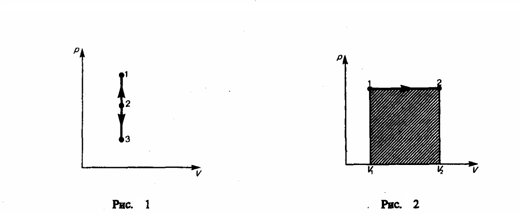
Изобарный
процесс (p=const).
Диаграмма этого процесса (изобара) в
координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна ![]()
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта: ![]() Диаграмма
этого процесса (изотерма) в координатах
р, V представляет собой гиперболу, которая
расположена на диаграмме тем выше, чем
выше температура, при которой происходит
процесс.
Теплоёмкость тела
(обычно обозначается латинской
буквой C) — физическая
величина, определяющая отношение
бесконечно малого количества
теплотыδQ, полученного телом, к
соответствующему приращению
его температуры δT:
Диаграмма
этого процесса (изотерма) в координатах
р, V представляет собой гиперболу, которая
расположена на диаграмме тем выше, чем
выше температура, при которой происходит
процесс.
Теплоёмкость тела
(обычно обозначается латинской
буквой C) — физическая
величина, определяющая отношение
бесконечно малого количества
теплотыδQ, полученного телом, к
соответствующему приращению
его температуры δT:

Единица измерения теплоёмкости в системе СИ — Дж/К.
Из
основного уравнения молекулярно-кинетической
теории ![]() .
При изобарическом процессе Р = const.
Следовательно, получим:
.
При изобарическом процессе Р = const.
Следовательно, получим:
 СР –
теплоемкость при постоянном
давлении.
СР –
теплоемкость при постоянном
давлении.
Это уравнение Майера для одного моля газа. Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе.
