
- •Принцип минимума энергии:
- •Принцип Паули:
- •Правило Гунда:
- •Значения электроотрицательности:
- •Изменения химических свойств элементов и их соединений в группах:
- •Характерные свойства металлов:
- •Ориентационное взаимодействие
- •Индукционное взаимодействие:
- •Дисперсионное взаимодействие:
- •Слабые электролиты:
- •Окислительно – Восстановительные Реакции:
- •Типичные реакции окисления-восстановления
- •Реакции в кислой среде.
- •Реакции в нейтральной среде
- •Реакции в щелочной среде:
- •Классификация:
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Номенклатура:
- •17.5. Химические свойства комплексных соединений
Окислительно – Восстановительные Реакции:
Примером ОВР является изменение степеней окисления элементов.
Метод полуреакций:
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону - анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
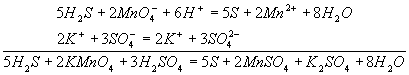
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4- + 8Н+→ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4- + 8Н+ + 5e-= Mn2+ + 4Н2О
Это вторая полуреакция - процесс восстановления окислителя, т.е. перманганат-иона
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
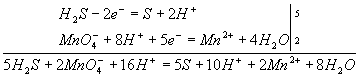
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4- + 6H+ = 5S + 2Mn2+ + 8Н2О
Диспропорциони́рование (дисмутация):
Химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления.
Примером может служить реакция взаимодействия оксида азота(IV) с водой:
![]()
Важнейшие окислители и восстановители:
Восстановители |
Окислители |
Металлы, Водород, Уголь, Окись углерода (II) (CO) Сероводород (H2S), Оксид серы (IV) (SO2), Cернистая кислота H2SO3 и ее соли, Галогеноводородные кислоты и их соли, Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3, Азотистая кислота HNO2, Аммиак NH3, Гидразин NH2NH2, Оксид азота(II) (NO), Катод при электролизе. |
Галогены, Перманганат калия(KMnO4) манганат калия (K2MnO4) оксид марганца (IV) (MnO2) Дихромат калия (K2Cr2O7) хромат калия (K2CrO4) Азотная кислота (HNO3) Серная кислота (H2SO4) концентрированная Оксид меди(II) (CuO) оксид свинца(IV) (PbO2) оксид серебра (Ag2O) пероксид водорода (H2O2) Хлорид железа(III) (FeCl3), Бертоллетова соль (KClO3) Анод при электролизе. |
Окислительно-восстановительный потенциал:
Мера способности химического вещества присоединять электроны (восстанавливаться).
Окисли́тель:
Вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
Виды окислительно-восстановительных реакций:
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Метод полуреакций:
B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается обмен электронами между ионами в растворе с учетом характера среды:
2Cl1- – 2ē |
Cl20 |
|
5 |
MnO41- + 8H+ |
+ 5ē |
Mn2+ + 4H2O |
2 |
7+ |
|
2+ |
|
––––––––––––––––––––––––––––––––––––––
10Cl- + 2MnO41- + 16H+ 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
