
- •Принцип минимума энергии:
- •Принцип Паули:
- •Правило Гунда:
- •Значения электроотрицательности:
- •Изменения химических свойств элементов и их соединений в группах:
- •Характерные свойства металлов:
- •Ориентационное взаимодействие
- •Индукционное взаимодействие:
- •Дисперсионное взаимодействие:
- •Слабые электролиты:
- •Окислительно – Восстановительные Реакции:
- •Типичные реакции окисления-восстановления
- •Реакции в кислой среде.
- •Реакции в нейтральной среде
- •Реакции в щелочной среде:
- •Классификация:
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Номенклатура:
- •17.5. Химические свойства комплексных соединений
Закон сохранения массы:
В изолированной закрытой физической системе всегда сохраняется её общая масса, равная сумме масс компонентов этой системы.
Закон постоянства состава:
Любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Стехиометрия:
(от греч. stoicheion-основа, элемент и metred-измеряю), учение о соотношениях - массовых или объемных реагирующих веществ.
Стехиометрические соединения:
Химические соединения, атомы которых соответствуют простым пропорциям целых чисел, и потому каждое такое соединение представляет собой точную химическую формулу. (Дальтониды)
Нестехиометрические соединения:
Химические соединения, в которых атомы не объединены в простых пропорциях из целых чисел. Состав таких соединений варьируется в зависимости от их источника. Например, оксид титана (IV) (ожидаемая формула TiO2), добываемый из рутиловых руд, обычно имеет формулу TiО1,8. (Бертолиды)
Закон Авогадро:
В равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Количество вещества:
Физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
n=m/M n=V/Vm n=N/Na
Число Авогаадро:
Физическая константа, численно равная количеству структурных единиц в 1 моле вещества. Определяется как количество атомов в 12 граммах изотопа углерода-12.
Эквивалент:
Частица вещества, которая равноценна (эквивалентна) одному катиону водорода Н+. в кислотно-основных взаимодействиях или 1е в ОВР.
Фактор эквивалентности:
Отношение
эквивалентной молярной массы к его
собственной молярной массе (обозначается
обычно как
![]() ).
).
Молярный объем эквивалента:
Объем, который занимает при нормальных условиях молярная масса эквивалента газообразного вещества (г/моль).
Vэ= fэ*Vn
V=22,4 (при н.у.)
nэ= m/Mэ (моль)
Mэ=fэ*M
Закон эквивалентов:
Вещества реагируют в количествах, пропорциональных их эквивалентам
m1/Mэ1=m2/Mэ2
nэ1=nэ2
m1/Mэ1=V2/Vэ2
Таблица 1.1 – Расчет фактора эквивалентности
Частица |
Фактор эквивалентности |
Примеры |
Элемент |
где В(Э) – валентность элемента |
|
Простое вещество |
где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента |
fЭ(H2) = 1/(21) = 1/2; fЭ(O2) = 1/(22) = 1/4; fЭ(Cl2) = 1/(21) = 1/2; fЭ(O3) = 1/(32) = 1/6 |
Оксид |
, где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента |
fЭ(Cr2O3) = 1/(23) = 1/6; fЭ(CrO) = 1/(12) = 1/2; fЭ(H2O) = 1/(21) = 1/2; fЭ(P2O5) = 1/(25) = 1/10 |
Кислота |
где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты) |
fЭ(H2SO4) = 1/1 = 1 (основность равна 1) или fЭ(H2SO4) = 1/2 (основность равна 2) |
Основание |
где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) |
fЭ(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или fЭ(Cu(OH)2) = 1/2 (кислотность равна 2) |
Соль |
где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка |
fЭ(Cr2(SO4)3) = 1/(23) = 1/6 (расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(32) = 1/6 (расчет по кислотному остатку)
|
Частица в окислительно-восстановительных реакциях |
где
|
Fe2+
+ 2 fЭ(Fe2+) =1/2;
MnO4– + 8H+ + 5 Mn2+ + 4H2O fЭ(MnO4–) = 1/5 |
Ион |
где z – заряд иона |
|
Изото́пы:
(от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа.
Изоба́ры
(в ед.ч. изоба́р; др.-греч. ἴσος (isos) — «одинаковый» + βάρος (baros) — «вес») — нуклиды разных элементов, имеющие одинаковое массовое число; например, изобарами являются 40Ar, 40K, 40Ca
Принципы заполнения электронных орбиталей:
Принцип минимума энергии:
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1s
< 2s < 2 p < 3s < 3p < 4s
< 3d < 4p < 5s < 4d < 5p
< 6s < 4f![]() 5d
< 6p < 7s < 5f
6d...
5d
< 6p < 7s < 5f
6d...
Атом водорода имеет один электрон, который может находиться на любой орбитали. Однако, в основном состоянии он должен занимать 1s-орбиталь, имеющую самую низкую энергию.
В атоме калия последний девятнадцатый электрон может заселить либо 3d-, либо 4s-орбиталь. В соответствии с принципом минимума энергии, электрон занимает 4s-орбиталь, что подтверждается экспериментом.
Принцип Паули:
Принцип Паули, который часто называют еще принципом запрета, ограничивает число электронов, которые могут находиться на одной орбитали. Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами (n, l, ml, ms).
Атом лития имеет три электрона. Орбиталь с самой низкой энергией - 1s-орбиталь - может быть заселена лишь двумя электронами, причем у этих электронов должны быть разные спины. Если обозначать спин +1/2 стрелкой, направленной вверх, а спин −1/2 - стрелкой, направленной вниз, то два электрона с противоположными (антипараллельными) спинами на одной орбитали можно схематически представить так:
![]()
Правило Гунда:
Правило Гунда (Хунда) определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Гундом (Хундом) в 1927 г. на основе анализа атомных спектров.
Согласно правилу Гунда, заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Например, атом азота имеет три электрона, находящиеся на 2р-подуровне. Согласно правилу Гунда, они должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины:
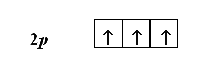
Квантовая химия:
Направление химии, рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики.
Квантовые числа:
Энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
 и
и
 .
.
Уравнение Луи де Бройля:
![]()
Правило Клечковского
Эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
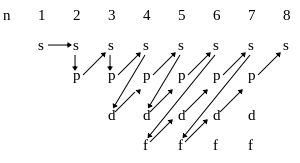
Правило Клечковского гласит:
Заполнение
электронами орбиталей в атоме происходит
в порядке возрастания суммы главного
и орбитального
квантовых
чисел
![]() .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
![]() .
.
n |
1 |
2 |
3 |
l |
5 |
4 |
3 |
Таблица 1. Энергетическая последовательность орбиталей в изолированных атомах |
||||
(n+l) |
n |
l |
Атомные орбитали |
|
1 |
1 |
0 |
1s |
Первый период |
2 |
2 |
0 |
2s |
Второй период |
3 |
2 |
1 |
2p |
|
3 |
0 |
3s |
Третий период |
|
4 |
3 |
1 |
3p |
|
4 |
0 |
4s |
Четвёртый период |
|
5 |
3 |
2 |
3d |
|
4 |
1 |
4p |
||
5 |
0 |
5s |
Пятый период |
|
6 |
4 |
2 |
4d |
|
5 |
1 |
5p |
||
6 |
0 |
6s |
Шестой период |
|
7 |
4 |
3 |
4f |
|
5 |
2 |
5d |
||
6 |
1 |
6p |
||
7 |
0 |
7s |
Седьмой период |
|
8 |
5 |
3 |
5f |
|
6 |
2 |
6d |
||
7 |
1 |
7p |
||
8 |
0 |
8s |
Начало восьмого периода |
|
Приведённую в таблице очерёдность заполнения электронами атомных орбиталей удобно представить в виде схемы:
Изоэлектронные частицы:
Изоэлектронными называются частицы (молекулы, ионы), имеющие одинаковое общее число электронов
*
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Окисление — это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд. Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны. Окислитель в процессе реакции восстанавливается, восстановитель — окисляется.
Восстановление — это процесс принятия электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд.
Атомные радиусы:
Эффективные характеристики атомов, позволяющие приближенно оценивать межатомное (межъядерное) расстояние в молекулах и кристаллах.
Энергия ионизации:
Разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность. В группе элементов энергия ионизации уменьшается с повышением порядкового номера элемента. Это обусловлено увеличением размеров атомов и экранированием внешних электронов внутренними.
Эне́ргией сродства́ а́тома к электро́ну (ε):
Энергия, выделяющаяся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующ Энергия, которая выделяется (или затрачивается) при присоединении к нейтральному атому электрона с образованием отрицательного иона: Э + е → Э- + ЕАего изолированного однозарядного аниона).
Эле́ктроотрица́тельность (χ):
Фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
