
- •12) Свойства аминокислот
- •Амфотерные свойства и изоэлектрическая точка белков
- •23) 1. Состав нуклеиновых кислот
- •24) 1.1. Состав днк
- •1.2. Состав рнк
- •Участвующие в трансляции
- •26) Биосинтез белка
- •Активный центр ферментов
- •34) Классификация белков (по форме, по сложности строения, по растворимости, по функциям)
- •Виды нуклеиновых кислот – днк и рнк, их биологическая роль, локализация в клетке, хим. Состав. Понятие о нуклеотидах и нуклеозидах.
- •30) Роль витаминов в обмене веществ. Классификация витаминов. Гипо-, авитаминозы. Связь между витаминами и ферментами. Общая характеристика жирорастворимых витиминов
- •Витамины группы к
- •32) Ферментативных реакций кинетика
- •35) Окисление биологическое
- •Роль глюкозы в организме человека
- •Регуляция уровня глюкозы (сахара) в крови.
- •Гликолиз
- •47) Азотистый баланс
47) Азотистый баланс
Баланс азота в организме (разность между количеством потребляемого и выделяемого азота) — один из широко используемых индикаторов белкового обмена. У здорового человека скорости анаболизма и катаболизма находятся в равновесии, поэтому азотистый баланс равен нулю. При травме или при стрессе, например при ожогах, потребление азота снижается,а потери азота повышаются, вследствие чего у больного азотистый баланс становится отрицательным. При выздоровлении азотистый баланс должен становиться положительным вследствие получения белка с пищей. Исследование азотистого баланса даёт более полную информацию о состоянии пациента, имеющего метаболические потребности в азоте. Оценка экскреции азота у критических больных позволяет судить о количестве азота, потерянного в результате протеолиза.Для оценки азотистого баланса используют два способа измерения потерь азота с мочой:
■ измерение азота мочевины в суточной моче и расчётный метод определения общей потери азота;
■ прямое измерение общего азота в суточной моче.
Общий азот включает все продукты обмена белков, выводимые с мочой. Количество общего азота сопоставимо с азотом усвоенного белка и составляет примерно 85% азота, поступившего с белками пищи. Белки содержат в среднем 16% азота, следовательно, 1 г выделенного азота соответствует 6,25 г белка. Определение суточного выделения азота мочевины с мочой позволяет удовлетворительно оценивать величину азотистого баланса (АБ) при максимально возможном учёте поступления белка: АБ = [поступивший белок (г)/6,25] - [суточные потери азота мочевины (г) + 3], где число 3 отражает приблизительные потери азота с калом и др.Этот показатель (АБ) является одним из самых надёжных критериев оценки белкового обмена организма. Он позволяет своевременно выявить катаболическую стадию патологического процесса, оценить эффективность коррекции питания и динамику анаболических процессов. Установлено, что в случаях коррекции выраженного катаболического процесса необходимо довести АБ с помощью искусственного питания до +4-6 г/сут. Важно следить за экскрецией азота изо дня в деньПрямое определение общего азота в моче предпочтительнее исследования азота мочевины, особенно у критических больных. Выделение общего азота с мочой в норме составляет 10-15 г/сут, его процентное содержание распределяется следующим образом: 85% — азот мочевины, 3% — аммония, 5% — креатинина, 1% — мочевой кислоты. Расчёт АБ по общему азоту проводят по следующей формуле: АБ = [поступивший белок (г)/6,25] --[суточные потери общего азота (г) + 4].Определение общего азота в моче во время начальной катаболической стадии необходимо проводить через день, а затем 1 раз в неделю.
Азотистый баланс-разность между количеством азота, который попадает в организм с пищей, и количеством азота, выводимого из организма с мочой, калом, потом; показатель уровня азотистого обмена организма.
48) Распад аминокислот в тканях до конечных продуктов обмена
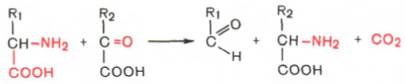
Основные пути распада аминокислот - это дезаминирование и декарбоксилирование. Дезаминирование - это отщепление аминогруппы в виде аммиака NH3 при действии специфических ферментов: дезаминазы, дегидрогеназы и других.Различают четыре вида дезаминирования: окислительное, восстановительное, гидролитическое и внутримолекулярное.
1.окислительное дезаминирование. Протекает в две реакции, сопровождается образованием кетокислот и NH3:
R НАДН2 ? О2 Н2О (3 АТФ) R R
CH - NH2 дегидрогеназа, + НАД C = NH + Н2О C = O + NH3
COOH COOH COOH
Аминокислота иминокислота кетокислота
2.востановительное дезаминирование. Протекает в основном в пищеварительном тракте под действием микроорганизмов.
R R
CH - NH2 + H2 CH2 + NH3
COOH COOH
Насыщенная жирная кислота
3.гидролитическое дезаминирование. Протекает в пищеварительном тракте под действием микрофлоры, при этом образуются оксикислоты и NH3.
R R
CH - NH2 + HOH CH - OH + NH3
COOH COOH
Оксикислота
4.внутримолекулярное дезаминирование. Участвуют микроорганизмы. В тканях представлено только для гистидина:
N CH2 - CH - COOH N CH = CH - COOH
NH2 + NH3
NH NH
гистидин уранотиновая кислота
Основной путь дезаминирования в тканях - это окислительное дезаминирование. Протекает путем дегидратации, под действием фермента дегидрогеназы.Но в тканях животных активен только дегидрогеназа глутаровой кислоты - глутамодегидрогеназа. Поэтому прямым путем окислительному дезаминированию в тканях может подвергаться только глутаровая кислота, а все остальные аминокислоты подвергаются непрямому окислительному дезаминированию, предварительно вступая в переаминирование с ?-кетоглутаровой кислотой. Переаминирование - это перенос аминогрупп с аминокислоты на кетокислоту. При этом образуется глутаминовая кислота и идет последующее дезаминирование.
Непрямой путь окислительного дезаминирования.
Протекает в 2 стадии:
1.переаминирование аминокислоты с ?-кетоглутаровой кислотой:
R COOH R COOH
CH - NH2 + CH2 аминотрансфераза C = O + CH2
COOH CH2 COOH CH2
амино- C = O кето- CH - NH2
кислота COOH кислота COOH
?-кетоглутаровая кислота глутаровая кислота
2.окислительное дезаминирование глутаминовой кислоты с образованием кетокислоты:
COOH НАДН2 ? О2 Н2О (3 АТФ) COOH COOH
CH2 + НАД CH2 CH2
CH2 глутаматдегидрогеназа CH2 + HOH CH2 + NH3
CH - NH2 C = NH C = O
COOH COOH CH2
Глутаровая кислота иминокислота ?-кетоглутаровая кислота
?-кетоглутаровая кислота может снова вступать в реакцию переаминирования с аминокислотами.
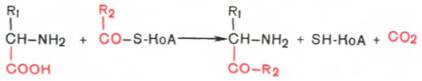
Декарбоксилирование аминокислот.
Это отщепление СО2 от карбоксильной группы. При этом образуются амины:
R R
CH - NH2 -CO2ДЕКАРБОКСИЛАЗА ФП CH2 - NH2
COOH амин
При тканевом декарбоксилировании аминокислот образуется физиологически активные амины, например, при декарбоксилировании гистидина - гистамин, цистеина - цистамин, из которого затем образуется таурин, входит в состав желчных кислот.
N CH2 - CH - COOH - СО2 N CH2 - CH2 - NH2
NH2 декарбоксилаза ФП
NH NH
гистидин гистамин
Гистамин расширяет кровеносные сосуды, снижает кровяное давление, возбуждает перистальтику матки и др.
CH2 - SH CH2 - SH CH2 - SO3H
CH - NH2 - CO2 CH2 - NH2 + 3 [O] CH2 - NH2
COOH цистамин таурин
цистеин
При декарбоксилировании глутаминовой кислоты образуется ?-аминомасляная кислота.
COOH COOH
CH2 CH2
CH2 -CO2 CH2
CH - NH2 CH2 - NH2
COOH ?-аминомасляная кислота
Глутаминовая
Кислота
?-аминомасляная кислота участвует в передаче нервных импульсов с нервных окончаний, является противосклеротическим веществом, используется как лекарство.
Обезвреживание аммиака в организме животных
Образуется при дезаминировании NH3, обезвреживается следующими путями:
1.образование солей аммония:
NH3 + HCL NH4CL
2. образование амидов кислот (аспарагиновой и глутаминовой).
COOH O = C - NH2
CH2 CH2
CH2 + NH3 -H2O CH2
CH - NH2 + H2O CH - NH2
COOH COOH
Глутаминовая глутамин
Кислота
Аналогично идет образование аспарагина. Глутамин и аспарагин являются резервом азота в организме. При недостатке аммиака реакция идет в обратном направлении.
3.аммиак участвует в биосинтезе заменимых аминокислот путем восстановительного аминирования кетокислот
R R R
C = O + NH3 - H2O C = NH + H2 CH - NH2
COOH COOH COOH
4. образование мочевины - это главный путь обезвреживания аммиака. 92% азота выводится из организма с мочой в виде мочевины. При образовании мочевины используется 1 молекула СО2 и 2 молекулы NH3.
NH2
CO2 + 2NH3 C = O + H2O
NH2
Мочевина
Впервые это установили Павлов, Ненский и другие. Позже было доказано, что в печени накапливаются аминокислота аргинин, здесь же активен фермент аргиназа. Отмечалось, что аргинин расщепляется под действием аргиназы гидролитическим путем с образованием орнитина и мочевины.
Мочевина иминная форма
NH2 - C = NH NH2
NH C - OH CH2 - NH2
CH2 + HOH NH CH2
CH2 NH2 + CH2
CH2 C = O CH - NH2
CH - NH2 NH2 COOH
COOH мочевина орнитин
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилиро-ванию в животных тканях, образующиеся продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глу-таминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цис-теина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто де-карбоксилирование ряда других аминокислот.В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
![]()
2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
![]()
3. Декарбоксилирование, связанное с реакцией трансаминирования:
В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:
Эта реакция в тканях животных осуществляется при синтезе δ-амино-левулиновой кислоты из глицина и сукцинил-КоА (см. главу 13) и при синтезе сфинголипидов, а также у растений при синтезе биотина.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот (см. главу 10) как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз.Таким образом, в двух совершенно различных процессах обмена аминокислот участвует один и тот же кофермент. Исключение составляют две декарбоксилазы: гистидиндекарбоксилаза Micrococcus и Lactobacilus и аденозилметионин-декарбоксилаза Е. coli, содержащие вместо ПФ остаток пировиноградной кислоты.Механизм реакции декарбоксилирования аминокислот в соответствии с общей теорией пиридоксалевого катализа (см. рис. 12.3) сводится к образованию ПФ-субстратного комплекса, представленного, как и в реакциях трансаминирования, шиффовым основанием ПФ и аминокислоты:
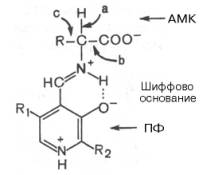
Образование подобного комплекса в сочетании с некоторым оттягиванием электронов белковой частью молекулы фермента сопровождается лабилизацией одной из трех связей при α-углеродном атоме, благодаря чему аминокислота способна вступать в реакции трансаминирования (а), декарбоксилирования (b) и альдольного расщепления (с).далее представлены отдельные примеры декарбоксилирования аминокислот, в частности тех, продукты реакции которых оказывают сильное фармакологическое действие. Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот. Она не обладает строгой субстратной специфичностью и катализирует декарбок-силирование L-изомеров триптофана, 5-окситриптофана и 3,4-диоксифе-нилаланина (ДОФА); продуктами реакций, помимо СО2, являются соответственно триптамин, серотонин и диоксифенилэтиламин (дофамин).Биогенные амины — вещества, обычно образующиеся в организме животных или растений из аминокислот при их декарбоксилировании (удалении карбоксильной группы) ферментами декарбоксилазами и обладающие высокой биологической активностью. К биогенным аминам относятся дофамин, норадреналин и адреналин (синтезируются изначально из аминокислоты тирозина), серотонин, мелатонин и триптамин (синтезируются из триптофана) и многие другие соединения. В организме животных многие биогенные амины выполняют роль гормонов и нейромедиаторов. Разлагаются в организме при участии ферментов аминоксидаз.Биогенными аминами (устаревший синоним термина — трупные яды, птомаины) также называют биогенные диамины, получающиеся в результате гнилостных процессов — частичного разложения белка и декарбоксилирования его аминокислот, ведущая роль среди которых принадлежит путресцину и кадаверину, а также спермидин и спермин. Имеют характерный отвратительный «сладковатый» (типичный трупный) запах. Однако острая токсичность полиаминов (в опытах на крысах) сравнительно невелика: кадаверин — 2000 мг/кг, путресцин — 2000 мг/кг, спермидин и спермин — 600 мг/кг.Кроме того, ранее трупным ядом называли гипотетическое вещество, действию которого приписывали смертельные заболевания лиц, вскрывающих трупы; по современным представлениям, причина этих заболеваний — заражение патогенными микроорганизмами.Птомаин (устар.) — токсичные вещества, яды, продукты гниения. До становления токсикологии это слово использовали, подразумевая суммарное впечатление от неприятного запаха падали (вызываемого, в частности, некоторыми аминами — продуктами микробного разложения белков, см. напр. кадаверин) и опасности отравления — от трупов можно было инфицироваться, животные, съевшие такое мясо, могли отравиться.
49) казано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака.
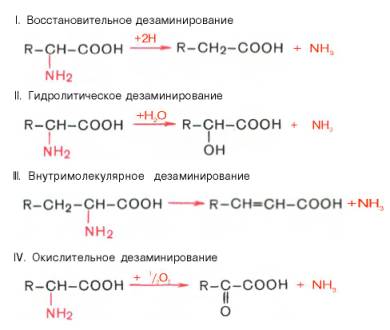
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гис-тидина, подвергающегося внутримолекулярному дезаминированию.Рассмотрим более подробно механизм окислительного дезаминиро-вания аминокислот, протекающего в две стадии.
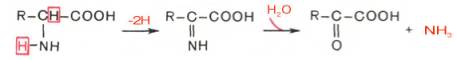
Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта (иминокислота), который на второй стадии спонтанно без участия фермента, но в присутствии воды распадается на аммиак и α-кетокислоту. Следует указать, что оксидазы аминокислот (L- и D-изомеров) являются сложными флавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые выполняют в этой реакции роль акцепторов двух электронов и протонов, отщепляющихся от аминокислоты. Оксидазы L-аминокислот могут содержать как ФМН, так и ФАД, а оксидазы D-аминокислот – только ФАД в качестве простетической группы. Схематически реакции окислительного дезами-нирования аминокислот с участием коферментов могут быть представлены в следующем виде:
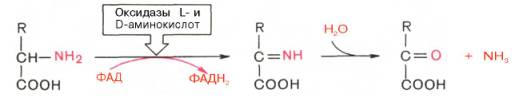
Восстановленные флавиннуклеотиды оксидаз L- и D-аминокислот могут непосредственно окисляться молекулярным кислородом. При этом образуется перекись водорода, которая подвергается расщеплению под действием каталазы на воду и кислород.
![]()
Впервые в лаборатории Д. Грина из ткани печени и почек крыс была выделена оксидаза, катализирующая дезаминирование 12 природных (L-изомеров) аминокислот. Оказалось, однако, что этот фермент имеет оптимум действия в щелочной среде (рН 10,0) и при физиологических значениях рН его активность на порядок ниже, чем при рН 10,0. В тканях животных и человека отсутствует подобная среда, поэтому оксидазе L-ами-нокислот принадлежит, вероятнее всего, ограниченная роль в процессе окислительного дезаминирования природных аминокислот. В животных тканях оксидазным путем со значительно большей скоростью дезами-нируются D-изомеры аминокислот. Эти данные подтвердились после того, как из животных тканей был выделен специфический фермент оксидаза D-аминокислот, который в отличие от оксидазы L-аминокислот оказался высокоактивным при физиологических значениях рН среды. Не до конца ясным остается вопрос о том, каково значение столь активной оксидазы D-аминокислот в тканях, если поступающие с пищей белки и белки тела животных и человека состоят исключительно из природных (L-изомеров) аминокислот.В животных тканях Г. Эйлером открыт высокоактивный при физиологических значениях рН специфический фермент (глутаматдегидрогеназа), катализирующий окислительное дезаминирование L-глутаминовой кислоты. Он является анаэробным ферментом и чрезвычайно широко распространен во всех живых объектах. В качестве кофермента глутамат-дегидрогеназа содержит НАД (или НАДФ). Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с образованием промежуточного продукта – иминоглутаровой кислоты и спонтанный гидролиз последней на аммиак и α-кетоглутаровую кислоту в соответствии со следующей схемой:
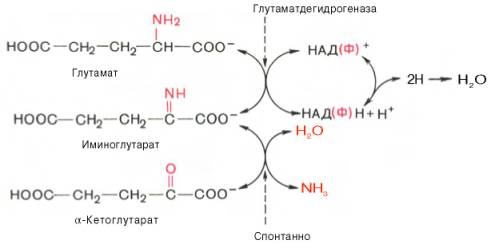
Первая стадия окисления глутаминовой кислоты аналогична реакции окислительного дезаминирования. Восстановленный НАДН далее окисляется при участии флавиновых ферментов и цитохромной системы (см. главу 9) с образованием конечного продукта воды. Образовавшийся аммиак благодаря обратимости ферментативной реакции, но обязательно в присутствии восстановленного НАДФН может участвовать в синтезе глу-тамата из α-кетоглутаровой кислоты. Различают три разных типа глутаматдегидрогеназ: один из них использует в качестве кофермента как НАД, так и НАДФ (клетки животных); два других используют или НАД, или НАДФ (микроорганизмы, клетки растений и грибов), соответственно катализируя дезаминирование или биосинтез глутамата.
Глутаматдегидрогеназа животных тканей является одним из наиболее изученных ферментов азотистого обмена. Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединиц (мол. масса каждой около 52000) и проявляющий свою основную активность только в мультимерной форме. При диссоциации этой молекулы на субъединицы, наступающей легко в присутствии НАДН, ГТФ и некоторых стероидных гормонов, фермент теряет свою главную глутаматдегидрогеназную функцию, но приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природе глутаматдегидрогеназы, действующей как регуляторный фермент в аминокислотном обмене.Помимо перечисленных 4 типов дезаминирования аминокислот и ферментов, катализирующих эти превращения, в животных тканях и печени человека открыты также три специфических фермента (серин- и треонин-дегидратазы и цистатионин-γ-лиаза), катализирующих неокислительное дезаминирование соответственно серина, треонина и цистеина.
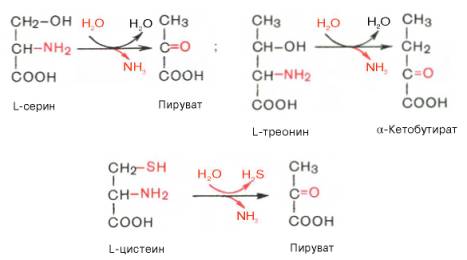
Конечными продуктами реакции являются пируват и α-кетобутират, аммиак и сероводород. Поскольку указанные ферменты требуют присутствия пиридоксальфосфата в качестве кофермента, реакция неокислительного дезаминирования, вероятнее всего, протекает с образованием шиффовых оснований как промежуточных метаболитов.Наиболее изучен фермент треониндегидратаза, которая оказалась не только аллостерическим ферментом, но наряду с триптофан-2,3-диокси-геназой и тирозинаминотрансферазой индуцибельным ферментом в животных тканях (индукция синтеза ферментов de novo является общим свойством микроорганизмов). Так, при скармливании крысам гидролизата казеина активность треониндегидратазы печени повышается почти в 300 раз. Этот синтез тормозится ингибитором белкового синтеза пуромицином. Поскольку индукция почти полностью тормозится также глюкозой пищи, треонингидратаза, по-видимому, является ответственной за глюконеогенез, так как α-кетобутират легко превращается в пируват и соответственно в глюкозу.
50) Пути образования аммиака
Аммиак образуется во всех тканях, особенно в головном мозге, а обезвреживается преимущественно в печени и почках.Пути образования аммиака: 1) дезаминирование аминокислот; 2) дезаминирование пуриновых оснований; 3) распад пиримидиновых оснований; 4) дезамидирование амидов; 5) дезаминирование биогенных аминов; 6) распад гексозаминов
Дезаминирование – основной путь распада (катаболизма) аминокислот. В сутки подвергается дезаминированию около 70г аминокислот. Различают следующие виды дезаминирования: 1) гидролитический
восстановительное дезаминирование
внутримолекулярное дезаминирование. Этому виду дезаминирования подвергаются асп, асн и гис
4) окислительное дезаминирование. Этот вид дезаминирования является основным, ему подвергается только глу. Процесс происходит под действием фермента – глутаматДГ, которая находится в активном виде, а все остальные оксидазы аминокислот неактивны при физиологическом значении рН. Поэтому аминокислоты, оксидазы которых неактивны, должны вначале перейти в глу путем переаминирования с a-КГ. Отсюда второе название этого вида дезаминирования – непрямое. Переаминированию подвергаются все 20 аминокислот кроме тре и лиз. Реакция переаминирования была открыта в 1937году Браунштейном и КрицманомТ.о., при дезаминировании аминокислот получаются безазотистые остатки аминокислот, преимущественно кетокислоты и выделяется аммиак.В основном образуются следующие безазотистые остатки – 1) ПВК; 2) a-КГ, 3) АЯК, 4) ЩУК, 5) фумарат, 6) кетогенные аминокислоты (лей, иле, фен, тир, три) при дезаминировании дают ацетоацетилКоА, который используется для образования кетоновых тел.Безазотистые остатки аминокислот преимущественно используются в ЦТК. Но тем не менее, только 10% от суточной потребности в энергии покрывается за счет распада аминокислот.Из безазотистых остатком могут образоваться глюкоза через ЩУК (глюконеогенез), липиды через АУК, которая может образоваться из ПВК, из ацетоацетилКоА (липонеогенез), при необходимости часть безазотистых остатков аминокислот можно использовать для синтеза аминокислот.Дезаминирование биогенных аминов является одним из путей образования аммиака в организме. Биогенные амины разрушаются окислительными ферментами – МАО. В условиях блокады МАО, при терапии антидепрессантами способность разрушать биогенные амины резко снижается. Организм может стать избыточно чувствительным к экзогенным моноаминам – например, прием в пищу сыра, красного вина, которые богаты тирамином, на фоне приема антидеперссантов может вызвать гипертензию. Активность МАО понижается при гипертиреозе. Наоборот, при дефиците витамина В1 наблюдается избыточная активность МАО и нехватка биогенных аминов, что сопровождается депрессией. Окислительное дезаминирование гистамина катализирует пиридоксальзависимый фермент гистаминаза.
Пути обезвреживания аммиакаАммиак в малых дозах – это физиологический раздражитель, а в больших дозах это токсическое вещество. Поэтому концентрация аммиака в организме должна находится на низком уровне – 60мкМ/л (в 100 раз меньше концентрации глюкозы в крови). В опытах на кроликах показано, что концентрация аммиака в крови 3 мМ/л является летальной. Однако аммиака образуется очень много. Гомеостаз аммиака поддерживается за счет его обезвреживания в тканях.Пути обезвреживания аммиака: 1) амидирование; 2) аммонийгенез; 3) восстановительное аминирование; 4) синтез мочевины.Основным путем обезвреживания аммиака является реакция амидирования. Амидирование происходит во всех тканях, особенно там, где много образуется аммиака – в головном мозге. Амидированию подвергаются преимущественно 2 аминокислоты – глу и асп. Реакция требует наличия АТФ, ускоряется ферментами – ГЛН-синтетазой и АСН-синтетазой соответственно.
При этом образуются транспортные формы аммиака — амиды глу и асп – глн и асн.
Значение реакции амидирования
временное обезвреживание аммиака и его транспорт
глн и асн, образующиеся при амидировании, используются для синтеза белков
глн и асн используются для синтеза гексозаминов, необходимых для образования ГАГов
глн и асн используются для образования пуринов и пиримидинов
Глн и асн приносятся в печень и почки и подвергаются обратной реакции – дезамидированию, причем эта реакция также требует АТФ.Аммиак, образующийся при дезамидировании в печени, обезвреживается, используясь на синтез мочевины. Образующийся при дезамидировании в почках, аммиак идет на образование аммонийных солей (аммонийгенез).Аммонийгенез. Аммиак, образующийся при дезамидировании и дезаминировании в почках поступает в канальцы почек. Сюда же экскретируются ионы водорода, которые образуются при диссоциации угольной кислоты в клетках почечных канальцев. Здесь происходит взаимодействие аммиака с ионами водорода и образуются катионы аммония.В канальцевую мочу также выделяются растворимые соли натрия, калия и кальция (хлориды, фосфаты, сульфаты). Эти соли диссоциируют и катионы (натрий, калий, кальций) реабсорбируются, а анионы (хлор, фосфат, сульфат) связываются с катионами аммония, образуя аммонийные соли – хлорид аммония, фосфат аммония, сульфат аммония, которые выводятся с мочойТ.о., значение аммонийгенеза гомеостатическое, т.к.: – 1) сберегаются ионы натрия, калия и кальция; 2) выводится избыток водорода, т.е. происходит нейтрализация кислых продуктов. В печени и других тканях аммиак обезвреживается в результате реакции восстановительного аминирования. Этот процесс является одним из путей образования заменимых аминокислот и лежит в основе токсического действия аммиака, т.к. аммиак, связываясь с a-КГ, выводит эту кислоту из ЦТК, при этом ЦТК замедляется и АУК не используется, а идет на синтез кетоновых тел, что приводит к кетоацидозу.Преимущественно в печени идет процесс образования мочевины, являющийся основным путем обезвреживания аммиака. Этот процесс открыт Кребсом в 1932году. Образование мочевины получил название орнитиновый цикл, или цитруллиновая теория. Синтез мочевины протекает в митохондриях печени. Процесс начинается с образования карбомоилфосфата. Реакция конденсации идет между СО2, NН3, Н2О. Требуется энергия 2 молекул АТФ.
2 реакция – образование цитруллина. Реакция идет между орнитином и карбомоилфосфатом. В результате получается цитруллин и выделяется молекула фосфорной кислоты
3 реакция – образование аргинин-янтарной кислоты. Реакция идет между асп и цитруллином, используется энергия АТФ
4 реакция – расщепление аргинин-янтарной кислоты на арг и фумарат
5 реакция – гидролиз арг под действием аргиназы до мочевины и орнитина – цикл замыкается.
Т.о., азот мочевины взят на 50% от аммиака и 50% от асп. Т.о., для синтеза мочевины необходима молекула асп, убыль которой можно восстановить, используя цикл, который также был открыт Кребсом. Фумарат, гидратируясь, дает малат, который, окисляясь, дает ЩУК. При переаминировании ЩУК образуется асп.
Конечные продукты обмена простых белков.Мочевина, 2. Креатинин, 3. Эфиросерные и эфироглюкуроновые кислоты, 4. СО2 и Н2О, 5. Аммонийные соли, 6. Гиппуровая кислота, 7. Альдегиды и кетоны при обезвреживании биогенных аминов – это конечные продукты обмена простых белков.
52) Живой организм и его функционирование находятся в постоянной зависимости от окружающей среды. Интенсивность обмена с внешней средой и скорость внутриклеточных процессов обмена веществ поддерживают постоянство внутренней среды и целостность организма.Как было указано, обмен веществ в организме человека протекает не хаотично; он интегрирован и тонко настроен. Все превращения органических веществ, процессы анаболизма и катаболизма тесно связаны друг с другом. В частности, процессы синтеза и распада взаимосвязаны, координированы и регулируются нейрогормональными механизмами, придающими химическим процессам нужное направление. В организме человека, как и в живой природе вообще, не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в целостный процесс метаболизма, подчиняющийся диалектическим закономерностям взаимозависимости и взаимообусловленности, допускающий также взаимопревращения между отдельными классами органических веществ. Подобные взаимопревращения диктуются физиологическими потребностями организма, а также целесообразностью замены одних классов органических веществ другими в условиях блокирования какого-либо процесса при патологии.Еще Кребс и Корнберг отмечали, что, несмотря на огромное разнообразие пищевых веществ (белки, жиры, углеводы), число химических реакций, обеспечивающих их превращения (распад) и образование энергии, «удивительно мало». Эти закономерности свойственны как организму животных и человека, так и микроорганизмам и растениям.В настоящее время экспериментально обосновано существование четырех главных этапов распада молекул углеводов, белков и жиров, которые интегрируют образование энергии из основных пищевых источников. На I этапе полисахариды расщепляются до моносахаридов (обычно гексоз); жиры распадаются на глицерин и высшие жирные кислоты, а белки – на составляющие их свободные аминокислоты. Следует подчеркнуть, что указанные процессы в основном являются гидролитическими, поэтому освобождающаяся в небольшом количестве энергия почти целиком используется организмами в качестве тепла.На II этапе мономерные молекулы (гексозы, глицерин, жирные кислоты и аминокислоты) подвергаются дальнейшему распаду, в процессе которого образуются богатые энергией фосфатные соединения и ацетил-КоА. В частности, при гликолизе гексозы расщепляются до пировиноград-ной кислоты и далее до ацетил-КоА. Этот процесс сопровождается образованием ограниченного числа богатых энергией фосфатных связей путем субстратного фосфорилирования. На этом этапе высшие жирные кислоты аналогично распадаются до ацетил-КоА, в то время как глицерин окисляется по гликолитическому пути до пировиноградной кислоты и далее до ацетил-КоА. Для аминокислот ситуация на II этапе несколько отлична. При преимущественном использовании аминокислот в качестве источника энергии (при дефиците углеводов или при сахарном диабете) некоторые из них непосредственно превращаются в метаболиты лимоннокислого цикла (глутамат, аспартат), другие – опосредованно через глутамат (пролин, гистидин, аргинин), третьи – в пируват и далее в ацетил-КоА (аланин, серин, глицин, цистеин). Наконец, ряд аминокислот, в частности лейцин, изо-лейцин, расщепляется до ацетил-КоА, а из фенилаланина и тирозина, помимо ацетил-КоА, образуется оксалоацетат через фумаровую кислоту. Как видно, II этап можно назвать этапом образования ацетил-КоА, являющегося по существу единым (общим) промежуточным продуктом катаболизма основных пищевых веществ в клетках.На III этапе ацетил-КоА (и некоторые другие метаболиты, например α-кетоглутарат, оксалоацетат) подвергаются окислению («сгоранию») в цикле ди- и трикарбоновых кислот Кребса. Окисление сопровождается образованием восстановленных форм НАДН + Н+ и ФАДН2.На IV этапе осуществляется перенос электронов от восстановленных нуклеотидов на кислород (через дыхательную цепь). Он сопровождается образованием конечного продукта – молекулы воды. Этот транспорт электронов сопряжен с синтезом АТФ в процессе окислительного фосфо-рилирования (см. главу 9).Необходимо отметить, что, помимо взаимных переходов между разными классами веществ в организме, доказано существование более сложных форм связи. В частности, интенсивность и направление любой химической реакции определяются ферментами, т.е. белками, которые оказывают непосредственное влияние на обмен липидов, углеводов и нуклеиновых кислот. В свою очередь синтез любого белка-фермента требует участия ДНК и всех 3 типов рибонуклеиновых кислот: тРНК, мРНК и рРНК. Если к этому добавить влияние гормонов, а также продуктов распада какого-либо одного класса веществ (например, биогенных аминов) на обмен других классов органических веществ, то становятся понятными удивительная согласованность и координированность огромного разнообразия химических процессов, совершающихся в организме. Многие из этих процессов были подробно освещены при описании обмена отдельных классов веществ (см. главы 10-12). В данной главе кратко представлены примеры взаимных переходов отдельных структурных элементов белков, жиров, углеводов (рис. 15.1) и нуклеиновых кислот в процессе их превращений и обмена.Помимо прямых переходов метаболитов этих классов веществ друг в друга, существует тесная энергетическая связь, когда энергетические потребности могут обеспечиваться окислением какого-либо одного класса органических веществ при недостаточном поступлении с пищей других. Важность белков (в частности, ферментов, гормонов и др.) в обмене всех типов химических соединений слишком очевидна и не требует доказательств. Ранее было отмечено большое значение белков и аминокислот для синтеза ряда специализированных соединений (пуриновые и пиримиди-новые нуклеотиды, порфирины, биогенные амины и др.). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться гликогенные аминокислоты через ацетил-КоА, но после предварительного превращения в пируват. Некоторые структурные компоненты специализированных липидов, в частности фосфоглицеринов, имеют своим источником аминокислоты и их производные, например серин, этаноламин, сфингозин и холин. Необходимо подчеркнуть, что превращение углеродных скелетов кетогенных или гликогенных аминокислот в жирные кислоты является необратимым процессом, хотя нельзя исключить возможности частичного синтеза глутамата и опосредованно других аминокислот из продуктов распада жирных кислот – ацетил-КоА – через цикл трикарбоновых кислот, включающий α-кетоглутарат. В то же время из глицерина нейтральных жиров через пируват полностью осуществляется синтез углеродных скелетов некоторых гликогенных аминокислот. Продукты гидролиза пищевых и тканевых триацилглицеролов, в частности высшие жирные кислоты, участвуют непосредственно в образовании сложных белков – липопротеинов плазмы крови. В составе липопротеинов, являющихся, таким образом, транспортной формой жирных кислот, они доставляются в органы-мишени, в которых жирные кислоты служат или источником энергии (сердечная и поперечно-полосатая мускулатура), или предшественниками синтеза тканевых триацилглицеролов с последующим их отложением в клетках ряда органов (депо липидов).Получены доказательства синтеза глюкозы из большинства аминокислот. Для некоторых аминокислот (аланин, аспарагиновая и глутами-новая кислоты) связь с глюконеогенезом является непосредственной, для других она осуществляется через побочные метаболические пути. Следует особо подчеркнуть, что три α-кетокислоты (пируват, оксалоацетат и кето-глутарат), образующиеся соответственно из аланина, аспартата и глу-тамата, не только служат исходным материалом для синтеза глюкозы, но являются своеобразными кофакторами при распаде ацетильных остатков всех классов пищевых веществ в цикле Кребса для получения энергии.Синтез незаменимых аминокислот из продуктов обмена углеводов и жиров в организме животных отсутствует. Клетки животных не содержат ферментных систем, катализирующих синтез углеродных скелетов этих аминокислот. В то же время организм может нормально развиваться исключительно при белковом питании, что также свидетельствует о возможности синтеза углеводов из белков. Процесс синтеза углеводов из аминокислот получил название глюконеогенеза. Он доказан прямым путем в опытах на животных с экспериментальным диабетом: более 50% введенного белка превращается в глюкозу. Как известно, при диабете организм теряет способность утилизировать глюкозу, и энергетические потребности покрываются за счет окисления аминокислот и жирных кислот. Доказано также, что исходными субстратами для глюконеогенеза являются те аминокислоты, распад которых сопровождается образованием прямо или опосредованно пировиноградной кислоты (например, аланин, серин, треонин и цистеин). Более того, имеются доказательства существования в организме своеобразного циклического процесса – глюкозоаланинового цикла, участвующего в тонкой регуляции концентрации глюкозы в крови в тех условиях, когда в период между приемами пищи организм испытывает дефицит глюкозы. Источниками пирувата при этом являются указанные аминокислоты, образующиеся в мышцах при распаде белков и поступающие в печень, в которой они подвергаются дезами-нированию. Образовавшийся аммиак в печени обезвреживается, участвуя в синтезе мочевины, которая выделяется из организма. Дефицит мышечных белков затем восполняется за счет поступления аминокислот пищи.Энергетическая ценность пищи оказывает определенное влияние на белковый обмен, контролируемый азотистым балансом. Так, если потребляемая энергия пищи ниже минимального уровня, то наблюдается увеличение экскреции азота, и, наоборот, при увеличении энергетической ценности пищи экскреция азота с мочой снижается.
53) Механизм действия стероидных (жирорастворимых) гормонов
Проникновение стероида (С) в клетку
Образование комплекса СР. Все Р стероидных гормонов представляют собой глобулярные белки примерно одинакового размера, с очень высоким сродством связывающие гормоны
Трансформация СР в форму, способную связываться ядерными акцепторами [СР] Любая клетка содержит всю генетическую информацию. Однако при специализации клетки большая часть ДНК лишается возможности быть матрицей для синтеза иРНК. Это достигается путем сворачивания вокруг белков гистонов, что ведет к препятствию транскрипции. В связи с этим генетический материал клетки можно разделить на ДНК 3-х видов: 1.транскрипционно неактивная 2.постоянно экспрессируемая 3.индуцируемая гормонами или другими сигнальными молекулами.
Связывание [СР] с хроматиновым акцептором. Следует отметить, что этот этап действия С полностью не изучен и имеет ряд спорных моментов. Считается что [СР] взаимодействует со специфическими участками ДНК так, что это дает возможность РНК-полимеразе вступить в контакт к определенным доменам ДНК.
Интересным является опыт, который показал, что период полужизни иРНК при стимуляции гормоном увеличивается. Это приводит к многим противоречиям: становится непонятно ¾ увеличение количества иРНК свидетельствует, о том что [СР] повышает скорость транскрипции или увеличивает период полужизни иРНК; в то же время увеличение полужизни иРНК объясняется наличием большого числа рибосом в гормон-стимулированной клетке, которые стабилизируют иРНК или другим действием [СР] неизвестным для нас на сегодняшний момент.
Избирательная инициация транскрипции специфических иРНК; координированный синтез тРНК и рРНК Можно полагать, что основной эффект [СР] состоит в разрыхлении конденсированного хроматина, что ведет к открыванию доступа к нему молекул РНК-полимеразы. Повышение количества иРНК приводит к увеличению синтеза тРНК и рРНК.
Процессинг первичных РНК
Транспорт мРНК в цитоплазму
Синтез белка
Посттрансляционная модификация белка
54) Гипоталамус служит местом непосредственного взаимодействия высших отделов ЦНС и эндокринной системы. Природа связей, существующих между ЦНС и эндокринной системой, стала проясняться в последние десятилетия, когда из гипоталамуса были выделены первые гуморальные факторы, оказавшиеся гормональными веществами с чрезвычайно высокой биологической активностью. Потребовалось немало труда и экспериментального мастерства, чтобы доказать, что эти вещества образуются в нервных клетках гипоталамуса, откуда по системе портальных капилляров достигают гипофиза и регулируют секрецию гипофизарных гормонов, точнее их освобождение (возможно, и биосинтез). Эти вещества получили сначала наименование нейрогормонов, а затем рилизинг-факторов (от англ. release – освобождать), или либеринов. Вещества с противоположным действием, т.е. угнетающие освобождение (и, возможно, биосинтез) гипофизар-ных гормонов, стали называть ингибирующими факторами, или статинами. Таким образом, гормонам гипоталамуса принадлежит ключевая роль в физиологической системе гормональной регуляции многосторонних биологических функций отдельных органов, тканей и целостного организма. К настоящему времени в гипоталамусе открыто 7 стимуляторов (либе-рины) и 3 ингибитора (статины) секреции гормонов гипофиза, а именно: кортиколиберин, тиролиберин, люлиберин, фоллилиберин, соматолиберин, пролактолиберин, меланолиберин, соматостатин, пролактостатин и меланостатин (табл. 8.1). В чистом виде выделено 5 гормонов, для которых установлена первичная структура, подтвержденная химическим синтезом.Большие трудности при получении гормонов гипоталамуса в чистом виде объясняются чрезвычайно низким содержанием их в исходной ткани. Так, для выделения всего 1 мг тиролиберина потребовалось переработать 7 т гипоталамусов, полученных от 5 млн овец.Следует отметить, что не все гормоны гипоталамуса, по-видимому, строго специфичны в отношении одного какого-либо гипофизарного гормона. В частности, для тиролиберина показана способность освобождать, помимо тиротропина, также пролактин, а для люлиберина, помимо лютеи-низирующего гормона,– также фолликулостимулирующий гормон.
55) Иерархия регуляторных систем
Системы регуляции обмена веществ и функций организма образуют 3 иерархических уровня. Первый уровень - ЦНС. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса и передают через синапсы, используя химические сигналы - медиаторы. Медиаторы вызывают изменения метаболизма в эффекторных клетках. Второй уровень - эндокринная система. Включает гипоталамус, гипофиз, периферические эндокринные железы (а также отдельные клетки), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула. Третий уровень - внутриклеточный. Его составляют изменения метаболизма в пределах клеттранспортируются по кровеносному руслу и связываются с рецепторами клеток-мишеней; Б - паракринная - гормоны секретируются во внеклеточное пространство и связываются с мембранными рецепторами соседних клеток; В - аутокринная - гормоны секретируются во внеклеточное пространство и связываются с мембранными рецепторами клетки, секретирующей гормон.
изменения активности ферментов путём активации или ингибирования;
изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их разрушения;
изменения скорости транспорта веществ через мембраны клеток.
57)
СТЕРОИДНЫЕ ГОРМОНЫ
СТЕРОИДНЫЕ ГОРМОНЫ, группа физиологически активных в-в стероидной природы. По хим. строению и биол. действию разделяются на С21-стероиды, обладающие скелетом прегнана (гестагены и кортикоиды), С19-стероиды со скелетом андростана (андрогепы) и С18-стероиды со скелетом эстрана (эстрогены). К ним относят также С27-стероиды со скелетом холестана (экдистероиды, или экдизоны) - гормоны линьки насекомых.По номенклатуре ИЮПАК стероидные гормоны наз. аналогично стероидам. Характерная особенность мн. природных стероидных гормонов -наличие сопряженной 4-ен-З-оновой группировки (С21- и С19-стерои-ды), ароматич. 3-гидроксицикла (С18-стероиды) и сопряженной 7-ен-6-оновой группировки (С27-стероиды).Осн. путь биосинтеза стероидных гормонов исходит из холестерина (ф-ла I). В организме позвоночных холестерин серией последоват. ферментативных р-ций окисления превращ. в прегненолон (II) или прогестерон (III); последний - типичный представитель гестагенов. Дальнейшее гидроксилирование направляется либо на С-17, начиная ветвь глюкокортикоидов, либо на С-21, приводя далее к минералокортикоидам. Послед. биотрансформации гестагенов и кортикоидов, связанные с деградацией 17-ацетильной боковой цепи, приводят к С19-стероидам. Наконец, ароматизация одного кольца и отщепление ангулярной метильной группы ведут к С18-стероидам. Эта осн. линия биотрансформации стероидных гормонов сопровождается многочисл. дополнит. ферментативными превращениями, включающими окислит.-восстановит. р-ции и изомеризацию. В результате этих р-ций в организме позвоночных образуется более 100 стероидных гормонов. Ранее эти побочные продукты биосинтеза стероидных гормонов рассматривались как биологически неактивные предшественники и метаболиты основных стероидных гормонов, однако недавно на примере андрогенов было показано, что их образование обусловлено возрастными и половыми факторами и задано генетически. В силу этого термин "метаболизм" в отношении стероидных гормонов предлагается заменить на "биотрансформацию".
Число биол. ф-ций, регулируемых стероидными гормонами в организме, очень велико. Помимо наиб. известных-регуляция беременности (гестагены), углеводного (глюкокортикоиды) и водно-солевого (минералокортикоиды) обмена, сперматогенеза (андро-гены) и овуляции (эстрогены), они вмешиваютя во мн. др. стороны жизнедеятельности, обнаруживая новые ф-ции стероидных гормонов. Многосторонность действия стероидных гормонов легла в основу концепции биол. мультифункциональности стероидных гормонов, рассматривающей это явление как результат взаимод. каждого стероидного гормона с несколькими различающимися по специфичности рецепторами.Биосинтез стероидных гормонов в организме происходит в органах, производящих гормоны (надпочечники, яичники, семенники и др.), откуда они (обычно в виде комплексов с белками) разносятся током крови к клеткам органов-мишеней, где вступают во взаимод. со специфич. белковыми (цитоплазматич.) рецепторами, расположенными либо на клеточной мембране, либо в цитоплазме. Стероидные гормоны обратимо связываются с рецепторами за счет водородных связей и гидрофобных взаимод., образуя стероид-рецепторные комплексы. Последние передают гормональный сигнал, либо оставаясь на месте (мембранные рецепторы), либо проникая в ядро клетки и вступая там во взаимод. с генами. Эффективность гормонального сигнала определяется законом действующих масс, специфичностью и энергетикой стероид-рецепторного взаимодействия. Помимо прямого действия стероидные гормоны могут препятствовать действию др. гормонов, блокируя взаимод. последних с их рецепторами. Т. обр., стероидные гормоны вследствие биотрансформации и мультифункциональности как бы образуют в организме широкую сеть (или древо), каскадно исходящую из холестерина и регулирующую многочисл. стороны гомеостаза и адаптации.В организме насекомых наиб. эффективный С27-стероид -экдизон (ф-ла IV; R - Н, R' = ОН) синтезируется из холестерина, поступающего с пищей, в разл. железах, иногда -в эноцитах и перикардиальных клетках. В жировом теле, кишечнике, покровах и нек-рых др. органах -экдизон пре-вращ. в -экдизон (экдистерон; в ф-ле IV R = R' = ОН). Экдизоны стимулируют процесс линьки, индуцируя транскрипцию в клетках линочных желез, участвуют в регуляции яйцепродукции у взрослого насекомого, а также адаптации насекомых к меняющимся условиям обитания. Осн. пути инактивации таких стероидных гормонов- выделение из организма в неизменном виде или превращение в дегидропроизводные, сульфо-эфиры и гликозиды с дальнейшим выделением катаболитов. В последнее время более 40 родственных С27-стероидам соед. выделены из растении (т. наз. фитоэкдизоны).Многосторонность биол. действия стероидных гормонов затрудняет их мед. использование. Предпринятая в 50-х гг. попытка использовать кортизон (один из кортикоидов) для лечения ревматоидного артрита потерпела неудачу ввиду развития атрофии надпочечников и подавления иммунитета при длит. применении. Осн. направление хим. модификации стероидных гормонов-поиск аналогов, обладающих узким направленным спектром биол. действия. В силу жесткости хирального скелета стероидных гормонов они являются также и объектом многочисл. стереохим. исследований. О полном синтезе стероидных гормонов см. Эстрогены.
58) Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сишалы нервной системы, идущие из мозга при возникновении экстремальных ситуаций (например, бегство или борьба), требующих внезапной мышечной деятельности. Адреналин является сигналом "тревоги". Он должен мгновенно обеспечить мышцы и мозг источником энергии. Адреналин (син. эпинефрин) – катехоламин; гормон, вырабатываемый мозговым веществом надпочечников.Синтез адреналина происходит из других катехоламинов – дофамина и норадреналина. Как физиологически активное вещество, он влияет на обменные процессы организма, усиливает потребление кислорода, влияет на содержание в крови глюкозы. Усиление секреции надпочечниками происходит в ситуациях необходимости быстрой адаптивной перестройки обмена веществ.В норме содержание данного гормона в крови составляет 0,13 мкг на 1 л крови, в суточной порции мочи – от 1 до 15 мкг.Патологическое увеличение уровня содержания адреналина в крови, а также усиленное его выведение с мочой наблюдается при некоторых заболеваниях (например, при черепно-мозговой травме, инфаркте миокарда и др.). Адреналин (эпинефрин)- катехоламин, который секретируется в надпочечниках при стрессе и является медиатором в некоторых синапсах. Высвобожденный адреналин распространяется повсюду с током крови и адсорбируется на определенных рецепторах на поверхности клеток в различных тканях тела, вызывая реакцию, которую сравнивают с ощущением "борьбы и полета". Эта реакция увеличивает ЧСС (частоту сердечных сокращений), уменьшает отток крови к внутренним органам, увеличивает приток крови к скелетным мышцам, увеличивает уровень глюкозы в крови, заставляет печень и клетки мышц расщеплять гликоген и вырабатывать глюкозу. Как адреналин вызывает все эти ответы? Действуя как лиганд, он связывается с рецептороми, экспонированными на поверхности разнообразных типов клеток повсюду в организме. Эти рецепторы называются b-адренергическими, являются серпентиновыми (рис. 13-4сер) Связывание вызывает, соответственно, бета-адренергические эффекты. Синтез, хранение и действие см. катехоламины.надпочечников - адреналин (рис. адреналин). На долю этого соединения приходится примерно 80% всех катехоламинов мозгового слоя. Вне мозгового вещества адреналин не образуется. Адреналин синтезируется из тирозина ( рис тк 32 ). Адреналин отличается от норадреналина наличием метильного радикала, замещающего атом водорода в аминогруппе. Структура этих гормоноидов была впервые охарактеризована Олдричем (1901-1902). Они найдены в организме беспозвоночных, причем даже у представителей Protozoa. По-видимому, химическая структура этих соединений в историческом плане одна из наиболее древних. Представляя биологически активные внутриклеточные метаболиты у Protozoa, они приобрели в эволюции функции нейромедиаторов в многоклеточных организмах беспозвоночных и позвоночных животных, с одной стороны, и гормоноидов в организме позвоночных - с другой. Катехоламины - адреналин, изопреналин, битолтерол и изоэтарин - содержат в своем составе бензольное кольцо с двумя гидроксильными группами в положениях 3 и 4 или 4 и 5 и этаноламиновой группой
Адренергические средства - это средства, влияющие на передачу возбуждения в адренергических синапсах.Напомним, что в адренергических синапсах передача возбуждения осуществляется посредством медиатора норадреналина (НА). В пределах периферической иннервации норадреналин принимает участие в передаче импульсов с адренергических (симпатических) нервов на эффекторные клетки. В ответ на нервные импульсы происходят освобождения норадреналина в синаптическую щель и последующее взаимодействие его с адренорецепторами постсинаптической мембраны. Адренергические рецепторы находятся в ЦНС и на мембранах эффекторных клеток, иннервируемых постганглионарными симпатическими нервами.Существующие в организме адренорецепторы обладают неодинаковой чувствительностью к химическим соединениям. С одними веществами образование комплекса лекарство-рецептор вызывает повышение (возбуждение), с другими снижение (ингибирование) активности иннервируемой ткани или органа. Для объяснения этих различий в реакциях разных тканей в 1948 году Ahlquist предложил теорию существования двух типов рецепторов: альфа и бета . Обычно стимуляция альфа-рецепторов вызывает эффекты возбуждения, а стимуляция бета-рецепторов сопровождается, как правило, эффектами ингибирования, торможения. Хотя в целом, альфа-рецепторы относятся к рецепторам возбуждающим, а бета-рецепторы - рецепторам тормозного плана, из этого правила имеются определенные исключения. Так, в сердце, в миокарде превалирующие бета-адренорецепторы являются стимулирующими по характеру. Возбуждение бета-рецепторов сердца повышает скорость и силу сокращений миокарда, сопровождается повышением автоматизма и проводимости в AV-узле. В ЖКТ и альфа- и бета-рецепторы являются ингибирующими. Их возбуждение вызывает релаксацию гладкой мускулатуры кишечника. Количественное соотношение в разных тканях альфа- и бетарецепторов различно. Преимущественно альфа-рецепторы сосредоточены в кровеносных сосудах кожи и слизистых оболочек, мозга и сосудах брюшной области (почек и кишечника, сфинктерах ЖКТ, трабекулах селезенки). Как видно, указанные сосуды относятся к разряду емкостных сосудов.В сердце локализованы приемущественно бета-1-стимулирующие адренорецепторы, в мышцах бронхов, мозговых, коронарных, легочных сосудах в основном находятся бета-2-тормозные адренорецепторы. Такое расположение эволюционно выработано, убегает при возникновении опасности : необходимо расширить бронхи, увеличить просвет сосудов головного мозга, повысить работу сердца.Действие норадреналина на адренорецепторы кратковременно, так как до 80% выделившегося медиатора быстро захватывается, поглощается посредством активного транспорта окончаниями адренергических волокон. Катаболизм (разрушение) свободного норадреналина осуществляется путем окислительного дезаминирования в адренергических окончаниях и регулируется ферментом моноаминооксидазой (МАО), локализованной в митохондриях и везикулах мембран. Метаболизм выделившегося из нервных окончаний норадреналина осуществляется путем метилирования цитоплазматическим ферментом эффекторных клеток - КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗОЙ (КОМТ). КОМТ есть и в синапсах, есть и в плазме и в ликворе.
60) Простагландины (Pg) — группа липидных физиологически активных веществ, образующиеся в организме ферментативным путём из некоторых незаменимых жирных кислот и содержащих 20-членную углеродную цепь. Простагландины являются медиаторами с выраженным физиологическим эффектом. Являются производными гипотетической простановой кислоты. Простагландины вместе с тромбоксанами и простациклинами образуют подкласс простаноидов, которые в свою очередь входят в класс эйкозаноидов.[1] Простагландины находятся практически во всех тканях и органах. Они являются аутокринными и паракринными липидными медиаторами, которые воздействуют на тромбоциты, эндотелий, матку, тучные клетки и другие клетки и органы. Простагландины синтезируются из незаменимых жирных кислот (НЖК). Промежуточный продукт образуется под действием фосфолипазы A2, который затем преобразуется либо по циклоксигеназному, либо по липоксигеназному пути. Циклоксигеназный путь синтезирует тромбоксаны, простациклин и простагландины D, E и F. Липоксигеназный путь синтеза, который активен в лейкоцитах и макрофагах, образует лейкотриены. Секреция из клетки.Ранее считалось, что после синтеза простагландины выходят из клетки за счёт пассивной диффузии, так как они обладают значительной липофильностью. Однако, позже был обнаружен белок-переносчик простагландина (PGT, SLCO2A1), который опосредует клеточный захват простагландинов. Секреция же осуществляется другими белками: multidrug resistance protein 4 (MRP4, ABCC4) из семейства ATP-binding cassette transporter и, возможно, другими переносчиками, которые пока неизвестны.
Циклооксигеназы
Синтез простагландинов осуществляется в два этапа: окисление под действием циклоксигеназы и конечной простагландинсинтазы. Существует два типа циклооксигеназ: ЦОГ-1 и ЦОГ-2. Считается, что ЦОГ-1 определяет базальный уровень простагландинов, а ЦОГ-2 запускает синтез простагландинов при стимуляции (например, при воспалении).
Простагландин E-синтаза
Простагландин E2 (ПГE2) образуется простагландин E-синтазой из простагландина H2 (ПГH2). Обнаружено несколько простагландин E-синтаз. Считается, что микросомальная простагландин E-синтаза-1 является ключевой формой фермента, синтезирующего ПГE2.
Простагландины
биологически активные вещества, представляющие собой производные полиненасыщенных жирных кислот, молекула которых содержит 20 углеродных атомов. Биологическое действие П. многообразно; один из основных биологических эффектов П. заключается в их выраженном действии на тонус гладкой мускулатуры различных органов. П. снижают выделение желудочного сока и уменьшают его кислотность, являются медиаторами воспаления и аллергических реакций (см. Медиаторы), принимают участие в деятельности различных звеньев репродуктивной системы, играют важную роль в регуляции деятельности почек, оказывают влияние на различные эндокринные железы. Нарушение биосинтеза П. может стать причиной развития тяжелых патологических состояний. Синтетические и полусинтетические П. используют в качестве лекарственных средств.
В середине 30-х гг. 20 в. шведский ученый Эйлер (V. Euler) обнаружил в экстракте из предстательной железы (простаты) биологически активные вещества, которые он назвал простагландинами, полагая, что они вырабатываются только в предстательной железе. Позже было установлено, что П. образуются практически во всех органах и тканях. В 1962 г. была расшифрована химическая структура простагландинов. Оказалось, что углеродный скелет молекулы П. имеет вид пятичленного цикла и двух боковых цепей. Простагландины можно рассматривать как производные так называемой простановой кислоты — соединения, не существующего в природе, но полученного синтетически.Известно около 20 различных простагландинов. В зависимости от строения их делят на несколько типов, обозначаемых буквами латинского алфавита: А, В, С, D, Е, F и т.д. Простагландины каждого типа разделяют на 1-ю, 2-ю и 3-ю серии в зависимости от числа двойных связей в боковых цепях молекулы. С учетом типа и серии П. обозначают ПГЕ2 (PGE2), ПГД1 (PGD1), ПГН2 (PGH2) и т.д.В 70-х гг. 20 в. было обнаружено, что в организме человека и животных образуются и другие биологически активные производные полиненасыщенных жирных кислот (Жирные кислоты), в тромбоцитах — тромбоксаны (ТХ), в лейкоцитах — лейкотриены (ЛТ). От простагландинов тромбоксаны отличаются наличием в молекуле вместо пятичленного цикла шестичленного оксанового кольца, в зависимости от структуры которого различают тромбоксаны А и В (ТХА и ТХВ). Тромбоксаны обоих типов, в свою очередь, делят на 1-ю, 2-ю и 3-ю серии по тому же принципу, что и простагландины.Особенностью строения лейкотриенов является отсутствие в молекуле циклической структуры. В зависимости от строения функциональных группировок в углеродной цепи лейкотриены разделяют на типы А, В, С, D и Е, а в зависимости от числа двойных связей в молекуле — на серии 3, 4 и 5. Сокращенно лейкотриены обозначают следующим образом: ЛТВ3, ЛТС3 и т.д. В молекулах ЛТС, ЛТD и ЛТ к 6-му углеродному атому присоединены остатки глутатиона, цистеинилглицина и цистеина соответственно.В организме человека и животных П., тромбоксаны и лейкотриены образуются из общего предшественника — незаменимых полиненасыщенных жирных кислот с соответствующим числом углеродных атомов и двойных связей в молекулах, в т.ч. из линолевой и арахидоновой кислот. Фактором, лимитирующим скорость биосинтеза П., является общее количество (пул) свободных жирных кислот, поэтому вещества, влияющие на гидролитическое расщепление триглицеридов (см. Жиры, Жировой обмен), фосфолипидов и эфиров холестерина (см. Липиды, Холестерин), в состав которых входят полиненасыщенные жирные кислоты, могут регулировать интенсивность образования П. Так, Катехоламины, брадикинин, ангиотензин II вызывают усиление освобождения жирных кислот в организме, тем самым косвенно стимулируя образование простагландинов. По-видимому, таков же механизм стимуляции биосинтеза П., тромбоксанов и лейкотриенов при ишемии или механическом воздействии на клетки. Кортикостероидные гормоны, напротив, подавляют биосинтез П., тромбоксанов и лейкотриенов, т.к. они ингибируют освобождение жирных кислот. Некоторые соединения влияют на образование отдельных типов П. и тромбоксанов, например перекиси жирных кислот специфически угнетают биосинтез простагландина I2-(простагландина I2 или простациклина), а имидазол — образование тромбоксана А2. Ряд лекарственных средств оказывает выраженное действие на образование П., тромбоксанов и лейкотриенов, изменяя не только их общее количество, но и соотношение между отдельными типами и сериями. например, лекарственные средства, обладающие противовоспалительным действием, — салицилаты, индометацин (метиндол), бруфен и др. — ингибируют циклооксигеназу, катализирующую первый этап биосинтеза П. Это приводит к уменьшению образования П. и тромбоксанов, повышению выхода лейкотриенов. В то же время некоторые флавоноиды (например, рутин) подавляют биосинтез лейкотриенов. Изменение соотношения образующихся П. имеет важное значение, поскольку индивидуальные П. обладают разным, а нередко и противоположным по характеру биологическим действием.Простагландины и тромбоксаны являются короткоживущими соединениями. Время полужизни некоторых из них исчисляется секундами. Быстрое разрушение П. обусловливает локальность их эффектов — П. действуют главным образом в месте их синтеза. Метаболизм П., приводящий к их быстрой инактивации, осуществляется во всех тканях, но особенно активно в легких, печени и почках.Биологическое действие П. многообразно благодаря не только биологической поливалентности индивидуальных П., но и большому их разнообразию. Простагландины F1 и D2 вызывают сокращение бронхов, а простагландин Е2 — их расслабление. Тромбоксан А2 сокращает стенки кровеносных сосудов и повышает АД, а простагландин I2 оказывает сосудорасширяющее действие, сопровождающееся гипотензивным эффектом. Антагонистические взаимоотношения между тромбоксаном А2 и простагландином I2 проявляются и при их действии на систему свертывания крови: тромбоксан А2 является мощным природным индуктором агрегации тромбоцитов, а простагландин I2, синтезирующийся в стенках кровеносных сосудов, выполняет в организме человека и животных роль ингибитора агрегации тромбоцитов. Соотношение простагландина I2 и тромбоксана А2 имеет важное значение для нормального функционирования сердечно-сосудистой системы.Простагландины необходимы для процесса овуляции; они влияют на продвижение яйцеклетки и подвижность сперматозоидов, на сократительную деятельность матки, а также необходимы для нормальной родовой деятельности: слабую родовую активность и перенашивание беременности связывают с недостатком П., а повышенное образование П. может стать причиной самопроизвольных абортов и преждевременных родов. У новорожденных П. регулируют закрытие сосудов пуповины и артериального протока.Простагландины помимо воздействия на специфические рецепторы способны непосредственно влиять на функциональные структуры клетки. В качестве лекарственных средств П. используются для вызывания родов (Роды), возбуждения и стимуляции родовой деятельности, прерывания беременности. В терапевтических дозах П. не оказывают неблагоприятного влияния на мать и плод. Чувствительность матки к введению П. различна на разных сроках беременности; на очень ранних и на поздних сроках стимулирующий эффект вызывается легко, а в промежутке между ними на введение препаратов П. миометрий реагирует слабо. Для искусственного прерывания беременности применяют внутривенное, внутримышечное, вагинальное, пероральное, экстра- и интраамниальное введение П. При прерывании беременности на ранних сроках наиболее эффективно введение 15-метил-ПГF2α (метилового эфира простагландина F2α) в виде свечей (3 мг) или внутримышечно (по 200—300 мкг 5 раз через каждые 3 ч); при беременности сроком 13—14 нед. — экстраамниальное однократное введение 15-метил-ПГF2α (2,5 мг) с вяжущим веществом (гискон) или в виде свечей (3 мг); после 15-й недели беременности — интраамниальное введение 2,5 мг 15-метил-ПГF2α или 40—50 мг ПГF2α, а также свечи с 15-метил-ПГF2α (3 мг).
