
- •1.Основные понятия коллоидной химии; классификация, основные особенности, количественные характеристики дисперсных систем.
- •2. Диспергационные методы получения дисперсных систем
- •3. Конденсационные методы получения дисперсных систем
- •4. Закон Эйнштейна-Смолуховского, броуновское движение.
- •5. Первый и второй законы Фика, диффузия, движущая сила диффузии, связь коэффициента диффузии с размерами частиц
- •6. Гипсометрический закон Лапласа, диффузионно-седиментационное равновесие. Кривая седиментации для монодисперсных и полидисперсных систем.
- •7. Строение двойного электрического слоя (фи-потенциал и дзета-потенциал), теория Квинке-Гельмгольца-Перрена, теория Гуи-Чепмена, теория Штерна, строение мицеллы.
- •8. Рассеяние света. Опалесценция. Эффект Тиндаля.
- •9. Закон Бугера-Ламберта-Бера, оптические свойства коллоидных растворов, оптические методы анализа дисперсности.
- •10. Работа когезии. Связь поверхностной энергии с взаимодействиями между молекулами (атомами, ионами), правило Трутона, уравнение Дюпре. .
- •12. Закон Лапласа: общая форма, частные случаи, капиллярное поднятие жидкости, уравнение Жюрена.
- •13. Томсона (Кельвина), зависимость давления насыщенного пара от кривизны поверхности жидкости, капиллярная конденсация.
- •14. Закон Гиббса-Оствальда-Фрейндлиха, влияние дисперсности на растворимость твердых частиц, процессы изотермической перегонки в дисперсных системах.
- •15. Лиофильные коллоидные системы, методы получения. Самопроизвольное диспергирование макрофаз: критерий самопроизвольного диспергирования (по Ребиндеру-Щукину, примеры).
- •16. Мицеллообразование в водных растворах пав. Критическая концентрация мицеллообразования (ккм), основные методы определения ккм
- •17. Солюбилизация
- •18. Термодинамика мицеллообразования, диаграмма фазовых состояний, точка Крафта, жидкокристаллические системы.
- •19. Образование и строение обратных мицелл
- •20. Аэрозоли. Молекулярно-кинетические свойства. Седиментация
- •21. Термопреципитация
- •22. Фотофорез
- •23. Термофорез.
- •24. Коалесценция.
- •25. Быстрая и медленная коагуляция.
- •26. Концентрационная и нейтрализационная коагуляция
- •27. Изотермическая перегонка.
- •28. Пены, классификация и строение, разрушение пен и практическое применение.
- •29. Эффект Марангони.
- •30. Тиксотропия.
- •31. Флотация.
- •32. Эмульсии. Обращение фаз, разрушение эмульсий и практическое применение.
- •33. Правило Банкрофта
- •34. Правило Дюкло-Траубе
- •35. Правило Шульца-Гарди.
- •36.Критерий Эйлера-Корфа.
- •37. Теория длфо.
- •38. Слои Шиллера
- •39. Тактоиды
- •40. Биконтинуальные дисперсные системы
- •41. Кольца и слои Лизеганга
- •42. Пептизация.
- •43. Флокуляция
- •44. Гетерокоагуляция.
- •45. Адагуляция.
- •46. Аддитивность коагуляции.
- •47. Антагонизм коагуляции
- •48. Синергизм коагуляции
- •49. Коагуляционные структуры
- •50. Структуры с фазовыми контактами
- •51. Синерезис.
- •52. Конденсационные структуры
- •53. Кристаллизационные структуры
- •54. Когезия.
- •55. Адгезия
- •56. Физико-химические методы регулирования структурно-механических свойств дисперсных систем.
- •57. Смачивание.
- •58. Капиллярное давление
- •59. Закон Ньютона (трение)
- •60. Диссипация энергии
- •61. Застудневание
- •62.Ползучесть
- •63. Вязкость коллоидных растворов. Зависимость вязкости раствора от концентрации взвешенных частиц (уравнение Эйнштейна)
- •64.Аномалия вязкости коллоидных систем. Причины, которые вызывают аномалии вязкости
- •65. Как образуется снежинка
- •66. Хемосорбция и каталитическая сорбция, сходства и отличия, привести примеры
- •67. Почему “химические дожди” выпадают недалеко от источника загрязнения?
- •68. Адсорбция
- •69. Абсорция.
- •70. Хемосорбция.
- •71. Каталитическая сорбция
- •72. Обеспечивает вертикальную устойчивость облаков?
- •73. В чём сходство и различие газовой и жидкой дисперсионных сред?
- •74. Почему туман в вечернее время распространяется в приземном слое, не оседая на поверхность?
- •75. Почему снег выпадает иногда в виде “крупы”?
- •76. Почему иней в большей степени образуется на открытых участках, чем в лесу?
- •77. Адсорбция и адагуляция, сходства и отличия, привести примеры
- •78. Количественные характеристики дисперсных систем
- •78. Количественные характеристики дисперсных систем.
- •79. Классификация дисперсных систем по размеру частиц дисперсной фазы ( отличительные особенности частиц разных размеров)
- •80. Классификация дисперсных систем по фракционному составу частиц.
- •81. Классификация дисперсных систем по концентрации частиц.
- •82. Классификация дисперсных систем по характеру взаимодействий дисперсной фазы с дисперсной средой.
- •83. Классификация дисперсных систем по характеру распределения фаз.
- •84. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсной среды.
- •85. Классификация дисперсных частиц по размерам.
- •86. Классификация дисперсных частиц по форме
- •87. Классификация дисперсных частиц по строению.
- •88. Классификация дисперсных частиц по химическому составу.
- •89. Размерные эффекты, наблюдаемые в дисперсных системах.
- •90. Термодинамические свойства дисперсных частиц.
- •91. Механические свойства дисперсных частиц.
- •92. Магнитные свойства дисперсных частиц.
- •93. Каталитические свойства дисперсных частиц.
- •94. Энергетическое и силовое определение поверхностного натяжения.
- •95. Факторы, влияющие на поверхностное натяжение жидкостей.
- •96. Дисперсионная и полярная составляющая поверхностного натяжения жидкостей.
- •97. Метод избыточных величин Гиббса.
- •98. Капиллярное давление (определение, физический смысл, от чего зависит)
- •99. Несмачивание, полное смачивание, гидрофильность и гидрофобность.
- •100. Правило Антонова.
- •101. Эффект Марангони
- •102. Зависимость смачиваемости от свойств твердой поверхности
- •103. Смачивание нанокаплями
- •104. Адгезия, когезия, уравнение Дюпре.
- •105. Изотермическая перегонка
- •106. Перекристаллизация
- •107. Капиллярная конденсация
- •108. Закон Жюрена. (высота подъема жидкости в капиллярных трубках)
- •109. Измерение поверхностного натяжения методом капиллярного подъема.
- •110. Измерение поверхностного натяжения методом сидящей капли.
- •111. Измерение поверхностного натяжения методом максимального давления.
- •112.Измерение поверхностного натяжения методом пластинки Вильгельми.
- •113. Измерение поверхностного натяжения методом вращающейся капли.
- •114. Измерение поверхностной энергии твердых тел
- •115. Адсорбция пав на поверхности раздела жидких фаз.
- •116. Адсорбция пав из растворов на поверхности твердых тел.
- •117. Химическое модифицирование твердых тел.
- •118. Классификация пав по растворимости.
- •119. Классификация пав по диссоциации в воде.
- •120. Классификация пав по происхождению и по способности к образованию мицелл.
- •121. Классификация пав по физико-химическому воздействию на поверхность раздела между фазами.
- •122. Гидрофильно-липофильный баланс.
- •123. Критический параметр упаковки
- •125. Строение дэс
- •126. Влияние электролитов на дэс.
- •127. Электрофорез.
- •128. Электроосмос.
- •129. Потенциал течения.
- •130. Потенциал оседания.
- •131. Электрокапиллярные явления. (Электрокапилярная кривая, уравнение Липпмана)
12. Закон Лапласа: общая форма, частные случаи, капиллярное поднятие жидкости, уравнение Жюрена.
Вследствие избыточной пов-й энергии подвешенная жидкость в условии невесомости приобретает сферическую форму. С уменьшением кол-ва жидкости роль силы тяжести снижается, т.к. она уменьшается пропорц-но кубу, а пов-ть квадрату радиуса тела, т.е. увеличивается удельная пов-ть . С появлением кривизны пов-ти тела радиусом r возникает дополнительное внутреннее давление дельта Р .Его можно представить как равнодейств. силу пов-го натяжения ,сходящихся в одной точке. Равнодейсв. направлена перпендикулярно пов-ти в центр кривизны.
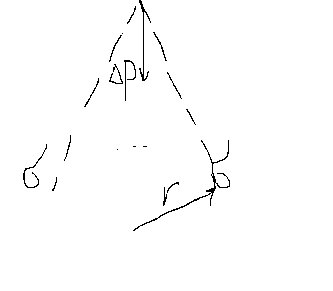
Эта сила рассчитана на ед площади и представляет собой доп-е давление:
 Где
Δ Р - разность давлений внутри тела
с изогнутой и плоской пов-ти.
Где
Δ Р - разность давлений внутри тела
с изогнутой и плоской пов-ти.
 -
кривизна поверхности. Чем больше σ, тем
влияние кривизны значительное для
сферической формы.
-
кривизна поверхности. Чем больше σ, тем
влияние кривизны значительное для
сферической формы.
Для
цилиндрической пов-ти длиной L
и радиусом r
имеем:
 Тогда:
Тогда:

для
пов-ти неправильной формы используется
представление средней кривизны, опред.
по уравнению: Где
1/r1
и 1/r2
-кривизна главных нормальных сечений
1 и 2.
Где
1/r1
и 1/r2
-кривизна главных нормальных сечений
1 и 2.
Тогда: - это и есть уравнение Лапласа.
- это и есть уравнение Лапласа.
Капиллярное явление наблюдается в сосудах, содержащих жидкость у которых расстояние между стенками соизмеримо с радиусом кривизны пов-ти жидкости. Поведение ж-ти в капиллярных сосудах зависит от того, смачивает или нет жидкость стенки сосуда. При смачивании наблюдается поднятие уровня в капилляре за счет растяжения ж-ти, а при не смачивании наоборот- опускание в рез-те сжатия. При равновесии Лапласовское давление = гидростатическому
 Где
ρ - плотность жидкости, ρ0
-
плотность газовой фазы, g-
ускорение свободного падения, r-радиус
мениска, h
- высота столба
Где
ρ - плотность жидкости, ρ0
-
плотность газовой фазы, g-
ускорение свободного падения, r-радиус
мениска, h
- высота столба
 -
Уравнение
Жюрена.
-
Уравнение
Жюрена.
Где
 .
.
Следует помнить, что капиллярное явление имеет место только на границе трех фаз: твердое тело – газ – жидкость.
13. Томсона (Кельвина), зависимость давления насыщенного пара от кривизны поверхности жидкости, капиллярная конденсация.
получаем условие равновесия жидкости при наличии между ними искривлённой поверхности раздела, описываемое уравнением Томсона (Кельвина):
 или
приближённо
или
приближённо ,
т.е.
,
т.е.
 .
.
Из уравнения Томсона (Кельвина) видно, что равновесное давление пара для капель жидкости тем выше, чем меньше радиус капель. Уравнение Томсона (Кельвина) в приближённом виде применимо практически во всех случаях, за исключением капель размерами, приближающимися к молекулярным.
Явление капиллярной конденсации состоит в том, что конденсация пара в тонких капиллярных порах твёрдых адсорбентов происходят при давлении меньших, чем давление насыщенного пара над плоской поверхностью жидкости (при условии смачивания конденсатом поверхности адсорбента). В соответствии с законом Томсона (Кельвина) чем меньше поры адсорбента, тем при меньшем давлении происходит конденсация. Это используется в частности при рекуперации (возвращение в производство) летучих растворителей в технологических процессах, а так же для анализа геометрии порогового пространства сорбента и др.
14. Закон Гиббса-Оствальда-Фрейндлиха, влияние дисперсности на растворимость твердых частиц, процессы изотермической перегонки в дисперсных системах.
Соотношение для зависимости растворимости с(r) вещества капель и кристаллов от их размера (уравнение Гиббса – Оствальда – Фрейндлиха):
 ,где
с0 – растворимость макроскопической
фазы.
,где
с0 – растворимость макроскопической
фазы.
Для снижения удельной поверхности, т.е. уменьшается энергия Гиббса, процесс самопроизвольный. Перенос вещества от мелких к крупным, т.к. хим. потенциал крупных меньше (эффект Кельвина).
Обычно рассматривают три стадии процесса изотермической перегонки: растворение или испарение мелких частиц, вещества от мелких частиц к крупным и рост крупных частиц. В зависимости от условий каждая из этих стадий может быть, лимитирующей, т. е. иметь меньшую скорость и, таким образом, определять скорость всего процесса изотермической перегонки. Первую и третью стадии можно отнести к химическим, которые, как правило, имеют большие энергии активации. Очевидно, что энергии активации этих стадий при прочих иных условиях больше у твердых частиц, чем у жидких. Кинетика процессов, протекающих на поверхности частиц (растворение и рост частиц), обсуждалась при рассмотрении образования новой фазы. Вторая перенос— является диффузионной. Как известно, коэффициент диффузии сильно зависит от агрегатного состояния дисперсионной среды, в тысячи и десятки тысяч раз уменьшаясь при переходе отобранной к жидкой и от жидкой к твердой средам. Скорость изотермической перегонки часто лимитируется скоростью диффузионного массопереноса в дисперсионной среде, которая следует закону Фика и зависит в данной среде янный коэффициент диффузии только от градиентаций или давлений (разности химических потенциалов). Вочередь градиент концентраций (давлений) определяется отличием размеров частиц, между которыми происходит перенос.
