
- •1) Предмет физики. Физика и математика. Роль физики в развитии техники.
- •2) Структура курса физики. Основные единицы си.
- •3) Физические модели. Пространство и время. Кинематическое описание движения.
- •5)Угловые характеристики движения. Нормальное и тангенциальное ускорение.
- •6)Связь линейных характеристик движения с угловыми.
- •7)Основная задача динамики. Масса. Импульс.
- •8)Первый и второй закон Ньютона. Дифференциальное уравнение движения транспортного средства.
- •9)Третий закон Ньютона. Силы в природе. Силы инерции.
- •10) Внешние и внутренние силы. Главный вектор внешних сил. Закон сохранения импульса.
- •11)Центр масс механической системы и теорема о его движении.
- •12)Работа силы. Мощность. Кинетическая энергия.
- •13)Виды взаимодействия. Силы в механике.
- •14)Поле как форма материи. Консервативные и неконсервативные силы. Потенциальная энергия.
- •15)Закон сохранения энергии в механике и его связь с однородностью времени.
- •16)Моменты импульса и силы. Уравнение моментов. Кинетическая энергия вращающегося тела.
- •17)Момент инерции. Теорема Штейнера.
- •18)Вычисление моментов инерции тел правильной формы.
- •19)Полная кинетическая энергия катящегося тела. Закон сохранения момента импульса.
- •20)Основное уравнение динамики вращательного движения твёрдого тела.
- •22)Механический принцип относительности. Преобразования Галилея.
- •2 3)Постулаты специальной теории относительности. Преобразования Лоренца и их следствия.
- •25)Релятивистский закон сложения скоростей.
- •26)Основной закон релятивистской динамики.
- •27)Взаимосвязь массы и энергии. Энергия связи системы. Границы применимости классической системы.
- •28)Статистические и термодинамические методы. Параметры состояния термодинамической системы.
- •29)Опытные газовые законы. Уравнение состояния идеального газа.
- •30)Основные уравнения молекулярно-кинетической теории идеального газа.
- •31)Модель идеального газа. Среднее значение величин.
- •32)Распределения Максвелла.
- •33)Распределения Больцмана. Барометрическая формула.
- •34)Понятие о физической кинетике. Число столкновений, средняя длина свободного пробега, эффективное поперечное сечение молекул.
- •35)Диффузия. Стационарная и нестационарная диффузия.
- •36)Внутреннее трение (вязкость). Свойства разряженных газов.
- •37)Стационарная и нестационарная теплопроводность. Теплопроводность твёрдых тел.
- •38)Внутренняя энергия. Теплота. Работа. Первое начало термодинамики.
- •39)Работа газа при изменении объёма.
- •40)Степень свободы молекул. Распределение энергии по степеням свободы.
- •41)Теплоёмкость. Теплоёмкость многоатомных газов. Недостатки классической теории теплоёмкости.
- •42)Применение первого начала термодинамики к изопроцессам.
- •43)Адиабатический процесс. Уравнение Пуассона.
- •44)Работа газа в адиабатическом процессе.
- •45)Обратимые и необратимые процессы. Круговые процессы.
- •46)Тепловые машины и холодильники. Циклы. Второе начало термодинамики.
- •47)Цикл Карно и его кпд.
- •48)Энтропия и её связь с вероятностью.
- •49)Статистический смысл второго начала термодинамики. Неравенства Клаузиса.
- •51)Реальные газы. Уравнение Ван-дер Ваальса.-
- •52)Теоретические и опытные изотермы реального газа. Критическое состояние.
- •53)Фазы. Фазовые переходы и диаграммы. Выражение критических параметров через газовые постоянные.
- •54)Особенности твёрдого и жидкого состояний вещества. Поверхностное натяжение в жидкостях. Капиллярные явления.
37)Стационарная и нестационарная теплопроводность. Теплопроводность твёрдых тел.
Теплопроводность.
Это способность вещества переносить тепловую энергию, а также количественная оценка этой способности.
Явление теплопроводности заключается в том, что кинетическая энергия атомов и молекул, которая определяет температуру тела, передаётся другому телу при их взаимодействии.
![]()
В твёрдом теле теплопроводность определяется как решёточная + электронная.
Энергия между узлами решётки передаётся при помощи фононов – квазичастиц теплового излучения (подчиняется статистике Бозе-Эйнштейна). Фононы существуют только внутри вещества. При высоких температурах преобладает фононное воздействие.
Общее
уравнение теплопроводности:
![]()
Общий
вид:
![]()
По Пригожину биологические системы обладаю устойчивостью к внешним воздействиям при минимальном возрастании энтропии.
38)Внутренняя энергия. Теплота. Работа. Первое начало термодинамики.
Первое начало термодинамики (закон сохранения энергии в применении к термодинамическим процессам) гласит: при сообщении термодинамической системе (например, пару в тепловой машине) определенного количества теплоты в общем случае происходит при приращении внутренней энергии системы и она совершает работу против внешних сил.
![]()
Тепло (связано с изменением энергии при тепловых процессах)
=Изменение внутренней энергии системы
+Изменение энергии при механических процессах
+Изменение энергии системы за счёт изменения количества частиц в ней.
Химический
потенциал
![]() .
.
Изопроцессы в изолированной системе
Теплоёмкость
![]() .
.
Газ dA=pdV
1.
Изотермический
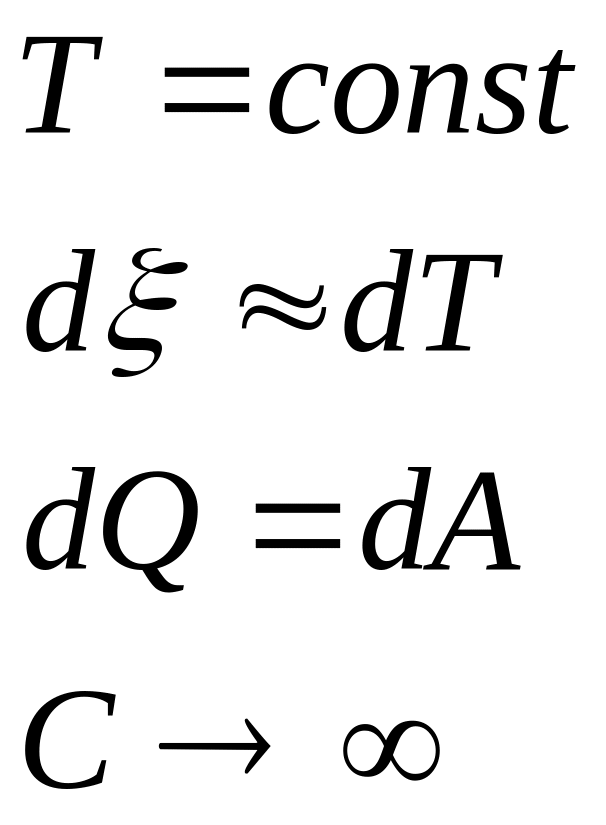
2.
Изохорическй
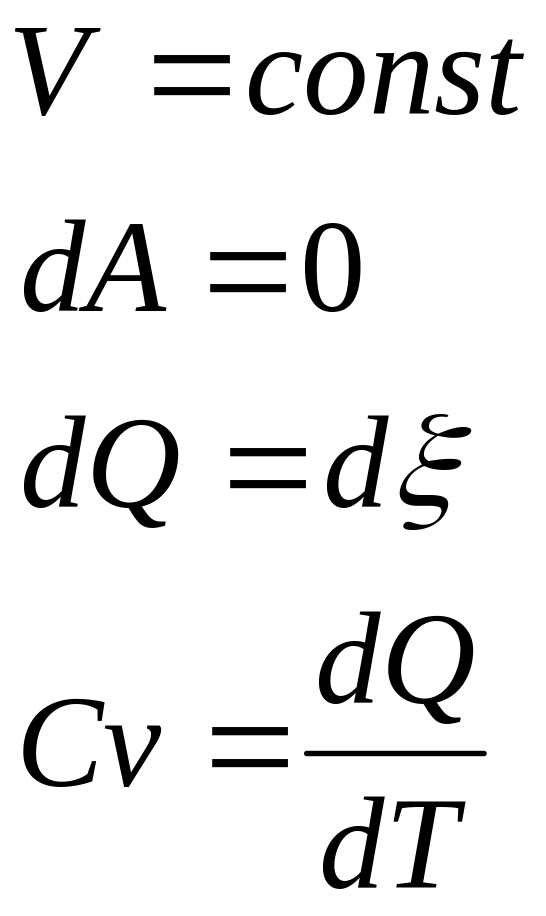 газ
газ
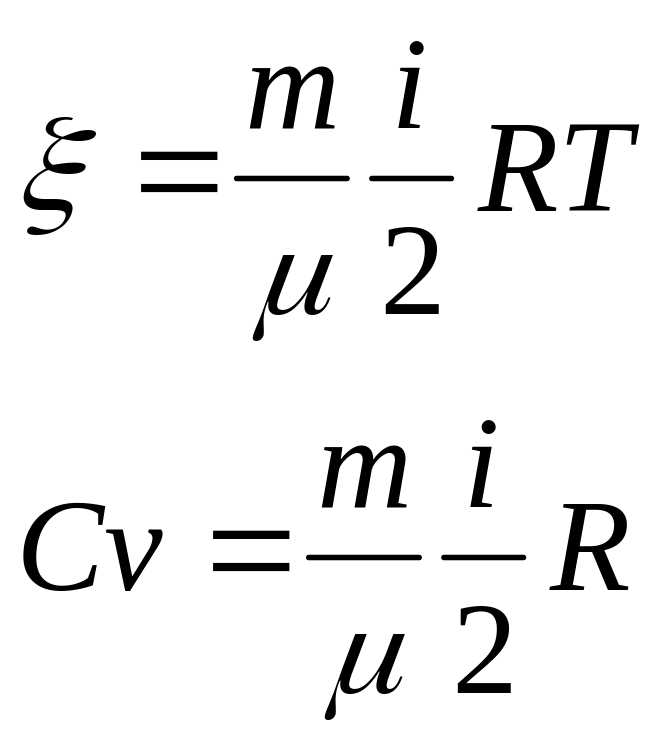
3.
Изобарический
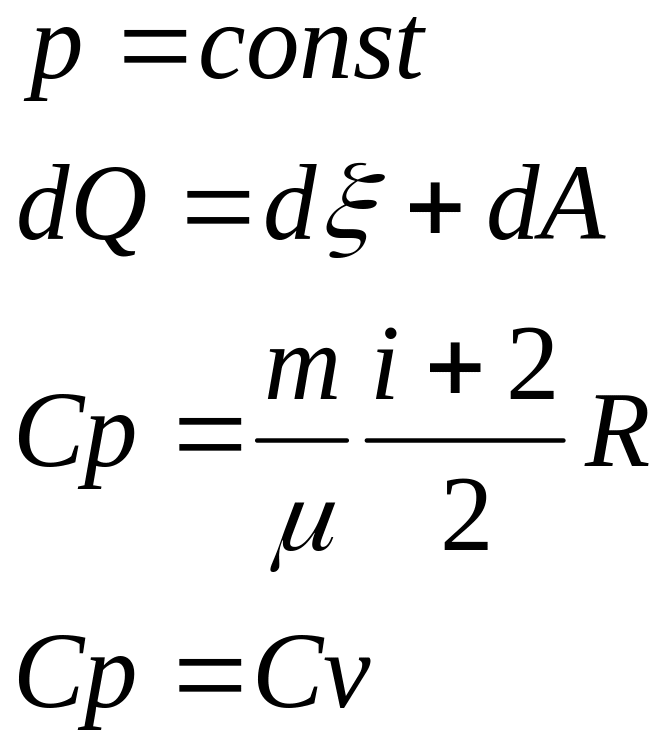
4.
Адиабатический (без теплообмена с
окружающей средой)

Внутренняя энергия- однозначная ф-ция термодинамич. сост. системы, т.е. в кажд. сост. сист. облад. определ.знач. внутр. энергии.
Работа - способ передачи энергии, связанный с измен. внеш. параметров системы.
Теплота – способ без изменения внутренней энергии системы.
Процесс передачи энергии наз. теплообменом.
Кол-во энергии без измен. внеш. парам., наз. кол-вом теплоты.
I
начало термодинамики:
Q=![]() U+A,
это математич. форма записи.
U+A,
это математич. форма записи.
Более
корректная форма записи:
![]() ,
где
,
где
![]() и
и
![]() - не полн. дифференциалы
- не полн. дифференциалы
![]() -
полн. дифференциал.
-
полн. дифференциал.
Перпетуум мобиле первого рода не возможен !
39)Работа газа при изменении объёма.
Ч![]() тобы
найти полную работу воспользуемся
формулой:
тобы
найти полную работу воспользуемся
формулой:
справедливо при любых изменениях объёма как твёрдых тел, так и газоборазных тел, а также жидкостей.
40)Степень свободы молекул. Распределение энергии по степеням свободы.
В одноатомном идеальном газе рассм. молек. как матер. точку, к-ая имеет опр. число степеней свободы. Она имеет 3 степени свободы.
Степень свободы – число отн. коор., относ. к-х молек. соверш. движение.
Если молек. движ по прямой, то имеет одну степ. свободы, по плоск-2, в пространстве-3
Если
молек. идеальна или реально сост. и
вращ. движ., то Т=Ек
вращ. отчки, тела или молек
![]()
Вращательной степенью свободы можно пренебречь.
Для термодинамич. систем, к-е наход. в сост. равновесия, применим з-н распред. Больцмана, к-й гласит,что энергия по степеням свободы распред. равномерно.
Ср.
кинетич. энергия
![]() ,
3-число степ. свободы.
,
3-число степ. свободы.
i=iпост+iвращ+iколеб
n=1 одноатомная молекула:
i=iпост=3
n=2 двухатомная молекула:
i=iпост+iвращ=3+2=5 при Т<1000K,
i=iпост+iвращ+iколеб=7 при Т>1000К.
3) n=3 многоатомная молекула:
iколеб=2S S=3n-5 линейная молекула
S=3n-6 пространственная молекула
i=iпост+iвращ=3+3=6 при Т<1000K,
i=iпост+iвращ+iколеб=3+3+2S при Т=1000К.
U=(i/2)*(m/M)RT=I/2vRT – внутренняя энергия идеального газа.
