Осадительное.
В этих методах исследуемое вещество при взаимодействии с титран-том образует малорастворимое соединение.
AgNO3+NaCl=AgCl+NaNO3
Комплексонометрическое. Эти методы основаны на образовании слабоионизированных комплексов титранта с исследуемым веществом.
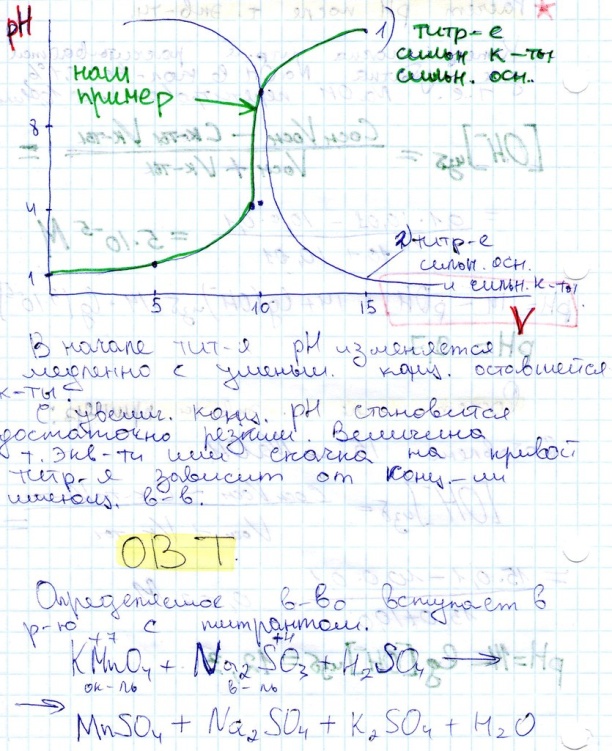
Способы титрования.
Прямое: к раствору опр.компонента добавляют небольшими порциями титрант
Обратное: (по остатку) используют 2 титранта с известными концентрациями. К раствору опр. Вещества добавляют в избыточном количестве точный объем 1-го титранта тк 1-ый титрант добавлен в избытке, то одна часть вступает в хим реакцию с опр. Веществом, а непрореагир. Часть 1-го титранта оттитровывается 2-ым титрантом A+D>продукты D+B, где D-первый титрант B-второй

где А-определяемое вещ-во
С-молярная концентрация компонента
V-объем
M(A)-молярная эквивалентная масса
m (A)-масса опр вещ-ва
NH4Cl+NaOH=NaCl+NH3+H2O
HCl+NaOH=NaCl+H2O
Заместительное
А+Е=L+…
L+B=продукты реакции
Метод применяют, если по первой реакции невозможно зафиксировать точку эквивалентности в связи с неустойчивыми веществами –легко окисляются)
К определяемому вещ-ву добавляют вспомогательный реагент, при взаимодействием с которым количественно определяется продукт реакции. Называют заместителем и далее титруют соответствующим титрантом, расчет массы определяемого по формуле
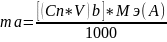
4NH4Cl+6CH2O=(CH)6N4+4HCl+6H2O
HCl+NaOH=NaCl+H2O
Способы приготовления первичных и вторичных растворов
Титрант с известной концентрацией называют стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением точного количества чистого химического вещества известного стехиометрического состава в определенном объеме растворителя. Вторичный стандартный раствор получают следующим образом: готовят раствор с концентрацией, близкой к желаемой, и определяют (стандартизируют) его концентрацию по подходящему первичному стандартному раствору. Для приготовления многих стандартных растворов можно воспользоваться фиксаналами. Фиксанал представляет собой ампулу, в которой запаяно точно известное количество стандартного вещества или раствора. Чтобы получить раствор известной концентрации, нужно разбить ампулу над специальной воронкой с пробивным устройством, перенести содержимое ампулы в мерную колбу подходящего объема и разбавить его водой до метки.
Буферные растворы
Буферные растворы— растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
Тканевая жидкость, кровь, моча и другие биологические жидкости являются буферными растворами.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Расчет рН буферных растворов
Значение pH буферного раствора можно рассчитать по формуле:
![]()
,
где
![]() это
отрицательный десятичный логарифм от
константы диссоциации кислоты
это
отрицательный десятичный логарифм от
константы диссоциации кислоты
![]() .
.
По сути
![]() .
.
Буферная ёмкость раствора — такое количество кислоты или основания, нужное для изменения pH буферного раствора ровно на 1.
Применение буферных растворов в химическом анализе. Примеры.