
- •Часть 1. Основы технической термодинамики
- •Глава 1.Основные понятия и законы термодинамики
- •1.1 Основные понятия технической термодинамики
- •1.2. Основные термодинамические параметры газа.
- •1.3. Внутренняя энергия
- •1.4. Теплота и работа.
- •1.5. Энтальпия
- •1.6. Первый закон термодинамики
- •1.7. Теплоемкость газов
- •1.8. Второй закон термодинамики
- •1.9. Уравнение состояния идеального и реального газов
- •1.10. Смеси идеальных газов
- •1.11. Уравнение состояния газовой смеси
- •1.12. Теплоемкости смесей идеальных газов
- •Глава 2.Термодинамические процессы
- •2.1.Основные газовые законы
- •2.2. Политропный процесс.
- •Глава 3.Термодинамические циклы тепловых машин
- •3.1. Понятие об идеальном термодинамическом цикле тепловых машин
- •3.2. Цикл Карно
- •3.3.Термодинамические циклы поршневых двигателей внутреннего сгорания
- •3.4. Цикл с изохорным подводом теплоты.
- •3.5. Цикл с изобарным подводом теплоты
- •3.6. Цикл со смешанным подводом теплоты
- •3.7. Сравнение термодинамических циклов пдвс.
1.11. Уравнение состояния газовой смеси
Так как газовая смесь состоит из отдельных идеальных газов, то она представляет собой также идеальный газ и может быть описана уравнением в виде:
![]() или
или
![]() (1)
(1)
![]() (2)
(2)
Из
уравнения (1) следует, что смесь идеальных
газов также как отдельных компонентов
подчиняется уравнению Клапейрона-Менделеева,
а
![]() ,
то из (2) следует, т.е. газовая постоянная
смеси равна
,
то из (2) следует, т.е. газовая постоянная
смеси равна
![]()
![]() .
.
Предыдущее выражение для Rсм можно записать в виде:
![]()
,где
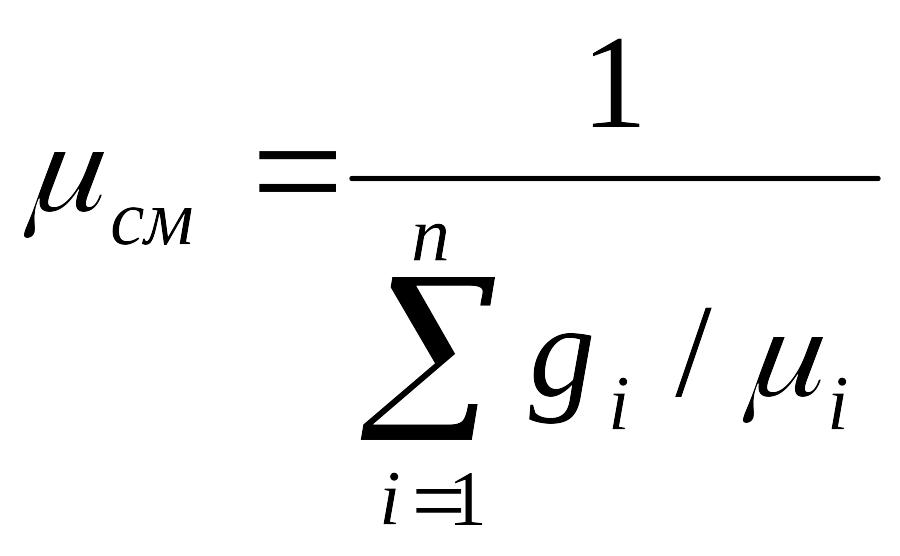 - кажущаяся молекулярная масса смеси
(КММС)
- кажущаяся молекулярная масса смеси
(КММС)
Из определения массовых долей следует, что
![]()
Если
сложить все компоненты газов и учесть,
что
![]() ,
получим выражение для КММС, заданной
объемными долями
,
получим выражение для КММС, заданной
объемными долями
![]() .
.
1.12. Теплоемкости смесей идеальных газов
Если
смесь газов задана массовыми долями,
т.е. массовая теплоемкость определяется
как сумма произведений массовых долей
на массовую теплоемкость каждого газа,
т.е.
![]()
![]()
При задании смеси объемными долями объемная теплоемкость смеси:
![]()
![]()
Аналогично мольная теплоемкость смеси равна произведению объемных долей на вольные теплоемкости составляющих смесь газов:
![]()
![]()
Глава 2.Термодинамические процессы
2.1.Основные газовые законы
Параметры состояния газов p, v, T находятся между собой в определенной взаимосвязи, зависящей от характера процесса изменения состояния газа. Эта взаимосвязь определяется газовыми законами
Закон Бойля-Мариотта – изотермический процесс осуществляется при Т=const, тогда для 1 кг газа pv=const, для m кг pV=const. При постоянной температуре объем данной массы газа обратно пропорционален его давлению
![]() или
или
![]()

Рис.8.Изотермические процессы в координатах PV и TS.
В координатах РV (pv) процесс изменения состояния рабочего тела изображается гиперболой и приведен на рис a. Поскольку в каждой точке этой кривой температура одинакова – кривая называется изотермой. На рис. b координатах T – S изотерма параллельно оси абсцисс. Поскольку в процессе T=const dT=0, то получим, что dU=0 и, следовательно, q1-2=l1-2.
Закон Гей-Люссака — изобарный процесс, т.е. p=const. Объем данной массы газа при постоянном давлении изменяется линейно в зависимости от температуры
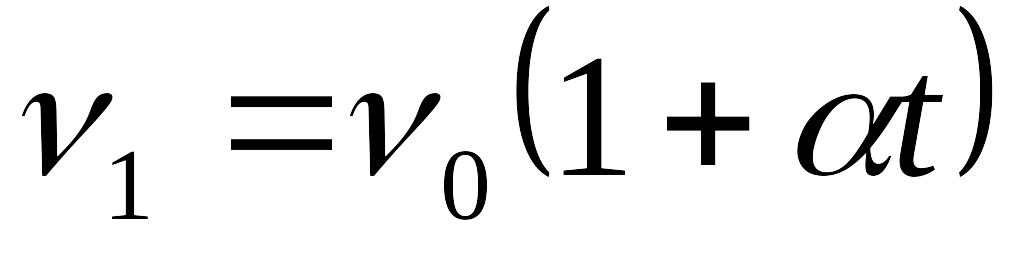 „где
„где
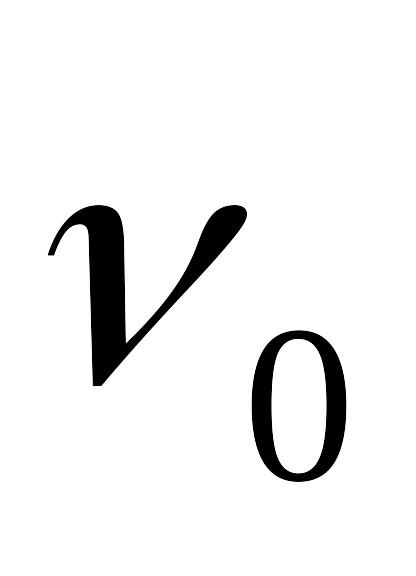 – удельный объем газа при t=0oC,
– удельный объем газа при t=0oC,
 =
1/273
коэффициента объемного расширения.
Уравнения для начального и конечного
состояния
=
1/273
коэффициента объемного расширения.
Уравнения для начального и конечного
состояния
![]()
![]() ,
разделив первое уравнение на второе
получим
,
разделив первое уравнение на второе
получим
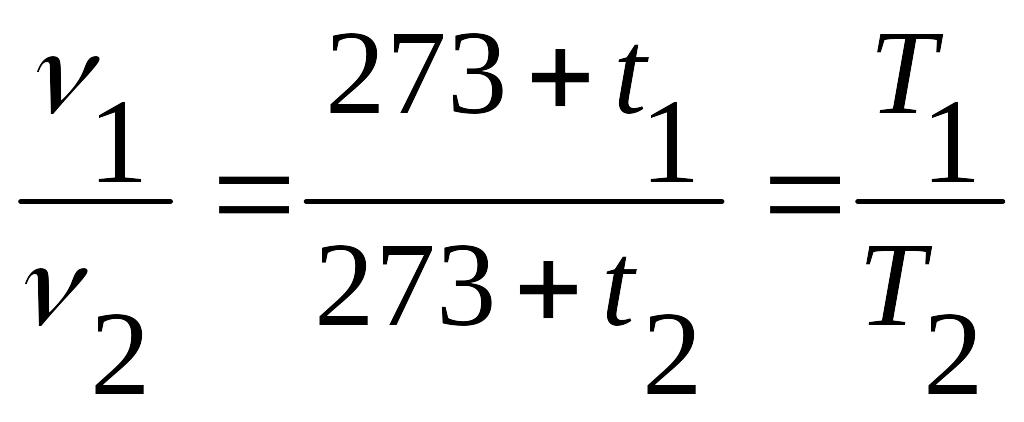 или
или
![]()
![]()
![]()
![]()
Таким образом на изменение энтальпии при p=const объемы данной массы газа прямо пропорциональны их абсолютным температурам

Рис.9 Изобарный процесс в координатах PV и TS.
Закон Шарля – изохорный процесс (v=const). При постоянном объеме давление данной массы прямо пропорционально температурам

Рис.10. Изобарный процесс в координатах PV и TS.
![]()
Поскольку
dv=0,
то dl=0
и первый закон термодинамики для
термодинамических систем при v=const
будет иметь вид
![]() или dq=du,
тогда уравнение изохоры будет иметь
вид:
или dq=du,
тогда уравнение изохоры будет иметь
вид:
или при v=const
![]()
Закон Авогадро: в равных объемах различных газов при одинаковых р и Т содержится одинаковое число молекул. Допустим, что в двух сосудах одинакового объема V1 = V2 = V при одинаковых Т1=Т2=Т и р1=р2=р находится два каких-либо газа. При этих условиях n1 =n2=n. Пусть массы молекул mмол1 и mмол2 одного и второго газа не равны, тогда массы газов m1 и m2 различны
![]() ,
,
![]()
разделив почленно получаем
![]() или
или
![]()
Вместо
массы молекул mмол,
представляющих малую величину, на
практике удобнее применять пропорциональную
ей относительную молекулярную массу
µ,
выраженную в атомных единицах массы
(1,66·10-24г),
за которую принята 1/12 часть массы изотопа
углерода с массовым число 12. Заменяя
mмол
на µ
и учитывая, что v=V/m
p=m/V
получим
![]() .
.
Из
закона Авогадро следует, что при
одинаковых условиях плотности различных
газов пропорциональны их относительным
молекулярным массам, а произведение µv
= const.
В качестве единицы измерения количества
вещества часто принимается моль —
количество вещества, содержащего столько
молекул и (атомов, ионов и другие) сколько
атомов содержится в изотопе углерода
![]() массой 0,012
кг.
Отсюда количество молекул, находится
в одном моле любого газа одинаково и
равно числу Авогадро (6,22·1023
моль-1).
массой 0,012
кг.
Отсюда количество молекул, находится
в одном моле любого газа одинаково и
равно числу Авогадро (6,22·1023
моль-1).
Масса киломоля (1 кмоль = 103 моль) какого-либо газа в 1кг численно равна молекулярной массе µ этого газа, например 1 кмоль углекислого лаза имеет массу 44, а кислорода 32.
Если в
произведении µv
за µ принять не относительную молекулярную
массу, а массу кмоля в кг, то оно представит
объем 1 кмоля
Vµ
(м3/
кмоль)
и тогда µv=
Vµ.
Поскольку p
и T
одинаковы, то µv=const.
При таких условиях объемы киломолей Vµ
всех газов одинаковы. При нормальных
условиях (pn=101,3кПа
Tn=273К)
Vµ
=22,4
м3/кмоль.
Тогда при нормальных условиях можно
определить плотность любого
![]() ,
например
,
например
![]()
![]()
5. Адиабатный процесс. Протекает без теплообмена термодинамической системы с окружающей средой, то есть не получает теплоты из вне и не отдает ее окружающей средой. Для осуществления такого процесса необходимо либо изолировать термодинамическую систему от окружающей среды, либо реализовать процесс настолько быстро, чтобы теплообмен с окружающей средой был пренебрежимо мал по сравнению с полезно используемой теплотой (например, теплотой преобразованной в механическую работу в процессах расширения сжатия). Условие протекания адиабатного процесса dq=0. Тогда уравнения первого закона термодинамики для адиабаты будут иметь вид
![]() или
или
![]()
подставив в полученное уравнение заменим du, получим
![]() или
или
![]()
![]()
разделив второе уравнение на первое получим
 или
или
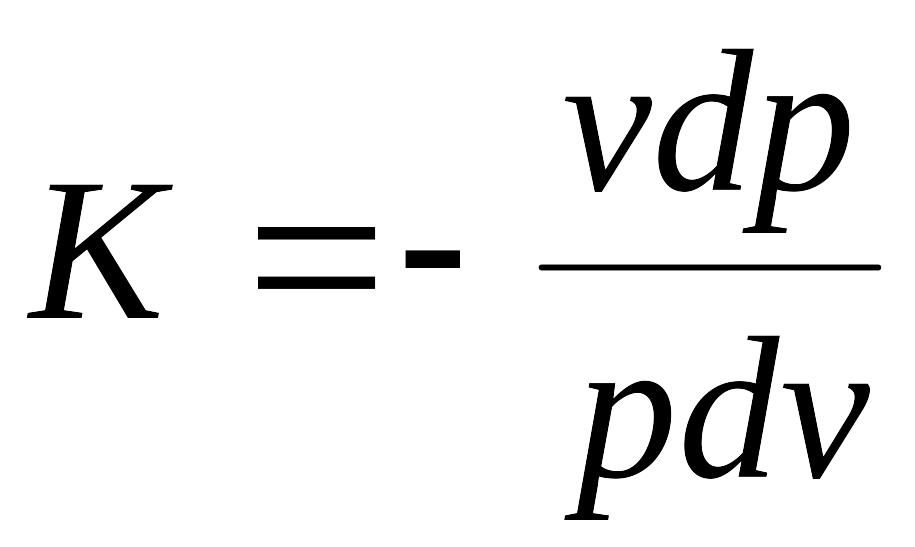
после разделения уравнения
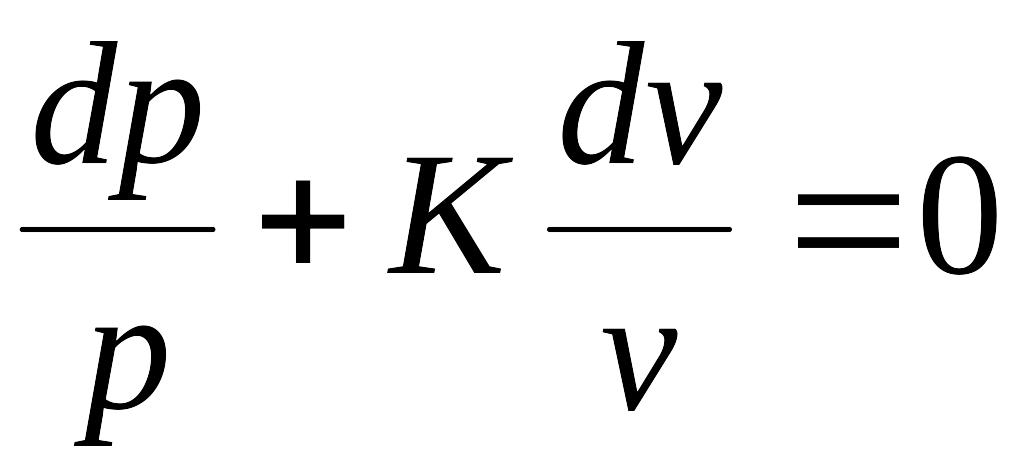
после интегрирования получим уравнения вида:
![]()
после потенцирования данного выражения получим pvк= const. Тогда связь между давлениями и объемами в процессе можно представить в виде:
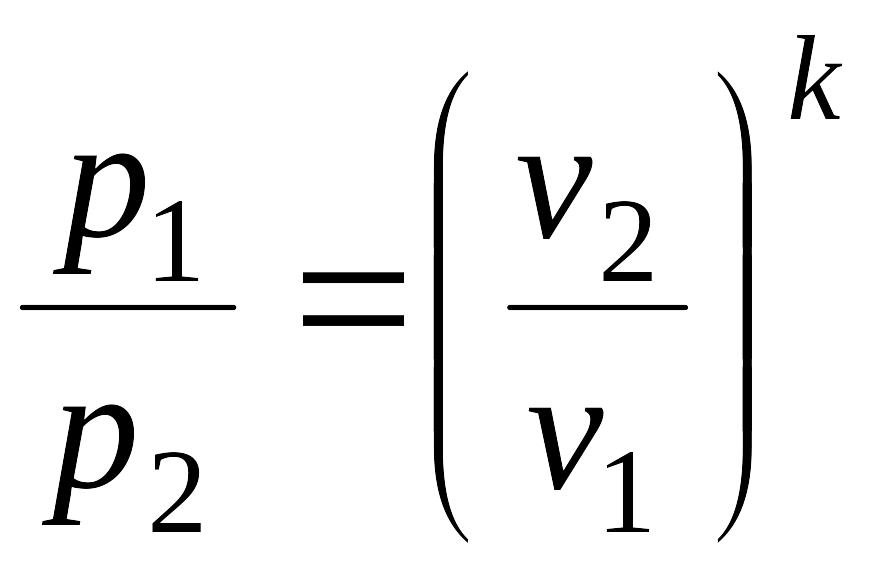
связь между температурами и объемами в виде:
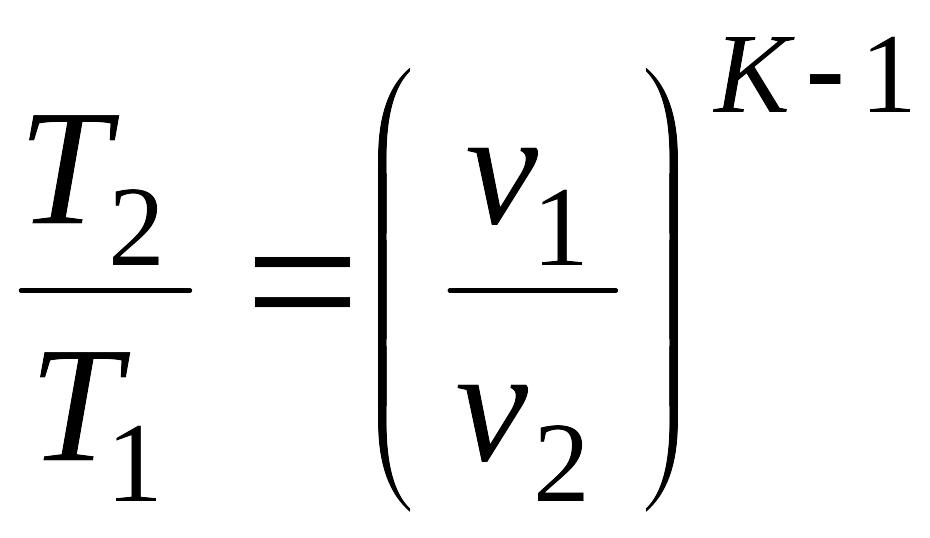
связь между давлениями и температурами в виде:
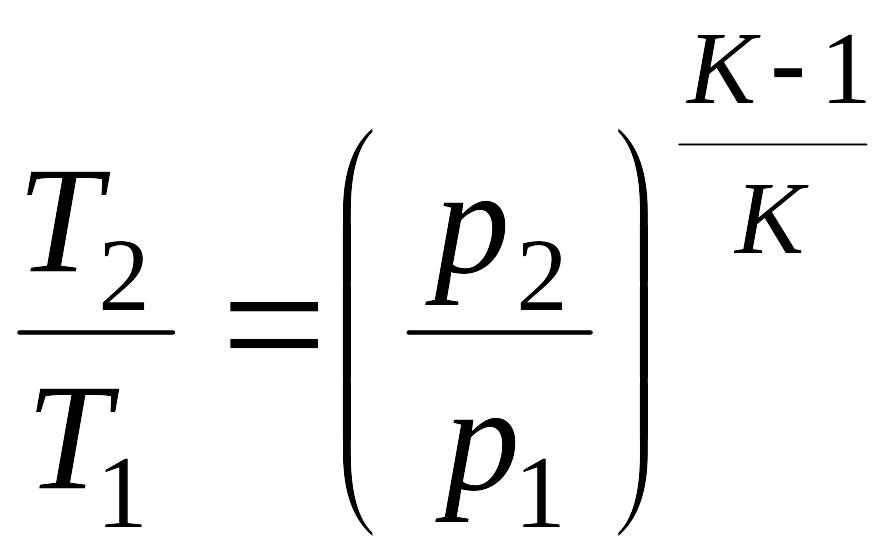
Полученные
уравнения и представляют собой уравнения
адиабата идеального газа при постоянном
отношении теплоемкостей
![]() .
Величина К
носит
название показатель
адиабаты. Поскольку сp=сv+R,
то
.
Величина К
носит
название показатель
адиабаты. Поскольку сp=сv+R,
то
![]()
Для одноатомных газов К=1,66, двухатомных К=1,4,трехатомных К=1,333.
Поскольку К>1, то в координатах p,v (рис.) линия адиабаты pvK=const проходит круче изотермы pv = const. Давление при адиабатном расширении изменяется быстрее, чем в изотермическом процессе, поскольку в процессах адиабатного расширения и сжатия изменяется температура. На T,S диаграмме адиабатный процесс изображается вертикально, поскольку dg=0, то и dS=O, следовательно, S=const
Полученные уравнение адиабаты можно выразить с использованием уравнения состояния через отношения температур.

Рис. Адиабатный процесс в координатах p-v и Т-S
Элементарная удельная работа изменения объема (внутренняя работа) в адиабатном процессе может быть вычислена по одной из формул
![]() ;
;
![]()
откуда

поскольку
![]() и
и
![]()
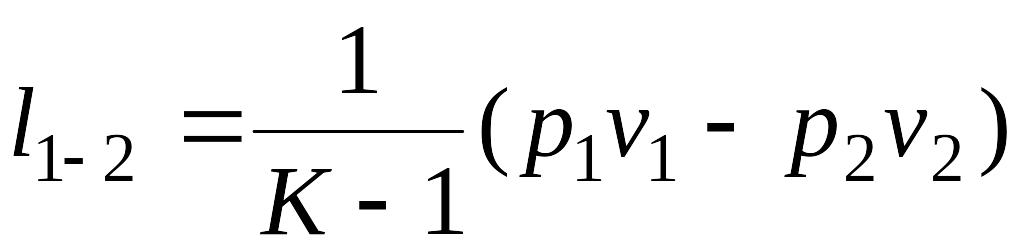
полезная
внешняя работа
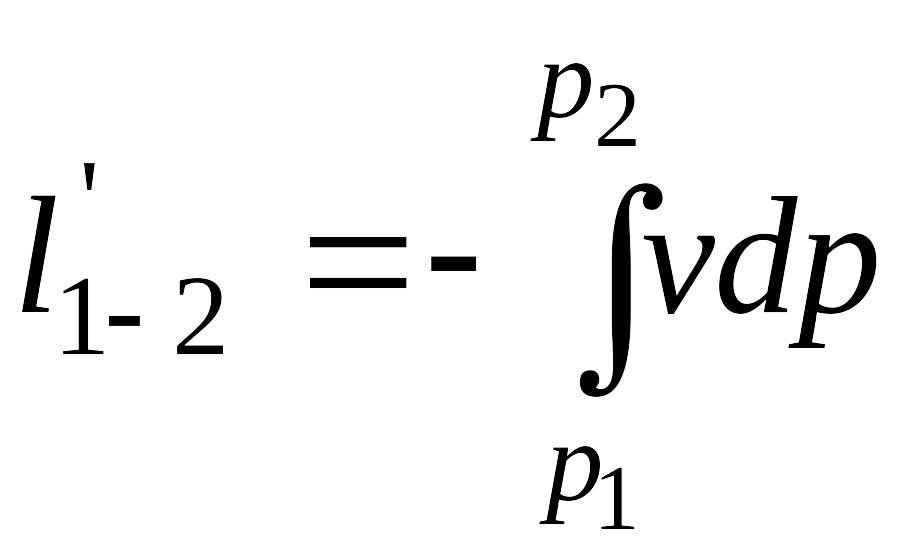 ,
но поскольку –vdp=Kvdp,
то
,
но поскольку –vdp=Kvdp,
то
![]()
Принимая
во внимание, что в адиабатном процессе
q=0,
a
![]() ,
то теплоемкость адиабатного процесса
равно нулю (с=0). Работа изменения объема
в адиабатном процессе осуществляется
за счет внутренней системы. При этом
внутренняя энергия газа и температура
при расширении уменьшается, а при сжатии
увеличиваются.
,
то теплоемкость адиабатного процесса
равно нулю (с=0). Работа изменения объема
в адиабатном процессе осуществляется
за счет внутренней системы. При этом
внутренняя энергия газа и температура
при расширении уменьшается, а при сжатии
увеличиваются.
