
- •Часть 1. Основы технической термодинамики
- •Глава 1.Основные понятия и законы термодинамики
- •1.1 Основные понятия технической термодинамики
- •1.2. Основные термодинамические параметры газа.
- •1.3. Внутренняя энергия
- •1.4. Теплота и работа.
- •1.5. Энтальпия
- •1.6. Первый закон термодинамики
- •1.7. Теплоемкость газов
- •1.8. Второй закон термодинамики
- •1.9. Уравнение состояния идеального и реального газов
- •1.10. Смеси идеальных газов
- •1.11. Уравнение состояния газовой смеси
- •1.12. Теплоемкости смесей идеальных газов
- •Глава 2.Термодинамические процессы
- •2.1.Основные газовые законы
- •2.2. Политропный процесс.
- •Глава 3.Термодинамические циклы тепловых машин
- •3.1. Понятие об идеальном термодинамическом цикле тепловых машин
- •3.2. Цикл Карно
- •3.3.Термодинамические циклы поршневых двигателей внутреннего сгорания
- •3.4. Цикл с изохорным подводом теплоты.
- •3.5. Цикл с изобарным подводом теплоты
- •3.6. Цикл со смешанным подводом теплоты
- •3.7. Сравнение термодинамических циклов пдвс.
1.3. Внутренняя энергия
Единая количественная мера движения материи, которая для совокупности всех взаимодействующих тел остается неизменной называется энергией. Поскольку материя немыслима без движения, то все тела обладают некоторым запасом, называемым внутренней энергией. Таким образом, любое тело обладает внутренней энергией.
Внутренняя энергия U тела определяется энергией хаотического движения молекул и атомов и включает в себя кинетическую энергию поступательного и вращательного движения его молекул, энергию внутримолекулярных колебаний, а также потенциальную энергию сил сцепления между молекулами. Как и все виды энергии U в системе СИ имеет размерность Дж(кДж, МДж).
Часто используется понятие удельной внутренней энергии.
![]() (Дж/кг)
(Дж/кг)
Внутренняя энергия газа зависит от его температуры и сил сцепления между молекулами (иными словами от среднего расстояния между ними), следовательно, от объема занимаемого рассматриваемым газом.
U=f(T,V)
Так как функция состояния газа однозначно определяется заданием двух его любых термодинамических параметров, то изменение dU не зависит от характера процесса, т.е. от промежуточного состояния газа, а полностью определяется его начальным и конечным состояниями.
Внутренняя энергия идеального газа равна суммарной кинетической энергии всех молекул.
![]()
где n-число молекул термодинамической системы
1.4. Теплота и работа.
Теплота и работа являются формами энергии, наряду с химической, электрической, магнитной и т.д., причем, работа связана с изменениями РТ.
Из курса физики известно, что элементарная работа dL равновесного процесса определяется в общем случае произведением силы на элемент перемещения точки приложения силы:
dL=Fdx=Fcos(F,x)dx
где F–сила; Fx–проекция силы на перемещение x; dx–элементарное перемещение.
Если F и Fх выразить в ньютонах, х в метрах, то L получится в джоулях.
Работа есть эффект действия силы при ее перемещении, зависит от условий протекания процесса и не зависит от состояния тела, поэтому элементарная работа не является полным дифференциалом и имеет
dL=Fxdx=pdV
где dV-элементарное изменение объема газа (пара) в цилиндре при перемещении поршня на dx или
![]()
В соответствии с этим выражением работу расширения или сжатия принято называть работой изменения объема или деформационной работой.
Отнеся работу к одному килограмму массы РТ получим удельную работу
dl=dL/M=pdV/M=pdv
тогда величина l, представляющая собой удельную работу, совершаемую системой, содержащей 1кг газа(пара) равна
![]()
Поскольку в общем случае р–величина переменная, то интегрирование возможно лишь тогда, когда известен закон изменения давления р=р(v).
Принимается работа расширения, совершаемая системой против внешних сил – положительная и называется внутренней работой. Работа сжатия, совершаемая окружающей средой против внутренних сил системы – отрицательная и называется внешней.

Рис. 4. Иллюстрация работы в координатах р – v
Рассмотрим на диаграмме p–v равновесный процесс 1–2 расширения системы.
Объем системы изменяется от v1 до v2. Работа расширения (сжатия) численно равна площади заштрихованной фигуры, ограниченной линией процесса, ординат крайних точек и осью абцисс. Работа зависит от пути перехода системы из состояния 1 в состояние 2. т.е. от характера процесса. И тогда удельная работа расширения в процессе 1–2 равна
![]()
Значение интеграла зависит от вида подинтегральной функции p(v), поэтому с изменением характера процесса изменяется работа расширенния.
Поскольку работа расширения(сжатия) является функцией процесса, то величина dl не является полным дифференциалом, как например, дифференциал внутренней энергии.
Теплота(количество теплоты) – энергетическая характеристика процесса теплообмена, измеряемая количеством энергии, которая получает(отдает) в процессе теплообмена рассматриваемое тело(или система). Обозначается буквой Q(Дж), удельное количество теплоты – q(Дж/кг).
Теплота сообщенная системе считается положительной, а отданная системой – отрицательной. То есть для работы и количества теплоты приняты противоположные правила знаков.
Теплота, как и работа, является функцией процесса, так как зависит от пути перехода системы из одного состояния в другое.
Элементарное количество теплоты равно
dQ=TdS или dq=Tds
На диаграмме рис. 5. Удельная теплота
численно равна заштрихованной площади
под кривой процесса 1–2,т.е.
![]()
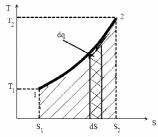
Рис 5. Иллюстрация теплоты в координатах (Т–S)
Величина dq также не является полным дифференциалом, а представляет элементарное количество теплоты, переданной (поглощённой) системе (системой) в термодинамическом процессе.
Таким образом теплота и работа – это энергетические характеристики процессов механического и теплового воздействий с окружающей средой. Они характеризуют количественные меры энергии, переданные ТС или отданные ею окружающей среде в определенном процессе.
Внутренняя энергия и энтропия – это свойства системы, они характеризуют только состояние системы.
