
- •2. Источники тепла и их характеристики.
- •4. Понятие о массах топлива. Элементарный состав.
- •5. Низшая и высшая теплота сгорания. Условное топливо.
- •6. Влажность и зольность топлива.
- •7. Рабочая масса топлива. Характеристики основных элементов.
- •8. Фактический и расчетный расходы топлива.
- •9. Схема соврем котла, его осн элементы, их значения.
- •10. Понятие о скорости горения. Закон действующих масс.
- •11. Маркировка котлов
- •12. Физическая сущность процессов воспламенения и горения.
- •14. Понятие об энергии активации.
- •15. Выход летучих веществ
- •16. Задачи и методика составления материального баланса процессов горения..
- •17. Теоретически необходимое кол-во воздуха.
- •18. Понятие о коэффициенте избытка воздуха и влияние его на экономичность работы котла.
- •20. Располагаемое тепло топлива.
- •21. Потеря тепла с уходящими газами и выбор оптимальной температуры уходящих газов ( ).
- •22. Присосы воздуха в котлоагрегат и их влияние на работу котла.
- •23. Состав газообразных продуктов сгорания при полном и неполном горении.
- •24. Количество газообразных продуктов сгорания.
14. Понятие об энергии активации.
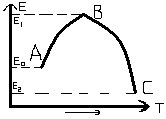
При фиксированной температуре реакция возможна, если взаимодействующие молекулы обладают определенным запасом энергии. Аррениус эту избыточную энергию назвал энергией активации, а сами молекулы активированными. По Аррениусу константа скорости k и энергия активации Ea связаны соотношением, получившим название уравнения Аррениуса: K=Kо е- E / RT . Здесь Kо – предэкспоненциальный множитель, определяется характеристикой полного числа столкновений молекул, он также учитывает, что для взаимодействия сложных активных молекул необходима определенная взаимная ориентация; R – универсальная газовая постоянная; Т – абсолютная температура реагирующих веществ; Е – энергия активации, равная сумме энергий атомов и молекул, вступающих в реакцию. Т.о. при постоянной температуре скорость реакции определяет E. Чем больше E, тем меньше число активных молекул и тем медленнее протекает реакция. При уменьшении E скорость возрастает, а при E = 0 реакция протекает мгновенно. e- E / RT =0 при Е→∞, Т→0; e- E / RT =1 при Е→0, Т→∞. На рис. видно, что затрачиваемая на перевод начальных продуктов в активное состояние (А* – активированный комплекс) энергия затем полностью или частично вновь выделяется при переходе к конечным продуктам. Разность энергий начальных и конечных продуктов определяет ΔH реакции, которая от энергии активации не зависит. Т.о., по пути из исходного состояния в конечное система должна преодолеть энергетический барьер. Только активные молекулы, обладающие в момент столкновения необходимым избытком энергии, равным E, могут преодолеть этот барьер и вступить в химическое взаимодействие. С ростом температуры увеличивается доля активных молекул в реакционнной среде.

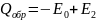
Существуют две принципиальные возможности ускорения реакции: а) увеличение температуры, б) снижение энергии активации.
15. Выход летучих веществ
При нагревании твердого топлива без доступа воздуха под действием высокой тем-ры (200-800С) нач-ся термическое разложение его на газообразную часть(летучие в-ва) и твердый остаток(кокс).Если не учитывать водяных паров, которые образовались в рез-те испарения влаги нагреваемого топлива, летучего вещ-ва содержат водород, тяжелые углеводороды, окись углерода, немного углекислоты и др. газы. Температура выхода летучих в-в, их кол-во и хим. состав зависят от хим. состава топлива. Чем моложе топливо(чем меньше степень углефикации), тем больше содержится термически неустойчивых молекул, больше выход летучих и ниже тем-ра их выхода.
Выход летучих в-в в лаб.условиях опр-ют путем подогрева без доступа воздуха навески анал.пробы топлива при темп-ре 850С в теч 7мин. Большой выход летучих в-в имеют горючие сланцы, торф, БУ, наименьший- антрацид, тощий уголь.
Кокс, оставшийся после сжигания после полного выделения летучих в-в, состоит из углерода и минеральной части топлива. Бывает порошкообразный, слипшийся, слабоспекшийся, спекшийся,сплавленный.У топлива с большим выходом летучих коксовый остаток пористый, что дает ему высокую реакционную способность. Хар-р горючего остатка играет решающую роль при определении наиболее рационального пути использования топлива
