
- •2. Источники тепла и их характеристики.
- •4. Понятие о массах топлива. Элементарный состав.
- •5. Низшая и высшая теплота сгорания. Условное топливо.
- •6. Влажность и зольность топлива.
- •7. Рабочая масса топлива. Характеристики основных элементов.
- •8. Фактический и расчетный расходы топлива.
- •9. Схема соврем котла, его осн элементы, их значения.
- •10. Понятие о скорости горения. Закон действующих масс.
- •11. Маркировка котлов
- •12. Физическая сущность процессов воспламенения и горения.
- •14. Понятие об энергии активации.
- •15. Выход летучих веществ
- •16. Задачи и методика составления материального баланса процессов горения..
- •17. Теоретически необходимое кол-во воздуха.
- •18. Понятие о коэффициенте избытка воздуха и влияние его на экономичность работы котла.
- •20. Располагаемое тепло топлива.
- •21. Потеря тепла с уходящими газами и выбор оптимальной температуры уходящих газов ( ).
- •22. Присосы воздуха в котлоагрегат и их влияние на работу котла.
- •23. Состав газообразных продуктов сгорания при полном и неполном горении.
- •24. Количество газообразных продуктов сгорания.
10. Понятие о скорости горения. Закон действующих масс.
Горение - сложный физ.-хим. процесс окисления топлива, протекающ. с интенсивным выделением тепла и характериз. значительным повышением температуры газообразных продуктов сгорания. В кач-ве окислителя в топках котлов исп-ся кислород воздуха.
Процессы горения подразделяются на гомогенные и гетерогенные.
Гомогенным наз. процесс горения, который происходит в однородной по агрегатному состоянию массе, т.е. горение смеси газообразного топлива с воздухом и смеси паров жидкого топлива с воздухом.
Гетерогенным наз. процесс горения, при котором горючее в-во и окислитель находятся в различных агрегатных состояниях, (горение твердого топлива).
Процесс горения может протекать с разной скоростью – от медленного до мгновенного. Медленное горение – самовозгорание твердого топлива при его хранении на складах. Мгновенное горение представляет собой взрыв. В теплоэнергетических установках практическое значение имеет такая скорость реакции, при которой происходит устойчивое горение, т.е. при постоянной подаче в зону горения топлива и окислителя. При этом соотношение концентрации топлива и окислителя должен быть определенным. При нарушении этого соотношения (богатая смесь, бедная смесь) скорость реакции снижается и уменьшается тепловыделение на единицу объема.
Хим. р-ии взаимодействующих в-в подчиняются закону действия масс, который формулируется след. образом:
при постоянной тем-ре скорость р-ии в гомогенной сис-ме пропорциональна произведению концентраций реагирующих в-ств.
mА+nB=pD+gF

11. Маркировка котлов
Существует два вида: по Госту и заводская.
Если давление пара от 1,3 до 3,9 Мпа эта маркировка предусматривает 4 типа котлов:
Пр – паровой стационарный котел (ПСТ) с принудительной циркуляцией без перегрева пара.
Е – ПСТ с естественной циркуляцией , с перегревом и без перегрева пара.
Еп – ПСТ с естественной циркуляцией, с перегревом и промежуточным перегревом.
Пп – ПСТ прямоточный с перегревом и промежуточным перегревом.
Е-1,0-1,4/224 ГМ
1,0-паропроизводительность
1,4-давление пара в барабане
224-температура перегретого пара
ГМ-газомазутный
С-слоевое сжигание
Г- на газе
Ж-жидкое
К-комбинированое
КВ-ГМ-100 - водогрейный , газомазутный
КВ-ТС-4 - твердое топливо, слоевое сжиг.
КВ-ТК-180 - камерное сжигание.
12. Физическая сущность процессов воспламенения и горения.
Горение топлива - это быстро протекающая химическая реакция взаимодействия органической массы топлива с кислородом воздуха, характеризуемая значительной скоростью тепловыделения и развитием высоких температур. Горение обычно сопровождается ярким свечением (пламенем). Для того чтобы инициировать горение топлива, необходимо поджечь или нагреть его от внешнего источника тепла до определенной температуры. Начинается процесс горения, и для поддержания высокой температуры внешний источник тепла уже не требуется.
Горение может начаться самопроизвольно в результате самовоспламенения горючего вещества при наличии окислителя и достаточной температуры.
В зависимости от вида и химического состава топлива характер горения может быть существенно различным. Так, например, газообразное топливо образует с окислителем (кислородом воздуха) однофазную гомогенную смесь, легко воспламеняющуюся и быстро сгорающую. При этом горение распространяется на весь объем топливовоздушной смеси. При сжигании жидкого топлива в топочную камеру подается распыленное топливо - капли мазута или дизтоплива. Быстрое прогревание и повышение температуры капель приводит к их испарению, в результате чего образуется гомогенная смесь паров топлива с воздухом. Несколько сложнее протекает процесс воспламенения и горения твердого топлива при факельном его сжигании (когда в топочную камеру подаются частицы твердого топлива размером от нескольких микрон до 1000 мкм). Сгорание твердого топлива производится в слоевых топках, топках с кипящим слоем, факельных и циклонных топках. После попадания тв.топлива в топку оно 1)подсушивается, т.е из него выделяется водяной пар 2)газифицируется, т.е. из него выделяется летучие вещ-ва3)после чего начинает гореть кокс.
Тем-ра, отвечающая равенству тепловыделения и теплопоглощения, наз. температурой воспламенения. Она не явл-ся постоянной величиной и зав-ит от от природы и состава горючей смеси и интенсивности теплообмена в зоне воспламенения.Для каждой обл-ти воспламенения хар-ны свои верхние и нижние пределы концентрации смеси с воздухом, вне кот-ых процесс горения невозможен.
Способы воспламенения:
-поджигание- горение нач-ся от постороннего высокотемпер. точечного ист-ка
-самовоспламенение- когда повышается температура всей реагирующей смеси.
13. Закон Аррениуса.
При фиксированной температуре реакция возможна, если взаимодействующие молекулы обладают определенным запасом энергии. Аррениус эту избыточную энергию назвал энергией активации, а сами молекулы активированными. По Аррениусу константа скорости k и энергия активации Ea связаны соотношением, получившим название уравнения Аррениуса:
K=Kо
е-
E
/ RT
.
Здесь к0
– предэкспоненциальный множитель,
определяется характеристикой полного
числа столкновений молекул, он также
учитывает, что для взаимодействия
сложных активных молекул необходима
определенная взаимная ориентация; R –
универсальная газовая постоянная; Т –
абсолютная температура реагирующих
веществ; Е – энергия активации, равная
сумме энергий атомов и молекул, вступающих
в реакцию. Т.о. при постоянной температуре
скорость реакции определяет E. Чем больше
E, тем меньше число активных молекул и
тем медленнее протекает реакция. При
уменьшении E
скорость возрастает, а при E = 0 реакция
протекает мгновенно. e-
E
/ RT
=0 при Е→∞, Т→0; e-
E
/ RT
=1 при Е→0, Т→∞. При данных значениях Т
и Е e-
E
/ RT
можно рассматривать как долю общего
числа столкновений молекул/атомов,
приводящим к химическим взаимодействиям.
Величина E характеризует природу
реагирующих веществ и определяется
э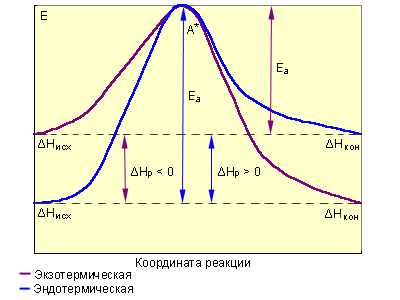 кспериментально
из зависимости k = f(T). На рис. видно, что
затрачиваемая на перевод начальных
продуктов в активное состояние (А* –
активированный комплекс) энергия затем
полностью или частично вновь выделяется
при переходе к конечным продуктам.
Разность энергий начальных и конечных
продуктов определяет ΔH реакции, которая
от энергии активации не зависит. Т.о.,
по пути из исходного состояния в конечное
сис-ма должна преодолеть энергетический
барьер. Только активные молекулы,
обладающие в момент столкновения
необходимым избытком энергии, равным
E, могут преодолеть этот барьер и вступить
в химическое взаимодействие. С ростом
температуры увеличивается доля активных
молекул в реакционнной среде.
кспериментально
из зависимости k = f(T). На рис. видно, что
затрачиваемая на перевод начальных
продуктов в активное состояние (А* –
активированный комплекс) энергия затем
полностью или частично вновь выделяется
при переходе к конечным продуктам.
Разность энергий начальных и конечных
продуктов определяет ΔH реакции, которая
от энергии активации не зависит. Т.о.,
по пути из исходного состояния в конечное
сис-ма должна преодолеть энергетический
барьер. Только активные молекулы,
обладающие в момент столкновения
необходимым избытком энергии, равным
E, могут преодолеть этот барьер и вступить
в химическое взаимодействие. С ростом
температуры увеличивается доля активных
молекул в реакционнной среде.
Предэкспоненциальный множитель A характеризует общее число соударений. Для реакций с простыми молекулами A близок к теоретической величине столкновений Z, т. е. A = Z, рассчитываемой из кинетической теории газов. Для сложных молекул A ≠ Z, поэтому необходимо вводить стерический фактор P: A = ZP Стерический фактор учитывает то обстоятельство, что для взаимодействия сложных активных молекул необходима определенная взаимная ориентация. Таким образом, уравнение Аррениуса имеет вид: k=(ZPe) - E / RT . Здесь Z – число всех соударений, P – доля соударений, благоприятных в пространственном отношении (принимает значения от 0 до 10–9), - E/RT– доля активных, т. е. благоприятных в энергетическом отношении соударений.
