
- •Оглавление
- •1. Свойства препарата 4
- •2. Средства измерений, вспомогательные устройства, материалы, растворы………...6
- •2.1. Йодометрическое титрование 8
- •Введение
- •1 Свойства препарата
- •2 Средства измерений, вспомогательные устройства, материалы, растворы
- •2.1 Йодометрическое титрование
- •2.2 Спектрофотометрия
- •3 Йодометрический метод анализа
- •3.1 Сущность метода определения
- •3.2. Исходные данные для анализа
- •3.3 Экспериментальная часть
- •3.4 Математическая обработка результатов
- •4 Спектрофотометрический метод определения фурацилина
- •4.1 Сущность метода определения
- •4.2 Экспериментальная часть
- •5 Математическая обработка результатов двух методов
- •Заключение
- •Список используемой литературы
3.4 Математическая обработка результатов
1). Среднеинтервальное значение выборки равно
 ;
;
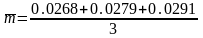 =0,0279
г.
=0,0279
г.
Оценка случайных погрешностей:
Вычисляем выборочную дисперсию:
Стандартное
отклонение равно
 ;
;

S=0,0012.
Вычисляем
интервал значений массы:
 ,
используя определение погрешности с
помощью критерия t
– Стьюдента.
,
используя определение погрешности с
помощью критерия t
– Стьюдента.
Коэффициент Стьюдента при числе степеней свободы f=2 и значении доверительного интервала α=0,95 равен 4,3. Следовательно,
 г
г
Таким
образом, получен результат:

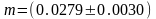 г
г
2). Перерасчет результата с учетом практического взвешивания 1 таблетки препарата.
Общая масса препарата в упаковке (10 таблеток) равна 8.2256 г, следовательно, масса 1 таблетки = 0.8226 г.
Тогда по пропорции находим примерное истинное содержание фурацилина в 1 таблетке: 0,0279*0,8226 = 0,8001*х.
Отсюда х = 0,0287 г – количественное содержание фурацилина в 1 таблетке препарата.
Массовая доля фурацилина в 1 таблетке препарата:
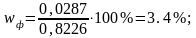

wср= 3,25% - среднее значение процентного содержания фурацилина в 1 таблетке препарата, исследованного методом йодометрии.
3). Итоговый результат количественного определения фурацилина в препарате методом йодометрии в 1 таблетке (m= 0.8226 г):
 г
г
4 Спектрофотометрический метод определения фурацилина
4.1 Сущность метода определения
Метод молекулярной абсорбционной спектроскопии в УФ и видимой областях спектра обычно называют спектрофотометрией. Объектом спектрофотометрических измерений, как правило, являются растворы. Фотометрирующий раствор помещают в кювету – сосуд с плоскими параллельными прозрачными гранями.
Спектрофотометрический метод основан на измерении поглощения света. Чтобы исключить влияние светорассеяния, фотометрируемый раствор должен быть прозрачным. Прочие эффекты можно скомпенсировать, используя раствор сравнения. В простейшем случае им является чистый растворитель или раствор контрольного опыта (содержащий все компоненты кроме определяемого). Раствор сравнения и фотометрируемый раствор помещают в кюветы одинаковой толщины.
Закон Бугера-Ламберта-Бера.
Пусть
слой однородной среды толщиной
 содержит светопоглощающее вещество в
концентрации
содержит светопоглощающее вещество в
концентрации
 .
Через него пропускают монохроматический
световой поток интенсивности
.
Через него пропускают монохроматический
световой поток интенсивности
 .
Интенсивность света на выходе из слоя
равна
.
Интенсивность света на выходе из слоя
равна
 ,
причем
,
причем
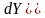 (поток ослабляется). Экспериментально
установлено, что доля поглощенного
света
(поток ослабляется). Экспериментально
установлено, что доля поглощенного
света
 прямо
пропорциональна толщине слоя и
концентрации поглощающего вещества:
прямо
пропорциональна толщине слоя и
концентрации поглощающего вещества:
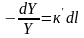 .
.
Математическое
выражение основного закона светопоглощения:
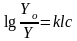 .
.
Величину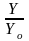 называют пропусканием и обозначают
называют пропусканием и обозначают
 (
( ).
).
Величину
 называют оптической плотностью (значению
T=1
соответствует
называют оптической плотностью (значению
T=1
соответствует
 =0,
=0
=+
=0,
=0
=+ ).
).
Коэффициент k называется коэффициентом поглощения.
При выводе основного закона светопоглощения не делалось никаких предположений ни о природе поглощающей среды, ни о характере поглощаемого излучения, следовательно, этот закон универсален. Он справедлив не только для спектрофотомерии, но и для абсорбционных спектроскопических методов. Поскольку связь между концентрацией и оптической плотностью прямо пропорциональна, то из всех возможных величин, характеризующих светопоглощение, именно оптическую плотность удобнее всего использовать в спектрофотометрии в качестве аналитического сигнала.
Если
концентрация поглощающих частиц выражена
в моль/л, а толщина слоя в сантиметрах,
то коэффициент поглощения обозначается
буквой
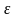 и называется молярным коэффициентом
поглощения. Общепринятая форма записи
основного закона светопоглощения в
спектрофотометрии выглядит так:
и называется молярным коэффициентом
поглощения. Общепринятая форма записи
основного закона светопоглощения в
спектрофотометрии выглядит так:

Ограничения основного закона светопоглощения:
1).
Выполняется при малых концентрациях
 ,
при больших концентрациях наблюдается
отклонение от прямолинейности;
,
при больших концентрациях наблюдается
отклонение от прямолинейности;
2).
Свет, падающий на раствор должен быть
монохроматичным ( );
);
3). В растворе должны находиться частицы только одного состава.
Закон аддитивности оптических плотностей:
Если в растворе присутствует несколько поглощающих веществ, то оптическая плотность раствора равна сумме вкладов каждого из компонентов:
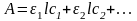
Квантово-механическими
расчетами показано, что для молекул в
растворах максимальная величина
составляет порядка
 .
Минимальное значение оптической
плотности, которое можно измерить с
необходимой точностью составляет
порядка 0,01, а величины l,
используемые в аналитической практике,
1 сантиметр. Отсюда минимальное значение
концентраций, определяемых
спектрофотометрическим методом,
составляет
.
Минимальное значение оптической
плотности, которое можно измерить с
необходимой точностью составляет
порядка 0,01, а величины l,
используемые в аналитической практике,
1 сантиметр. Отсюда минимальное значение
концентраций, определяемых
спектрофотометрическим методом,
составляет
 .
Спектрофотометрический метод относится
к среднечувствительным.
.
Спектрофотометрический метод относится
к среднечувствительным.
Способы определения концентрации в спектрофотометрии:
1) абсолютная спектрофотометрия:
За раствор сравнения принимают раствор, в котором не содержится определяемого компонента (нулевой раствор). Оптическую плотность остальных растворов измеряют относительно нулевого раствора;
2) дифференциальная спектрофотометрия:
За раствор сравнения выбирают раствор с точно известной концентрацией вещества. Его оптическую плотность приравнивают к нулю и измеряют относительно него оптическую плотность остальных растворов, расширяя при этом диапазон концентраций. Минусом является то, что при малых концентрациях имеем большую погрешность.
Методы спектрофотометрии:
1. Метод градуировочного графика;
2. Метод сравнения;
3. Метод добавок;
4. Расчетный метод.
Остановимся подробнее на методе градуировочного графика. В методе градуировочного графика готовят серию растворов с точно известной концентрацией, измеряют их оптическую плотность относительно раствора сравнения и по данным этих измерений строят градуировочный график (график зависимости оптической плотности от объема вещества). Затем измеряют оптическую плотность раствора с неизвестной концентрацией и, зная ее, непосредственно определяют концентрацию. Градуировочный график можно построить и дифференциальным способом, но для этого необходимо принять за ноль концентрацию одного из растворов, последовательность дальнейших действий та же самая.
