
- •1. Классификация, изомерия, номенклатура
- •2. Алифатические амины
- •2.1. Методы получения.
- •2.2. Физические свойства и строение
- •2.3. Химические свойства
- •3. Енамины
- •3.1. Методы получения
- •3.2. Строение
- •3.3. Химические свойства
- •4. Ароматические амины
- •4.1. Методы получения
- •4.2. Физические свойства и строение
- •4.3. Химические свойства
- •1. Методы получения
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции по аминогруппе
- •2.3. Реакции по карбоксильной группе
- •2.4. Специфические реакции аминокислот
- •3.1. Строение и классификация
- •3.2. Стереоизомерия.
- •3.3. Кислотно-основные свойства.
- •4. Пептиды
- •4.1. Строение пептидов
- •4.2. Определение аминокислотной последовательности
- •4.3. Синтез петидов
- •1. Моносахариды
- •1.1. Строение и классификация
- •1.2. Химические свойства
- •2. Дисахариды
- •2.1. Строение
- •2.2. Химические свойства
- •3. Полисахариды
3. Енамины
Енамины (виниламины) устойчивы в том случае, если при атоме азота нет атомов водорода. Такие енамины можно рассматривать как азотистые аналоги виниловых эфиров. В противном случае енамины нестабильны и перегруппировываются в имины, подобно тому, как енолы изомеризуются в карбонильные соединения.
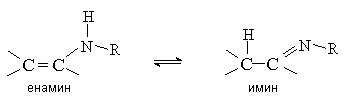
3.1. Методы получения
Основной метод получения енаминов – взаимодействие карбонильных соединений со вторичными аминами в присутствии кислотных катализаторов и средств, связывающих воду.

Реакция протекает по общему для присоединения азотистых оснований к карбонильной группе механизму.
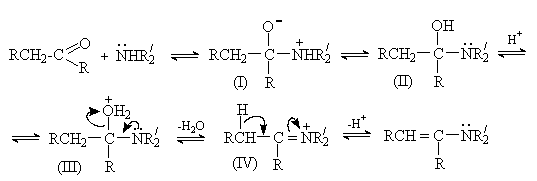
Отщепление воды от интермедиата (III) приводит к образованию иммониевого иона (IV), который при отсутствии водорода у атома азота стабилизируется путем отщепления протона от -углеродного атома.
3.2. Строение
Молекула енамина представляет собой р- -сопряженную систему, строение которой можно отразить набором двух резонансных структур.
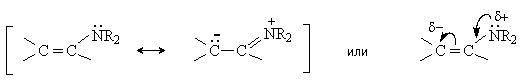
Таким образом, молекула енамина содержит два нуклеофильных центра – атом азота и атом углерода в -положении, который несет частичный отрицательный заряд.
3.3. Химические свойства
а) Протонирование и гидролиз
Енамины являются слабыми основаниями. Их протонирование может протекать как по атому азота, так и по атому углерода. Образующаяся при протонировании по -углеродному атому соль иммония гидролизуется, давая исходное карбонильное соединение и вторичный амин.
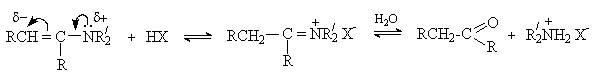
Гидролиз енаминов – процесс, обратный их образованию, и протекает по такому же механизму.
б) Алкилирование
Алкилирование енаминов алкилгалогенидами и другими алкилирующими реагентами протекает, как правило, по -углеродному атому. Последующий гидролиз иммониевой соли приводит к карбонильному соединению.
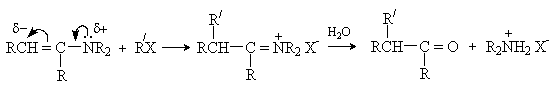
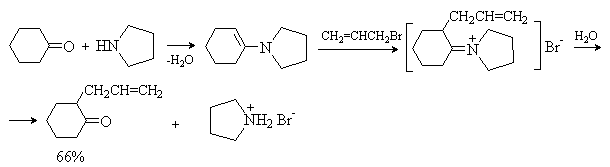
Последовательность превращений – получение енамина из карбонильного соединения, алкилирование, гидролиз приводит к алкилированию исходного карбонильного соединения по -положению и носит название реакция Сторка. Этот метод имеет преимущества перед алкилированием кетонов, так как требует более мягких условий и дает в основном продукты моноалкилирования.
Для проведения этой реакции чаще всего используют циклические амины – пирролидин, пиперидин, морфолин. Лучшие результаты достигаются при использовании активных галогенидов – аллил- и бензилгалогенидов, -галогензамещенных производных простых и сложных эфиров. Например:
в) Ацилирование
При действии галогенангидридов и ангидридов кислот енамины дают продукты С-ацилирования. Последующий гидролиз приводит к дикарбонильному соединению.

Таким образом, последовательность реакция – получение енамина из карбонильного соединения, ацилирование, гидролиз – метод получения -дикарбонильных соединений. Например:
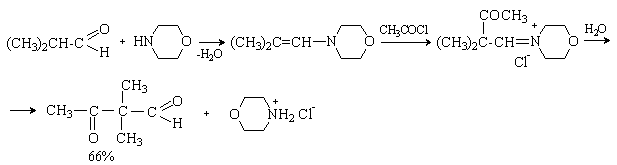
4. Ароматические амины
4.1. Методы получения
1) Восстановление ароматических нитросоединений
![]()
Для восстановления в препаративных целях используют металл (Fe, Zn, Sn) и кислоту, соли металлов в низших степенях окисления (SnCl2, TiCl3), сульфиды щелочных металлов, в промышленности применяют в основном каталитическое гидрирование. См. также лекцию №40.
2) Алкилирование

Реакция аналогична алкилированию алифатических аминов. В качестве алкилирующих реагентов используют алкилгалогениды, алкилсульфаты, спирты.
3) Арилирование
Галогенарены реагируют с аммиаком и аминами в жестких условиях. Процесс катализируется медью и ее соединениями.
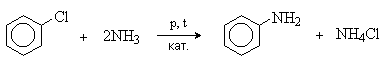
Реакция замещения галогена протекает легче при наличии в орто- и пара-положениях электроноакцепторных групп (NO2, CN).
Галогенарены взаимодействуют с ариламинами в присутствии меди с образованием диариламинов (реакция Ульмана).

