
- •1. Моделирование как метод исследования
- •2. Виды моделей. Классификация моделей
- •3. Физическое моделирование. Примеры физических моделей
- •4.Теория и соотношения подобия
- •5.Математическое моделирование и примеры математических моделей
- •6. Компьютерное моделирование и вычислительный эксперимент
- •4. Исследование модели:
- •10. Использование модели.
- •7. Горение как физико-химический процесс. Основные понятия и определения.
- •8. Типы химических реакций. Скорость реакции. Закон Аррениуса
- •9. Теплота реакции и энергетика горения.
- •10. Понятие ламинарного и турбулентного течений
- •11. Пожар и пожарная опасность
- •12. Цепная реакция и ее признаки
- •13.Неразветвленные цепные реакции. Активные центры
- •14.Разветвленные цепные реакции Основное уравнение цепной реакции.
- •15.Нижний и верхний пределы цепных реакций и причины их существования.
- •16. Период индукции
- •18. Условия теплового взрыва
- •19. Критическое условие Семенова
- •21. Ламинарные пламенна. Химическое превращение в пламени.
- •22. Подобие распределений температуры и концентраций в пламени
- •23. Нормальная скорость распространения пламени
- •24. Особенности горения в закрытых сосудах.
- •Пределы распространения горения. Причины существования пределов.
- •Устойчивость ламинарного пламени.
- •Положение фронта пламени и принцип Гюйгенса.
- •28. Условие стационарного горения и понятие удерживающей точки.
- •29. Пламя бунзеновской горелки. Поджигающее кольцо.
- •30. Распространение фронта пламени в горизонтальной трубе.
- •31 Понятие ведущей точки пламени. Представления о турбулентном горении.
- •32 Диффузионное горение газов
- •33Общие свойства диффузионных пламен
- •34. Предел диффузионного горения неперемешанных газов
21. Ламинарные пламенна. Химическое превращение в пламени.
Известны два различных режима распространения волны реакции в пространстве — со сверхзвуковой и дозвуковой скоростями. Первый — детонационный. Второй режим распространения волны химической реакции происходит со скоростями, значительно меньшими звуковых, и связан с молекулярными процессами теплопроводности и диффузии — это режим распространения пламени. При тепловом механизме распространения пламени тепло, выделившееся при химической реакции, теплопроводностью передается в соседние участки нереагировавшего газа, нагревает их и инициирует активную химическую реакцию. При цепном механизме распространение очага реакции происходит путем диффузии активных центров. Возможно, также и наиболее вероятно в реальных случаях горения совместное действие диффузии и теплопроводности.
Опытные данные и теоретическое рассмотрение свидетельствуют о том, что при распространении пламени реакция идет в каждый момент времени в сравнительно (по сравнению с размерами камер сгорания) тонком слое — зоне реакции. В непосредственной близости от зоны реакции, также в тонком слое, происходит разогрев несгоревшей смеси. Поэтому в первом приближении распространение пламени можно представить себе так: имеются две области — несгоревшего газа и продуктов реакции, разделенные поверхностью горения, толщиной которой можно пренебрегать и рассматривать ее как геометрическую поверхность, движущуюся относительно газа с известной скоростью — нормальной скоростью распространения пламени.
Уже из общих соображений можно предвидеть, что химическая реакция внутри фронта пламени будет протекать неравномерно — из-за резкой зависимости скорости реакции от температуры она будет, главным образом, сосредоточена в части фронта пламени, прилегающей к горячим продуктам сгорания. Там, где температура пониже,- реакция протекает со значительно меньшей скоростью и поэтому ее вообще, можно не учитывать, а рассматривать только молекулярный перенос тепла и вещества. Эти процессы в пламени доминируют в силу "большого перепада температуры и концентраций реагирующих веществ, они и определяют в основном структуру пламени.
22. Подобие распределений температуры и концентраций в пламени
Структура
ламинарного пламени описывается системой
уравнений теплопроводности и диффузии.
Рассмотрим самый простой случай когда
фронт пламени плоский, а хим реакция
описывается одним стехиометрическим
уравнением , так что скорости превращения
по каждому веществу связаны соотношением
Wi/νi=W’j/νj=W.
В сист. коорд, движуйся вместе с фронтом
пламени ур-я имеют вид:
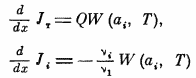 (изменение теплового потока JT
и потоков реагирующих веществ Ji
происходит вследствие тепловыделения
и изменения кол-ва реагирующих в-в в
хим. реакции). Здесь Q
– теплота реакции, через ai
обозначены относительные весовые
концентрации реагентов; скорость хим.
Реакции рассчитана на моль в-ва, которому
присвоен индекс 1. Будем считать, что
это вещество в исходной смеси находится
в недостатке. Потоки тепла и вещества
скаладываются из конвективного и
молекулярного переноса
(изменение теплового потока JT
и потоков реагирующих веществ Ji
происходит вследствие тепловыделения
и изменения кол-ва реагирующих в-в в
хим. реакции). Здесь Q
– теплота реакции, через ai
обозначены относительные весовые
концентрации реагентов; скорость хим.
Реакции рассчитана на моль в-ва, которому
присвоен индекс 1. Будем считать, что
это вещество в исходной смеси находится
в недостатке. Потоки тепла и вещества
скаладываются из конвективного и
молекулярного переноса
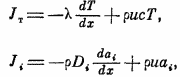 ,
где Di
– коэф-ты диффузии, с- теплоемкость при
постоянном давлении. С учетом уравнения
неразрывности потомка массы в пламени
pu=p0un=pbub=const,
система ур-й может быть переписано в
виде:
,
где Di
– коэф-ты диффузии, с- теплоемкость при
постоянном давлении. С учетом уравнения
неразрывности потомка массы в пламени
pu=p0un=pbub=const,
система ур-й может быть переписано в
виде:
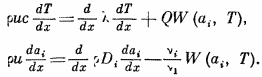 Перейдем к рассмотрению газов близкого
молекулярного веса. В этом случае коф-ты
диффузии можно считать равными между
собой. Кроме того, если потенциалы
межмолекулярных сил между различными
молекулами не сильно различаются, из
кинетической теории газов следует, что
коэ-ты диффузии приближенно равны
коэф-ту температуропроводности газовой
смеси во всем интервале температур Di≈х
В таких смесях несущественны также и
перекрестные эффекты молекулярного
тепломассопереноса (термодиффузия,
диффузионная теплопроводность и др.).
Утверждение о постоянстве суммы хим и
тепловой энергии внутри пламени было
высказано в 1934 г. Льисом и Эльбе в случае
цепной реакции, инициируемой диффузией
активных центров. Пусть скорость пламени
определяется очень легкими активными
центрами, концентрация которых очень
мала; тогда ни диффузия, ни теплопроводность
не успевают заметно изменить
концентрационные и температурное поля.
В этом случае реакция протекает, как в
сосуде с подвижным поршнем (давление
постоянно), и сохранение энтальпии
очевидно. Такую ситуацию предст. себе
эти ученые. Однако, постоянство полной
энтальпии в стационарном потоке зависит
не от механизма реакции, а от соотношения
между коэф диффузии и теплопроводности
смеси. Полные энтальпии исходной смеси
и продуктов равных между собой при любых
соотношениях между х и D
– это закон сохранения энергии. Но, если
выполнено еще условие x=D,
а скорости превращения реагирующих
веществ связаны стехиометрическими
соотношениями (простая реакция), то
полная энтальпия постоянна и внутри
пламени. При постоянной теплоемкости
постоянство полной энтальпии внутри
пламени может быть записано в виде:
Qa+cT=Qa0+cT0=cTb,
т.е. распределения температуры и
концентрации оказываются подобными
(a0-a)/a0=(T-T0)/(Tb-T0).
Точно так же подобны между собой
распределения температуры и распределения
концентраций остальных реагирующих
веществ, а также концентраций продуктов
сгорания, если, конечно, их коэффициенты
диффузии тоже равны х. Подобие имеет
место и в тех случаях, когда скорость
простой реакции зависит от концетраций
конечных продуктов реакции (обратимая
реакция или автокатализ конечными
продуктом). Если реакция является
сложной, то концентрации промежуточных
продуктов не связаны стехиометрическими
соотношениями, и подобия полей нет. Но
и в этом случае при равенстве всех коэф
переноса (Di=x)
полная энтальпия системы также остается
постоянной – Н=const,
однако отсюда нельзя получить однозначную
зависимость ai=f(T)
для каждого из веществ, участвующих в
реакции.
Перейдем к рассмотрению газов близкого
молекулярного веса. В этом случае коф-ты
диффузии можно считать равными между
собой. Кроме того, если потенциалы
межмолекулярных сил между различными
молекулами не сильно различаются, из
кинетической теории газов следует, что
коэ-ты диффузии приближенно равны
коэф-ту температуропроводности газовой
смеси во всем интервале температур Di≈х
В таких смесях несущественны также и
перекрестные эффекты молекулярного
тепломассопереноса (термодиффузия,
диффузионная теплопроводность и др.).
Утверждение о постоянстве суммы хим и
тепловой энергии внутри пламени было
высказано в 1934 г. Льисом и Эльбе в случае
цепной реакции, инициируемой диффузией
активных центров. Пусть скорость пламени
определяется очень легкими активными
центрами, концентрация которых очень
мала; тогда ни диффузия, ни теплопроводность
не успевают заметно изменить
концентрационные и температурное поля.
В этом случае реакция протекает, как в
сосуде с подвижным поршнем (давление
постоянно), и сохранение энтальпии
очевидно. Такую ситуацию предст. себе
эти ученые. Однако, постоянство полной
энтальпии в стационарном потоке зависит
не от механизма реакции, а от соотношения
между коэф диффузии и теплопроводности
смеси. Полные энтальпии исходной смеси
и продуктов равных между собой при любых
соотношениях между х и D
– это закон сохранения энергии. Но, если
выполнено еще условие x=D,
а скорости превращения реагирующих
веществ связаны стехиометрическими
соотношениями (простая реакция), то
полная энтальпия постоянна и внутри
пламени. При постоянной теплоемкости
постоянство полной энтальпии внутри
пламени может быть записано в виде:
Qa+cT=Qa0+cT0=cTb,
т.е. распределения температуры и
концентрации оказываются подобными
(a0-a)/a0=(T-T0)/(Tb-T0).
Точно так же подобны между собой
распределения температуры и распределения
концентраций остальных реагирующих
веществ, а также концентраций продуктов
сгорания, если, конечно, их коэффициенты
диффузии тоже равны х. Подобие имеет
место и в тех случаях, когда скорость
простой реакции зависит от концетраций
конечных продуктов реакции (обратимая
реакция или автокатализ конечными
продуктом). Если реакция является
сложной, то концентрации промежуточных
продуктов не связаны стехиометрическими
соотношениями, и подобия полей нет. Но
и в этом случае при равенстве всех коэф
переноса (Di=x)
полная энтальпия системы также остается
постоянной – Н=const,
однако отсюда нельзя получить однозначную
зависимость ai=f(T)
для каждого из веществ, участвующих в
реакции.
