
- •7.12 Визначення тривалості перебування метала вище заданої температури
- •7.13 Нагрів тіл при електроконтактному зварюванні
- •8 Металургійні процеси при зварюванні плавленням
- •8.1 Типи зварювальних ванн
- •8.2 Газова фаза
- •8.3 Вплив кисню на властивості сталі
- •8.4 Вплив азоту на властивості сталі
- •8.5 Вплив водню на властивості сталі
- •8.6 Вплив сo на властивості сталі
- •8.7 Шлаки та їх призначення
- •8.8 Властивості зварювальних шлаків
- •8.9 Властивості основних оксидів шлакової фази
- •8.10 Взаємодія між розплавленим металом, газовим
- •8.11 Окиснювальні процеси
- •8.12 Розкиснювальні процеси
- •8.13 Дифузійне розкиснення
- •8.14 Розкиснення металу кислотними та основними
- •8.15 Легування металу шва
- •8.16 Рафінування металу шва
- •8.17 Очищення металу зварювальної ванни від сірки
- •8.18 Очищення зварювальної ванни від фосфору
- •9 Термодеформаційні процеси при зварюванні
- •9.1 Поняття про зварювальні напруги і деформації
- •9.2 Класифікація зварювальних напруг та
- •9.3 Особливості виникнення деформацій при зварюванні
- •9.4 Теплофізичні властивості в термодеформаційних
- •9.5 Механічні характеристики в деформаційних
- •9.6 Дилатометричні криві
- •9.7 Термодеформаційний цикл
- •9.8 Теоретичні методи визначення зварювальних
- •9.9 Експериментальні методи визначення зварювальних
- •9.10 Методи визначення тимчасових напруг
- •9.11 Визначення тимчасових деформацій
- •9.12 Методи визначення залишкових напруг та
- •9.13 Типові поля залишкових напруг в зварних
- •10 Здатність металів до зварювання
- •10.1 Поняття про здатність металів до зварювання
- •10.2 Оцінка технологічної здатності металів до
- •10.3 Вибір способу зварювання в залежності від
- •10.4 Принципи вибору зварювальних матеріалів
- •10.5 Принципи вибору раціональних режимів зварювання
- •10.6 Особливості здатності металів та сплавів до
- •11 Кристалізація металу шва та технологічна міцність
- •11.1 Загальні положення теорії кристалізації
- •11.2 Особливості плавлення та кристалізації металу шва
- •11.3 Структура металу шва та біляшовної зони
- •11.4 Вторинна кристалізація
- •11.5 Хімічна неоднорідність металу
- •11.6 Ліквація металу шва
- •11.7 Фізична неоднорідність металу шва
- •11.8 Технологічна міцність
- •Література
8.11 Окиснювальні процеси
В реакційній зоні зварювання відбувається окиснення металу.
Оксиди можуть бути:
1. Розчинні у металі шва.
2. Не розчинні у металі шва.
У першому випадку оксиди утворюють розчини з підвищеним вмістом кисню, а це значно погіршує властивості металу шва.
Оксиди, що відносяться до другої групи, присутні у вигляді окремих фаз і легко відводяться у шлак. Сам процес окиснення металу у зварювальній ванні може іти по трьом схемам:
1. Пряме окиснення
![]() . (8.33)
. (8.33)
2. Окиснення нижчих оксидів до вищих (див. пункт 8.3).
3. Окиснення в результаті обмінних реакцій
![]() . (8.34)
. (8.34)
Кисень передається металу зварювальної ванни повітрям, вуглецевим
газом, карбонатами, вищими оксидами, які дисоціюють, виділяючи вільний кисень.
8.12 Розкиснювальні процеси
Це процес звільнення металу з його оксидів. Елементи, що звільняють метал з його оксидів мають назву розкиснювачі (алюміній, титан, марганець, вуглець, кремній, хром, тощо). Крім розкиснювання розкиснювачами, розкиснення може іти дифузійним шляхом.
8.12.1 Розкиснення з утворенням конденсованих продуктів
реакцій (на прикладі сталі)
Розкиснення протікає з утворенням нового оксиду розкиснювача, що переводиться у шлак, а відновлений метал переходить у зварювальну ванну.
В загальному випадку реакція розкиснення заліза має вигляд
![]() , (8.35)
, (8.35)
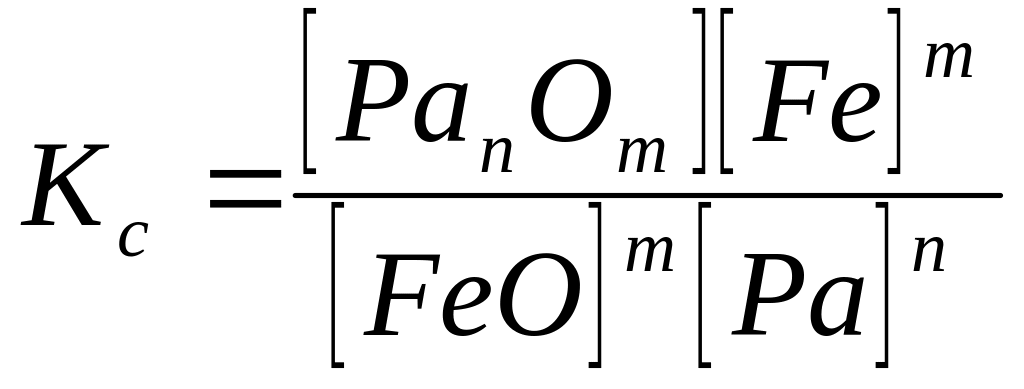 , (8.36)
, (8.36)
де К с — константа рівноваги.
Для
сталі
![]() ,
тоді
,
тоді
![]() . (8.37)
. (8.37)
Можна
рахувати, що концентрація
![]() =const
і включити
її в константу рівноваги. Тоді
=const
і включити
її в константу рівноваги. Тоді
![]() . (8.38)
. (8.38)
Чим більша концентрація розкиснювача, тим менша концентрація оксидів у металі.
Використовуючи формулу (8.38) та задаючись концентрацією закисі заліза у зварювальній ванні, визначають необхідну кількість розкиснювача.
Властивості розкиснювачей:
1. Кремній. Температура плавлення 1440 °C, густина 2,4 гсм–3. Окиснюється до SіO2, не розчиняється у воді, схильний до утворення комплексних сполук, які переводяться у шлак. Чим більша концентрація Sі, тим інтенсивніше процес розкиснення і чим нижча температура, тим більш розкиснююча спроможність кремнію.
2. Марганець. Температура плавлення 1244 °C, густина 7,5 гсм–3. При взаємодії з киснем утворює відносно сильний основний оксид, який не розчинний у металі. MnO утворює з FeO нерозривний ряд розчинів як у рідкому, так і у твердому стані. Чим більша концентрація марганцю і чим нижча температура, тим більша його розкиснююча спроможність.
3. Титан. Температура плавлення 1660 °C, густина 4,5 гсм–3. Є більш сильнішим розкиснювачем, ніж марганець та кремній. Утворює TіO2, який не розчиняється у воді, з оксидами металу утворює титанати, які переводяться у шлак. При взаємодії з азотом утворює нітриди. Хороший модифікатор.
4. Алюміній. Температура плавлення 658 °C, густина 2,7 гсм–3. Один з найсильніших розкиснювачів. Утворює амфотерний оксид Al2O3, процес розкиснення супроводжується звільненням великої кількості тепла, що додатково підігріває зварювальну ванну. Al2O3 погано виходить на поверхню, часто знаходиться у вигляді включень у зварному шві. Алюміній взаємодіє з азотом з утворенням нітридів.
8.12.2 Розкиснення з утворенням газоподібних продуктів
реакцій
Розкиснення вуглецем. Може іти у два етапи.
Перший етап
![]() . (8.39)
. (8.39)
Другий етап
![]() . (8.40)
. (8.40)
CO при великих температурах стійкий, тому вважають, що процес розкиснення обмежується реакцією (8.39), константа рівноваги якої буде визначатися згідно формули (8.41).
![]() . (8.41)
. (8.41)
Так, як , то
![]() , (8.42)
, (8.42)
де рСО — парціальний тиск CO.
Якщо зварювання проводиться при нормальних атмосферних умовах, то рСО = 1 атм і
![]() . (8.43)
. (8.43)
З формули (8.43) бачимо, що чим вища концентрація вуглецю, тим менша концентрація FeO, тим активніше іде процес розкиснення, але введення великої кількості вуглецю у зварювальну ванну може привести до кипіння сталі і зниженню технологічної міцності.
Розкиснення воднем.
![]() . (8.44)
. (8.44)
![]() . (8.45)
. (8.45)
Приймаємо
![]() ,
а також замінюємо
,
а також замінюємо
![]() на
на
![]() ,
,
а
![]() на
на
![]() .
.
Тоді
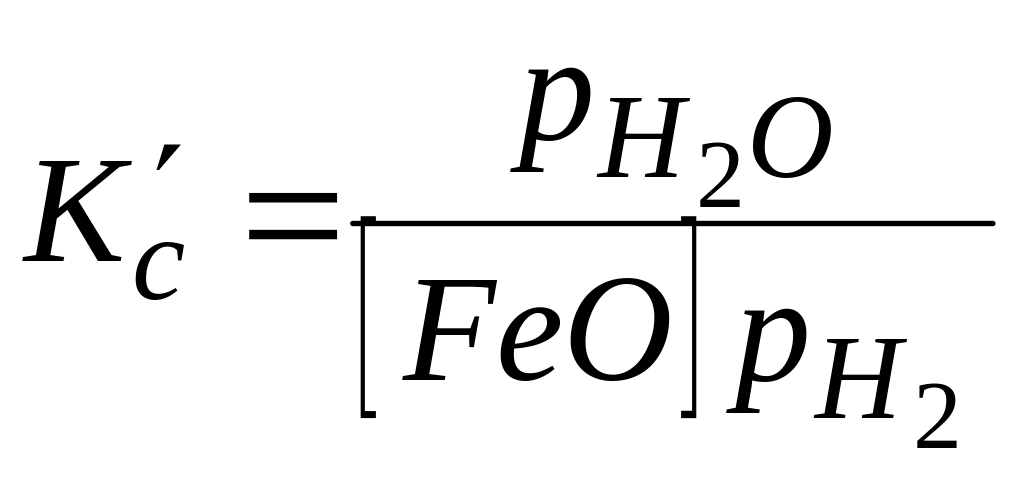 , (8.46)
, (8.46)
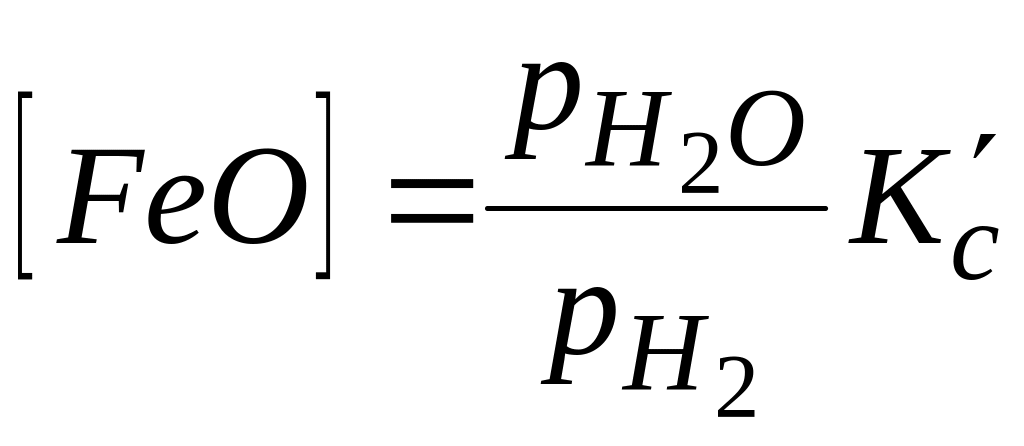 . (8.47)
. (8.47)
Водень є хорошим розкиснювачем, але його використання приводить до утворення пор і тріщин.
Розкиснювачі, що використовуються, можна розташувати в порядку зменшення розкиснюючих здібностей у ряд: Al, Tі, Sі, C, H, Mn, Cr.
