
РЕПАРАЦИЯ - свойственное всем клеткам живых организмов восстановление нативной структуры ДНК в случае ее нарушения.
Причины появления повреждений в ДНК:
Ошибки репликации
Повреждения ДНК эндогенными агентами Гидролиз (депуринизация, дезаминирование)
Повреждения ДНК экзогенными агентами облучение, повреждение химическими агентами (например, алкилирование)
Репликация «через повреждения» с использованием полимераз, отличающихся низкой точностью копирования
Гидролиз: спонтанная депуринизация – сахарофосфатный остов остается, дезаминирование – замена аминогруппы на кислород (цитозин переходит в урацил, CG->TA, так как урацила нет в ДНК; гуанин может переходить в ксантин, который может образовывать пару с цитозином с двумя водородными связями, и в итоге мутагенного эффекта нет; аденин может переходить в гипоксантин, который образует пару с цитозином, AT->GC). Другой процесс, который также может приводить к модификации оснований – алкилирование (включение этильной/метильной группы). Этому эффекту чаще всего подвергаются 6 позиция в гуанине и 4 позиция в тимине, включение алкильных групп тоже изменяет характер спаривания. Алкилированный гуанин не может образовывать классическую Уотсон-Криковскую пару с цитозином, зато он образует пару с тимином, GC->AT (т.е. опять нарушение первичной структуры ДНК и мутация). Алкилирование по тимину тоже изменяет характер спаривания, 4-этилтимин образует пару с гуанином, тоже получается мутация, TA->GC. Еще очень частое событие - образование тимидиновых димеров под воздействием УФ-света, происходит между соседями сверху-снизу и два основания теперь химически ковалентно соединены, это приводит к остановке репликации (такое событие имеет достаточно высокую частоту из-за частых воздействий УФ-света, и если димеры не удаляются, то это приводит к ксеродерме). Еще довольно часто возникают разрывы.
Cтратегии коррекции повреждений:
1) Ошибки репликации: многоэтапная стратегия, прежде всего - исправление ошибок ДНК полимеразой (3’-5’ экзонуклеазная активность), в подавляющем количестве случаев сама полимереза чувствует нарушение Уотсон-Криковской пары, останавливает репликацию, цепь ДНк переносится в экзонуклеазный центр, далее удаление нуклеотида и возобновление лрепликации. Но этого все равно недостаточно, на этот случай есть репарация неспаренных оснований (mismatch repair) – распознает нарушения в геометрии ДНК (как и полимераза), удаляет нуклеотид, возвращает все к Уотсон-Криковской паре.
Повреждение ДНК эндогенными и экзогенными агентами, разные стратегии реализации в зависимости от типа повреждения. Некоторые повреждения можно удалить просто прямым удалением повреждений (например, просто расшить тимидиновые димеры). Но совсем так непосредственно происходит довольно редко, поэтому чаще реализуются другие стратегии: удаляется кусок ДНК с поврежденным нуклеотидом и на нормальной матрице по комплементарности строится заново. Если удаляется всего один нуклеотид, то это называется - эксцизия оснований (base excision repair). При более серьезном повреждении - эксцизия нуклеотидов (nucleotide excision repair), вырезается более протяженный участок ДНК (у прокариот чуть больше 10, у эукариот около 20 с небольшим). Но бывает так, что ничего не успели починить, а репликация уже идет, ее остановка может привести к апоптозу, поэтому выход – осуществление репликации, невзирая на повреждения - рекомбинация и черезблоковый синтез особыми полимеразами (не удаляет ошибок но позволяет продолжить репликацию), возникают мутации, но это лучше, чем сразу погибнуть.
Далее более подробное рассмотрение всех этих стратегий.
Прямое удаление повреждений.
Есть такой фермент – фотолиаза (у прокариот), который удаляет тимидиновые димеры – может просто взять и удалить неправильную сшивку. Энергию для расшивки этот фермент берет из видимого света, что было открыто случайно: облучали E.Coli сначала УФ-светом, а затем помещали их на обычный свет, после чего многие выживали. Каким-то образом этот фермент фиксирует квант света и восстанавливает структуру.
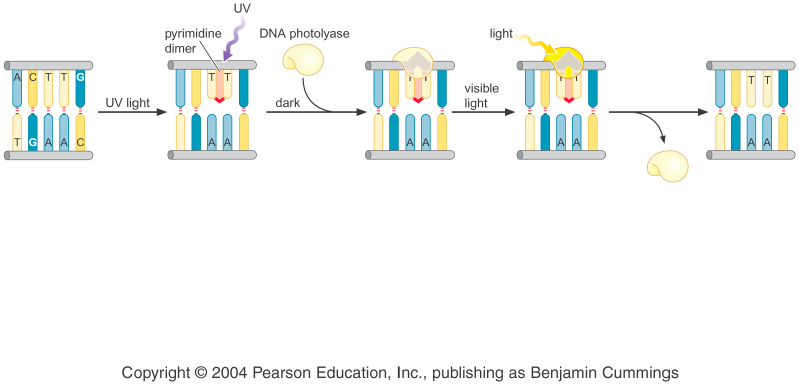
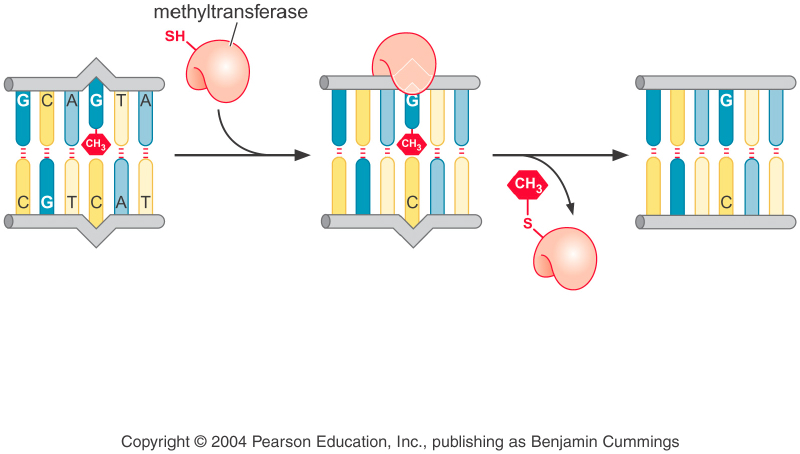
Все живые организмы (от E. Coli до человека) имеют О6-метилгуанин метил трансферазу (тоже прямое удаление повреждений), которая удаляет метильную (этильную) группу из позиции О6 гуанина. При этом фермент, который обладает SH-группой, необратимо связывается с удаленной с гуанина метильной (этильной) группой, после чего сам инактивируется. Это важная особенность этого фермента, так как обычно ферменты работают по циклам. Это довольно затратный процесс (фермент каждый раз нужно синтезировать заново), поэтому так удаляется мало повреждения. (Еще, вроде бы, этот фермент переносит также группы с метелированных фосфатов, и, таким образом, сам превращается в активатор транскрицпии)
Чаще используются механизмы удаления оснований и нуклеотидов, оба эти механизма есть и у прокариот, и у эукариот. В целом, механизмы похожи, но различаются в деталях.
Base excision repair (ber) эксцизия оснований.
Основной путь удаления модифицированных (в том числе окисленных) оснований и включенного по ошибке урацила (его довольно много в клетке, так как он компонент РНК). Различные ДНК-гликозилазы адресно узнают поврежденные основания и удаляют их, разрезая гликозидную связь (предварительно выворачивая). При этом возникает AP (апуриновый/апиримидиновый) сайт. Этот сайт узнается специальными клеточными АР эндонуклеазами, которые разрезают фосфодиэфирный остов ДНК рядом с AP сайтом. Разрыв должен быть внесен с обеих сторон и это может происходить по двум механизмам:
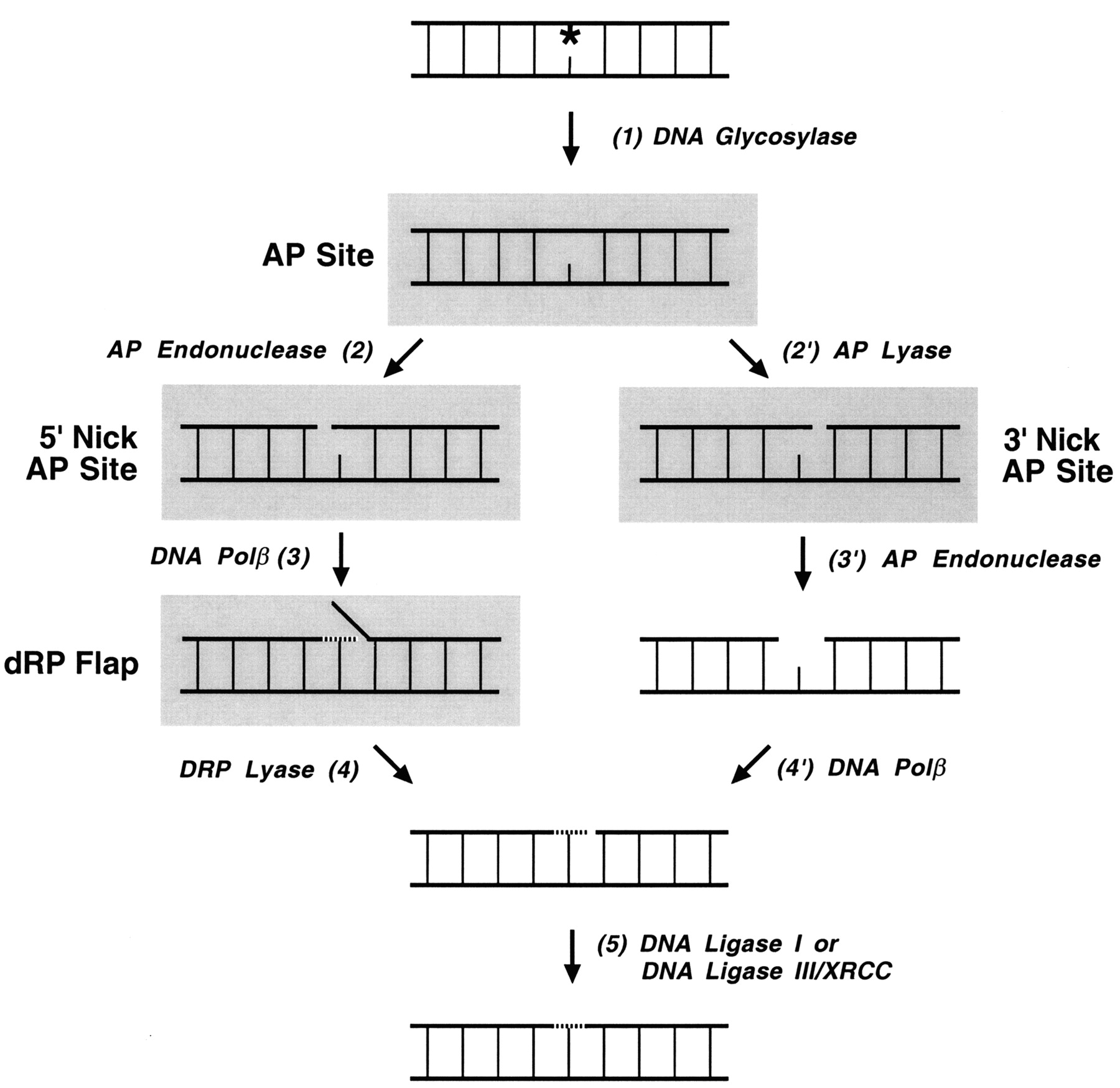
AP nucleotide удаляется экзонуклеазой/дезоксирибофосфодиэстеразой и «брешь» застраивается репаративной ДНК полимеразой.
В клетке большое количество ДНК-гликозилаз, которые узнают модифицированные основания, выворачивают их и отрезают:
Гликозилазы обладают определенной специфичностью в отношении определенного повреждения или очень узкого класса повреждений (если нет нужной гликозилазы, то повреждение никак не лечится). Поэтому всегда имеется целый набор этих ферментов, и этот набор разный у разных организмов. (Есть слайд, где перечислены гликозилазы человека, но, я думаю, это лишнее).
Основные типы повреждений, которые удаляются посредством BER:
1)Окисленные основания, в том числе 8-oкси-G, который спаривается с А, вызывая GC --> TA
2)Дезоксиурацил
3)Различные продукты алкилирования оснований (например, 3-meA)
4)Спонтанно возникающие апуриновые сайты
Все эти повреждения не блокируют репликацию (не такие уж они и опасные), но зато именно они и вызывают мутации.
Эксцизия нуклеотидов (nucleotide excision repair).
Этот механизм используется для коррекции более «серьезных» повреждений, которые блокируют репликацию (у человека таковыми являются, в частности, тимидиновые димеры). Особые белки узнают поврежденные участки ДНК и привлекают специальные нуклеазы, которые вносят разрывы на некотором расстоянии перед повреждением и на некотором расстоянии после него. Фрагмент ДНК, содержащий повреждение, удаляется, и образовавшаяся брешь застраивается репаративной ДНК полимеразой. У E.Coli в этом процессе участвуют 4 белка, названные по названиям генов: UvrA, UvrB, UvrC, UvrD. UvrA и UvrB сканируют ДНК и выявляют поврежденные места (главный признак – нарушение геометрии). После выявления поврежденного участка UvrA удаляется из комплекса, а UvrB вызывает локальную денатурацию поврежденного участка (участок становится еще более узнаваем для других ферментов) и привлекает UvrC. Комплекс UvrBС вносит однонитевые разрывы с 5’- и 3’- конца от повреждения. DNA хеликаза UvrD обеспечивает удаление из дуплекса фрагмента ДНК (рвет еще и водородные связи), содержащего повреждение. DNA Pol I застраивает брешь и лигаза «зашивает» однонитевой разрыв.
У эукариот изучение этого механизма репарации происходило из-за такого заболевания, как ксеродерма (УФ-лучи ведь есть и в обычном солнечном свете, что у людей с этим заболеванием приводит к тяжелым повреждениям кожи). Названия многих белков человека, участвующих в NER происходят от названия этого заболевания. 8 генов, идентифицированны в экспериментах по комплементации деффектов при слиянии клеток от разных больных: от XPA до XPG и еще hHR23B. У эукариот механизм эксцизии нуклеотидов в общих чертах схож с прокариотическим, но существенно отличается в деталях. Повреждения в ДНК могут узнаваться либо особой группой белков 1)global NER, либо РНК-полимеразой 2)transcription-coupled NER.
1) XPC в комплексе с hHR23B узнают повреждения и вызывают локальную денатурацию ДНК. XPA стабилизирует комплекс и привлекает другие белки. XPB+XPD - субъединицы TFIIH. TFIIH является общим транскрипционным фактором, обладающим хеликазной активностью (участвует в инициации транскрипции и эукариот). В данном случае TFIIH расширяет локально-денатурированный участок. Участок теперь еще более узнаваем. XPF – эндонуклеаза, вносящая 5’-разрыв. XPG – эндонуклеаза, вносящая 3’-разрыв. RPA расталкивает все остальное и помогает правильно позиционировать нуклеазы по краям расплавленного участка ДНК. (Функции XPE не понятны. In vitro этот белок не нужен. ) Таком образом, фрагмент ДНК выбрасывается, затем синтезируется новый и зашивается ДНК-лигазой (все как обычно). Такой механизм называется global genome NER, так как он реализуется во всем геноме. Есть еще второй механизм,
2) Возможно узнавание также полимеразой. Повреждения ДНК могут вызвать остановку элонгирующей РНК-полимеразы (РНК-полимераза2) (включает транскрипцию и видит повреждения). Ферменты NER узнают такой задержанный комплекс и процессируют его подобно комплексу XPA-XPC –hHR23B. Это называется – ассоциированная с транскрипцией эксцизия оснований.
