
- •Оптика. Учение о свете.
- •Волновые свойства.
- •Квантовые свойства света.
- •3. Импульс.
- •Волновая оптика. Интерференция- перераспред. Света в пространстве.
- •Способы получения когерентных волн.
- •Дифракция света.
- •Принцип Гюйгенса-Френеля.
- •Дифракция на щели.
- •Дифракционная решетка.
- •Вопрос 1: сколько углов дифракции может быть? (любое или конечное)
- •Вопрос 2: что представляет собой картина на экране в случае дифракционной решетки?
- •Поляризация света.
- •Фотоэффект.
- •Тепловое излучение.
- •Атомная физика.
- •Квантовая механика (волновая).
- •1. Гипотеза Луи де Бройля. 1924 г.
- •Принцип неопределенности.
- •Основное уравнение квантовой механики.
- •2. Значение волновой функции.
- •Применение квантовой механики для объяснения электрических свойств различных твердых тел.
- •Состав и характеристика атомного ядра.
Тепловое излучение.
Излучение происходит порциями.
Имеет место при любой температуре, отличной от температуры абсолютного нуля.
В спектре излучения нагретого тела наблюдаются практически все длины волн, но максимум излучения приходится в каждом отдельном случае на определенный диапазон длин волн.
Характеристики ТИ.
1. RT- энергетическая светимость. Энергия, излучаемая с единицы поверхности во времени во всем диапазоне длин волн.
![]() -
интегральная характеристика.
-
интегральная характеристика.
2.
![]() -
испускательная способность (спектральная
плоскость энергетической светимости).
Энергия,
излучаемая с единицы поверхности во
времени в узком (единичном)
диапазоне длин волн (в определенной
области спектра).
-
испускательная способность (спектральная
плоскость энергетической светимости).
Энергия,
излучаемая с единицы поверхности во
времени в узком (единичном)
диапазоне длин волн (в определенной
области спектра).
![]() -
дифференциальная характеристика.
-
дифференциальная характеристика.
3.
![]() -
поглощательная способность (коэффициент
поглощения).
Показывает, какая доля падающей на тело
энергии поглощается телом.
-
поглощательная способность (коэффициент
поглощения).
Показывает, какая доля падающей на тело
энергии поглощается телом.
Ф - световой поток.
Ф=RT*S
=Ф’(поглощенный поток энергии)/ Ф(падающий- весь поток энергии)
=1- абсолютно черное тело.
Закон Кирхгофа.
Утверждает, что отношение двух характеристик теплового излучения r и a не зависит от природы тела и является константой для разных тел, взятых при одной и той же температуре.
![]() -
испускательная способность
-
испускательная способность
Для
абсолютно черного тела
![]()
В 1900г. Макс Планк выдвигает гипотезу, что нагретое (холодное) тело испускает (поглощает) отдельными порциями – квантами.
Исходя
из этой гипотезы и применив законы
статистики Планк рассчитал
![]() .
Эта формула получила название «функция
Планка для теплового излучения».
.
Эта формула получила название «функция
Планка для теплового излучения».
График ее выглядит: Рис.1.1
Анализ.
1.
площадь S,
ограниченная кривой графика:
![]() .
Если
подставить в это выражение значение
функции Планка, то
.
Если
подставить в это выражение значение
функции Планка, то
 ,
где G=5,76*10-8
Вт/м2К4-
константа Стефана-Больцмана. Для серого
тела:
,
где G=5,76*10-8
Вт/м2К4-
константа Стефана-Больцмана. Для серого
тела:
RT=GT4 - для абс. черного тела. Этот теоретический вывод Планка совпал с ранее полученным экспериментальным законом Стефана-Больцмана.
2.
![]() ;
=max
;
=max
Максимум у относится к , показывая, что значение максимально, а не .
![]()
![]() -
этот теоретический вывод Планка совпал
с ранее полученным экспериментальным
законом – первым законом Вина, который
иначе называется «закон смещения».
-
этот теоретический вывод Планка совпал
с ранее полученным экспериментальным
законом – первым законом Вина, который
иначе называется «закон смещения».
b=2,90*10-3 м*К- первая константа Вина.
3. ; -max. Если подставить ее в формулу функции Планка, получим максимальное значение испускательной способности абсолютно черного тела ( =max), которое оказывается прямо пропорционально Т5.
max=С1Т5 - этот теоретический вывод Планка совпал с ранее полученным экспериментальным законом – вторым законом Вина. С1=1,29*10-5 Вт/м2К5– вторая константа Вина.
ОБЩИЙ ВЫВОД.
Совпадение выводов из теории Планка с экспериментальными законами подтверждает справедливость квантовой гипотезы теплового излучения.
Из анализа всех ранее рассмотренных нами явлений (фотоэффект…) окончательно делаем вывод, что свету (фотону) присуще свойства и волновые и квантовые одновременно.
Атомная физика.
Краткие теоретические сведения к началу ХХ столетия.
А. Атом – чрезвычайно устойчивая система.
Б. Атом – может при определенных условиях излучать (поглощать). На это указывали спектры излучения (поглощения). Причем, они являются линейчатыми. Следовательно, атом излучает (поглощает) не постоянно, а дискретно (квантами, отдельными порциями).
В. В 1911г. опытами Резерфорда был «опровергнут» первый вывод: было установлено, что атом есть система сложная, состоящая из положительно заряженного ядра и отрицательно заряженных электронов (атом[q=0]=ядро[+Ze]+электроны[-Ze]).
Z(порядковый номер элемента в таблице Менделеева).
mатома![]() mядра;
mядра;
![]()
По каким законам движутся электроны в атоме?
1. Попытка дана классической электромагнитной теорией. По законам классической теории движение заряженной частицы с ускорением должно сопровождаться:
- непрерывным излучением энергии. Следовательно, спектр излучения атома должен быть сплошным.
- так как атом непрерывно теряет энергию, то электрон неизбежно должен упасть на ядро, т.е. атом – неустойчивая система.
Оба эти вывода противоречат эксперименту.
2. Попытка объяснить законы движения электронов в атоме дана в 1913 году Нильсом Бором (1885-1962гг.).
Теория Бора.
ПОСТУЛАТЫ.
А. Атомы характеризуются известными состояниями, называемыми стационарными, в которых, несмотря на происходящие в них движения электронов, атомы не излучают и не поглощают энергию. В каждом таком состоянии электрон движется по орбите определенного радиуса и имеет строго определенную энергию.
СТРУКТУРНАЯ ЭЛЕКТРОННАЯ СХЕМА АТОМА.
meVnrn - момент импульса электрона на орбите.
![]() ,
n- главное
квантовое число, показывает номер
орбиты.
,
n- главное
квантовое число, показывает номер
орбиты.
h=6,62*10-34 Дж*сек- постоянная Планка.
![]()
n=1,2,3….; r1,r2,r3,…..; E1,E2,E3….. - дискретный ряд (квантовый).
Момент
импульса на орбите целократен
![]() .
Это есть правило
квантования орбит по Бору.
.
Это есть правило
квантования орбит по Бору.
Б. Атом может испускать (поглощать) монохроматическое излучение только при переходе электрона с одной орбиты на другую.
![]() -
правило частот Бора.
-
правило частот Бора.
![]() -
излучения
энергии.
-
излучения
энергии.
n1>n2 - излучение (с большей орбиты на меньшую); n1<n2 - поглощение.
Применение теории Бора к атому H2.Рис.1.4.
z=1;
Fk=Fц.стрем.

![]()
![]()
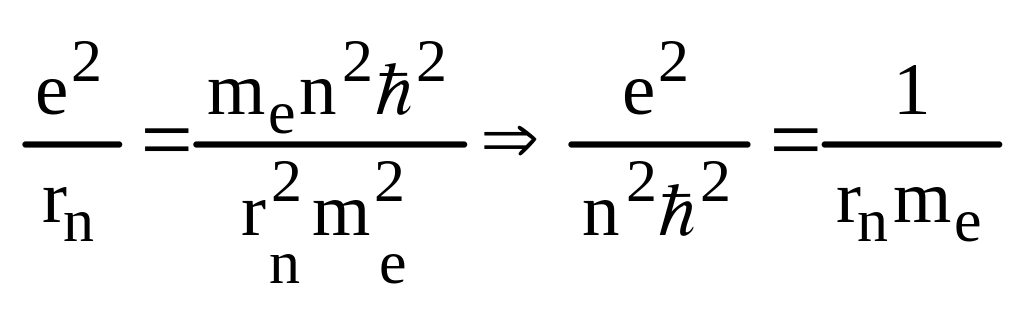
![]()
Если
n=1,
![]() (ангстрем) радиус
первой боровской орбиты.
(ангстрем) радиус
первой боровской орбиты.
rn=r1*n2
 Знак
минус
(-) указывает
на то, что электрон в атоме.
Знак
минус
(-) указывает
на то, что электрон в атоме.
n=1,
r1=0,529![]()
![]() эВ
эВ
1 эВ= qU = 1,6*10-19Кл * 1В = 1,6*10-19 Дж.
n=2,
r2=r1*n2=4*r1=2,116
![]() эВ
эВ
n=3,
r3=9*r1=4,761
![]() эВ
эВ
Энергетическая схема атома.
Энергия, которой обладает электрон в данном стационарном состоянии, схематически изображается в виде тонкой линии – уровня энергии. Рис.1.5
Для электрона в атоме водорода самым стабильным является первый (нормальный) уровень с наименьшим значением энергии.
Выше расположенные уровни - возбужденные.
Совокупность спектральных линий, которые возникают при переходе электрона на данный энергетический уровень с выше расположенных, называется спектральной серией. В спектре атома водорода известны семь спектральных серий. В видимой части спектра находится серия Бальмера, которая возникает при переходе электрона на второй энергетический уровень.
По
второму постулату Бора
![]()
Подставляя
En
по формуле Бора, получим:
![]() (обобщенная
формула Бальмера),
где
(обобщенная
формула Бальмера),
где
R - постоянная Ридберга; n1- номер уровня, на который переходит электрон; n2- значение уровня, с которого переходит электрон.
Для серии Бальмера n1=2.
Расчет по этой формуле, полученной из теории Бора, совпал со значением спектра водорода, полученным экспериментально.
Применение теории Бора к многоэлектронным атомам потребовало введение дополнительных принципов.
Все это говорит о том, что теория Бора является переходным моментом от старой классической теории к новой квантовой теории.
