- •22.04.08. Лекция №11 Тема №35 «Сложные атомы и молекулы»
- •34.7 Кратность вырождения уровней энергии (окончание)
- •Тема №35
- •35.1. Спин электрона. Опыты Штерна и Герлаха. Спиновое квантовое число
- •35.2. Принцип Паули.
- •35.3. Стpоение многоэлектpонных атомов. Пеpиодический закон Менделеева
- •24. Рентгеновские спектры. Рентгеновские спектpы
22.04.08. Лекция №11 Тема №35 «Сложные атомы и молекулы»
34.7 Кратность вырождения уровней энергии (окончание)
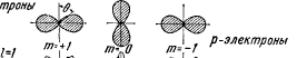
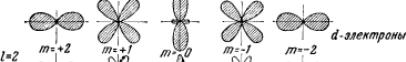
Электрон при своем движении как бы "размазан" по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m характеризует ориентацию электронного облака в пространстве. Каждой такой комбинации квантовых чисел l и m соответствует определенное распределение вероятности f = |Ψ|2 обнаружения электрона в различных точках пространства («электронное облако»). В атомной физике, по аналогии со спектроскопией, состояние электрона, характеризующееся квантовым числом l = 0, называется s −состоянием ((1s, 2s, ..., ns, ...), электрон в этом состоянии называется s -электроном), l =1 — p -состоянием, l = 2 — d -остоянием, l = 3 — f -состоянием и т.д.
На рис.34.12 показаны графические изображения (полярные диаграммы) плотностей вероятности для s -, p -, d - и f -электронов и соответствующее каждому случаю пространственное квантование.
n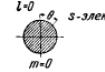 =1
=1
}n=2
 }
n=3
}
n=3
Н
![]() а
рис.34.12 видно, что распределение
электронной плотности
для состояний с заданным главным
квантовым числом n,
но с различными значениями орбитального
l
и магнитного m
квантовых чисел существенно
различаются,
хотя
согласно формуле (34.7): (34.7/),
а
рис.34.12 видно, что распределение
электронной плотности
для состояний с заданным главным
квантовым числом n,
но с различными значениями орбитального
l
и магнитного m
квантовых чисел существенно
различаются,
хотя
согласно формуле (34.7): (34.7/),
им соответствуют одинаковые значения энергии.
Ситуация, когда одному и тому же энергетическому уровню En несколько различных квантовых состояний системы (волновые функции Ψnlm различаются значениями l и m) называется вырождением уровней энергий. Уровень энергии называется невырожденным, если ему отвечает лишь одно состояние Ψnlm , и Уровень энергии - g –кратно вырожденный, если система в различных квантовых состояниях с Ψnlm имеет одинаковую энергию En.
В атоме водорода, если задано главное квантовое число, то не может быть пpоизвольным оpбитальное число: l может пpинимать значения: 0, 1, 2, ... n - 1, т.е. всего n значений. Если l фиксиpовано, то число m дает 2 l + 1 ваpиаций (т.к. m изменяется в интервале от – l до + l . Стало быть, если n фиксиpовано, то число ваpиаций паp чисел (m, l ) опpеделяется так:
![]()
= gn (34.8),
т.е. кратность вырождения определяется суммой арифметической прогрессии.
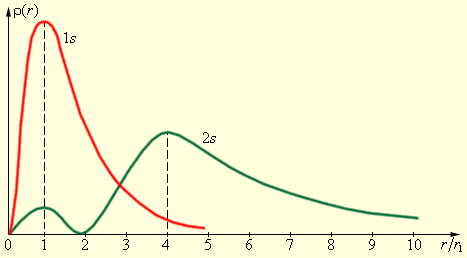
На рис. 34.12 изображены кривые распределения вероятности ρ(r) = 4πr2|Ψ|2 обнаружения электрона в атоме водорода на различных расстояниях от ядра в состояниях 1s и 2s. Как видно из рис. 34.12 , электрон в состоянии 1s (основное состояние атома водорода) может быть обнаружен на различных расстояниях от ядра. С наибольшей вероятностью его можно обнаружить на расстоянии, равном радиусу r1 первой боровской орбиты. Вероятность обнаружения электрона в состоянии 2s максимальна на расстоянии r = 4r1 от ядра. В обоих случаях атом водорода можно представить в виде сферически симметричного электронного облака, в центре которого находится ядро.
|
Рисунок 34.12. Распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s. r1 = 5,29·10–11 м – радиус первой боровской орбиты. |