
Природа сил, обуславливающих комплексообразование.
Для объяснения образования и свойств комплексных соединений в настоящее время широко применяются:
1) метод валентных связей,
2) теория кристаллического поля,
3) метод молекулярных орбиталей.
Метод Валентных Связей
Согласно теории валентных связей при образовании комплексов возникают донорно–акцепторные связи за счет неподеленных электронных пар лигандов и свободных гибридных орбиталей комплексообразователя. Например, образование комплексных ионов [NH4]+ и [Cu(NHз)4]2+ представляется следующим образом:

Молекулы аммиака являются донорами, так как имеют неподеленную пару электронов, а ионы Сu2+, имеющие свободные орбитали, – акцепторами. Таким образом, при образовании комплексных соединений акцептором является комплексообразователь, а донорами – лиганды.
Структура комплекса определяется в основном электронным строением центрального иона, но она также зависит и от природы лигандов.
Рассмотрим это на примере Ni2+. Этот ион имеет восемь валентных электронов на 3d–подуровне. В соответствии с правилом Гунда они заполняют все свободные орбитали на 3d –подуровне.
При образовании комплексного иона [NiCl4]2‑ с ионами Сl‑, сравнительно слабо взаимодействующими с Ni2+ (ион хлора имеет большой радиус), в образовании связей принимают участие гибридные 4sp3–орбитали Ni2+; в образовании комплексного иона [Ni(NH3)6]2+ гибридные 4sр3d2– орбитали, а иона [Ni(CN)4]2‑ – гибридные 4sp23d –орбитали:
Ni2+ |
|
||
|
3d |
4s |
4p |
[NiCl4]2 4sp3–гибридизация |
|
||
Тетраэдрическое строение ‑ |
3d |
4s |
4p |
[Ni(NH3)6]2+ 4sp3d2–гибридизация |
|
|||
Октаэдрическое строение |
3d |
4s |
4p |
4d |
[Ni(CN)4]2‑ 4sp23d–гибридизация |
|
||
Плоское квадратное строение |
3d |
4s |
4p |
В последнем случае Ni2+ очень сильно взаимодействует с CN‑–при этом происходит спаривание двух 3d–электронов и освободившаяся ячейка заполняется электронной парой CN‑. Как показывает пример, число неспаренных электронов в комплексах, образуемых одним и тем же комплексообразователем, может быть различным. Так, в [Ni(NH3)6]2+ и [NiCl4]2‑ оно равно 2, а в [Ni(CN)4]2‑ неспаренных электронов нет; первые два комплекса парамагнитны, третий – диамагнитен.
Из рассмотренных примеров видно, что гибридизация с участием d–орбиталей может быть двух видов: с использованием внешних d–орбиталей (4d для [Ni(NH3)6]2+) и с использованием внутренних d–орбиталей (3d для [Ni(CN)4]2‑). Комплексные соединения с "внутренней" гибридизацией являются более прочными, чем с "внешней" гибридизацией.
Большим достоинством метода валентных связей является и то, что с его помощью можно предсказать реакционную способность комплексных соединений. Условиями, влияющими на эту способность, являются:
1) "внешняя" гибридизация;
2) наличие у комплексообразователя свободных "внутренних" d–орбиталей.
Например, связь в комплексных ионах [Cr(NH3)6]3+ и [V(NH3)6]3+ осуществляется за счет Зd24sp3 – гибридизации:
Для [Cr(NH3)6]3+ |
|
||
|
3d |
4s |
4p |
Для [V(NH3)6]3+ |
|
||
|
3d |
4s |
4p |
Второй
комплекс более реакционноспособен, так
как имеет свободную внутреннюю Зd–орбиталь
![]()
Комплексные ионы, содержащие комплексообразователь с непарными электронами в (n–1)d – подуровне, обычно окрашены. Например, [Сu(NH3)4]2+ (3d9 4s0) имеет синюю окраску.Некоторые характеристики комплексных соединений представлены в табл.1.
Таблица 1.
Некоторые характеристики комплексных соединений
Характеристика комплексообразователя |
Примеры катионных, анионных и нейтральных комплексов |
Тип гибридизации |
Пространственная конфигурация |
|
Степень окисления |
Координационное число |
|
|
|
+1 |
2 |
[Cu(NH3)2]+; [CuI2]‑; [AgBr2]‑; [Au(CN)2]‑ |
sp |
Линейная |
+2 |
4 |
[Zn(NH3)4]2+; [Zn(CN)4]2‑; [Cd(NH3)4]2+;[HgI4]2‑ |
sp3 |
Тетраэдр |
|
4 |
[PdCl4]2‑; [Pt(NH3)4]2+; [Pt(NH3)2Cl2]0; [Ni(CN)4]2‑ |
dsp2 |
Квадрат |
|
6 |
[Ni(NH3)6]2+; [Mn(CN)6]4‑; [Fe(CN)6]4‑ |
d2sp3 |
Октаэдр |
+3 |
4 |
[BF4]‑; [TlBr4]‑; |
sp3 |
Тетраэдр |
|
4 |
[AuCl4]‑; [AuBr4]‑ |
dsp2 |
Квадрат |
|
6 |
[Fe(CN)6]3‑ ; [Co(NH3)3F3]0; Cd(NO2)6]3‑ |
d2sp3 |
Октаэдр |
+4 |
6 |
[MnF6]2‑; [Pt(NH3)2Cl4]0; [PtCl6]2‑ |
d2sp3 |
Октаэдр |
Теория кристаллического поля
Основные положения:
1. Между комплексообразователем и лигандами существует электростатическое притяжение.
2. При сближении лигандов с комплексообразователем происходит изменение энергетического состояния d- орбиталей, которое зависит от их ориентации в пространстве

Схема энергетических уровней d-орбиталей центрального иона: а- свободный ион, б- ион в гипотетическом сферическом поле, в- ион в октаэдрическом поле лигандов.

Ориентация орбиталей dZ2 (а), dX2-У2(б), dXZ (в) в октаэдрическом поле лигандов (условно изображены в виде шариков)
Величина энергии расщепления ∆ зависит от природы комплексообразователя и лигандов, конфигурации комплекса.
Чем больше ∆, тем прочнее комплекс.
∆ тем больше, чем больше заряд комплексообразователя и чем сильнее поле, создаваемое лигандами. По мере возрастания ∆ лиганды расположены в спектрохимический ряд:
ЭДТА, En, CO, CN-, NH3, CNS-, H2O, OH-, F-, CI-, Br-, I-
Сильное поле среднее слабое поле
Заполнение орбиталей происходит по принципам Паули и наименьшей энергии. Правило Хунда не всегда выполняется. Если ∆ >р, где р- это энергия, затрачиваемая на спаривание электронов, то правило Хунда не выполняется.
Пример
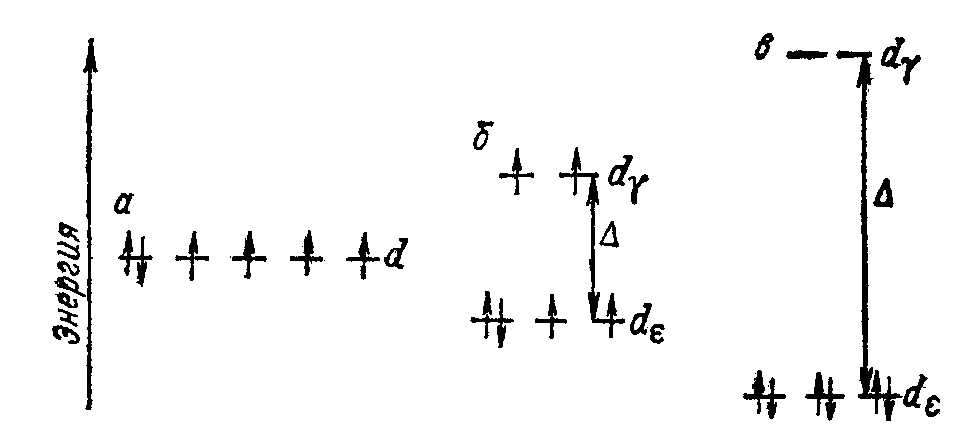
Распределение электронов в ионе Co 3+ по d-орбиталям :
а) в гипотетическом сферическом поле лигандов,
б) в слабом октаэдрическом поле лигандов (F-),
в) в сильном октаэдрическом поле лигандов (CN-)
Энергия расщепления ∆ может быть рассчитана как теоретически, так и по спектрам поглощения соединений.
Е= hν = hc/λ
С другой стороны, зная ∆, можно рассчитать длину волны, частоту излучения и определить окраску соединения.
Спектр поглощения (а следовательно, и окраска) обусловлен электронными переходами с низшей d- орбитали на d- орбиталь с более высокой энергией при наличии на последней вакантных мест. Если же вакантных мест нет, то соединение бесцветно. Таким образом объясняется тот факт, что большинство ионов d- элементов окрашены, не имеют окраски ионы, имеющие полностью заполненный d- подуровень. Наряду с этим теория кристаллического поля позволяет объяснить магнитные свойства соединений по наличию неспаренных электронов (парамагнитные свойства), либо их отсутствию (диамагнитные свойства).
Ограниченность теории кристаллического поля:
Не объясняет свойства комплексных соединений s- и p- элементов и d-элементов в высших степенях окисления.
Метод молекулярных орбиталей
Рассматривает комплекс как единую квантово-механическую систему, в которой отдельные атомы и молекулы теряют свои индивидуальные черты. Валентные электроны располагаются на многоцентровых МО, охватывающих ядра комплексообразователя и всех лигандов.
