
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •По взаимодействию между частицами дисперсной фазы и дисперсионной средой:
- •По агрегатному состоянию фаз (табл. 1.1)
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •Влияние добавок
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •Адсорбция на однородной поверхности
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Изотермы адсорбции на поверхности ж/г.
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •Теории полимолекулярной адсорбции а) теория Поляни(*)
- •Основные положения теории Поляни:
- •Адсорбция обусловлена чисто физическими силами взаимодействия.
- •Основные положения теории бэт
- •Адсорбция газов и паров на пористых адсорбентах
- •Характеристика твердых адсорбентов
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •Повтор рис.2.28 – см.2.4.4.
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •Концентрация
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •Адсорбция ионов зависит от радиуса (r) иона
- •2.4.6.1.3. Ионно-обменная адсорбция
- •Лекция 6
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •Броуновское движение
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •Седиментационный анализ дисперсных систем
- •Реологические свойства дисперсных систем
- •Основные понятия
- •Реологические модели
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Реологические свойства твердообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6. Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6 .2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Истинно растворимые и коллоидные
- •По растворимости в среде – жирорастворимые и водорастворимые
- •По способности к диссоциации в водных растворах к оллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •Длина углеводородного радикала r.
- •Характер полярной группы.
- •Влияние добавок электролитов и полярных органических веществ.
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
Электрические свойства коллоидных растворов (золей)
5.1. Электрокинетические явления
Основаны на взаимосвязи между электрическими и кинетическими свойствами дисперсной системы. Делят на прямые и обратимые явления.
Прямые возникают под действием внешнего электрического поля (электрофорез, электроосмос).
Обратные связаны при механическом перемещении одной фазы относительно другой, при которых возникает электрический потенциал: протекания или седиментации (оседания).
Некоторые особенности переноса в дисперсионной среде впервые были обнаружены профессором Московского университета Ф.Рейссом(*) в 1808 г. при исследовании закономерностей электролиза.

Изображение установок для опытов из статьи Рейсса 1809 г.
Первые электрокинетические явления — электрофорез и электроосмос были открыты профессором Московского университета Ф.Ф.Рейссом (1778 — 1852) в 1807 г.; его статья « Notice sur un nouvel effet de l'électricité galvanique », из которой взяты приведенные схемы, опубликована в 1809 г.
Электроосмос – явление переноса дисперсионной среды через неподвижную капиллярно-пористую перегородку под действием внешнего электрического поля.
Для предотвращения взаимодействия продуктов электролиза, Рейсс разделил У-образную трубку диафрагмой из песка. После помещения в трубки электродов, наблюдалось изменение уровня жидкости в разных трубках: перенос жидкости из анодного пространства в катодное.
Электроосмотическое поднятие может быть значительным (при разности потенциалов 100 В подъем Н=20 см).
Электрофорез – явление перемещения частиц дисперсной фазы под действием внешнего электрического поля.
Был открыт им же в аналогичном эксперименте, роль диафрагмы играла глина. Погрузив во влажный комок глины две заполненные водой трубки, он обнаружил, что после приложения разности потенциалов наряду с подъемом жидкости у катода, в анодном пространстве появляется взвесь частиц.








 + -
+ -
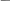

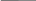



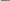

Рис.5.1. Экспериментальное обнаружение
электорофореза и электроосмоса в опытах Рейсса
Обратные электрокинетические явления:
Потенциал течения (протекания) – возникновение разности потенциалов на электродах, расположенных по обеим сторонам диафрагмы при протекании через нее жидкости.
Это явление, обратное осмосу, было обнаружено Квинке(*) (1859).
Диафрагмой в этом опыте может быть глина, песок, графит, дерево и т.д.

















В 1878 г. Дорн(*) открыл потенциал седиментации – при оседании частиц суспензии кварца под действием силы тяжести возникает разность потенциалов на электродах, расположенных на разной высоте.





Квинке первым высказал предположение о пространственном разделении зарядов вблизи поверхности.
Все электрокинетические явления основаны на наличии ДЭС на границе твердой и жидкой фаз. Возникновение ДЭС происходит вследствие установления адсорбционного равновесия в системе, приводящего к возникновению на поверхности частиц слоя потенциалопределяющих ионов.
