
- •Часть I хирургия печени
- •Глава 1. Анатомия и физиология
- •Глава 2. Опухоли печени
- •Глава 3. Травматические повреждения печени
- •Глава 4. Абсцессы печени
- •Глава 5. Эхинококкоз и альвеококкоз печени
- •Глава 6. Непаразитарные кисты печени
- •Глава 7. Хронический гепатит, цирроз печени и синдром портальной гипертензии
- •Глава 8. Пересадка печени
- •Часть II
- •Глава 1. Анатомия и физиология
- •Глава 2. Аномалии развития желчевыводящих путей
- •Глава 3. Желчнокаменная болезнь и заболевания желчного пузыря
- •Глава 4. Непроходимость желчных протоков доброкачественной этиологии
- •Глава 5. Рак желчного пузыря и внепеченочных желчных протоков
Глава 7. Хронический гепатит, цирроз печени и синдром портальной гипертензии
Этиология и патогенез. Причинами хронического гепатита могут быть: 1) острый инфекционный гепатит; 2) заболевания печени и желчевыводящих путей — малярия, желчнокаменная болезнь; 3) хроническая интоксикация химическими веществами; 4) нарушение иммунологической реактивности организма.
Хронический гепатит чаще вызывает вирус В, в 20—30 % наблюдений— вирус «ни А, ни В» (S. Erlinger, С. Dedott, 1979).
Цирроз печени может быть следствием как перенесенного острого гетатита с некрозом части паренхимы, так и хронической интоксикации гепатотропными веществами — этиловым спиртом, соединениями хлора и др. Реже он бывает обусловлен другими причинами. Панамским конгрессом гастроэнтерологов принята следующая классификация этиологических факторов цирроза печени.
Общепринятые этиологические факторы: 1) вирусный гепатит, 2) алкоголизм, 3) белковая и витаминная недостаточность (экзогенная и эндогенная), 4) обтурация внепеченочных желчных путей, 5) нарушение кровообращения (заболевания сердца, тромбоз и флебит сосудов портальной системы), 6) конгенитальный сифилис, 7) нарушение обмена железа (гемохроматоз), 8) нарушение обмена меди.
Факторы, нуждающиеся в уточнении: 1) гранулематозы (бруцеллез, туберкулез), 2) токсические агенты (четыреххлористый углерод, тринитротолуол и др.), 3) гельминтозы.
Синдром портальной гипертензии развивается при многих заболеваниях, характерной особенностью которых является нарушение оттока крови из вен воротной системы. Мы различаем пять форм портальной гипертензии: 1) портальная гипертензия в результате увеличения порто-портальной циркуляции, 2) допеченочный блок портальной системы, 3) внутрипеченочный блок портальной системы, 4) надпеченочный блок портальной системы, 5) комбинированный внутри-, внепеченочный блок портальной системы.
Увеличение порто-портальной циркуляции с синдромом портальной гипертензии у больных без признаков цирроза печени и блока магистральных сосудов может быть обусловлено функционированием артериовенозных свищей на уровне кишечника, селезенки, возможно, желудка и поджелудочной железы (М. Д. Пациора, Ю. А. Ершов, 1980).
Стойкие нарушения портального кровообращения возникают вследствие образования артериовенозного свища между печеночной артерией и воротной веной. Мы наблюдали такое заболевание у 1 больной.
Известны случаи развития синдрома портальной гипертензии вследствие заболеваний селезенки — саркоидоза Бека, миелоидной метаплазии и др. Изменения кровотока в селезенке приводят к повышенному сбросу артериальной крови в селезеночную вену, что и сопровождается повышением давления в последней.
Допеченочный блок портальной системы, в свою очередь, может быть вызван рядом патологических процессов.
Врожденные аномалии воротной вены обусловлены нарушениями процессов закрытия венозного (арранциева) протока (сообщения между воротной и нижней полой венами, существующего у плода), а также сохранением клапанов в селезеночной и воротной венах после рождения. Клапаны функционируют лишь в период внутриутробной жизни плода, а затем атрофируются. Задержка этого процесса может сопровождаться стазом крови в венах.
В. И. Шелковский и А. Ф. Леонтьев (1981) показали, что внепеченочный блок воротной вены чаще носит врожденный характер.
Аномалии воротной вены в виде удвоения ее и гипоплазии связаны с уменьшением пропускной способности сосуда. Кроме замедления кровотока увеличивается вероятность образования тромбов, что еще более уменьшает проходимость вены.
Тромбоз воротной вены и ее ветвей обычно возникает вследствие острых воспалительных процессов в брюшной полости (острый аппендицит, перфорация язвы желудка или двенадцатиперстной кишки, острый панкреатит, перитонит любой этиологии, гнойный холангит, абсцессы печени и селезенки).
Травма органов брюшной полости способствует образованию тромбов в венах портальной системы (Ф. Г. Углов, Т. О. Корякина, 1964).
Кавернозная трансформация воротной вены представляет собой замещение ствола сосуда множественными (до 100) мелкими извитыми венами. Одни авторы считают, что кавернозная трансформация является следствием нарушения процесса облитерации венозного протока.
По мнению других, в данном случае имеет место организация и реканализация тромба в воротной вене (В. И. Генералов, 1964). Наконец, высказано предположение о неопластическом генезе болезни, опухолевом перерождении стенки вены.
Сдавление вен портальной системы может быть следствием хронического панкреатита, кист, опухолей органов брюшной полости и забрюшинного пространства, склероза забрюшинной клетчатки.
Внутрипеченочный блок портальной системы обусловлен непосредственным поражением паренхимы печени. Наиболее частая причина болезни — цирроз печени, но определенную роль играют и другие заболевания — фиброз печени, злокачественные новообразования печени и др.
Патогенез внутрипеченочного блока сложен и окончательно не изучен. Выделяют три типа нарушений внутрипеченочного кровотока: 1) пресинусоидальный блок, 2) парасинусоидальный блок; 3) постсинусоидальный блок.
Пресинусоидальный блок может развиваться в результате сдавления вен (шистосомоз, болезнь Вильсона, обтурационная желтуха) и при дополнительном притоке артериальной крови в воротную вену (артериовенозные свищи, пресинусоидальные сообщения между артериолами и венулами у больных циррозом печени).
Парасинусоидальный блок обусловлен разбуханием гепатоцитов при остром гепатите, жировой дистрофии печени, обтурационной желтухе и при циррозе печени.
Постсинусоидальный блок возникает при нарушении проходимости печеночных вен. Последнее может быть вызвано сдавлением их опухолью, мембранной обструкцией нижней полой вены.
Нарушения функции печени, возникающие при циррозе ее, приводят к неполной инактивации многих гормонов. Это, в свою очередь, усугубляет имеющиеся изменения кровообращения.
Надпеченочный блок портальной системы (синдром Budd— Chiari) является результатом затруднения оттока крови из печени. Причинами его служат сдавление печеночных вен опухолью или кистой, мембранная обструкция надпеченочного сегмента нижней полой вены.
В литературе имеются сообщения о более чем 500 наблюдениях синдрома Budd—Chiari (M. J. Orloff, К. Н. Johamsen, 1978).
Выделяют 4 формы синдрома Budd—Chiari (Б. В. Петровский и соавт., 1984). Первая форма — облитерирующий эндофлебит печеночных вен (болезнь Chiari) — отличается быстрым, в течение нескольких недель, прогрессированием, лечение малоэффективно. Абсолютное большинство больных — молодые женщины, что наводит на мысль об участии гормональных нарушений в патогенезе этой формы болезни. Вторая форма — сегментарная окклюзия нижней полой вены с поражением печеночных вен. Поскольку окклюзия полой вены находится обычно на уровне впадения в нее печеночных вен, авторы считают первичным патологический процесс именно в печеночных венах. Третья форма — сегментарная окклюзия нижней полой вены выше печеночных вен в виде мембранозного заращения или рубцового сужения сосуда. Четвертая форма—тотальный тромбоз нижней полой вены на почве прогрессирующего тромбоза подвздошных вен или злокачественных опухолей почки, печени.
Комбинированный блок портальной системы характеризуется сочетанием до- и внутрипеченочного блока и развивается обычно у больных циррозом печени при осложнении его тромбозом воротной вены и ее ветвей.
Выделение данного вида нарушения портального кровообращения считают нецелесообразным из-за того, что основное прогностическое значение имеет состояние печени (Ф. Г. Углов, Т. О. Корякина, 1964).
Однако мы считаем, что комбинированный блок представляет собой качественно новое состояние, требующее особого подхода к лечению, вследствие чего необходимо выделение его в отдельный вид.
Нарушение кровотока в системе воротной вены, независимо от его формы, и возникающая портальная гипертензия вызывают развитие коллатерального кровообращения. Все коллатерали воротной вены разделяют на: 1) порто-портальные, или гепатопетальные; 2) портокавальные, или гепатофугальные. Функционирование отдельных групп коллатералей зависит от формы и степени нарушения портального кровообращения.
Гепатопетальный коллатеральный кровоток наблюдается при непроходимости ствола воротной вены. Венозная кровь из портальной системы поступает в печень по истинным добавочным воротным венам, которые отходят от самого ее ствола. Ограниченное количество портальной крови попадает в печень через околопупочные вены (вены Саппея) — небольшие сосуды, берущие начало от ствола воротной вены, из стенок желудка и двенадцатиперстной кишки и направляющиеся к воротам печени.
Выделяют три зоны гепатопетального коллатерального кровотока: 1) в толще печеночно-дуоденальной связки; 2) в толще желудочно-печеночной связки; 3) между левой долей печени, брюшной частью пищевода и кардиальным отделом желудка (Л. Л. Гугишвили, 1963). Автор выделяет следующие варианты крупных гепатопетальных анастомозов: 1) дополнительной воротной веной служит правая желудочная вена; 2) левая желудочная вена сообщается непосредственно с левой ветвью воротной вены; 3) ветвь правой желудочной вены направляется к левой ветви воротной вены, а от головки поджелудочной железы к правой ветви воротной вены идет дополнительная ветвь; 4) крупная ветвь, отходящая от места формирования верхней брыжеечной вены, впадает в правую ветвь воротной вены.
Гепатофугальный кровоток наиболее часто встречается при синдроме портальной гипертензии. Основными путями оттока крови являются следующие виды портокавальных анастомозов: 1) в области кардиального отдела желудка и брюшной части пищевода, соединяющие систему воротной вены с верхней полой через непарную вену; 2) венозное сплетение стенки прямой кишки через верхние, средние и нижние прямокишечные вены в нижнюю полую вену; 3) через пупочную и надчревные вены в систему верхней и нижней полой вен.
Печень получает кровоснабжение, равное 100—130 мл/мин на 100 г ее массы, в том числе 25—30 % объема крови поступает по собственной печеночной артерии под давлением 110—130 мм.рт. ст., а остальное — по воротной вене под давлением 70— 120 мм вод. ст.
На основании исследования с веществами, которые практически полностью выделяются печенью, и теми, которые практически не подвергаются метаболическим изменениям, было установлено, что при хронических заболеваниях печени снижение кровотока на печень и масса функционирующих гепатоцитов строго взаимосвязаны (A. McLean и соавт., 1979). Это позволило авторам сформулировать гипотезу, согласно которой гепатоциты в непораженных участках органа кровоснабжаются и функционируют так же, как и в нормальных условиях (гипотеза интактного гепатоцита). Согласно этой гипотезе низкий клиренс индоцианового зеленого объясняется наличием внутрипеченочных шунтов кровотока.
Коллатеральный кровоток недостаточно эффективно уменьшает повышенное давление в системе воротной вены. Если предположить, что диаметр поперечного сечения нормальной воротной вены равен 2 см, то по закону Пуазейля для обеспечения эквивалентного кровотока необходимо 4000 вен диаметром 0,5 см.
Затруднение кровотока по воротной вене, существующее при синдроме портальной гипертензии, ведет к резкому расширению коллатералей. Типичные изменения возникают в венах нижней трети пищевода и кардиального отдела желудка. Предрасполагающими факторами являются магистральный тип строения вен подслизистого слоя и незначительная фиксация их стенок. Под воздействием высокого портального давления вены удлиняются, расширяются, становятся извилистыми и узловатыми. Этому способствует также недостаточность анастомозов вен пищевода с сосудами бассейна непарной вены, проходящими через мышечный слой пищевода.
Кровотечения из варикозно расширенных вен пищевода и желудка могут возникать уже при относительно невысоком портальном давлении — 250—300 мм вод. ст., хотя прямой зависимости между высотой давления и кровотечением нет. В настоящее время установлено, что пусковыми моментами кровотечения служат: резкое повышение давления в портальной системе, пептическое действие желудочного сока на измененную в результате трофических нарушений слизистую оболочку пищевода, нарушения свертывания крови (П. А. Иванов, 1967; М. Д. Пациора и соавт., 1971).
Увеличение селезенки — прямой результат повышения давления в воротной вене. Давление в селезенке и в воротной вене существенно не различается, колебания его происходят практически синхронно. Депонируя часть крови, селезенка играет роль буфера, уменьшающего резкие колебания давления. Этим обстоятельством объясняется тот факт, что после спленэктомии кровотечение из варикозно расширенных вен пищевода и желудка учащается.
Однако с течением времени в селезенке нередко развиваются явления воспаления, капсула ее утолщается, паренхима уплотняется. При этом буферная роль селезенки уменьшается. Кроме того, возможно развитие синдрома гиперспленизма, проявляющегося анемией, лейкопенией, тромбоцитопенией, гиперплазией костного мозга с нарушением процессов созревания форменных элементов крови.
Глубокие нарушения функции печени, наступающие при тяжелом хроническом гепатите и циррозе печени, приводят не только к развитию синдрома портальной гипертензии.
Несвоевременная инактивация гормонов сопровождается глубокими нарушениями водно-солевого баланса, в результате которых возникает асцит.
Нарушение пигментообразовательной функции гепатоцитов проявляется стойкой желтухой.
При печеночной недостаточности возникают нарушения психики, причиной которых может быть повышение содержания в крови жирных кислот с короткой цепью аммиака, меркаптанов, ароматических аминокислот и их производных (L. Copocaccia и соавт., 1982). Авторы указывают, что единственной аминокислотой, содержание которой в плазме крови коррелирует со степенью и эволюцией печеночной энцефалопатии, является триптофан.
Почечная недостаточность при поражении печени может носить функциональный характер в связи с уменьшением почечного кровотока и быть обусловленной острым тубулярным некрозом (U. Polozzo, 1981). Из 40 больных с терминальной стадией цирроза печени острая почечная недостаточность диагностирована у 26, в том числе у 15 она носила функциональный характер, у 3 развился острый тубулярный некроз, а в 7 наблюдениях установить природу нарушения функции почек не удалось. Почечная недостаточность отмечалась с одинаковой частотой у больных с асцитом и без него.
Затруднение оттока крови по воротной вене приводит к скоплению тканевой жидкости в органах брюшной полости, вследствие чего они индурируются, а лимфатические сосуды значительно расширяются. Изучение лимфотока и содержания белка в лимфе у больных с синдромом портальной гипертензии показало, что повышение давления в воротной вене сопровождается повышенным выходом жидкости в лимфатическое русло, но уровень белка в ней остается низким (М. Н. Witte и соавт., 1981).
Повышение уровня ренина и альдостерона в сыворотке крови сопровождается значительным сокращением продолжительности жизни больных с циррозом печени и асцитом (V. Arroyo и соавт., 1981). Из 75 наблюдаемых больных 37 умерли в течение 6 мес, в то время как в контрольной группе этот показатель равнялся 28 мес.
Желтуха при синдроме портальной гипертензии может быть обусловлена обтурацией желчных протоков замазкообразной массой (М. Д. Пациора и соавт., 1978). Авторы наблюдали 3 больных, у которых можно было предположить первичное нарушение физических свойств желчи.
Течение хронического активного гепатита характеризуется чередованием периодов обострения заболевания и ремиссии. В 70— 80 % наблюдений заболевание переходит в цирроз печени, 25— 30 % больных умирают от печеночной недостаточности, только 20 % больных живут более 10 лет (А. С. Ломнов, 1977).
Патологическая анатомия. Морфологические различия между хроническим персистирующим и хроническим активным гепатитом отмечают A. J. Czojo и соавторы (1981).
Гистологически хронический персистирующий гепатит проявляется незначительными изменениями строения печени. Отмечается скопление лимфоцитов, плазматических клеток и макрофагов вокруг портальных триад. Ступенчатые некрозы гепатоцитов отсутствуют.
Хронический активный гепатит характеризуется наличием ступенчатых, или мостовидных, некрозов гепатоцитов.
Для гепатита, вызванного вирусом «ни А, ни В», характерно своеобразное поражение внутрипеченочных желчных путей: внутренний слой их представлен многослойным эпителием с неравномерным утолщением стенки протока (М. Schmidt и соавт., 1982).
У больных хроническим активным гепатитом и циррозом печени обнаружено повышенное содержание интерферона в крови (G. Koto и соавт., 1990).
У 85 % больных хроническим активным гепатитом и у 80 % больных первичным билиарным циррозом печени выявлено повышенное содержание микроглобулина в крови, уровень которого не коррелировал с уровнем билирубина, гамма-глобулина и активностью трансаминаз (S. Beorchig и соавт., 1982).
М. И. Торкачева (1922) выделяет следующие пути коллатерального кровотока из системы воротной вены в систему полых вен: 1) поверхностный путь, соединяющий воротную вену с верхней полой через околопупочные и внутреннюю грудную вены; 2) поверхностный путь, соединяющий воротную вену с нижней полой посредством околопупочных вен, нижней надчревной, бедренной и общей подвздошной вен; 3) глубокий путь, соединяющий воротную вену с верхней полой: а) через левую желудочную, пищеводные, межреберные, непарную и полунепарную вены; б) через пупочную, верхнюю надчревную и внутреннюю грудную вены; в) через левую желудочную, диафрагмальные и внутреннюю грудную вены; г) через вены капсулы почки и внутреннюю грудную вену; 4) глубокий путь, соединяющий воротную вену с нижней полой: а) через левую желудочную и диафрагмальные вены; б) через нижнюю брыжеечную, прямокишечные и внутренние подвздошные вены; в) через верхнюю брыжеечную, прямокишечные и вены мочевого пузыря; г) через верхнюю или нижнюю брыжеечную вену, вены двенадцатиперстной и нисходящей ободочной кишок; д) через правую желудочную и диафрагмальные вены.
Варикозным изменениям могут быть подвержены вены пищевода на всем его протяжении, вены желудка, двенадцатиперстной, тонкой, ободочной и прямой кишок. Однако для синдрома портальной гипертензии наиболее характерно и постоянно выявляется варикозное расширение вен нижней трети пищевода (М. Д. Пациора и соавт., 1971).
Частота варикозных изменений вен пищевода и желудка прямо пропорциональна величине портального давления. Отмечено, что при давлении выше 250 мм вод. ст. подобные изменения имеются почти у всех больных (Б. А. Петров, Э. И. Гальперин, 1959). Другие авторы указывают, что «критическим» является давление 270 мм вод. ст. (А. А. Эндер, 1968).
Клиника. Считают, что о хроническом гепатите можно говорить при длительности заболевания от 10 нед до 6 мес и более (A. J. Czojo, 1981; М. MacKinnan и соавт., 1981).
Клинические проявления хронического гепатита, цирроза печени и синдрома портальной гипертензии многообразны.
Характерны признаки, отражающие нарушения функции печени: пальцы в виде барабанных палочек, телеангиэктазии, гиперемия ладоней («печеночные ладони»), отсутствие аппетита, «металлический» привкус во рту, ощущение тяжести в правом подреберье, усиливающееся после еды и физической нагрузки. При тяжелом поражении печени появляются желтушность склер и кожи, асцит.
По клиническому течению различают три типа асцита: 1) транзиторный — исчезающий под влиянием лечения; 2) прогрессирующий — терапия неэффективна или дает кратковременный эффект; 3) дистрофический — конечная стадия заболевания (П. Н. Напалков, С. А. Апаков, 1971).
Нарушения психики прогрессируют от повышенной утомляемости и рассеянности до эйфории, которая сменяется угнетением психической и двигательной активности вплоть до комы.
Синдром портальной гипертензии, помимо перечисленных выше, имеет свои клинические признаки, важнейшими из которых являются: увеличение селезенки, кровотечение из вен пищевода и желудка, кровотечение из прямокишечных вен, повышенная кровоточивость из носа, десен (геморрагический диатез), расширение подкожных вен живота и грудной стенки.
Артериовенозные свищи сосудов органов брюшной полости сопровождаются систолическим шумом над определенной областью живота у 62 % больных, болью в животе — у 39 % (Н. Bisler и соавт., 1979).
При хроническом гепатите печень обычно несколько увеличена, уплотнена, край ее умеренно болезнен при пальпации, гладкий, тестоватой консистенции. У больных циррозом печени возможны два варианта изменений органа. При одном из них печень увеличивается, становится плотной, край ее заостренный, бугристый, безболезненный. Другой вариант характеризуется уменьшением печени, которая не прощупывается даже при глубокой пальпации.
Для синдрома Budd—Chiari типично резкое увеличение печени, болезненность ее при пальпации, однако край печени остается гладким, тестоватой консистенции.
Отечность ног у больных циррозом печени — признак терминальной стадии болезни. Однако при синдроме Budd—Chiari отечность ног, а также поясницы свидетельствует о нарушении проходимости нижней полой вены.
Кровотечение из вен пищевода и желудка у больных с синдромом портальной гипертензии возникает без предвестников и происходит в виде срыгивания свежей неизмененной непенящейся крови без рвотных движений. Через некоторое время, от 30—60 мин до 12 ч в зависимости от интенсивности кровотечения, появляется жидкий дегтеобразный стул с неприятным запахом (мелена).
С возникновением кровотечения становятся ярко выраженными признаки печеночной недостаточности — желтуха, асцит, нарушения психики.
Интенсивность и тяжесть кровотечения из вен пищевода и желудка зависят от формы портальной гипертензии. При допеченоч-ном блоке кровотечение возникает часто, однако кровопотеря обычно небольшая. Смерть после первого кровотечения наступает редко (В. В. Гаврюшов, 1969).
Внутрипеченочный блок приводит к редким, но значительно более тяжелым кровотечениям. В течение года после первого кровотечения умирает от 14,5 до 80 % больных и более.
Внутрибрюшной разрыв варикозно расширенных вен воротной системы — редкое осложнение синдрома портальной гипертензии.
Асцит у рассматриваемой категории больных свидетельствует о тяжелом поражении печени. При инфицировании асцитической жидкости развивается асцит-перитонит. Повышается температура тела, усиливается боль в животе, появляются признаки раздражения брюшины. Заболевание медленно прогрессирует (в течение 2—4 сут и более), хорошо поддается лечению антибактериальными и мочегонными препаратами.
Асцитическая жидкость считается инфицированной, если она содержит более 3-105/л лейкоцитов, из которых 25% приходится на долю нейтрофилов (S. Moterin и соавт., 1979).
Лабораторно-инструментальные методы исследования. Общий анализ крови необходим для обнаружения гиперспленизма. Критериями его являются содержание лейкоцитов менее 4-109/л, тромбоцитов— менее Ы08/л.
Количество эритроцитов и цветной показатель, скорость оседания эритроцитов косвенно свидетельствуют о состоянии функции печени. Количество эритроцитов, уровень гемоглобина и гематокритное число контролируют при лечении кровотечения из вен пищевода и желудка.
Биохимические исследования крови неспецифичны для рассматриваемой патологии и отражают функцию печени в целом. Наиболее распространено в клинике определение общего белка крови и его фракций, билирубина и его фракций, аланиновой и аспарагиновой трансаминаз, креатинина, остаточного азота и мочевины. Клинически выраженный гепатит и цирроз печени сопровождаются повышением уровни хенодеоксихолевой кислоты в сыворотке крови, в то время как вне- и внутрипеченочная обтурация желчных путей вызывает повышение уровня холевой кислоты (S. Мо-terin, W. Gerok, 1979). Снижение соотношения холевой и деоксихолевой кислот по результатам определения их в сыворотке крови указывает на плохой прогноз. Авторы считают, что определение содержания желчных кислот в крови имеет наибольшее значение при диагностике безжелтушных форм гепатита и цирроза печени.
Исследование свертывающей системы крови показано при установлении формы портальной гипертензии, а также для коррекции соответствующих нарушений во время кровотечения. Для цирроза печени характерно снижение протромбинового индекса на 50 % и более по сравнению с нормой.
Иммунологические пробы. Установлено, что алкогольный гепатит сопровождается повышенным содержанием гаптоглобина, нормальным или несколько сниженным уровнем альбумина, повышенной концентрацией IgA, нормальным содержанием IgG в сыворотке крови (В. Nolpos и соавт., 1980). Для алкогольного цирроза печени характерно уменьшение уровня гаптоглобина и альбумина, повышение уровня IgG и IgA. Авторы считают, что при нормальном уровне IgA в сыворотке крови диагноз алкогольного гепатита или цирроза печени вызывает большие сомнения.
Диагноз вирусного гепатита А устанавливают при выявлении в крови больных специфических антител, относящихся к IgM (J. H. Hoofnagle, 1983).
Гепатит В характеризуется наличием в крови антигенов HBs, НВс и антител к ним: HBsAg, HBeAg и HBcAg.
Выделение антител к митохондриям считают высоко достоверным диагностическим признаком при первичном билиарном циррозе печени (L. E. Munoz и соавт., 1981).
Диагноз вирусного гепатита типа «ни А, ни В» устанавливают путем исключения возбудителей гепатита А и В, вируса Эпштейна—Борра и цитомегаловируса (L. Bianchi и соавт., 1983).
Определение печеночного кровотока возможно путем внутривенного введения веществ, которые практически полностью выводятся печенью. К ним относятся индоциан зеленый, лидокаин и некоторые другие. Индоциан зеленый вводят внутривенно капельно до 0,5 мг/кг, достигая стабильной концентрации его в крови. Затем определяют содержание красителя в периферической крови и в печеночных венах, на основании чего рассчитывают клиренс вещества.
Спленоманометрию используют для определения давления в селезенке, что позволяет судить о портальном давлении в целом. В асептических условиях под местной анестезией селезенку пунктируют тонкой иглой в восьмом и девятом межреберье между средней и задней подмышечными линиями. Иглу соединяют с аппаратом Вальдмана и измеряют величину давления.
Обычно спленоманометрию дополняют спленопортографией. Исследование проводят в рентгенкабинете.
Спленопортография заключается в том, что после спленоманометрии через иглу вводят вначале пробную дозу — 5 мл контрастного вещества, а затем автоматическим шприцем вводят 40— 60 мл контрастного вещества и выполняют рентгеновские снимки с интервалом 1 с.
После исследования иглу извлекают, на место пункции накладывают асептическую наклейку. Больной должен в течение 1 сут находиться под наблюдением дежурного хирурга, который систематически контролирует частоту пульса и артериальное давление.
Противопоказаниями к спленоманометрии и спленопортографии являются: нарушение свертывания крови, непереносимость контрастных препаратов, тяжелое общее состояние больного, при котором противопоказано оперативное вмешательство на органах брюшной полости.
Артериография чревного ствола и верхней брыжеечной артерии позволяет оценивать артериальный кровоток в печени. При циррозе печени последний резко снижен, сосуды истончены, удлинены (рис. 29).
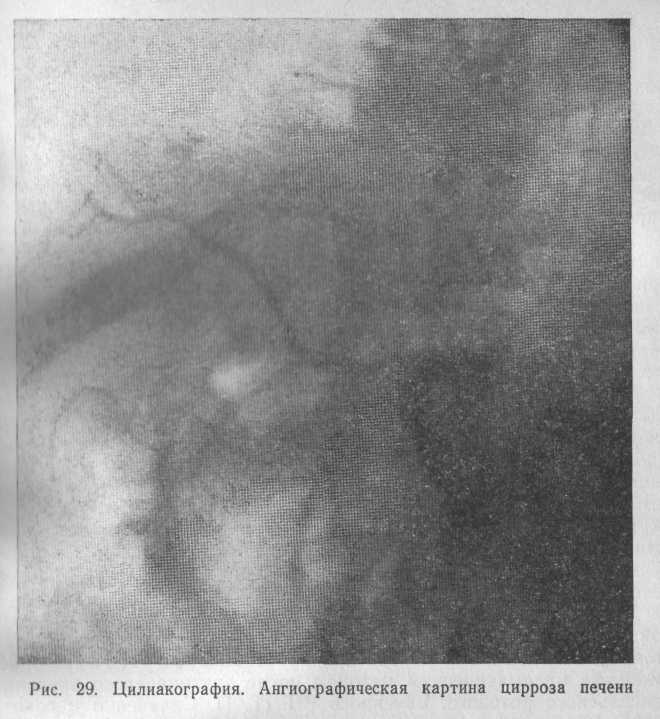
Одновременно усиливается кровоток в селезенке.
Венозная фаза ангиографии иногда позволяет получить достаточно хорошее изображение воротной вены и ее ветвей. Такой метод получил название непрямой портографии.
Для оценки кровотока в варикозно расширенных венах пищевода и желудка можно использовать артериографию через селезеночную артерию, в то время как для оценки проходимости наложенного спленоренального анастомоза контрастное вещество необходимо вводить в верхнюю брыжеечную артерию (В. М. Norlinder и соавт., 1979).
Эндоскопическое исследование пищевода и желудка достоверно обнаруживает варикозно расширенные вены в подслизистом слое.
Кроме того, обычно выявляются рефлюкс-эзофагит, зияние привратника и заброс содержимого двенадцатиперстной кишки в желудок.
Эндоскопическое исследование высокоинформативно при установлении причины кровотечения из пищевода и (или) желудка.
R. Morsimaun (1982) производил пункцию варикозно расширенных вен пищевода и измерение давления в них во время эндоскопического исследования.
Рентгенологическое исследование желудка ранее широко использовалось для выявления варикозно расширенных вен пищевода и желудка, а также для дифференциации источника кровотечения. В настоящее время в связи с развитием эндоскопии рентгенологическое исследование потеряло свое прежнее значение.
Обызвествление кольца в сосудах при артериовенозных свищах обнаруживают у 12 % больных (Н. Bisler и соавт., 1979).
Радионуклидное сканирование, ультразвуковая эхолокация показаны при циррозе печени.
Скорость исчезновения радионуклидов 85Кг и 133Хе после их ретроградного введения в печеночные вены определили P. Lundbergh и Т. Stroudell (1974). Поскольку ксенон более прочно связывается с жировой тканью, дифференцированное определение скорости выведения радионуклидов может быть использовано для определения содержания жира в печени.
В эксперименте на собаках показано, что определение кровотока в печени путем сцинтисканирования воротной вены после внутриселезеночного введения 1,0—1,5 мКи 133Хе тесно коррелирует с показателями, устанавливаемыми при помощи прямой флуомет-рии (Р. И. М. Lorn и соавт., 1979). Печеночный кровоток можно определять также после ретроградного введения шХе в печеночные вены (Т. Stroudell, 1978).
Н. J. W. Wlbbrube и Н. Stroug (1979) вводили 165 больным следовую дозу аминопирина, меченного 14С, и определяли содержание через 6 ч меченого углекислого газа (иСОг) в выдыхаемом воздухе для оценки функции гепатоцитов. В норме константа элиминации превышает 24 % в 1 ч. У больных хроническим гепатитом она составила 21—12 %, циррозом печени — менее 9 %, при внутрипеченочном холестазе — 28%. Проба указывала на нарушение функции при нормальных показателях исследования с бромсульфалеином и индоциановым зеленым, что свидетельствует о высокой чувствительности радионуклидного метода.
Для характеристики функции печени предлагают использовать показатели относительного печеночного клиренса, секреции, постоянную экскреции и показатель кровенаполнения печени, определяемые математическим методом после внутривенного введения бенгальского розового, меченного 1331 (Т. П. Сиваченко и соавт., 1980). В норме перечисленные показатели равны соответственно 2,1 % (1,8 % ± 3 %); 33 % (20 % ± 50 %); 5,5 % (2,5 % ±8,5 %); 6% (4% ±8%).
Радионуклидное сканирование позволяет диагностировать спле-номегалию как осложнение синдрома портальной гипертензии.
Проведенные в клинике КНИИКЭХ исследования показали, что при синдроме портальной гипертензии увеличивается время максимального поступления крови в селезенку при одновременном снижении амплитуды кривой накопления радионуклида (В. Н. Короткий и соавт., 1980).
Точность ультразвуковой эхолокации в диагностике алкогольного поражения печени составила 95,5 % (К- J. Toylor и соавт.; 1981).
Эндоскопическая ретроградная холангиография или чрескожная чреспеченочная холангиография необходима при установлении природы желтухи.
Реогепатографию используют для оценки внутрипеченочного кровотока.
Пункционную биопсию печени выполняют так же, как при опухолях печени. Исследование необходимо для морфологического подтверждения диагноза гепатита или цирроза печени.
Поскольку дифференциация хронического активного и хронического персистирующего гепатита наиболее достоверна по результатам морфологического исследования гепатоцитов, пункционную биопсию целесообразно производить всем больным хроническим гепатитом.
Правильный гистологический диагноз хронического активного гепатита (P. Schlichting и соавт., 1983) установили у 94 % больных при длине столбика ткани более 5 мм.
При наличии асцита чрескожная пункция печени противопоказана ввиду высокого риска внутрибрюшного кровотечения и жел-чеистечения. В этих условиях рекомендуют выполнять чрезвенозную пункционную биопсию печени из доступа через внутреннюю яремную вену (D. Lebrec и соавт., 1982). Авторы выполнили подобное исследование у 932 больных. Произведено 1033 пункции печени; материал, достаточный для морфологического исследования, получен после 1000 пункций. Правильное заключение цитологов получено у 64,2 % больных циррозом и фиброзом печени и у 98,9 % больных, у которых фиброзные изменения печени отсутствовали.
Лапароскопия — высокодостоверный метод диагностики цирроза печени, спленомегалии и асцита как осложнений заболевания. Малая травматичность позволяет применять этот метод во всех трудных для диагностики случаях.
Исследование желудочной секреции при циррозе печени и синдроме портальной гипертензии у детей показало, что снижение уровня секреции зависит не от сопутствующего повышения давления в системе воротной вены, а от поражения гепатоцитов (А. Ф. Леонтьев и соавт., 1980). При допеченочном блоке портальной системы желудочная секреция была нормальной или повышенной. Авторы установили, что спленэктомия увеличивает стимулируемую секрецию желудка, а операция Таннера — резко угнетает ее на срок до 3 лет.
Классификация. Согласно международной классификации, выделяют персистирующий и активный (агрессивный) хронический гепатит.
Единой общепринятой классификации цирроза печени, а также состояний, характеризующих синдром портальной гипертензии и асцит, нет. Мы считаем, что для выбора врачебной тактики необходимо учитывать следующие факторы.
I. Характер морфологических изменений печени — нормальная паренхима, хронический гепатит, цирроз печени.
II. Функциональное состояние печени: а) полная компенсация всех функций; б) нестойкая компенсация; в) печеночная недостаточность.
III. Причины возникновения синдрома портальной гипертензии:
а) увеличение порто-портальной циркуляции; б) допеченочный блок портальной системы; в) внутрипеченочный блок портальной системы; г) надпеченочный блок портальной системы; д) комбинированный внутри- и внепеченочный блок портальной системы.
IV. Степень увеличения селезенки и ее функциональное состояние: а) селезенка нормальных размеров или умеренно увеличена;
б) селезенка огромных размеров, из-за чего двигательная активность больного резко ограничена; в) функция селезенки нормальная; г) имеются признаки гиперспленизма.
V. Клиническое течение асцита: а) транзиторное; б) стойкое, то есть не меняющееся, несмотря на медикаментозную терапию в течение 4—6 нед; в) прогрессирующее.
Диагноз гепатита или цирроза печени устанавливают на основании клинической картины, результатов биохимических и специальных исследований. Полноценное обследование позволяет не только правильно поставить диагноз, но и определить степень поражения печени.
Дифференциальный диагноз гепатита и цирроза печени необходимо проводить с: 1) внутрипеченочной гематомой и фиброзом, развившимся после травмы печени; 2) опухолями печени и желчных протоков на уровне бифуркации долевых протоков.
Если больной обратился к врачу по поводу желудочно-кишечного кровотечения, синдром портальной гипертензии необходимо дифференцировать с другими заболеваниями, которые могут осложняться кровотечением — язвенной болезнью желудка и двенадцатиперстной кишки, опухолью желудка, ободочной кишки, хроническим панкреатитом и опухолью поджелудочной железы, а также с гемобилией, носовым и легочным кровотечением.
В тех случаях, когда поводом для обращения к врачу является асцит, необходимо дифференцировать гепатит и цирроз печени с опухолевым поражением органов брюшной полости, малого таза и забрюшинного пространства с диссеминацией ракового процесса по брюшине.
Спленомегалию на почве цирроза печени необходимо дифференцировать со спленомегалией, вызванной тромбозом селезеночной вены или перекручиванием ножки селезенки, а также с заболеваниями крови.
Асцит-перитонит вследствие спонтанного инфицирования асцитической жидкости необходимо дифференцировать с перитонитом, развившимся на почве острой хирургической патологии органов брюшной полости. Обычно правильный диагноз ставят на основании эффективности антибактериальной терапии, однако иногда истинный характер заболевания трудно установить даже во время
операции.
Консервативная терапия. Лечение гепатита и цирроза печени направлено на создание условий, благоприятных для функции и регенерации гепатоцитов. В стадии обострения заболевания про-водится интенсивная терапия печеночной недостаточности, описанная в главе «Непроходимость желчных протоков доброкачественной этиологии»
При отсутствии осложнений лечение заключается в соблюдении диеты и приеме желчегонных (см. главу «Желчнокаменная болезнь и заболевания желчного пузыря»), а также в периодически повторяющихся курсов витаминотерапии.
Назначение кортикостероидов при хроническом агрессивном гепатите в сочетании с азатиоприном или без него рекомендуют при отсутствии HBsAg. Moskinnon и соавторы (1981). При наличии HBsAg назначение кортикостероидов может сопровождаться активацией вируса. В связи с тем что при неблагоприятном течении хронического активного гепатита, вызванного вирусом В, отме-чается низкая степень репликации ДНК, применение ингибиторов синтеза ДНК у таких больных нецелесообразно (S. Rocehia и со-авт., 1982). Стероидные препараты не показаны при гепатите «ни Л, ни В» (R. Botey, 1982).
D-пеницилламин в дозе 900 мг/сут в сочетании с пиридоксина гпдрохлоридом назначали в течение 3—6 мес при хроническом активном гепатите и первичном билиарном циррозе печени X. X. Мансуров и соавторы (1981). При этом наряду с улучшением клинико-функциональных показателей значительно уменьшалось содержание орсеинположительных гранул в цитоплазме гепатоцитов. Это связано со способностью препарата деполимеризовать патологические макроглобулины и образовывать хелаты с медью, что тормозит активность медьсодержащих оксидаз, участвующих в процессах внеклеточного синтеза коллагена.
Поскольку хронический активный гепатит и цирроз печени сопровождаются повышением уровня альдостерона в сыворотке крови, при асците целесообразно назначать антагонист альдостерона спиронолактон.
Разрабатываются методы профилактики вирусного гепатита. Лицам с угрозой вирусного гепатита А вводят соответствующий иммуноглобулин. Подвергающимся риску возникновения гепатита В вводят специфическую вакцину. Поскольку возбудитель вирусного гепатита типа «ни А, ни В» не идентифицирован, профилактика заболевания заключается в возможно более раннем применении иммуноглобулина против вируса А (М. J. Alter, 1984).
Появление желудочно-кишечного кровотечения и (или) асцита требует направленной терапии.
Своевременная и правильная коррекция кровопотери является наиболее эффективной мерой профилактики прогрессирования печеночной недостаточности при синдроме портальной гипертензии.
Переливание свежей крови показано до тех пор, пока не стабилизируется артериальное давление на уровне не ниже 90/50 мм рт. ст. Добиваться более высокого подъема артериального давления нецелесообразно из-за угрозы рецидива кровотечения. При наблюдении в динамике необходимо поддерживать гемоглобин на уровне 81—89 г/л при гематокритном числе 0,35—0,4.
Снижения уровня портального давления достигают назначением питуитрина (М. Д. Пациора и соавт., 1971). Препарат вводят в дозе 20 ЕД внутривенно капельно в 250 мл 5 % раствора глюкозы. При необходимости введение повторяют через 24 ч. По данным авторов, метод позволяет снизить портальное давление на 20— 35 % от исходного, что уменьшает кровопотерю из разорвавшихся вен пищевода. Однако необходимо учитывать, что одновременное снижение артериального кровотока в печени усиливает угрозу печеночной недостаточности. Кроме того, во время введения питуитрина может появляться боль в области сердца.
Учитывая нарушения свертывания крови у больных циррозом печени, в комплекс лечения включают викасол, аминокапроновую кислоту.
Во время кровотечения и в первые 1—2 сут после его остановки прием жидкости и пищи категорически запрещается.
С гемостатической целью назначают смесь аминокапроновой кислоты и тромбина (М. А. Уманский и соавт., 1971). В 100 мл воды растворяют 10 г сухого тромбина и 200 мг аминокапроновой кислоты и дают больному по 1 столовой ложке каждые 10 мин в течение первых 2 ч, а затем по 1 столовой ложке каждые 2 ч на протяжении суток.
При неэффективности консервативной терапии и наличии противопоказаний к экстренному хирургическому вмешательству для остановки кровотечения применяют тампонаду пищеводным зондом Blakemore (рис. 30).
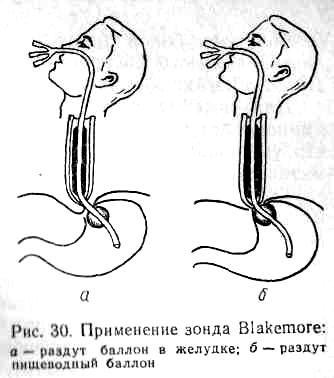
Зонд состоит из трехпросветной трубки с двумя баллонами. Два канала трубки служат для раздельного раздувания баллонов, третий — для эвакуации содержимого из желудка и контроля эффективности гемостаза.
Методика применения зонда. Носоглотку анестезируют путем смазывания слизистой оболочки 1 % раствором дикаина. Зонд смазывают вазелином и через носовой ход вводят в пищевод до отметки, указывающей, что нижний баллон находится в желудке. Желудочный баллон раздувают воздухом (около 200 см3) и несколько подтягивают. Это обеспечивает правильную установку пищеводного баллона и сдавливание кардиального отдела желудка.
затем отдельными порциями по 10 - 15 см3 с интервалом 3—5 мин раздувают пищеводный баллон до объема 80—150 см3. Аспирируют содержимое желудка, повторным введением охлажденных растворов отмывают желудок до чистых промывиых вод и в дальнейшем по характеру содержимого оценивают эффективность тампонады.
После остановки кровотечения через зонд больного можно кормить жидкой легкоусвояемой пищей. Через каждые 5-6 ч воздух из пищеводного
балона выпускают и контролируют содержимое желудка: если кровь не поступает, значит кровотечение остановлено.
Зонд извлекают через 24-72 ч, предварительно освободив баллоны от воздуха.
На время нахождения зонда в пищеводе больным назначают промедол пли пантопон в обычной дозировке.
Применение зонда может сопровождаться осложнениями: изъязвлением слизистой оболочки пищевода, образованием пролежней, аспирационной пневмонией. Во избежание осложнений однократное применение зонда в течение более 2—3 сут не рекомендуют. Однако при рецидиве кровотечения допустимо повторное использование зонда. Эффективность зондовой тампонады составила 74 % У 50 больных (М. Д. Пациора и соавт., 1971).
Необходимо учитывать, что седативные препараты могут усугубить печеночную недостаточность у больных циррозом печени. Поэтому применение их данной категории больных противопоказано.
Изучение корреляции между величиной давления в воротной системе и клиническим течением болезни показало, что при давлении 270—300 мм вод. ст. кровотечение остановилось под действием консервативной терапии, а при давлении 490—500 мм вод. ст. медикаментозное лечение оказалось полностью неэффективным у всех больных (R. J. Adamson и соавт., 1977).
Обнаружение в гепатоцитах телец Маллори сопровождалось повышением послеоперационной летальности и сокращением продолжительности жизни после операции (F. E. Eckhouser и соавт., 1980). Авторы считают обнаружение множественных телец Маллори противопоказанием к ургентной операции из-за высокой послеоперационной летальности.
Множественные мелкие узлы регенерации печени при циррозе ее являются более благоприятным прогностическим признаком портокавального сосудистого шунтирования, чем крупные узлы (М. И. Лыткин и соавт., 1976).
Для лечения печеночной энцефалопатии внутривенно вводят аминокислоты с разветвленной цепью (валин, лейцин, изолейцин), что уменьшает поступление в центральную нервную систему ароматических аминокислот (L. Capocaccio и соавт., 1982).
Хирургическое лечение. Показания к хирургическому лечению можно разделить на экстренные и плановые. К первым относятся: 1) профузное желудочно-кишечное кровотечение у больных циррозом печени, угрожающее развитием тяжелой печеночно-почечной недостаточности; 2) желудочно-кишечное кровотечение, которое не удается остановить консервативными методами в течение 24—36 ч.
Плановыми показаниями к хирургическому лечению хронического гепатита, цирроза печени и портальной гипертензии являются: 1) хронический гепатит, сопровождающийся стойкой желтухой в течение 6 мес; 2) синдром портальной гипертензии, осложненный повышением давления в воротной вене до 250 мм вод. ст. и (или) желудочно-кишечным кровотечением при поступлении или в анамнезе; 3) спленомегалия с признаками гиперспленизма; 4) цирроз печени, осложненный стабильным или медленно прогрессирующим асцитом, не поддающимся медикаментозной терапии.
По своей направленности все методы хирургических вмешательств можно разделить на следующие группы: 1) воздействующие непосредственно на печень; 2) предназначенные для влияния на портальное кровообращение; 3) направленные на устранение асцита.
У больных хроническим гепатитом, особенно при циррозе печени и синдроме портальной гипертензии, резко повышена кровоточивость всех тканей, что связано как с нарушением свертывания крови, так и с изменением проницаемости сосудистых стенок. В то же время большая кровопотеря, даже вовремя компенсированная, значительно повышает риск возникновения печеночной недостаточности в послеоперационный период. Поэтому во время оперативных вмешательств необходимо особенно тщательно следить за гемостазом, добиваясь поэтапной остановки кровотечения даже мельчайших сосудов. Наиболее эффективно комбинированное применение диатермокоагуляции и лигирования сосудов. Временная тампонада кровоточащих участков марлевыми салфетками в надежде на спонтанное прекращение кровотечения, по нашему мнению, мало эффективна.
Поскольку при выборе метода оперативного вмешательства важное значение имеет величина давления в воротной вене, необходимо систематическое определение этого показателя. Для этого мы применяем мерную пипетку, соединенную с иглой. Установив
иглу и пипетку строго вертикально, пунктируем сосуд. По высоте столба крови в пипетке судим о величине давления.
Операции, воздействующие непосредственно на печень. Периартериальная симпатэктомия общей и собственной печеночных артерий. После верхней срединной лапаротомии рассекают желудочно-печеночную связку, а затем брюшину но медиальному краю печеночно-дуоденальной связки, Раздвигая клетчатку, выделяют собственную печеночную артерию или ее правую ветвь. Используя сосудистый хирургический инструментарий, рассекают наружную оболочку артерии, в которой
находится периартериальное нервное сплетение. Нередко удается проследить крупные нервные стволы, переплетающиеся между собой и сдавливающие артерию. Перемещаясь вдоль артерии в направлении как к печени, так и к чревному стволу, поэтапно рассекают брюшину, расслаивают жировую клетчатку и иссекают наружную оболочку по всему периметру общей и собственной печеночных артерий, а при низком давлении последней—и на начальных участках долевых печеночных артерий. Во время выделения сосудов возможно кровотечение из мелких ветвей, особенно вблизи чревного ствола, где приходится отделять многочисленные крупные лимфатические узлы. Гемостаз устанавливают прижиганием кровоточащих участков диатермокоагуляцией. Во время операции необходимо строго придерживаться послойности отделения наружной оболочки артерий. Если этот принцип нарушен и иссечена мышечная оболочка, возможно образование аневризмы на пораженном месте. Операцию завершают перемещением большого сальника поверх поперечной кишки и желудка в подпеченочное пространство и ушиванием брюшной полости наглухо.
Периартериальная симпатэктомия печеночных артерий сопровождается увеличением числа митозов в гепатоцитах (Н. С, Ефимишин, 1969). В эксперименте установлено, что денервация печени приводит к расширению синусоидных капилляров и пространств Диссе, десквамации эндотелиальных клеток, расширению отводящих вен через 1—2 нед после операции (И. К. Капиносов, 1979). Автор считает, что сосудистые и дистрофические изменения после денервации печени вызывают ответные компенсаторные и восстановительные реакции, следствием которых является усиление процессов регенерации.
Периартериальная симпатэктомия печеночных артерий произведена нами у 49 больных. После операции умерли от нарастающей печеночной недостаточности 3 больных с признаками хронического активного гепатита (повышение активности аланиновой трансаминазы на 300 % и более) при нестойкой компенсации функции печени — вялость психомоторных реакций, снижение свертывания крови, потребовавшее медикаментозной коррекции в предоперационный период.
Учитывая полученные результаты, считаем противопоказанным выполнение денервации печеночной артерии при хроническом активном гепатите и нестойкой компенсации функции печени.
Хороший отдаленный результат отметили у 85,6 % больных, оперированных на фоне клинически выраженной желтухи, и только у 34 % больных хроническим гепатитом, у которых к моменту вмешательства желтухи не было.
Для улучшения оттока желчи считаем целесообразным сочетать денервацию печеночной артерии с перихоледохеальной неврэктомией.
Перихоледохеальная неврэктомия. После верхней срединной лапаротомии рассекают брюшину печеночно-дуоденальной связки непосредственно ниже места слияния пузырного и общего печеночного протоков. По латеральному краю общего желчного протока несколько кзади от него отыскивают нерв, проходящий в виде 1—2 крупных стволов. Нерв иссекают на протяжении 1—1,5 см. Мобилизуют общий желчный проток на протяжении около 1,5 см на этом же уровне, берут его на турникет и отодвигают в латеральную сторону. Между общим желчным протоком и воротной веной с медиальной стороны отыскивают второй нерв, также проходящий в виде 1—2 стволов. Нерв иссекают на протяжении 1—1,5 см. Турникет удаляют. В подпеченочное пространство перемещают большой сальник, брюшную полость ушивают наглухо.
Атипичную резекцию печени выполняют для усиления регенераторных процессов в органе. В зонах, в которых допустимо выполнение атипичных резекций (см. главу «Опухоли печени»), иссекают участок ткани массой 100—200 г. После обработки раневой поверхности к ней подводят перчаточно-трубчатый дренаж.
Исходя из того что каждый сегмент печени имеет автономное кровоснабжение, для стимуляции регенерации гепатоцитов предложили иссекать небольшие участки паренхимы в различных сегментах печени (Ю. И. Малышев и соавт., 1978). Авторы в эксперименте доказали, что при такой методике удаление 0,6 % массы печени для стимуляции регенераторных процессов эквивалентно краевой резекции 7 % массы печени.
Оментогепатопексия заключается в том, что после верхней срединной лапаротомии скальпелем скарифицируют или диатермокоагулятором коагулируют серозную оболочку печени на всей диафрагмальной поверхности ее. Большой сальник заворачивают и фиксируют отдельными кетгутовыми швами к печени.
Операции, влияющие на портальное кровообращение. Сосудистые портокавальные анастомозы являются наиболее эффективными в снижении давления в воротной вене. Различают: 1) прямые портокавальные и мезентерикокавальные анастомозы; 2) спленоренальные анастомозы; 3) другие сосудистые анастомозы.
Сосудистые портокавальные анастомозы накладывают при уровне давления в воротной вене не менее 250 мм вод. ст. и градиенте давления между воротной и нижней полой венами не менее 10 мм вод.ст.
Портокавальный анастомоз может быть наложен по типу «бок в бок», «конец в бок» или «два конца в бок».
Методика операции. Положение больного на спине с приподнятым правым боком на 30° над уровнем стола. Операционный доступ — верхняя срединная лапаротомия или клюшкообразный разрез брюшной стенки.
Широко мобилизуют двенадцатиперстную кишку с головкой поджелудочной железы. Рассекают забрюшинную фасцию и выделяют переднюю поверхность и боковые стенки нижней полой вены на протяжении от почечных вен до нижней поверхности печени. Затем рассекают брюшину по латеральному краю печеночно-дуоденальной связки. Пересекают нерв, идущий по латеральному краю общего желчного протока. Последний выделяют, берут на турникет и смещают влево. После этого становится доступной манипуляциям воротная вена. Можно также выделять воротную вену со стороны задней поверхности ее, предварительно приподняв и сместив медиально двенадцатиперстную кишку и головку поджелудочной железы.
Создание соустья по типу «бок в бок» начинают с бокового отжатия стенок сосудов, не прерывая полностью кровоток в них (рис. 31).
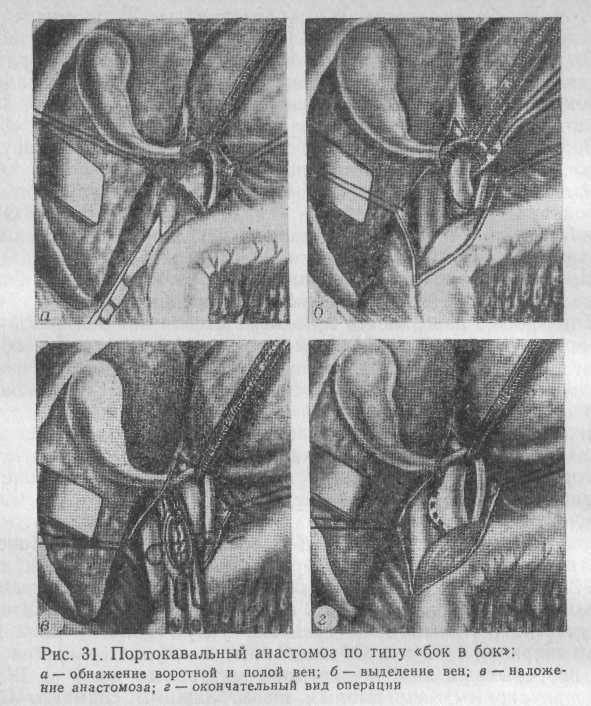
Зажимы сближают, в отжатом участке полой вены иссекают овальное окно длиной до 2 см, шириной 0,3—0,5 см. В отжатом участке воротной вены иссекают узкую полоску длиной до 2 см и шириной 1—2 мм. Образованные в сосудах отверстия сшивают непрерывным выворачивающим матрацным швов по Blalock или циркулярным непрерывным швом. Зажимы снимают. После окончательного гемостаза в зоне анастомоза укладывают на прежнее место головку поджелудочной железы и двенадцатиперстную кишку; последнюю фиксируют отдельными швами к париетальной брюшине.
Однако иногда не удается сблизить воротную и нижнюю полую вены настолько, чтобы можно было наложить анастомоз между ними.
В нашей клинике разработана и применяется методика порто-кавального шунтирования протезом. Принцип метода заключается в том, что при значительном диастазе между воротной и нижней полой венами для соустья используют аортальный протез, который одним концом вшивают в бок воротной, а вторым — в бок нижней полой вен.
Портокавальный анастомоз по типу «конец в бок» выполняют следующим образом (рис. 32).

После выделения нижней полой и воротной вен последнюю пересекают на уровне бифуркации ее. Проксимальный (печеночный) конец перевязывают. Выполняют боковое отжатие передней стенки нижней полой вены, иссекают участок ее и формируют соустье между образованным отверстием и дистальным концом воротной вены.
Создание анастомоза по типу «два конца в бок» отличается от предыдущего тем, что печеночный конец воротной вены не перевязывают, а используют для наложения отдельного соустья. Вначале накладывают анастомоз нижней полой вены с печеночным концом воротной вены, а затем — анастомоз нижней полой вены с дистальным концом воротной. Расстояние между анастомозами обычно составляет 5—10 мм.
Портокавальные анастомозы по типу «конец в бок» и «два конца в бок» менее подвержены тромбированию, нежели анастомоз по типу «бок в бок».
Анастомоз по типу «конец в бок» можно выполнять при выраженном ретроградном токе крови из печени, устанавливаемом после пересечения воротной вены. При отсутствии или незначительном ретроградном кровотоке необходимо накладывать анастомоз по типу «два конца в бок».
Порторенальный анастомоз накладывают следующим образом. После лапаротомии и выделения воротной вены мобилизуют нижнюю полую вену до места впадения в нее почечной вены. Выполняют нефрэктомию, после чего культю почечной вены вшивают в воротную вену по типу «конец в бок». Операцию можно технически выполнять с использованием как правой, так и левой почечных вен. Однако необходимость удаления почки резко ограничивает применение этого метода.
Мезентерикокавальные анастомозы. Впервые такую операцию выполнил Н. А. Богораз в 1912 г.
Методика операции. После срединной или правосторонней трансректальной лапаротомии поперечную ободочную кишку поднимают вверх, а брюшину у корня брыжейки ее рассекают поперечно на протяжении 8—10 см таким образом, чтобы 2/3 разреза находились справа от верхних брыжеечных сосудов. Находят верхнюю брыжеечную вену на уровне прохождения ее над двенадцатиперстной кишкой и выделяют на протяжении 4—6 см. Вена расположена справа от одноименной артерии. Смещают нижнюю горизонтальную часть двенадцатиперстной кишки вверх и выделяют нижнюю полую вену на протяжении 4—б см. Этот уровень соответствует месту впадения в полую вену почечных вен.
Затем приступают к наложению мезентерикокавального анастомоза по одной из методик.
Н. А. Богораз пересекал верхнюю брыжеечную вену ниже места впадения в нее правой ободочной вены и анастомозировал дистальный конец с нижней полой веной по типу «конец в бок».
Существует метод, согласно которому нижнюю полую вену пересекают ниже уровня впадения в нее почечных вен. Периферическую культю лигируют, а центральную вшивают в верхнюю брыжеечную вену по типу «конец в бок». Для предупреждения сдавления анастомоза нижней горизонтальной частью двенадцатиперстной кишки предложено формировать соустье по типу «бок в бок» после предварительного пересечения кишки и восстановления ее проходимости (Maillard и со-авт., 1971). С этой же целью формируют анастомоз при помощи протеза (рис. 33),
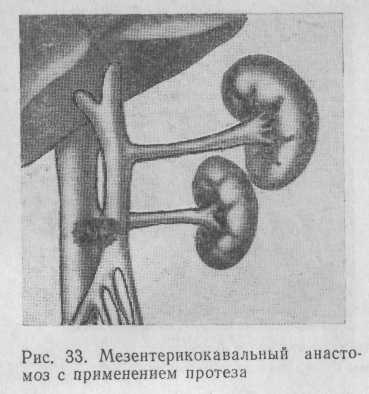
проводя последний между поджелудочной железой и двенадцатиперстной кишкой. Однако такая методика проведения протеза чревата опасностью развития послеоперационного панкреатита, поэтому предложено проводить протез справа от двенадцатиперстной кишки, предварительно сместив ее влево.
Вместе с тем, опыт реконструктивной хирургии брюшной части аорты свидетельствует о высокой вероятности пролежня протеза в кишку, если между ними нет прослойки брюшины. Это необходимо учитывать при выполнении мезентерикокавальных анастомозов с использованием протеза.
Предложение накладывать мезентерикоренальный анастомоз по типу «конец в конец» с левой почечной веной мало пригодно для практики, поскольку связано с необходимостью удаления почки.
Спленоренальные анастомозы могут быть выполнены по типу ««конец в конец», «конец в бок» и «бок в бок».
Методика операции. Операционный доступ — клюшкообразный разрез с пересечением левой прямой мышцы живота. Выделяют и перевязывают селезеночную артерию в воротах селезенки. Производят спленэктомию с максимальным щажением селезеночной вены. Далее по методике Wipple удаляют левую почку и селезеночную вену анастомозируют с почечной по типу «конец
п конец». Отрицательным моментом операции является необходимость удаления почки. Избежать ее можно при пересечении почечной вены между левыми яичковой (яичниковой) и надпочечной венами. Центральную культю вены используют для наложения спленоренального анастомоза, а периферическую перевязывают. Функция левой почки при этом нарушается незначительно.
Спленоренальный анастомоз по типу «конец в бок» также начинают с перевязки селезеночной артерии, удаления селезенки и выделения селезеночной вены. Далее рассекают околопочечную фасцию и выделяют левую почечную вену на протяжении 3—5 см. На этом участке производят боковое отжатие стенки вены, часть ее иссекают и формируют соустье между центральной культей селезеночной вены и образованным отверстием в левой почечной вене.
При наложении анастомоза по типу «бок в бок» селезеночную вену выделяют на задне-нижней поверхности поджелудочной железы. Для этого поднимают поперечную ободочную кишку на уровне хвоста поджелудочной железы, параллельно ему производят разрез брюшины длиной 8—10 см. Тупо отслаивают хвост поджелудочной железы вверх и приподнимают его. Селезеночную вену выделяют вплоть до ворот селезенки. Рассекают капсулу левой почки и выделяют левую почечную вену. Производят боковое отжатие стенок обеих вен, иссекают участки их на протяжении 1,5—2 см шириной около 2 мм, отверстия сближают и накладывают анастомоз. Диаметр соустья должен быть не менее 1 см во избежание тромбирования его.
В тех ситуациях, когда сближение селезеночной и левой почечной вен затруднено, используют артериальный протез для создания анастомоза.
Использование почечной вены для спленоренального анастомоза иногда оказывается невозможным из-за рассыпного типа строения ее. В этой ситуации можно соединять селезеночную вену непосредственно с нижней полой.
Дистальный спленоренальный анастомоз по типу «конец в бок» предложен W. D. Warreu и соавторами (1967). Методика операции заключается в перевязке левой желудочной вены у места впадения ее в воротную (или селезеночную) вену, выделении и пересечении селезеночной вены возможно ближе к месту слияния ее с верхней брыжеечной веной. После этого центральный конец селезеночной вены перевязывают, а периферический анастомозируют с левой почечной веной по типу «конец в бок».
Эффективность портокавальных сосудистых анастомозов иллюстрируется следующими цифрами. Непосредственно после их выполнения давление в воротной вене снижается в среднем на (9,7± ±5,8) мм вод. ст. (L. Leger и соавт., 1970). Операции сопровождались снижением печеночного кровотока с 1261 до 671 мл/мин, при
этом 37 % крови подвергалось внутрипеченочному шунтированию (A. Meheon и соавт., 1979). Спадение варикозно расширенных вен пищевода после наложения портокавальных анастомозов наступило у 73 % больных, спленоренальных — у 22 % (P. Palmer, 1966). Рецидивы кровотечения по сводной статистике отмечены после 131 мезентерикокавального анастомоза у 17,6 % больных, после 744 спленоренальных анастомозов — у 25,8 % (К. Hoffman и соавт., 1971).
Образование портокавальных сосудистых анастомозов сопровождается значительным снижением печеночного кровотока, что оказывает отрицательное действие на ее функциональные возможности. Этим объясняется высокая частота развития психических расстройств в послеоперационный период, достигающая, по данным R. H. Bell и соавторов (1981), 31,5 %.
Учитывая наличие хронической гипоксии печени при циррозе и ухудшение кровообращения в ней после сосудистых портокавальных анастомозов, патогенетически обосновано сочетание их с артериализацией печени. В то же время, в связи с недостаточной изученностью последних, считаем допустимым подобное сочетание по строгим показаниям, а именно — при циррозе печени с высоким давлением в воротной вене с частым кровотечением из вен пищевода и желудка, когда узкая селезеночная вена или ее тромбоз исключают наложение спленоренального анастомоза, а функции печени находятся в состоянии нестойкой компенсации. По описанным показаниям мы выполнили портокавальный анастомоз по типу «конец в бок» в сочетании со спленоумбиликальным артериальным анастомозом по типу «конец в конец» 2 больным. Одна больная умерла на 3-й сутки после операции; на вскрытии выявлен тромбоз артериального анастомоза. У другой больной отдаленный результат операции хороший.
Всего нами выполнено 129 сосудистых портокавальных анастомозов. Непосредственная послеоперационная летальность составила 14%.
Изучение непосредственных результатов различных видов сосудистых анастомозов при синдроме портальной гипертензии показало, что после прямых портокавальных анастомозов из 14 больных умерли 5, а после спленоренальных анастомозов из 53 больных умерли 8, причем у всех умерших последней группы анастомоз был сформирован по типу «конец в бок» с удалением селезенки. Учитывая полученные результаты, мы с 1974 г. предпочитаем выполнять спленоренальный анастомоз по типу «бок в бок» или дистальный спленоренальный анастомоз по Warren.
Ангиографическое исследование после наложения сосудистых портокавальных анастомозов произвели L. Possati и соавторы (1981). У 20 из 27 больных установлено увеличение диаметра печеночной артерии и внутрипеченочных артериальных ветвей.
В отдаленные сроки после операции при функционирующем анастомозе наблюдали аневризмоподобное расширение нижней полой вены.
Наложение дистального спленоренального анастомоза в эксперименте приводило к увеличению активности митохондрий гепатоцитов на 150 %, чего не наблюдалось после спленокавального анастомоза (Y. Yamaoka и соавт., 1978).
Операции при артериовенозных свищах заключаются в резекции участков сосудов, несущих свищ, с последующим восстановлением их проходимости (Н. Bisler и соавт., 1979). Авторы подчеркивают, что все варикозно расширенные вены должны быть иссечены, ибо после операции в результате резкого снижения ве-нозного давления они послужат местом образования множественных тромбов. При локализации артериовенозного свища в толще печени или селезенки авторы рекомендуют производить резекцию этого участка органа.
Операции при надпеченочном блоке портальной системы (синдроме Budd—Chiari). В тех случаях, когда возможна полноценная хирургическая коррекция первичного процесса, обусловившего возникновение этого заболевания, специального лечения синдрома портальной гипертензии не требуется. Хирургическая коррекция первичного патологического процесса может заключаться в иссечении забрюшинных кист или опухолей, резекции печени с удалением кист или опухолей, рассечении мембраны нижней полой вены. Однако, если такое вмешательство невозможно, необходимо наложение сосудистого анастомоза для устранения гипертензии в системе воротной вены.
Портокавальный анастомоз по типу «бок в бок» показан в тех случаях, когда синдром Budd—Chiari вызван нарушением проходимости на уровне печеночных вен. Проходимость нижней полой вены подтверждается венограммой. Техника наложения анастомоза не отличается от описанной выше.
О 6 операциях портокавального шунтирования при синдроме Budd—Chiari сообщили М. J. Orloff и К. Н. Johansen (1978). Умер 1 больной, которому вмешательство выполнили на фоне частичного тромбоза нижней полой вены. У остальных больных наступила полная ремиссия, исчезли желтуха и асцит, размеры печени и селезенки уменьшились до нормальных, при повторном гистологическом исследовании признаков некроза печени не обнаружено.
Экспериментальные исследования на собаках показали, что портокавальный анастомоз по типу «конец в бок» не приводит к излечению, в то время как наложение анастомоза по типу «бок в бок» дает выраженный лечебный эффект.
Мезентерикопредсердное шунтирование показано в тех случаях, когда синдром Budd—Chiari обусловлен тромбозом нижней полой вены (J. L. Camoron, W. С. Moodrey, 1978).
Методика операции, Операционный доступ — верхняя срединная лапаротомия. Поднимают поперечную ободочную кишку и рассекают брюшину над верхнебрыжеечными сосудами. Выделяют верхнюю брыжеечную вену непосредственно над двенадцатиперстной кишкой и на этом участке после бокового отжатия стенки вены накладывают анастомоз с аортальным протезом диаметром 16 мм. Через окно в бессосудистой зоне брыжейки поперечной ободочной кишки и желудочно-ободочной связки протез проводят позади ободочной кишки и впереди желудка к мечевидному отростку. Тупым путем создают канал в переднее средостение. Производят правостороннюю торакотомию, вскрывают полость перикарда. Протез проводят в полость перикарда и после бокового отжатия стенки правого предсердия накладывают анастомоз шунта с предсердием. Путем пункции шунта и снятия зажима с верхней брыжеечной артерии заполняют протез кровью и устраняют из него воздух. После этого снимают зажим с правого предсердия.
Анастомоз левой общей подвздошной вены с правым предсердием протезом диаметром 16 мм с дополнительным вшиванием протеза диаметром 10 мм между верхней брыжеечной веной и наложенным ранее шунтом выполнили J. E. Choprnan и J. L. Ochs-ner (1978). Ближайший и отдаленный результаты операции хорошие.
В тех случаях, когда синдром Budd—Chiari сопровождается диссеминированным тромбозом вен воротной системы, объем оперативного вмешательства ограничивают, создавая органные анастомозы. Одна из подобных методик — спленопневмопексия (Н. Akita, К. Sakoda, 1980).
Одностороннюю портализацию надпочечниковой и почечной крови для лечения хронического гепатита предложили А. П. Тор-гунаков и соавторы (1984). Сущность операции заключается в наложении анастомоза между левой почечной и воротной венами по типу «конец в бок». При этом почечную вену пересекают вблизи нижней полой вены таким образом, чтобы левая надпочечниковая вена оказалась дистальнее места пересечения, то есть чтобы кровь из левого надпочечника оттекала в воротную вену.
Авторы выполнили подобную операцию у 6 больных и отметили положительный эффект. По мнению авторов, эффект операции зависит от поступления в печень надпочечниковой крови, насыщенной противовоспалительными гормонами, увеличением содержания кислорода в портальной крови. Для усиления кровотока в печени перевязывают селезеночную артерию в средней трети ее. При угрозе развития асцита или транзиторном асците авторы рекомендуют дополнять операцию удалением правого надпочечника, что усиливает выведение натрия из организма (А. П. Торгунаков, 1982).
Артериализация печени предложена для усиления кровотока в печени после сосудистых портокавальных анастомозов. Существует несколько методик артериализации печени. Шунтирование синтетическим протезом между аортой и центральным концом воротной вены выполнили Maillard и соавторы (1970). Трансплантат из большой подкожной вены вшивали между общей подвздошной или подвздошно-толстокишечной артерией и центральной культей воротной вены (Motzanden и Consigio, 1971). Burlui и соавторы (1968) накладывали анастомоз между пупочной веной и селезеночной артерий. Имплантацию селезеночной артерии в паренхиму печени предложил Fujishiro (1964).
Однако вопрос о целесообразности артериализации печени до настоящего времени не решен. Известно, что повышение давления в воротной вене сопровождается повреждением гепатоцитов. Кроме того, установлено, что основные факторы, оказывающие стимулирующее влияние на регенерацию гепатоцитов, поступают именно с кровью воротной вены. Эти вопросы требуют дальнейшего изучения.
Ограничение притока крови в портальную систему. Для уменьшения притока крови и снижения давления в воротной вене было предложено перевязывать селезеночную, желудочные и желудоч-но-сальниковые артерии, производить деваскуляризацию кардиаль-ного отдела желудка, нижнего отдела пищевода, вен нижней поверхности диафрагмы и др. Однако эффект операции в большинстве наблюдений незначителен и нестоек.
Не получила применения и перевязка печеночной артерии. Предполагалось, что уменьшение наполнения синусов печени артериальной кровью вызовет усиление портального кровотока. Однако существенного понижения давления в воротной вене после перевязки печеночной артерии не происходит. Так, после перевязки собственной печеночной артерии давление в воротной вене снижается на 15 % (Р- D. J. Richardoson, P. I. Withrington, 1981). Кроме того, у больных циррозом печени такое вмешательство связано с высоким риском печеночной недостаточности; летальность достигает 40,5 % (Г. Г. Караванов, М. П. Павловский, 1968).
Органные анастомозы предложены для создания оттока крови из системы воротной вены путем образования искусственных сращений между органами. Было разработано большое количество вмешательств подобного рода, но большинство из них не нашло широкого применения из-за малой эффективности. Наиболее известными являются оменторенопексия, оментогепатодиафрагмопексия, перемещение селезенки в плевральную полость или в забрюшинное пространство.
Оменторенопексия впервые выполнена П. А. Герценом в 1913 г.
Сущность операции заключается в том, что после лапаротомии производят декапсуляцию почки, окутывают ее большим сальником и фиксируют в таком положении.
Оментогепатодиафрагмопексия отличается от оментогепатопексии тем, что дополнительно повреждают брюшину на нижней поверхности диафрагмы металлической щеткой или химическими агентами, а затем фиксируют к ней сальник редкими швами.
Операция Оппеля в модификации Шалимова (рис. 34)
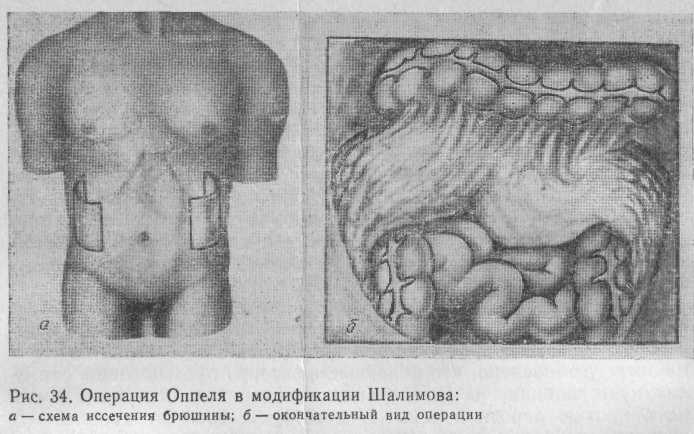
заключается в иссечении боковых отделов париетальной брюшины шириной 12—18 см на протяжении от диафрагмы до таза, широком двустороннем вскрытии забрюшинного пространства с обнажением нижней полой вены и ее ветвей. Одну половину большого сальника подводят к крупным венам забрюшинного пространства, а другой окутывают нисходящую и сигмовидную ободочные кишки, которые перемещают в забрюшинное пространство слева.
Перемещение селезенки в плевральную полость может быть выполнено как из трансторакального доступа, так и после лапаротомии. Рассекают брюшину по нижней и задней поверхностям селезенки, рассекают в мышечной части левый купол диафрагмы и перемещают селезенку в плевральную полость. Последнюю дренируют. Диафрагму ушивают таким образом, чтобы не сдавливались селезеночные сосуды.
Перемещение селезенки в забрюшинное пространство выполняют через лапаротомный доступ. Рассекают и отслаивают брюшину позади селезенки, образуя карман. Снимают или повреждают на значительной поверхности капсулу селезенки, после чего перемеща-
ют ее в сформированный внебрюшинный карман. Брюшину поверх селезенки ушивают, избегая сдавления селезеночных сосудов.
Операцию перемещения селезенки можно сочетать с перевязкой селезеночной артерии, что дает непосредственный декомпрессионный эффект.
Оригинальной по замыслу является операция спленогепатопластики, при которой верхний полюс селезенки вводят в канал, образованный в левой доле печени. При этом создается дополнительный артериальный и венозный приток к печени.
Снижение давления в воротной вене после создания органных анастомозов незначительно. Положительный эффект подобных пмешательств, очевидно, связан с улучшением оттока лимфы из органов брюшной полости (М. Д. Пациора, 1971). Преимуществом операций, органного анастомозирования является их малая травматичность, в связи с чем они выполнимы при нестойкой компенсации функции печени.
Наложение органных анастомозов мы считаем оправданным при: 1) невозможности создания сосудистых анастомозов из-за кавернозной трансформации воротной вены, тромбоза или малого диаметра сосудов; 2) отсутствии достаточных показаний к наложению сосудистых анастомозов — низком давлении в воротной ве не, отсутствии варикозного расширения вен пищевода и желудка, течении заболевания без кровотечения; 3) наличии противопоказания к наложению сосудистых анастомозов—нестойкой компенсации функции печени. Из методов создания органных анастомозов предпочтение отдаем операции В. А. Оппеля в модификации А. А. Шалимова.
Поскольку наложение органного анастомоза не сопровождается значительным снижением давления в системе воротной вены, считаем целесообразным дополнять операцию вмешательством, уменьшающим приток крови в органы брюшной полости. Чаще всего прибегаем к перевязке селезеночной артерии.
Спленэктомия при синдроме портальной гипертензии показана лишь при: 1) фиброаденозном превращении селезенки; 2) явлениях гиперспленизма; 3) тромбозе селезеночной вены.
Методика операции. Операционный доступ — верхнесрединная лапаротомия или клюшкообразный разрез с поворотом влево. Рассекают желудочно-селезеночную связку на небольшом протяжении в наиболее доступной ее части. Выделяют и перевязывают селезеночную артерию вблизи ворот селезенки. После этого полностью пересекают желудочно-селезеночную связку. Далее выделяют и перевязывают селезеночную вену в воротах селезенки. Рассекают брюшину по нижней, а затем и по задней поверхностям селезенки, выводят ее в рану и удаляют. Отдельными швами восстанавливают целость париетальной брюшины. Поддиафрагмальное пространство дренируют перчаточно-трубчатым дренажем, который выводят через контрапертуру в левом подреберье.
Необходимо учитывать, что удаление селезенки при синдроме портальной гипертензии неизбежно приводит к усилению кровотока через вены кардиалыюго отдела желудка и нижней части пищевода. Поэтому во избежание разрыва указанных вен и кровотечения в ранний послеоперационный период целесообразно дополнять спленэктомию вмешательством, направленным на разобщение кровотока по перечисленным сосудам.
Вмешательства на расширенных венах пищевода и желудка нередко выполняют из трансторакального доступа. Применение его обусловлено стремлением избежать необходимости разделения многочисленных сращений в брюшной полости, что при синдроме портальной гипертензии очень трудоемко и связано с большой кровопотерей. Трансторакальный доступ к пищеводу осуществляют путем левосторонней торакотомии по седьмому — восьмому межреберью.
Прошивание вен пищевода можно выполнить несколькими методами. Рассечение пищевода и прошивание варикозно расширенных вен отдельными кетгутовыми швами рекомендовал Tanner (1950). Целость стенки пищевода восстанавливали трехрядным швом: слизистую оболочку ушивали непрерывной кетгутовой нитью, а мышечную оболочку — отдельными нерассасывающимися швами. Для полной облитерации вен авторы рекомендуют вводить в них 66 % раствор глюкозы.
Разработаны методики прошивания варикозно расширенных вен пищевода снаружи, без вскрытия просвета его или с рассечением только мышечной оболочки. Для большей надежности швы накладывают в несколько слоев или же по спирали.
Однако описанная операция оказалась малоэффективной, поскольку в отдаленные сроки происходило расширение мелких вен, не захваченных в швы, что приводило к рецидиву варикозного расширения вен.
Учитывая это, предложено полностью пересекать пищевод в наддиафрагмальной части с последующим восстановлением проходимости его двухрядным швом (Tanner, 1950).
В связи с тем что в мышечном слое пищевода варикозного расширения вен практически не бывает, предложено не пересекать его полностью, а рассекать продольно (Walker, 1960). Затем слизистую оболочку циркулярно рассекают и сшивают непрерывным швом, а на продольный разрез мышечной оболочки накладывают отдельные швы.
Эндоскопическое склерозирование вен пищевода представляет своеобразный вариант изолированного вмешательства на варикозно расширенных венах пищевода. Методика его заключается в том, что под местной анестезией гибким эзофагоскопом проникают в пищевод и поэтапно вводят по 3—8 мл склерозирующего вещества. В зависимости от химической природы вещества его вводят непосредственно в варикозно расширенные вены или в толщу слизистой оболочки пищевода. Для инъекции непосредственно в вены применяют 66 % раствор глюкозы, 1 % или 3 % раствор тромбова-ра и др. (М. Д. Пациора и соавт., 1980). Склерозирования клетчатки пищевода достигали введением в нее смеси фенола и арахисового масла, жидкого парафина и бензинового спирта, скипидарного масла и двойного уксуснокислого аминоазотолуола (Н. Denk, 1977; Н. Hansen и соавт., 1981). В клинике КНИИКЭХ апробировано введение в просвет варикозно расширенных вен ферромагнитной жидкости с удержанием ее на месте инъекции самарий-кобальтовыми магнитами в течение 8—12 сут.
Анализ эффективности склеротерапии у 511 больных представил Н. Denk (1977). Непосредственная летальность составила 16,5 %. Отсутствие рецидивов в течение 5 лет после лечения отмечено у 55 % больных, рецидивирующее кровотечение с летальным исходом — у 15%. Непроходимость пищевода, потребовавшая бужирования, развилась у 2 больных. В целом результаты эндоскопического склерозирования соответствуют результатам трансторакального прошивания вен пищевода.
Однако изолированные вмешательства на пищеводе не избавляют больного от рецидивов кровотечения. Кроме того, такие операции недостаточно эффективны при их выполнении на высоте кровотечения. Вследствие этого их обычно дополняют вмешательством на кардиальной части желудка, которые осуществляют из торакоабдоминального или из лапаротомного доступа.
Мы считаем допустимым ограничение объема операции трансторакальным прошиванием или лигатурным пересечением пищевода только при наличии ургентных показаний к хирургическому лечению и высоком риске операции из-за нестойкой компенсации функции печени или при значительном спаечном процессе в брюшной полости у многократно оперированных больных.
Плановые операции производит из лапаротомного доступа.
Пересечение кардиальной части желудка, желудочно-печеночной и желудочно-селезеночной связок выполнял Tanner (1950). В различных модификациях эта операция получила довольно широкое применение (Б. А. Петров, Э. И. Гальперин, 1959; П. Н. Напалков, 1971).
Лигатурное пересечение пищевода на кольце. Операция может быть выполнена как из трансторакального, так и из лапаротомного доступа. Сущность ее заключается в том, что в пищевод на зонде вводят металлическое кольцо с бороздой по наружной окружности его. На уровне борозды пищевод пережимают на кольце толстой нитью из нерассасывающегося материала. Место прохождения нити инвагинируют отдельными швами, соединяющими участки мышечной оболочки пищевода, расположенные выше и ниже нити.
Стенка пищевода в месте наложения лигатуры некротизирует-ся и кольцо выходит через кишечник естественным путем. Однако за это время происходит тромбоз вен по всему периметру пищевода.
В клинике К.НИИКЭХ применяется комбинированное вмешательство, заключающееся в пересечении и прошивании брюшной части пищевода аппаратом ПКС-25 в сочетании с перевязкой селезеночной артерии и созданием органного анастомоза.
Методика операции. Доступ — верхне-срединная лапаротомия. Выделяют брюшную часть пищевода с освобождением его и кардиальной части желудка от окружающей клетчатки. Между двух нитей-держалок производят гастротомию на 8—10 см ниже пищеводно-желудочного соединения. Через разрез в просвет желудка вводят аппарат ПКС-25 и проводят его в пищевод. Ниже головки на штоке аппарата капроновой нитью перевязывают пищевод. Смыкая бранши рукоятки аппарата, одномоментно пересекают и сшивают пищевод. Линию пересечения дополнительно укрывают рядом узловых швов мышечной оболочки пищевода. Ушивают место гастротомии. Перевязывают селезеночную артерию и создают органоанастомоз по типу операции Оппеля—Шалимова.
Перевязку варикозно расширенных вен желудка и пищевода после гастротомии производили Б. А. Петров и Э. И. Гальперин (1963). Со стороны слизистой оболочки расширенные вены захватывают зажимом Люэра и перевязывают. Слизистую оболочку и подслизистый слой прошивают кетгутом по задней стенке желудка. Переднюю стенку желудка ушивают двухрядным швом. Модификацию этой операции применяли М. Д. Пациора и соавторы (1967).
Такие операции, как гастрэктомия, резекция нижней трети пищевода и кардиальной части желудка, интерпозиция сегмента тонкой или толстой кишки на место пищевода не нашли широкого применения вследствие большой травматичности.
Неудовлетворительные результаты операций пересечения пищевода и желудка связаны в основном с высокой частотой рецидивов кровотечения.
Обширную деваскуляризацию нижней половины пищевода, верхней половины желудка в сочетании с пересечением и сшиванием пищевода, селективной ваготомией, пилоропластикой и спленэктомией предложили выполнять М. Suginra и соавт. (1973). Вмешательство производят из двух доступов — абдоминального и трансторакального.
Мы модифицировали описанную операцию. Вмешательство выполняем из абдоминального доступа. Для обеспечения доступа к нижней половине пищевода производим диафрагмокруротомию.
Деваскуляризацию желудка и пищевода осуществляем с сохранением стволов блуждающих нервов по принципу проксимальной селективной ваготомии. Пересечение и прошивание пищевода производим аппаратом СПТУ или ПКС-25. Селезенку не удаляем.
Поулодифицированной методике оперировали 6 больных. Непосредственные результаты операции хорошие во всех наблюдениях. Рецидивов кровотечения в сроки до 9 мес после операции не отмечено.
Окклюзию кровоточащих вен пищевода производят после чрес-кожной пункции воротной вены и избирательного введения в сосуды желатиновых капсул или подобных предметов. Эффективный гемостаз этим методом достигнут у 33 из 38 больных (W. С. Widrich и соавт., 1978). Представляется перспективным использование метода при кровотечении у больных с высоким риском трансабдоминального вмешательства.
Реинфузия асцитической жидкости может быть выполнена как последняя мера консервативного лечения асцита. Эффективность такой реинфузии послужит основанием для выполнения или отказа от постоянного перитонеовенозного шунтирования.
Методика реинфузии заключается в том, что в асептических условиях пунктируют брюшную полость, по игле вводят проводник, иглу удаляют, а по проводнику вводят катетер. Последний соединяют со стерильным флаконом. Собирают асцитическую жидкость, а затем переливают ее внутривенно этому же больному.
Реинфузия асцитической жидкости усиливает диурез, повышает чувствительность почек к мочегонным лекарственным препаратам (В. П. Сухорукое и соавт., 1980). Авторы считают, что с использованием реинфузии следует полностью отказаться от парацентеза и эвакуации жидкости как метода лечения асцита.
Мы выполнили реинфузию асцитической жидкости 12 больным. Хороший эффект отмечен у 7. Реинфузия сопровождалась ознобом у 5 больных, что потребовало уменьшения скорости переливания или прекращения его. Разовый объем реинфузии составил от 300 до 2800 мл.
Операции, направленные на устранение асцита. Операция Кальба (1916) заключается в том, что латеральнее восходящей и нисходящей ободочных кишок в области бедренных треугольников иссекают участки париетальной брюшины и мышц диаметром до 3—4 см. Лапаротомный разрез ушивают наглухо. После этой операции асцитическая жидкость всасывается подкожной клетчаткой.
Более расширенное вмешательство выполнял В. А. Оппель. Он иссекал париетальную брюшину и околопочечную фасцию вверх до почки и вниз до подвздошной кости. Мышечную щель в области бедренного треугольника тупо расслаивал. Для образования большей поверхности всасывания асцитической жидкости автор обнажал околопочечную и околопузырную клетчатку.
Однако эффект подобных операций непродолжителен. В эксперименте доказано, что всасывание асцитической жидкости прекращается через 3—4 нед (А. И. Клопцов, 1953).
Отведение асцитической жидкости непосредственно в сосудистое русло предложил Rontte (1907). Большую подкожную вену выделяют на протяжении 10—15 см и пересекают, периферический конец ее перевязывают, а центральный заворачивают кверху и вшивают в отверстие брюшины над паховой связкой. Однако, как показали наблюдения, вена вскоре обли-терируется и отток асцитической жидкости прекращается.
Попытки отведения асцитической жидкости в мочевые пути путем наложения анастомозов брюшины с мочеточником или с почечной лоханкой оказались неэффективными и вследствие высокой частоты развития мочевого перитонита. Неэффективно и выведение в брюшную полость сегмента тощей кишки в расчете на абсорбцию асцитической жидкости слизистой оболочкой.
Использование специальных шунтов из силиконизированных синтетических масс для перитонеовенозного шунтирования нашло применение в последние годы. Наиболее часто применяют шунты, предложенные Н. U. Le Veen (1974), R. H. Sund и J. В. Neukirk (1979).
Конструкция шунтов рассчитана на то, чтобы при повышении давления асцитической жидкости до 2—5 мм рт. ст. (0,3—0,7 кПа) последняя проходила через клапан в венозное русло.
Шунт состоит из заборной трубки длиной 20 см с множественными боковыми перфорациями, цилиндрического переходника длиной 6 см из эластического материала и отводящего катетера длиной до 70 см с танталовыми метками, нанесенными через равные промежутки. Переходник действует по принципу «невыливайки», при расположении его в подкожной клетчатке больной может массировать цилиндр, изменяя его емкость и тем самым освобождая трубки от сгустков фибрина.
Методика операции. Под местной анестезией или внутривенным наркозом производят поперечный разрез брюшной стенки в правом подреберье длиной 4—6 см. Послойно разделяют апоневроз, мышцы и предбрюшинную фасцию. На брюшину накладывают кисетный шов, в центре которого делают отверстие и через него вводят заборную трубку в брюшную полость. Кисетный шов затягивают и завязывают, герметизируя брюшину вокруг заборной трубки. Послойно ушивают мышцы, апоневроз. Под кожей живота и грудной клетки делают туннель до правой ключицы. В туннеле проводят шунт, выполняя дополнительный разрез кожи над ключицей. Разрез брюшной стенки полностью ушивают. Выделяют внутреннюю или наружную яремную вену и в нее вводят отводящий катетер. Вену перевязывают на катетере. Кожу зашивают наглухо.
В клинике КНИИКЭХ в качестве клапана используют трансплантат большой подкожной вены, содержащий естественные клапаны. Силиконизированную трубку из брюшной полости проводят подкожно до уровня ключицы, как это описано выше. Затем трубку вставляют в венозный трансплантат и лигируют на нем. Второй конец трансплантата сшивают с внутренней яремной веной.
Для успеха перитонеовенозного шунтирования необходимо соблюдение следующих условий: тщательный гемостаз во избежание образования сгустков фибрина, которые могут обтурировать шунт; герметичное закрытие брюшной полости, поскольку подтекание асцитической жидкости чревато нагноением раны и инфицированном брюшной полости. Для того чтобы обеспечить присасывающее действие катетера, рекомендуют отводящий конец его устанавливать на уровне верхней полой вены (L. Z. Hyde и соавт., 1982). Для контроля проходимости шунта вводят рентгеноконтрастное вещество и выполняют рентгенологические снимки сразу после окончания операции (J. Oosterlee, 1980).
Усиленный приток асцитической жидкости в кровяное русло может привести к развитию диссеминированного сосудистого свертывания и сердечной недостаточности в ранний послеоперационный период. Для профилактики этих осложнений в течение 3 сут после операции назначают мочегонные средства (лазикс, верошпи рон), добиваясь диуреза не менее 60 мл/ч (P. D. Greig и соавт., 1980).
В клинике КНИИКЭХ перитонеовенозное шунтирование выполнено 19 больным. Умерли сразу после операции 2 из них. Отсутствие асцита в течение 6—12 мес после операции отмечалось у 9 больных.
Лимфовенозные анастомозы накладывают после выделения на шее грудного протока. Наш опыт 18 подобных операций свидетельствует о малой выраженности и нестойкости их лечебного эффекта.
