
- •Часть I хирургия печени
- •Глава 1. Анатомия и физиология
- •Глава 2. Опухоли печени
- •Глава 3. Травматические повреждения печени
- •Глава 4. Абсцессы печени
- •Глава 5. Эхинококкоз и альвеококкоз печени
- •Глава 6. Непаразитарные кисты печени
- •Глава 7. Хронический гепатит, цирроз печени и синдром портальной гипертензии
- •Глава 8. Пересадка печени
- •Часть II
- •Глава 1. Анатомия и физиология
- •Глава 2. Аномалии развития желчевыводящих путей
- •Глава 3. Желчнокаменная болезнь и заболевания желчного пузыря
- •Глава 4. Непроходимость желчных протоков доброкачественной этиологии
- •Глава 5. Рак желчного пузыря и внепеченочных желчных протоков
Глава 3. Травматические повреждения печени
Повреждения печени относятся к тяжелым травмам. В мирное время частота их составляет 21—28 %, причем закрытые повреждения наблюдаются у 26—51 % пострадавших, колото-резаные ранения — у 46—70 %, огнестрельные — у 4—8 %.
Травматические повреждения печени встречаются в среднем у 1 на 1300 больных и в 287 из 1310 вскрытий погибших от травматических повреждений.
Чаще страдают мужчины — 4:1 (А. И. Сичкарук, 1972; А. Е. Романенко, 1978; С. А. Шалимов и соавт., 1990; R. N. Сагmana и соавт., 1982, и др.). По данным литературы, колото-резаные и огнестрельные ранения явились причиной травмы печени у 58,1 % мужчин, в то время как закрытая травма, преимущественно автодорожная, отмечена у 64,6 % женщин.
Редко разрыв печени происходит спонтанно на фоне беременности. С 1844 г. описано более 120 наблюдений подобной патологии. У большинства беременных отмечалось повышение артериального давления.
Возраст пострадавших с травмами печени составляет в среднем 29 лет — 31 год, хотя отмечены индивидуальные колебания от периода новорожденности до 81 года (Т. И. Гуляева, 1975; Z. M. Flint и соавт., 1977).
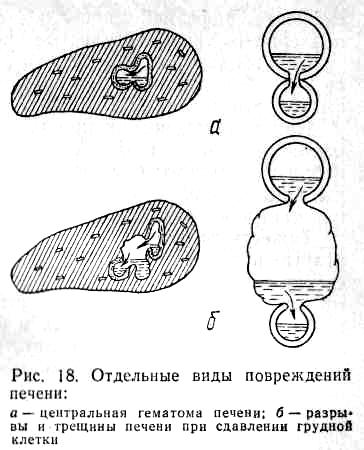
Различные виды поврежденной печени представлены на рис. 18.
Мы оперировали 83 больных с повреждениями печени в возрасте от 7 до 38 лет. Колото-резаные раны отмечались у 12 больных, огнестрельные — у 1, закрытые повреждения — у 70. Изолированная травма печени была у 59 больных, сочетанная — у 14.
Этиология и патогенез. Среди причин повреждений печени мирного времени ведущее место занимают транспортный и бытовой травматизм (72—87%), 13—22% приходится на долю промышленного травматизма. Другие причинные факторы — родовая
травма, повреждение патологически измененной печени — наблюдаются у 0,9—1,5 % больных.
Колото-резаные раны печени характеризуются длинным и узким раневым каналом, незначительным повреждением окружающей паренхимы. После извлечения ранящего предмета стенки канала смыкаются. Кровь и желчь из паренхимы печени
изливаются в свободную полость, но возможно формирование гематомы в толще органа. Объем кровопотери и желчеистечения определяется диаметром поврежденных coсудов и желчных протоков. Рваные раны являются результатом внедрения в печень небольшого предмета, двигающегося с большой скоростью. Входное отверстие часто значительно меньше, чем полость внутри печени .Окружающая раневой канал паренхима находится в состоянии контузии и парабиоза. Если повреждены крупные сосуды и желчные протоки, то происходит обильное истечение крови и желчи в брюшную полость.
В тех случаях, когдй во время первичной хирургической обработки достигнут гемостаз, но участки паренхимы, находившиеся в состоянии парабиоза, не удалены, возможно омертвение их с формированием через 10—15 сут секвестров или кисты, или абсцесса по ходу раневого канала.
Закрытые повреждения печени возникают в результате удара в живот, сдавлении тела, падения с высоты, а у новорожденных — при несоответствии размеров плода и таза матери, реанимации детей, родившихся с признаками асфиксии. Механизм закрытой травмы—сдавление, удар или противоудар. В результате травмы происходит разрыв, а при очень сильном воздействии—размозжение паренхимы печени. Возможен разрыв печени с истечением крови и желчи в брюшную полость или же центральный разрыв нарушения целости фиброзной оболочки, когда кровь и желчь
накапливаются внутри печени.
И в ряде случаев наблюдаются спонтанные разрывы печени при патологическом ее состоянии. Такие разрывы отмечены у 8 % больных с первичной карциномой печени, при токсикозе беременных, сифилисе, тифозной лихорадке, малярии. Спонтанным разрывам подвержены также сосудистые аневризмы печени.
Спонтанные разрывы печени при беременности чаще возникают во 2-м и 3-м периодах или сразу после родов. Многие авторы связывают это явление с токсемией и токсическим васкулитом.
При патологических процессах в печени значительно увеличивается ее объем и она становится более уязвимой. Достаточно небольшой травмы или резкого напряжения брюшного пресса (роды, кашель, поднятие тяжести и даже изменение положения тела), как наступает разрыв органа.
Тяжесть закрытых повреждений печени, помимо обширных разрывов паренхимы и сосудов, связана также с частыми сопутствующими повреждениями. Так, у 42 больных с закрытой травмой печени отмечено 112 сопутствующих повреждений, в то время как после 10 колото-резаных и 2 огнестрельных ранений их было 18 (М. J. Kaisaluoma и соавт., 1977).
Перечисленные обстоятельства обусловливают высокую смертность после сочетанной закрытой травмы печени (табл. 2).

У 102 пострадавших с закрытой травмой печени изолированные повреждения составили 55,8 %, сочетанные — 44,2 % (С. Д. Атаев,1975).
Из 172 пострадавших с колото-резаными ранами печени на месте происшествия погибли 21, из 107 пострадавших со слепыми огнестрельными ранениями умерли 33 (К. А. Грачев, 1972).
Высокую летальность отмечали при травме печени еще во время первой мировой войны (66,2%)- В настоящее время она несколько снизилась, но все же остается довольно высокой — 45— 60% (А. Е. Романенко, 1978). По данным Н. 3. Козлова и соавторов (1986), летальность при повреждениях печени колеблется
от 8,3 до 23 %.
Особенно тяжело протекают повреждения с глубокими разрывами паренхимы, а при полном разрыве паренхимы между долями или даже в пределах одной из долей летальность достигает 100 %. Изучив результаты хирургического лечения 239 больных с травматическими повреждениями печени, авторы установили, что при повреждениях печени в области VII i сегмента смертность и осложнения отмечаются в 71 % наблюдений, V сегмента — в 64%, IV сегмента — в 66%, VII сегмента — в 59%, II сегмента — в 23%, III сегмента — в 10%. Летальность и осложнения при повреждении левой доли наблюдаются лишь в 22 % наблюдений, в то время как при повреждении правой доли — в 78 %.
Основной причиной летальных исходов при травме печени является кровотечение (48%), реже больные умирают от перитонита (16 %) и других причин (36 %).
Массивные кровотечения, сопровождающие разрывы печени, связаны с плохой сократительной способностью паренхимы, постоянным движением печени при дыхании, отсутствием клапанов в печеночных венах и плохим их сокращением, а также с расстройством свертывания крови в связи с истечением желчи в рану. Темп и объем кровопотери зависят от калибра поврежденных сосудов.
Если повреждения крупных сосудов нет, возможна спонтанная остановка кровотечения. J. S. Aldrete и соавторы (1979) наблюдали ее у21 из 108 больных.
В результате повреждения паренхимы внутри печени могут образоваться внутрипеченочные гематомы. Jeis и соавторы (1981) Наблюдали их у 15 больных. Гематомы рассосались самостоятельно у !) больных. Значительное увеличение гематомы с нарастанием признаков анемии явилось показанием к хирургическому лечению у 2 больных, абсцесс печени — у 4. Осложнения возникают Через1—28 сут после травмы. Зависимости частоты осложнений ОТ локализации гематом не выявлено. Особо неблагоприятным в отношении прогноза оказалось сочетание гематомы и проводимой по поводу других заболеваний терапии антикоагулянтами.
Одним из тяжелых осложнений травматических повреждений печени является гемобилия. Сущность ее состоит в том, что кровь из поврежденного сосуда скапливается вокруг желчного протока и через травматический дефект стенки последнего поступает в желчевыводящие пути.
Раз возникнув, гемобилия неизменно рецидивирует до тех пор, пока не будет устранено сообщение между сосудом и желчным Протоком либо больной не погибнет от кровопотери. Такое течение болезни связывают с тем, что желчь значительно замедляет рост соединительной ткани и регенерацию паренхимы печени (P. Sandblom, V. Mizkovitch, 1977).
Медленно поступающая в желчные протоки кровь не сворачивается, а транзитом проходит в двенадцатиперстную кишку. Однако если удельный объем крови в желчных протоках превысит 70 %, происходит образование сгустков, которые вызывают обтурационную желтуху (К. A. Merendino и соавт., 1963).
Спонтанное прекращение гемобилии возможно только в тех случаях, когда причиной ее была пункционная чрескожная чреспеченочная холангиография (J. E. Loodnight, F. W. Blaisdill, 1981).
Билигемия — редкое осложнение травмы печени. Оно описано при одновременном поражении крупных печеночных вен и желчных протоков (G. Wittrin и соавт., 1978). Во время диастолы в нижней полой вене создается отрицательное давление до 5 см вод. ст., а в желчных путях в промежутках между едой давление достигает 15 см вод. ст. и более.
При наличии сообщения между печеночными венами и желчными протоками создаются условия для забрасывания желчи в кровь. Спонтанного закрытия билиовенозных свищей до настоящего времени не наблюдали.
В отдаленные сроки после закрытых травм печени возможны секвестрация, образование абсцесса или кисты по месту разрыва.
Патологическая анатомия. Большие объем и масса печени, значительная площадь соприкосновения с реберной дугой, прочность связочного аппарата, превосходящая прочность самого органа (Б. В. Петровский, 1972), являются факторами, способствующими повреждению печени даже при относительно небольшой силе внешнего воздействия.
Зависимость количества и локализации повреждений печени от характера травмы представлена в табл. 3.

Представленные данные свидетельствуют о том, что множественные повреждения печени, преимущественно расположенные в правой анатомической доле ее, сопровождаются высокой летальностью. Открытые ранения (84,4 % составили колото-резаные раны) обычно одиночные и чаще поражают левую анатомическую половину печени. Анализ клинических наблюдений и экспериментальных исследований показывает, что при закрытой травме печени разрывы ее чаще всего проходят по срединной, правой портальной и межсегментарным щелям. Только при большой силе воздействия наблюдаются разрывы крупных сосудов и желчных протоков.
Разрыв долевых ветвей воротной вены, собственной печеночной артерии и долевых желчных протоков обнаружен соответственно в 25,5, 18,9 и 17,7 % наблюдений, разрыв правой верхней печеночной, средней печеночной и левой печеночной вен — соответственно в 25,5, 12,8 и 1,5 % наблюдений (П. И. Лукьянов, 1968).
Морфологические изменения в печени при травме бывают в виде трещин, разрывов, очаговых некрозов и кровоизлияний.
Динамика патоморфологических изменений в печени после закрытой травмы изучена С. Д. Атаевьш (1975). Признаки посттравматического гепатита развиваются уже через 6 ч после травмы и прослеживаются на расстоянии до 15 см от места разрыва паренхимы. В 1-е сутки после травмы отмечаются сосудистые расстройства, начальные некробиотические и некротические изменения паренхимы печени, которые достигают максимальной выраженности к 3-5- м суткам. Проявлении репаративных процессов удается обнаружить через 10—15 сут после травмы, а окончательная нормализация структуры печени происходит спустя 30—180 сут.
Если разрывы печени сопровождаются повреждением фиброзной оболочки, то кровь и желчь обнаруживаются в брюшной полости; если повреждена и диафрагма, то последние попадут в плевральную полость. В том случае, если фиброзная оболочка не повреждена, излившиеся кровь и желчь скапливаются под ней и отслаивают ее на значительном протяжении. Субкапсулярные повреждения встречаются редко, течение их более скрытое, так как внутрибрюшное кровотечение при этом отсутствует.
Наиболее приемлемой является классификация повреждений печени, предложенная Г. Ф. Николаевым (1955), в основу которой положены как клинические, так и секционные данные.
А. Повреждения печени без нарушения целости фиброзной оболочки:
1) субкапсулярные гематомы;
2) глубокая, или центральная, гематома.
Б. Повреждения печени, сопровождающиеся нарушением целости фиброзной оболочки;
1) одиночные и множественные трещины;
2) разрывы изолированные и сочетающиеся с трещинами;
3) размозжение или расчленение печени на отдельные фрагменты;
4) разрывы и трещины печени, сопровождающиеся повреждением желчного пузыря и крупных желчных протоков;
5) изолированные повреждения желчного пузыря и внепеченочных желчных протоков.
Повреждения печени без нарушения целости фиброзной оболочки. На практике чаще приходится сталкиваться со второй фазой подобного поражения, когда подкапсулярная гематома, образовавшаяся вследствие повреждения поверхностных сосудов печени, в результате повторной небольшой травмы или сотрясения самопроизвольно вскрывается в брюшную полость, В первой же фазе такие больные чаще попадают в стационар по поводу ушиба печени или продолжают работать, испытывая небольшую боль в области правого подреберья. Общее состояние при этом существенно не нарушается.
Субкапсулярная гематома. Количество излившейся под фиброзную оболочку крови обычно небольшое, но всегда имеется хотя бы поверхностное нарушение целости паренхимы печени и поверхностных сосудов. Отслойка фиброзной оболочки происходит на небольшом протяжении, если гематома не увеличивается в результате продолжающегося кровотечения. Иногда гематома захватывает всю переднюю и диафрагмальную поверхности. Повреждение паренхимы печени бывает столь незначительным, что его иногда трудно заметить невооруженным глазом.
Г. Ф. Николаев (1955) наблюдал субкапсулярные гематомы у 5 из 260 погибших с закрытыми травмами печени.
Мы у 7 (8,4%) из 83 больных по анамнестическим данным установили, что внутрибрюшное кровотечение является результатом разрыва фиброзной оболочки уже отслоенной гематомой. Эти больные перенесли травму печеночной области за 3—4 дня до поступления в клинику. В области трещин паренхимы обнаружены участки некроза печеночной ткани. При гистологическом исследовании отмечалась лейкоцитарная реакция. У всех больных не наблюдалось кровотечения из поврежденных участков паренхимы.
Глубокая, или центральная, гематома. Из-за трудности клинической диагностики подобные повреждения печени определяются редко. Чаще всего они не являются первопричиной смерти или срочной операции. Центральную гематому печени мы заподозрили у 2 (2,4%) больных по наличию гемобилии на 2-е — 3-й сутки после тупой травмы живота.
Повреждения печени, сопровождающиеся нарушением целости фиброзной оболочки. Эта группа повреждений объединяет все ранения печени (проникающие и непроникающие) в связи с наличием общего синдрома внутрибрюшного кровотечения, с которым и приходится сталкиваться хирургу. До операции определить количество повреждений печени невозможно, их устанавливают лишь на секции или во время операции при тщательном осмотре органа.
Как и Г. Ф. Николаев (1955), мы разделили трещины и разрывы печени на 5 подгрупп в связи с их различной патологоанатомической картиной и способами хирургического лечения.
Одиночные и множественные трещины. Трещины характеризуются линейным расположением, чаще они множественные, распространяются в глубь органа вдоль соединительнотканных прослоек, отсутствует зияние краев раны. Края трещин обычно неровные, но соприкасаются, между ними отмечается небольшое скопление крови. Одиночные трещины относятся к легким повреждениям, не сопровождающимся большим кровоизлиянием в брюшную полость (больные иногда даже не попадают в операционную). Множественные трещины относятся к тяжелым, сопровождающимся массивным кровотечением. Часто они сочетаются с повреждением других органов брюшной и грудной полостей.
Повреждение правой доли печени отмечено в 14 раз чаще, чем левой, и только у 6 больных мы отметили повреждение обеих долей. Страдает больше всего диафрагмальная поверхность (88 %), затем нижняя (8 %) и обе одновременно (4 %). У большинства больных трещины были множественными. На диафрагмальной поверхности органа трещины имели поперечное направление, на нижней — продольное; длина их составляла 3—10 см, глубина — 3—5 см.
Множественность повреждений находилась в прямой зависимости от силы травмы.
Перехода трещин с одной доли на другую нами не отмечено. Отмечался лишь переход трещин с нижней поверхности на диафрагмальную, особенно в тех случаях, когда они располагались вдоль желчного пузыря.
Разрывы изолированные и сочетающиеся с трещинами. Это чаще всего зияющие раны различной глубины и протяженности, по углам переходящие в трещины. Просвет их выполнен сгустками крови и оторванными или некротизированными участками печеночной ткани. Раны, нанесенные ножом, имеют гладкие края, небольшую протяженность, но значительную глубину; часто они множественные. При них наблюдается значительное кровотечение, а в ряде случаев — истечение желчи. Огнестрельные раны напоминают разрывы, но они отличаются более круглой формой. Раневой канал выполнен размозженной и некротизированной тканью, имеются входное и выходное отверстия или ранящий снаряд находится внутри паренхимы печени. Ранения современным огнестрельным оружием имеют значительные отличия. Вследствие высокой скорости движения и плохой устойчивости в полете пуля при попадании в орган перемещается по сложным траекториям. Полость внутри органа обычно значительно больше, чем входное отверстие. Часто наблюдаются множественные разрывы печени, имеющие такую же форму, как и при закрытой травме (R. H. Carmona и соавт., 1982).
Подавляющее большинство изолированных разрывов в сочетании с трещинами локализовалось на диафрагмальной поверхности печени и имело поперечное направление. Длина ран достигала 10—25 см, глубина не превышала 5 см. Между краями ран имелось большое количество сгустков крови и оторвавшихся или почти оторвавшихся участков паренхимы печени. Масса отторгнутых частей составляла от 50 до 250 г. По краям ран в паренхиме отмечались мелкие кровоизлияния.
У 17% больных были одиночные трещины, не имеющие непосредственного отношения к разрывам печени и располагающиеся на значительном расстоянии от них.
Размозжение или расчленение печени на отдельные фрагменты. В большинстве своем эти повреждения являются несовместимыми с жизнью, и таких больных сравнительно редко доставляют в клинику в операбельном состоянии. Возникают они обычно в результате тупых травм, часто сочетаются с повреждением других внутренних органов, травмой черепа, костей, в связи с чем больные погибают на месте происшествия от тяжелого травматического шока.
Размозжение печени — один из частых видов тяжелых повреждений. Ему чаще подвергаются обе доли, которые после травмы представляют собой крупнозернистую массу, состоящую из паренхимы и крови.
Травматическое повреждение печени, сопровождающееся повреждением желчного пузыря и крупных желчных протоков, мы наблюдали у 8,3 % больных, доставленных в нашу клинику для оперативного лечения. Повреждения возникли после тупых травм значительной силы (удар тяжелым предметом, попадание под колеса автомашины, сдавление между вагонами и др.). Повреждение желчного пузыря отмечалось в виде его отрыва, пропитывания стенок кровью, разрывов со вскрытием просвета и истечением желчи в брюшную полость.
Повреждение общего желчного протока отмечено нами у 2 погибших больных, оно сочеталось с отрывом желчного пузыря и пузырного протока. Разрывы локализовались в супрадуоденальной части общего желчного протока и месте впадения в него пузырного протока. В одном случае был продольный разрыв, в другом — косопоперечный.
Изолированное травматическое повреждение желчного пузыря и внепеченочных желчных протоков, благодаря их глубокому расположению, наблюдается редко и описано в литературе как казуистика.
По данным А. С. Раренко (1978), всего в литературе описано 233 наблюдения травматических повреждений желчного пузыря, причем у 55 больных были изолированные разрывы. Автор делит повреждения желчного пузыря на 3 группы:
1) разрыв желчного пузыря;
2) отрыв желчного пузыря от печени;
3) сочетание отрыва желчного пузыря с его разрывом.
Еще реже встречаются изолированные травматические повреждения общего желчного протока. Нерр и соавторы (1964) нашли в литературе описание 61 подобного повреждения и сами наблюдали 2 таких больных.
Подобные повреждения нами обнаружены лишь у 3 умерших на секции. У 2 больных был разрыв желчного пузыря у его шейки, у 1 — полный отрыв общего желчного протока в супрадуоденальной части.
Такие повреждения возникают при тяжелых травмах, и разрыв происходит подобно разрывам полых органов (кишечник, желудок). Отрыв общего желчного протока происходит в результате резкого смещения двенадцатиперстной кишки.
У наблюдаемых нами больных повреждение желчного пузыря и общего желчного протока не было причиной смерти: 2 больных умерли от сочетанных повреждений головного мозга, у 1 больного был отрыв корня брыжейки тонкой кишки.
Таким образом чаще всего повреждения печени сопровождаются образованием изолированных разрывов в сочетании с трещинами. Эти повреждения встречаются почти одинаково часто у погибших в момент травмы и доставленных для оперативного лечения. Па втором месте по частоте находятся одиночные и множественные трещины.
Чем меньше размозженных участков печеночной паренхимы, тем быстрее происходит заживление ран. Лучше заживают колотые раны. Если поврежденной паренхимы небольшое количество, она рассасывается, и на месте кровяного сгустка образуется соединительнотканный рубец. При обширных размозжениях образуется более грубый рубец или возникает нагноение - абсцесс печени
И. Л. Криворотое, 1949; Г. Ф. Николаев, 1955). Сосуды, располагающиеся вокруг ран печени, содержат тромбы и свободно лежащие отторгнутые гепатоциты, которые иногда являются источником эмболии легочной артерии.
Клиника травматических повреждений печени разнообразна. Это обусловлено сочетанностью повреждений печени, а также осложнениями, которые возникают или сразу после травмы (кровотечение), или через некоторое время (абсцедирование, нагноение экссудата); основным осложнением, встречающимся почти у 75% больных, является шок. Он характеризуется общей слабостью, бледностью кожи и слизистых оболочек, холодным потом, частым и поверхностным дыханием, головокружением или потерей сознания, похолоданием конечностей, жаждой, понижением артериального давления, учащением пульса. Эти симптомы возникают в первые часы после травмы и затем усиливаются за счет кровотечения и перитонита. Возбуждение, отмечающееся у ряда больных в первые часы после травмы, характерно для эректильной фазы шока, которая вскоре (через 4—5 ч) сменяется торпидной и проявляется резким угнетением сознания, расстройством дыхания, падением артериального давления. Вывести больного из такого состояния крайне трудно.
Явления шока при повреждении печени являются следствием травматического раздражения рецепторов тканей грудной клетки, брюшной стенки, брюшинного покрова и самой ткани печени, а также кровотечения. Особенно выражены они при сочетанных повреждениях печени и других органов, сопровождающихся попаданием в брюшную полость желудочного или кишечного содержимого. Переломы костей таза, конечностей, ребер, повреждения легких еще больше усиливают шоковое состояние.
Признаки шока при госпитализации отмечены у 35,2—41 °/о больных с повреждениями печени (Г. А. Покровский, В. С. Дурнев, 1970; И. М. Мороз, А. С. Король, 1986; J. S. Aldrete и соавт., 1979).
Выделяют три степени шока у больных с повреждениями печени (С. Е. Incas, A. M. Ledgerwood, 1978): I степень — артериальное давление удерживается на нормальном уровне; II степень — максимальное артериальное давление менее 80 мм рт. ст., но нормализуется после восполнения объема циркулирующей крови; III степень — артериальное давление менее 80 мм рт. ст. и не восстанавливается, несмотря на внутривенное введение значительного количества жидкости. Последняя степень шока отмечена при повреждении крупных сосудов и продолжающемся кровотечении.
Тяжесть состояния при повреждении печени обусловливается не только шоком, но и величиной кровопотери, которая в свою очередь зависит как от характера повреждения, так и от времени, прошедшего с момента травмы. Наибольшая кровопотеря (до 2500 мл) отмечена при размозжении печени, наименьшая (от 50 до 100 мл)—при субкапсулярном и внутрипеченочном повреждениях.
Боль является почти постоянным симптомом повреждения печени и может быть даже при отсутствии клинических проявлений шока. Боль обычно сильная и усугубляется дыхательными движениями. Однако некоторые больные ее вовсе не ощущают. Локализация боли — правый верхний квадрант брюшной полости с иррадиацией в правое плечо, лопатку, правую половину шеи. Разрывы выпуклой части печени сопровождаются сильной болью в области правой лопатки и нижней половины грудной клетки. При повреждении нижней поверхности печени боль локализуется в печеночно-пупочной области (Г. Мондор, 1939).
При центральном разрыве печени с повреждением желчных протоков возникает коликообразная боль.
Боль усиливается при поворачивании на левый бок, так как кровь, скапливающаяся при повреждении печени в правой половине живота, перемещается влево.
Некоторые больные принимают характерное положение сидя, при перемене которого боль усиливается (симптом «ваньки-встаньки»).
При изолированных разрывах печени редко отмечается резкая и сильная боль. Интенсивность ее возрастает при одновременном повреждении полых органов брюшной полости.
Клинические проявления внутрибрюшной кровопотери находятся в прямой зависимости от степени повреждения печени. При незначительных трещинах, подкапсулярных, центральных гематомах, когда кровопотеря не превышает 3—7 мл/кг, мы не наблюдали беспокойства, бледности кожи и видимых слизистых оболочек, изменений гемодинамики.
У большинства больных симптомы внутреннего кровотечения носят выраженный характер. К ним относятся прогрессирующее падение артериального давления, выраженное головокружение, особенно при перемене положения тела, бледность кожи и слизистых оболочек, а иногда цианоз губ, холодный пот и частый нитевидный пульс.
Притупления перкуторного звука в области правого подреберья при разрывах печени, отмеченного Terrier и Anvray (1898), мы не наблюдали. Более достоверным, хотя и поздним признаком внутрибрюшного кровотечения является притупление во фланках при перкуссии брюшной стенки. Кровь, стекающая в малый таз, обусловливает нависание передней стенки прямой кишки и повышенную чувствительность в прямокишечно-маточном или прямокишечно-пузырном углублении.
Особенно часто наблюдается притупление перкуторного звука в илеоцекальной области (Н. А. Ковальский, 1930; Н. Н. Боярский, 1936; Б. М. Браташ, 1976, и др.). Притупление в правой подвздошной области мы отмечали у 32 больных, в обеих подвздошных областях — у 9, в нижних отделах живота в сочетании с нависанием передней стенки прямой кишки — у 5.
Степень и распространенность притупления перкуторного звука находятся в прямой зависимости от количества излившейся крови. У большинства больных с излитием менее 500 мл крови мы подобного симптома не наблюдали.
Перемещение свободной жидкости, определяемое перкуссией, является достоверным, но поздним симптомом, так как для этого необходимо скопление не менее 1000 мл крови.
Нами отмечен симптом перемещения жидкости у 15 больных, поступивших в поздние сроки. Иногда следствием раздражения брюшины является рвота. Некоторые авторы к характерным симптомам относят вздутие живота (Г. Мондор, 1939). В ряде случаев разрыв печени проявляется клиническими признаками непроходимости кишечника. Температура тела не повышена.
Желтуха, появляющаяся через несколько дней после разрыва печени, не является ранним симптомом.
При субкапсулярном разрыве печени отмечается увеличение тупости ее в краниальном и кардиальном направлениях.
Тщательный осмотр пострадавшего помогает диагностировать травму печеночной области (ссадины, кровоподтеки, небольшие гематомы). У 50 % пострадавших, доставленных в клинику, были обнаружены подобные изменения в области нижних отделов грудной клетки, правой реберной дуги, на спине, брюшной стенке.
Колото-резаные раны могут указывать на локализацию повреждений печени. Расположение их в области передней поверхности грудной клетки (в нижних ее отделах), в надчревной области подтверждает ранение центральных сегментов печени. Локализация ран в заднебоковых отделах грудной клетки, в подреберьях указывает на повреждение периферических ее отделов. Раны в надчревье и чревье чаще свидетельствуют о повреждении нижней поверхности печени и нередко сочетаются с повреждениями желудка и поперечной ободочной кишки.
У больных, поступивших в первые часы после травмы, отмечалась лишь болезненность и легкое напряжение мышц передней брюшной стенки в области правого подреберья и правой половины живота. При поступлении в стационар через 4 ч и более после травмы наблюдались болезненность, напряжение мышц передней брюшной стенки и симптомы раздражения брюшины. У детей эти симптомы появлялись несколько позже, чем у взрослых.
Напряжение мышц передней брюшной стенки через 12—36 ч после травмы также является признаком увеличения гематомы печени (W. P. Greis и соавг., 1981). Авторы связывают его с растяжением фиброзной оболочки печени.
У больных с симптомами раздражения брюшины сразу после травмы или в первые часы после нее во время операции, как правило, наблюдалось повреждение полых органов живота, крупных внутри- или внепеченочных желчных протоков или желчного пузыря с попаданием желчи в брюшную полость.
При повреждении наружных желчных протоков и желчного пузыря быстро развивается желчный перитонит общий или локализованный. При значительном истечении желчи в брюшную полость кал обесцвечивается, а при пункции брюшной полости получают желчь.
Разрывы печени у новорожденного проявляются не сразу, а на 2-е — 3-и сутки. В первое время ребенок кажется совершенно здоровым, затем картина быстро прогрессирует. Развивается шок, внутрибрюшное кровотечение определяется по нарастающему притуплению в правой половине брюшной полости, которое постепенно распространяется на всю брюшную полость. На 2—8-е сутки после рождения на фоне бледности кожи, вялости движений возникают беспокойство, отказ от груди, одышка, тахикардия, иктеричность склер и кожи, вздутие живота (Т. И. Гуляева, 1975).
На 2—30-е сутки после повреждения печени у больных, которым не производили оперативное вмешательство в первые 24—48 ч, появляются клинические признаки таких осложнений, как разрыв подкапсулярнои гематомы, нагноение гематомы, секвестрация не-кротизированных участков печени, гемобилия, аррозивное кровотечение. Прогрессирующее ухудшение общего состояния объясняется нарастанием признаков печеночной недостаточности, внутрипеченочного абсцесса, сепсиса. Иногда на этом фоне вследствие разрыва гематомы, гемобилии возникает острое осложнение — внутреннее кровотечение. Если больному производилась первичная хирургическая обработка раны печени, аррозия сосудов проявляется кровотечением через дренаж. Подобные осложнения мы наблюдали у 3 больных, оперированных в других лечебных учреждениях, у которых некротизированные участки паренхимы печени не удаляли. Вследствие секвестрации очагов некроза и вторичного инфицирования их наступила аррозия сосудов.
Гемобилия возникает в среднем через 1 мес после травмы печени, однако R. N. McLehu и соавторы (1974) наблюдали это осложнение через 1 год с момента травмы (С. А. Шалимов и соавт., 1987).
Классическими клиническими признаками гемобилии являются кровотечение в просвет кишечника, приступы «печеночной колики» и желтуха, выявляемые соответственно у 90, 70 и 60 % больных (P. Sandblom, V. Mirkovitch, 1977). Среди более чем 500 наблюдений гемобилии в мировой литературе более 50 % имеют посттравматический генез (С. А. Шалимов и соавт., 1987). Поэтому при клинических признаках кровотечения из желчных протоков необходимо тщательное изучение анамнеза в отношении предшествующей травмы печени, в том числе операционной. Однако нельзя забывать и о таких причинах гемобилии, как желчнокаменная болезнь, опухоли печени и желчных протоков, атеросклероти-ческие аневризмы печеночных артерий (А. А. Шалимов и соавт., 1988).
Билигемия развивается вскоре после травмы и проявляется быстрым нарастанием желтухи и повышением уровня билирубина в крови до 680—585 мкмоль/л (G. Wittrin и соавт., 1978).
Н. К. Голобородько и соавторы (1986), обобщив свой опыт лечения 207 больных с повреждениями печени в Харьковском НИИ общей и неотложной хирургии, отмечают, что диагностические задачи при травме печени должны решаться с учетом 3 основных факторов: этиологии, морфологических признаков и характера функциональных повреждений.
По особенностям клинической картины травматических повреждений печени в целях выбора тактических действий хирург должен различать: 1) ранения и закрытые повреждения печени, сопровождающиеся признаками профузного внутреннего кровотечения (лечебные меры должны носить экстренный, реанимационный характер); 2) ранения и закрытые повреждения печени, сопровождающиеся признаками медленно нарастающего внутреннего кровотечения (лечебные мероприятия должны иметь характер неотложных) ; 3) закрытые повреждения печени, проявляющиеся поздними осложнениями — разрывом или нагноением гематомы, гемобилией (характер лечения зависит от вида осложнения).
Вспомогательные исследования. Общий анализ крови в первую очередь отражает изменения, обусловленные кровопотерей. Количество эритроцитов и гемоглобина уменьшается через 1—2 ч после травмы; в последующие часы развивается острая анемия. Темп снижения этих показателей определяется интенсивностью кровотечения. Через несколько часов после травмы начинает увеличиваться количество лейкоцитов в периферической крови.
Информативность общего анализа крови значительно возрастает при повторных исследованиях через несколько часов.
Развитие гнойно-септических осложнений после повреждения печени — внутрипеченочного абсцесса, секвестрации печени — сопровождается изменениями общего анализа крови, типичными для гнойно-септических заболеваний: несколько снижается количество эритроцитов, повышается количество лейкоцитов, отмечаются сдвиг лейкоцитарной формулы влево, повышение СОЭ.
Примесь крови в рвотных массах и желудочном содержимом является следствием гемобилии при центральных разрывах печени. Биохимическое исследование крови обнаруживает повышение уровня билирубина, аланиновой и аспарагиновой трансаминаз через 1—2 сут после травмы печени. В эти же сроки снижается уровень альбумина.
Повышение активности трансаминаз может быть диагностическим тестом, поскольку отмечается только при травме печени и не наблюдается при повреждении других органов брюшной полости (С. Д. Атаев, 1975). Автор отметил также повышение свертывания крови за счет ускорения начальных фаз свертывания и повышения уровня фибриногена в 1-е сутки после травмы.
Резкое повышение концентрации прямого билирубина в крови наблюдается при билигемии (С. Enneker, J. P. Berens, 1978).
Лапароцентез и исследование «шарящим» катетером является высокоинформативным в обнаружении крови в брюшной полости как следствия разрыва печени. Метод ценен при обследовании больных с закрытой травмой, особенно находящихся в состоянии алкогольного опьянения или в бессознательном состоянии из-за сопутствующей черепно-мозговой травмы.
Этот метод позволяет правильно поставить диагноз в 95—98 % случаев, выявить наличие жидкости в брюшной полости в объеме не более 100 см3. Возможность ранения полых органов во время лапаропункции при правильном соблюдении техники ее выполнения практически исключается. По данным Н. К. Голобородько и соавторов (1986), лапароцентез является методом выбора ранней диагностики возникшей катастрофы при закрытых повреждениях.
Техника лапароцентеза. По средней линии живота на 2—6 см ниже пупка надсекают кожу и подкожную клетчатку на расстоянии до 2 см, однозубым крючком максимально приподнимают апоневроз для предупреждения случайного повреждения кишечника. Пункцию производят троакаром под острым углом открытым книзу. Диаметр троакара должен соответствовать диаметру катетера, который будет через него проведен в брюшную полость. Пункцию выполняют в положении больного лежа на спине. После извлечения стилета троакар несколько продвигают в брюшную полость (излитие чистой крови указывает на значительное кровотечение). Если кровь не поступает сразу, то через троакар вводят хлорвиниловую стерильную трубочку с перфорациями на конце па глубину 20—25 см в сторону малого таза, правую или левую подвздошную область (направление придается наклоном троакара). Троакар извлекают. Если через дренаж кровь не отсасывается, то в брюшную полость вводят до 1 л изотонического раствора натрия хлорида и затем производят отсасывание шприцем. У детей манипуляцию лучше производить под наркозом, у взрослых применяют и местную анестезию.
При получении достоверных данных катетер из брюшной полости , удаляют и проводят соответствующее лечение. В тех случаях, когда жидкость лишь слегка окрашена кровью, а общее состояние больного не требует срочного оперативного лечения, катетер, введенный в брюшную полость, можно оставить на 2—3 ч и более. Оставление катетера на некоторое время позволяет судить об усилении или продолжении кровотечения. Каких-либо осложнений, связанных с оставлением катетера даже на 1 сут, мы не наблюдали.
Полученную при пункции жидкость при необходимости исследуют. Высокое содержание в ней аммиака свидетельствует о внутрибрюшном разрыве мочевого пузыря, высокое содержание лимфоцитов (в 3 раза и больше по сравнению с обычным содержанием их в периферической крови) —о повреждении селезенки, обнаружение желчи и крови — о повреждении крупных желчных протоков и паренхимы печени, наличие в пунктате желчи — об изолированном повреждении желчного пузыря или крупных желчных протоков. Примесь в полученной жидкости желудочного или кишечного содержимого темно-коричневого, зеленовато-серого цвета свидетельствует о перфорации полых органов и, наконец, гнойный пунктат — о наличии перитонита.
Считают, что выделение через катетер 10 мл крови является признаком значительного внутрибрюшного кровотечения. Показанием к лапаротомии служит обнаружение в оттекающей жидкости эритроцитов более 1012/л или лейкоцитов более 5-109/л (W. Cochran, W. S. Sobat, 1984).
Лапароцентез, осуществляемый по специальной методике с помощью спиралевидного катетера, по данным Н. К. Голобородько и соавторов (1986), обладает диагностической точностью до 98 %.
Относительным противопоказанием к лапароцентезу является спаечный процесс.
Лапароскопия при закрытой травме печени ненамного информативнее лапароцентеза. Преимуществом метода является возможность обнаружения подкапсулярных гематом, расположенных по передней поверхности печени.
К сожалению, применение лапароскопии в условиях кровяного или мутного поля резко затруднено, а введение в брюшную полость воздуха при тяжелом состоянии больного вообще невозможно. Лапароскопия может помочь в установлении диагноза, и ее следует применять лишь при наличии отрицательных результатов лапароцентеза и клинических данных, свидетельствующих о возможном повреждении внутренних органов.
Обзорное рентгенологическое исследование органов грудной клетки и брюшной полости в 1-е сутки после травмы проводят обычно для диагностики других повреждений, сопутствующих травме печени. В более поздние сроки метод позволяет обнаружить косвенные признаки осложнений травмы печени — увеличение тени органа, уменьшение подвижности купола диафрагмы, реактивный плеврит, пневмонию, перикардит.
Редко обнаруживаемыми признаками ранения печени являются скопление газа по ходу раневого канала и инородное тело в проекции печени (Л. Д. Линденбратен, 1980).
Ангиографию применяют обычно через 1 сут после травмы и позже. О повреждении печени свидетельствуют обрывы контрастирования сосудов, выход контрастного вещества за пределы сосуда с образованием «затеков».
При гемобилии обнаруживается попадание контрастного вещества в желчные протоки. В промежутке между кровотечениями часто выявляют полость, в которой скапливается контрастное вещество, поступающее из сосудов (J. E. Goodnight, F. W. Blisdell, 1981). Ценность метода заключается в возможности точной локализации поврежденного сосуда, что облегчает выбор метода хирургического лечения (С. А. Шалимов и соавт., 1987).
Сканирование печени с Тс произвели 33 больным с подозрением на травму печени R. S. Stadalnic и соавторы (1981). Исследование позволило, помимо повреждения печени, выявить внутрипеченочную гематому у 13 больных. Благодаря сканированию удалось диагностировать травму печени у 2 больных, у которых подозревалось повреждение селезенки. Вместе с тем, авторы указывают, что по данным сканирования трудно дифференцировать повреждение с опухолью, абсцессом и эхинококкозом печени.
Эндоскопическая ретроградная холангиография использована нами для диагностики разрыва долевых желчных протоков вследствие травмы печени у 2 больных.
Метод высокоинформативен также при выявлении гемобилии и билигемии как осложнений травмы печени (С. Enneker, I. P. Berens, 1978). Эндоскопическая ретроградная холангиография служит основным методом диагностики билигемии.
Классификация. В. С. Шапкин и Ж. А. Гриненко (1977) предлагают следующую классификацию повреждений печени:
1. Закрытые повреждения печени.
A. Вид повреждения.
Разрывы печени с повреждением капсулы (чрескапсулярные).
Субкапсулярные гематомы.
Центральные разрывы или гематомы печени.
Повреждение внепеченочных желчных путей и сосудов печени.
Б. Степень повреждения.
Поверхностные трещины и разрывы глубиной до 2 см.
Разрывы глубиной от 2—3 см до половины толщины органа.
Разрывы глубиной более половины толщины органа и сквозные.
Размозжение частей печени или расчленение на отдельные фрагменты.
B. Локализация повреждения по долям и сегментам печени.
Г. Характер повреждения внутрипеченочных сосудов и желчных протоков.
2. Ранения печени.
Огнестрельные. Пулевые, дробовые, осколочные. Колото-резаные.
3. Сочетание тупой травмы с ранением.
Однако, по нашему мнению, эта классификация недостаточно четко отражает тактику хирурга при повреждениях печени.
J. S. Aldrete и соавторы (1979) различают следующие типы травм печени.
Тип I — небольшие повреждения, включая разрывы капсулы, с минимальным кровотечением.
Тип II — повреждения с активным и значительным кровотечением.
Тип III — большие внутрипаренхиматозные гематомы.
Тип IV — большие повреждения с рассечением различимых внутрипеченочных ветвей печеночной артерии, воротной вены, печеночных вен или желчных протоков, не поддающиеся ушиванию.
Тип V — большие повреждения с рассечением различимых внутрипеченочных ветвей печеночной артерии, воротной вены, печеночных вен или желчных протоков, требующих резекции участка паренхимы печени.
Тип VI — большие повреждения с сопутствующей травмой позадипеченочных и нижней полой вен, приводящие к массивному кровотечению.
Авторы указывают, что повреждения первых 3 типов обнаружены у всех 17 больных с колото-резаными ранами печени, у 28 из 43 больных — с огнестрельными и у 27 из 48 больных с закрытыми травмами.
Приведенная классификация отличается полнотой и хирургической ориентацией. Вместе с тем, в ней не учтены такие важные аспекты, как характер, травмы, степень повреждения печени, число поврежденных органов и исходное состояние паренхимы печени.
С учетом вышеперечисленных факторов мы предлагаем следующую классификацию травм печени.
I. Характер травмы.
1. Закрытая.
2. Ранения печени: а) колото-резаные раны; б) рваные раны; в) огнестрельные.
II. Степень повреждения печени.
1. Поверхностные.
2. Глубокие: а) с нарушением целости артерий; б) с нарушением целости вен; в) без нарушения целости сосудов.
3. Размозжение паренхимы печени; повреждение долевых (сегментарных) сосудов и желчных протоков; повреждение печеночных и нижней полой вен.
III. Число поврежденных органов.
1. Изолированная травма печени.
2. Сочетанная травма.
IV. Исходное состояние печени.
1. Травма здоровой печени.
2. Травма патологически измененной печени: а) очаговая патология (опухоль, киста); б) диффузное поражение (малярия, лучевая болезнь, интоксикация, цирроз).
Диагностика. В первые часы после травмы у больных, поступивших с признаками массивного внутрибрюшного кровотечения или перитонита, диагноз повреждения печени устанавливают обычно после лапаротомии, а в более поздние сроки — на основании тщательного анализа механизма травмы, а также данных дополнительных исследований, указывающих на нарушение целости паренхимы и ее структур.
Дифференциальная диагностика. Всем больным с тяжелой сочетанной травмой необходимо производить лапароцентез. Выявление крови в брюшной полости служит показанием к незамедлительной лапаротомии.
В дифференциальной диагностике важно учитывать, что черепно-мозговая травма редко сопровождается шоком. Если нет двустороннего расширения зрачков и фиксации взгляда, а дыхательные пути проходимы, то следует искать иную причину шока (L. F. Madding и соавт. 1977).
Лечение. При явлениях шока, внутреннего кровотечения, перитонита консервативное лечение в виде инфузионнои терапии должно быть начато безотлагательно. Лечебные мероприятия должны быть направлены прежде всего на снятие боли и восполнение объема циркулирующей крови. На месте происшествия обычно ограничиваются пункцией периферической вены, однако при поступлении больного в стационар сразу же катетеризируют одну из центральных вен через вену локтевой ямки или путем пункции подключичной вены. У больных с признаками большой кровопотери катетеризуют одновременно две вены.
В тех случаях, когда струйное внутривенное введение жидкости в течение 10—15 мин не приводит к стабилизации артериального давления и имеются признаки внутреннего кровотечения, следует немедленно произвести оперативное вмешательство.
Необходимо помнить о возможности одновременного повреждения грудной клетки и ее органов, сопровождающихся пневмо-, гемотораксом, разрывами легкого.
Еще и дооперационный период назначают антибиотики широкого спектра действия, анальгетики. В желудок вводят зонд для предотвращения его расширения и освобождения от пищи. Для определения диуреза в мочевой пузырь вводят катетер.
Хотя консервативные мероприятия в большинстве случаев оказываются неэффективными, L. Cheatham и соавторам (1980) все же удалось излечить 5 больных с внутрипеченочными гематомами, возникшими в результате закрытых травм печени. Диагноз был установлен на основании сканирования с "Тс. Во время лапароцентеза признаков внутрибрюшного кровотечения не обнаружено. Контрольные лабораторные исследования, а также повторное сканирование не выявили нарастания анемии и увеличения гематомы, в связи с чем консервативная терапия была продолжена до полного исчезновения клинических проявлений травмы печени.
Так как осложнения повреждений печени — разрыв гематомы, формирование абсцесса, возникновение гемобилии — могут проявиться в отдаленный период после травмы, больной должен находиться под диспансерным наблюдением не менее 4 нед.
Хирургическое лечение. Показаниями к хирургическому лечению повреждений печени служат:
1) массивное внутрибрюшное кровотечение после закрытой травмы живота;
2) открытое ранение живота и нижней части грудной клетки;
3) нарастающие в течение 2—3 сут признаки анемии в сочетании с данными анамнеза, ангиографии, ультразвукового исследования и радионуклидного сканирования;
4) гемобилия и билигемия;
5) секвестрация, формирование абсцесса или кисты печени.
По мнению Н. К. Голобородько и соавторов (1986), М. В. Гринева и Н. Ю. Александрова (1986), хирургическая тактика при травмах печени предусматривает выполнение двух видов операций — реанимационных (высшей срочности) и экстренных. По степени эффективности авторы разделяют операции на радикальные, условно радикальные и паллиативные. В основу этих операций положен подход, предусматривающий радикальный гемо- и холестаз, удаление нежизнеспособных тканей, профилактику осложнений и ишемического некроза гепатоцитов.
Выбор операционного доступа обусловлен характером повреждения. У больных с признаками внутрибрюшного кровотечения и (или) перитонита выполняют верхнюю срединную лапаротомию. При открытых ранениях печени с локализацией входного отверстия раневого канала в нижней части грудной клетки нередко производят торакотомию по седьмому-восьмому межреберью, которую затем дополняют диафрагмо- и лапаротомией.
При обширных повреждениях правой доли печени, сопровождающихся профузным кровотечением, обычно нет времени для тщательной мобилизации печени из лапаротомного доступа. В таких случаях показан правосторонний торакоабдоминальныи доступ от задней подмышечной линии по седьмому-восьмому межреберью до пупка.
Торакотомию в целях реанимации при признаках остановки сердца на фоне кровопотери выполнили у 39 больных с травмой печени R. H. Carmona и соавторы (1982). Выжили только 8 больных.
У больных с повреждениями печени, оперируемых в срочном порядке, важное значение имеет своевременное восполнение кровопотери. Однако нередко большого количества совместимой крови не оказывается. Поэтому собирают излившуюся в брюшную полость кровь и производят аутотрансфузию. Возможно отсасывание крови электро- или вакуумным отсосом, однако ввиду опасности механического разрушения эритроцитов рекомендуется просто вычерпывать ее. В стерильную посуду, куда предполагается собирать кровь, добавляют гепарин из расчета 0,2 мл в 5—10 мл изотонического раствора натрия хлорида на 250 мл крови или 4 % раствор натрия цитрата из расчета 10 мл на 100 мл крови (Г. В. Головин и соавт., 1974). Покачиванием колбы смачивают раствором стенки сосуда. Собранную кровь фильтруют через 8 слоев стерильной марли для удаления сгустков и затем переливают больному.
Нельзя переливать аутокровь при ее гемолизе и инфицировании. Инфицированной считается кровь у пострадавших с открытыми ранениями печени, а также с сопутствующими повреждениями желудка и кишечника.
Для оценки степени гемолиза центрифугируют пробирку с 5— 10 мл крови. Розовая окраска плазмы после полного оседания эритроцитов указывает на гемолиз крови.
Переливать надо цельную свежую кровь. Следует также учитывать, что переливание излившейся в брюшную полость крови при повреждении печени может оказать токсическое действие в связи с примесью в ней желчи. Этому явлению в ряде случаев приписывается возникновение анурии.
Интраоперационная диагностика. После вскрытия брюшной полости удаляют кровь и сгустки, а также оторванные участки печени. Большое количество крови в брюшной полости еще не свидетельствует о повреждении крупных сосудов, и обычно во время операции сильного кровотечения не отмечается. Диагностика повреждения печени не представляет затруднений в тех случаях, когда на диафрагмальнои или висцеральной поверхности ее видны разрывы фиброзной оболочки, паренхимы или гематомы.
Однако при разрывах в глубине паренхимы органа гематома может быть не видна. Разрывы печеночных вен иногда сопровождается кровоизлиянием в забрюшинную клетчатку, что затрудняет выявление локализации источника кровотечения. В связи с этим для полной оценки характера повреждения печени необходима широкая мобилизация ее с пересечением серповидной, треугольных и желудочно-печеночной связок.
Для временной остановки кровотечения из небольших ран или разрывов печени обычно достаточно прижать рану салфеткой и рукой. Однако при разрывах печени на большом протяжении более эффективен другой прием: ассистент заводит руки по ходу треугольных связок справа и слева, сжимает печень между руками. При отсутствии признаков повреждения нижней полой и печеночных вен и значительном снижении артериального давления на этом этапе можно временно прекратить хирургические манипуляции и восполнить объем циркулирующей крови.
Если после лапаротомии обнаруживается обильное кровотечение из раны печени, необходимо рукой и тампоном сдавить печень в области разрыва, а затем наложить турникет на печеночно-дуоденальную связку.
Пережатие печеночно-дуоденальной связки, помимо гемостаза, имеет и диагностическое значение. Если после затягивания турникета кровотечение полностью прекращается, значит, повреждена ветвь собственной печеночной артерии и объем вмешательства можно ограничить перевязкой долевой печеночной артерии. В случаях, когда пережатие печеночно-дуоденальной связки не приводит к полной остановке кровотечения, следует предполагать повреждение ветвей воротной или печеночных вен, а хирургическая коррекция должна включать в себя или рассечение печени по ходу раны с поэтапным гемостазом, или резекцию пораженного участка печени.
При повреждении нижней полой и (или) печеночных вен следует как можно быстрее выделить нижнюю полую вену выше и ниже печени для возможного пережатия в момент сильного кровотечения, а затем расширить раневой канал в месте повреждения печени и в кратчайший срок зажать и ушить дефект стенки вены.
Лишь после этого становится возможным восполнение кровопотери и продолжение операции.
Наибольшие, до 5 см в диаметре, подкапсулярные гематомы печени, не увеличивающиеся в размерах и не пульсирующие, можно не вскрывать. В дальнейшем, в первые 6 мес после травмы, необходимо динамическое ультразвуковое исследование в целях своевременной диагностики абсцедирования. Более крупные, а также пульсирующие гематомы вскрывают и содержимое их эвакуируют. Дальнейшие действия зависят от характера кровотечения из сосудов, повреждение которых вызвало образование гематомы. Показания к каждому из методов хирургического лечения подробно рассмотрены ниже.
Забрюшинную гематому вблизи внутрипеченочного сегмента нижней полой вены можно оставить только при отсутствии признаков продолжающегося кровотечения в брюшную полость или в полость гематомы. В других случаях производят вскрытие гематомы и ревизию на этом участке нижней полой и устьев печеночных вен. Однако следует учитывать, что сразу же после вскрытия гематомы может начаться профузное кровотечение из указанных вен. Поэтому надо быть готовым к возможному выключению печени из кровообращения. Для обеспечения визуального контроля задней поверхности правой доли печени в тех случаях, когда не предполагается ее резекция (то есть нет видимых больших гематом и обширных повреждений печени), перед вскрытием забрюшинной гематомы целесообразно произвести правостороннюю торакофренолапаротомию, если операция выполняется только через лапаротомный доступ.
Необходимо помнить, что вследствие отрицательного давления в нижней полой вене на высоте выдоха при повреждении печеночных вен возможна воздушная эмболия. Поэтому место повреждения сразу же после, лапаротомии зажимают рукой и салфеткой, а после выделения вены — немедленно перевязывают ее или ушивают.
Интраоперационная артерио- и холангиография показаны: 1) при сомнениях в целости сегментарных сосудов, желчных протоков и печеночных вен; 2) больным, оперируемым в отдаленные сроки после травмы, у которых предполагаются внутрипеченочная гематома, абсцесс или гемобилия, но результаты предоперационного обследования не позволяют наметить объем операции. Для артериографии катетеризируют собственную печеночную артерию через правую желудочную артерию. При отсутствии аппарата для серийного производства рентгенограмм производят один снимок по окончании введения контрастного вещества. Подробная техника интраоперационной холангиографии описана в главе «Непроходимость желчных протоков доброкачественной этиологии».
Пункция желчных протоков и аспирация их содержимого используются для подтверждения диагноза гемобилии у больных, оперируемых по поводу осложнений травмы печени.
Таким образом, первые лечебные мероприятия при травматических повреждениях печени должны быть направлены на выявление и остановку кровотечения. Одновременно производят хирургическую обработку раны вплоть до резекции доли печени. Обычно рана печени выполнена размозженной тканью или оторванными кусочками паренхимы, кровяными сгустками. Необработанная рана, как правило, осложняется абсцессами, желчными свищами и вторичным кровотечением, а всасывание продуктов распада ведет к развитию гепаторенального синдрома. Экономное иссечение краев раны с удалением всех поврежденных и оборвавшихся тканей является единственно правильным способом лечения повреждения печени. Возникшее при хирургической обработке раны кровотечение останавливают перевязкой сосудов в ране, а менее сильное — путем ее ушивания или с помощью биологической тампонады.
Г. Ф. Николаев (1955) различает следующие методы остановки кровотечения:
1) механические (тампонада, шов раны, перевязка сосудов и др.);
2) физические;
3) биологические;
4) с помощью различных гемостатических препаратов;
5) резекция печени.
Механические методы. Наиболее надежным способом остановки кровотечения, создающим условия для хорошего заживления раны при неглубоких повреждениях печени, является сближение краев после иссечения поврежденных участков и наложение швов.
Различают обычные и специальные швы для ушивания паренхиматозных органов. Чаще всего применяют П-образные кетгуто-вые швы, однако техника наложения их на ткань печени имеет свои особенности. Используют круглую иглу с большой кривизной изгиба. Вкол в паренхиму печени надо производить на 2—3 см отступя от края раны. Шов должен захватывать всю границу раны до дна для предотвращения образования центральных гематом. Одномоментным подтягиванием за концы нитей края разрыва сближают до плотного соприкосновения их, нити завязывают двойным узлом. К месту шва подводят перчаточно-трубчатыи дренаж. Если в глубине раны или на ее стенках есть сосуды, необходимо их перевязать после предварительного захватывания кровоостанавливающим зажимом или обшить. В связи с тем, что ткань печени легко прорезывается, в качестве прокладки большинство хирургов используют сальник изолированный или на ножке.
При ушивании ран печени следует всегда помнить о возможности перевязки или прошивания крупных ветвей воротной вены, печеночной артерии, желчных протоков или печеночных вен, что впоследствии может привести к образованию анемического некроза печени, развитию посттравматического гепатита, желчных свищем. Кроме того, острая блокада магистральных ветвей портального пучка может вызвать резкие гемодинамические сдвиги в организме с последующим развитием послеоперационного коллапса и шока. В снязи с этим рекомендуют прошивать края раны на определенную глубину, которая на диафрагмальной поверхности не должна превышать 2—2,5 см, а на нижней— 1,5 см.
Очень важно своевременно распознать кровотечение в ране, связанное с повреждением магистральных ветвей сосудов портального пучка (Г. А. Покровский и соавт., 1970). Характерными признаками подобного повреждения являются соответствующая локализация раны, пульсирующее кровотечение, кратковременное потемнение ткани печени с последующим стойким изменением ее цвета (темно-фиолетовый, черный). В таких случаях следует решать вопрос о резекции печени, так как попытка ушивания глубоких разрывов печени приводит к скоплению крови и желчи внутри паренхимы с доследующим нагноением их. При повреждении сегментарных и более крупных сосудов ушивание паренхимы не вызывает остановку кровотечения, оно лишь замедляется, поэтому возможны как рецидив кровотечения, так и формирование внутрипеченочной гематомы. Сшивание нежизнеспособных участков печени не предотвращает их некроза и последующей секвестрации.
Ушивание производят кетгутом, размоченным в теплом изотоническом растворе натрия хлорида. Применение шелковых нитей нежелательно, так как они инкрустируются желчью и становятся источником лигатурного холелитиаза.
Предложено много различных специальных видов швов ран печени, которые используются как при первичной хирургической обработке, так и при выполнении резекции (рис. 19).


Критерием эффективности ушивания раны печени считают отсутствие поступления крови через швы и внутрипеченочной гематомы в течение 15 мин после наложения швов.
Противопоказаниями к наложению шва на паренхиму печени являются: 1) глубокие повреждения, когда не видно дна раневого канала; 2) интенсивное кровотечение из раны; 3) наличие нежизнеспособных участков паренхимы на расстоянии 5—6 см от краев раны.
Ранее широко применяли для остановки кровотечения тампонаду раны печени. Использовали прядь сальника на сосудистой ножке, мышечный лоскут, изолированные участки сальника и мышцы, марлевые тампоны, гемостатическую губку.
Тампонаду раны печени выполняют в тех случаях, когда из-за обширности повреждения простое ушивание невозможно (В. С. Суворин, 1971).
Наилучшие результаты получены при использовании для тампонады раны печени сальника на ножке. Мобилизованную прядь сальника плотно укладывают на всем протяжении раны печени, края разрыва сближают П-образными кетгутовыми швами. К месту ушивания подводят трубчатые дренажи.
При невозможности использования большого сальника (небольшие размеры, деформация его вследствие предшествующих операций) применяют марлевую тампонаду раны печени. Марлевые салфетки плотно укладывают по ходу раны, наружные концы их выводят на переднюю брюшную стенку.
Применение тампонады раны печени у 21 больного, оперированного нами на первых этапах, сопровождалось развитием перитонита у 2, вторичного кровотечения — у 3, поддиафрагмального абсцесса — у 1, абсцесса печени—у 3, наружного желчного свища— у 1 больного. Анализ причин возникновения осложнений показал, что тампонада не предотвращает крово- и желчеистечения из сосудов и протоков среднего и большого диаметра, а лишь замедляет темп выделения их. Выделяющиеся кровь и желчь скапливаются под тампоном, что в дальнейшем приводит к развитию перечисленных осложнений. В то же время опыт резекций печени показал, что кровотечение из мелких сосудов по раневой поверхности (паренхиматозное кровотечение) останавливается самостоятельно, независимо от того, применяется тампонада или нет. Следовательно, тампонада раны печени не дает длительного лечебного эффекта и ее можно применять лишь как метод временной остановки кровотечения.
Ушивание и тампонаду кровоточащей раны печени можно рекомендовать как первый этап лечения, если хирург не владеет техникой более расширенных вмешательств, или тяжесть состояния больного не позволяет предпринять подобное вмешательство, либо нет условий для его проведения. Сразу же после операции рекомендуется консультация специалиста или перевод больного в специализированное отделение для выполнения полноценной хирургической помощи.
Одним из методов механической остановки кровотечения из ран печени является гепатопексия, которую можно рассматривать как вариант тампонады (рис. 20).
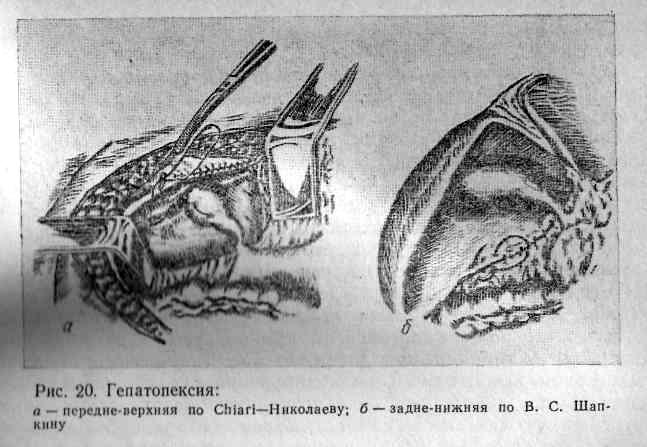
Предложено два вида гепатопекспи: передне-верхняя по Chiari—Николаеву и нижне-задняя по Шапкину.
Первый вид операции применяют при повреждении диафрагмальной поверхности IV—VIII сегментов печени, локализующемся выше правой треугольной связки. Второй вид операции выполняют при локализации повреждения V—VII сегментов печени ниже правой треугольной связки.
Техника гепатопексии по Chiari—Николаеву заключается в следующем. В девятом межреберье на уровне средней или передней подмышечной линии делают контрапертуру, через которую проводят перчаточно-трубчатый дренаж вдоль правой треугольной связки печени на всем ее протяжении. Правую долю печени максимально вдавливают в правое поддиафрагмальное пространство и в таком положении фиксируют, сшивая капсулу печени и париетальную брюшину П-образными кетгутовыми швами на всем протяжении от серповидной до правой треугольной связки. В подпеченочное пространство вводят дополнительный перчаточно-трубчатый дренаж.
Нижне-задняя гепатопексия по Шапкину заключается в следующем. Из контрапертуры на уровне конца XI ребра проводят перчаточно-трубчатый дренаж позади печени под правую треугольную связку. Печень максимально вдавливают в правое поддиафрагмальное пространство. П-образными кетгутовыми швами фиксируют париетальную брюшину и капсулу печени в здоровых участках, закрывая зону повреждения от остальной брюшной полости. В подпеченочное пространство вводят дополнительный перчаточно-трубчатый дренаж.
Лечебное действие гепатопексии обусловлено сдавлением разрыва печени. Поэтому, как и после тампонады раны, хорошего результата можно ожидать только при повреждении мелких сосудов и желчных протоков, при отсутствии участков нежизнеспособной паренхимы. Важным является то, что оба вида гепатопексии применимы при повреждениях диафрагмальной поверхности печени, доступ к которым при лапаротомии затруднен, а тампонада сальником или марлей трудновыполнима.
Учитывая изложенное, считаем гепатопексию показанной при разрывах, локализующихся на диафрагмальной поверхности IV— VIII сегментов печени, повреждении мелких сосудов и желчных протоков, отсутствии участков нежизнеспособной паренхимы. Допустимо выполнение гепатопексии как первого этапа хирургического лечения при больших разрывах IV—VIII сегментов печени и массивном кровотечении, если хирург не владеет техникой резекции печени либо условия не позволяют оказать полноценную хирургическую помощь (крайне тяжелое состояние больного, отсутствие должного анестезиологического обеспечения и др.). В последнем случае после гепатопексии проводят интенсивную инфу-зионную терапию, одновременно организуя соответствующее обеспечение повторной операции, которую выполняют в течение ближайших 24 ч.
Противопоказанием к гепатопексии является возраст до 1 года: швы, наложенные на паренхиму печени, прорезаются, что еще больше увеличивает кровоточивость (Т. И. Гуляева, 1975).
Перевязка собственной печеночной артерии или ее ветвей показана при изолированном повреждении самой артерии или ее внутрипеченочных ветвей (G. Madding и соавт., 1977).
Техника операции заключается в следующем. Турникетом пережимают печеночно-дуоденальную связку. Прекращение кровотечения из раны печени подтверждает целесообразность перевязки собственной печеночной артерии или ее ветви. На уровне слияния пузырного и общего печеночного протоков выделяют собственную печеночную артерию. Перемещаясь вверх вдоль артерии, выделяют бифуркацию собственной печеночной артерии. Долевую артерию, отходящую к поврежденному участку печени, пережимают артериальным зажимом или турникетом, а сдавление печеночно-дуоденальной связки временно прекращают. Отсутствие кровотечения подтверждает, что выделенный сосуд является искомой долевой артерией. Перевязывают двумя лигатурами и между ними пересекают ту долевую печеночную артерию, которая отходит к поврежденному участку печени. После этого удаляют турникет с печеночно-дуоденальной связки. На дно раны печени укладывают перчаточно-трубчатый дренаж, который выводят через контрапертуру брюшной стенки. Поверх раны печени подшивают прядь большого сальника на сосудистой ножки.
При выделении долевой печеночной артерии необходимо помнить о возможных анатомических вариантах ее. Поэтому если ослабление турникета на печеночно-дуоденальной связке приводит к возобновлению кровотечения, несмотря на пережатие сосуда, необходима тщательная ревизия элементов печепочно-дуоденальной связки и малого сальника для выявления истинной долевой артерии.
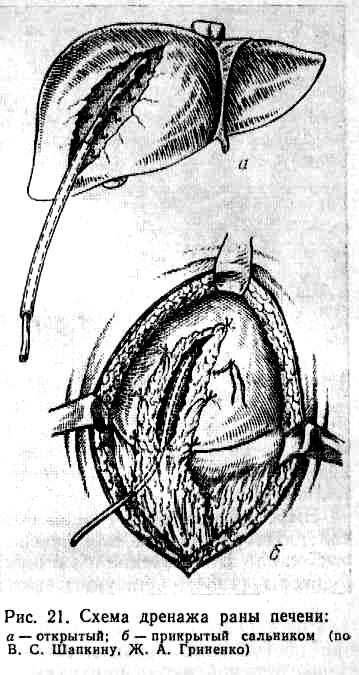
При кровотечении из узких и глубоких ран печени выделяют и поочередно пережимают правую и левую ветви собственной печеночной артерии. Если после пережатия одной из ветвей кровотечение прекращается, сосуд перевязывают, а раневой канал на всю глубину дренируют трубчатым дренажем (рис. 21).
Остановка артериального кровотечения из печени достигнута перевязкой собственной печеночной артерии или ее ветвей у всех 59 больных, оперированных L. M. Flint и соавторами (1977). Необходимость в повторной операции не возникла ни в одном наблюдении. После операции умерли 18 больных. Частота послеоперационных септических осложнений и летальность после перевязки собственной печеночной артерии не отличались от аналогичных показателей у больных, леченных другими методами. Авторы предостерегают от применения перевязки собственной печеночной артерии у больных с циррозом печени, а также считают опасным широкое пересечение печеночных связок с ликвидацией путей коллатерального артериального кровотока. Перевязка собственной печеночной артерии сопровождалась повышением активности лактатдегидрогеназы и аланиновой трансаминазы в 4—6 раз по сравнению с нормальными показателями, максимальный уровень отмечен в первые 72 ч после операции. Повышение уровня билирубина в крови тесно коррелировало с развитием септических осложнений.
Перевязка долевой печеночной артерии допустима при гемобилии, если по данным клинического обследования и ангиографии именно эта артерия является источником кровотечения и нет признаков внутрипеченочной гематомы, абсцесса или разрушения паренхимы печени.
После перевязки собственной печеночной артерии уменьшается синтез альбумина в печени и усиливается гликогенолиз (Е. Т. Mays и соавт., 1979). Для профилактики и устранения метаболических расстройств, связанных с этими нарушениями, авторы рекомендуют внутривенное введение гипертонических растворов глюкозы и альбумина или даже перевод больного на полное парентеральное питание.
Эмболизацию собственной печеночной артерии после селективной катетеризации ее для лечения посттравматической гемобилии выполнили D. M. Heimbach и соавторы (1978), S. J. A. Schlafani и соавторы (1984). Они указывают на высокую эффективность метода.
Рассечение паренхимы печени с гемостазом в ране необходимо при поступлении крови и желчи из глубокого разрыва печени. Через раневой канал паренхиму печени рассекают на всю глубину его, направление разреза выбирают в соответствии с сегментарным строением печени, избегая повреждения сегментарных сосудов и желчных протоков (см. главу «Опухоли печени»). Поэтому захватывают и перевязывают сосуды и желчные протоки в ране. После достижения окончательного гемостаза оценивают жизнеспособность всех частей печени. При возникновении сомнений в жизнеспособности какого-то участка его удаляют.
В последнее время получил распространение способ остановки кровотечения при помощи клипс (рис. 22).

Физические методы. Из физических методов остановки кровотечения применяют только электрокоагуляцию.
Хотя метод электрокоагуляции нашел применение главным образом при операциях на печени по поводу опухолей, его с успехом используют и при обработке обширных закрытых повреждений печени, которые фактически являются атипичными резекциями. К сожалению, электрокоагуляцию нельзя применять при обильном продолжающемся кровотечении.
Отдельные хирурги (В. А. Вишневский и соавт., 1988, 1990; L. Putman, 1983) в целях гемостаза при травмах печени и после резекции используют ультразвуковой хирургический аспиратор. Принципиальная схема его устройства включает 3 системы — колебательную, оросительную и аспирационную, позволяющие избирательно разрушать паренхиму печени, не повреждая внутрипеченочных протоков и сосудов.
В. А. Вишневский и соавторы (1988) отмечают, что с помощью ультразвукового хирургического аспиратора удается обезопасить методики экономных, чаще всего сегментарных резекций при опухолях и «резекций-обработок» при травмах печени, так как данная гехника позволяет верифицировать крупные сосуды до их рассечения и производить лигирование только тех образований, которые имеют отношение к удаляемой части.
Некоторые хирурги (В. В. Грубник и соавт., 1990) для остановки кровотечения из мелких сосудов рекомендуют использовать лазерный скальпель, Применяют различные установки на базе углекислого и неодимового лазеров с длиной волны 1,06 мкм,
В. С. Савельеву и соавторам (1990) удалось в эксперименте и (6—7 раз уменьшить объем кровопотери с помощью плазменного скальпеля. По данным авторов, эффективность рассечения ткани печени плазменной струей зависит от ее мощности, которая должна быть не менее 1000 Вт. При таком напряжении происходит испарение тканей без образования выраженной зоны обугливания и некроза. Используемая авторами установка позволяет получить поток плазмы мощностью свыше 1500 Вт, что обеспечивает рассечение ткани печени за один проход на глубину до 10 мм. Ткань печени толщиной более 8—10 см целесообразно отсекать стальным скальпелем, после чего раневую поверхность обрабатывают плазменным скальпелем в режиме коагуляции при меньшей мощности и температуре около 900 °С.
Наряду с выраженным гемостатическим эффектом плазменный скальпель оказывает бактериостатическое действие за счет ультрафиолетового излучения.
Биологические методы, гемостатические препараты. В тех случаях, когда кровотечение в глубине раны трудно остановить механическим путем, применяют тампонаду сальником на ножке, который укладывают на дно раны и подшивают ушивающими рану швами. Боязнь развития непроходимости кишечника в этих случаях (А. Г. Караванов, И. В. Данилов, 1967) явно преувеличена. Применение же изолированного участка сальника ведет к некрозу и в случае инфекции создает источник нагноения. В гемостатических целях, наряду с ушиванием раны
печени, применяют гемостатическую губку, сухой тромбин и гемостатическую марлю.
Хороший гемостатический эффект наблюдается при комбинированном применении гемостатической губки и сальника, причем после осушивания к кровоточащему участку печени вначале прикладывают губку, затем сальник и лишь после этого прижимают тампон на 3—4 мин. Прижатие губки непосредственно тампоном способствует возобновлению кровотечения после его снятия, так как вместе с тампоном отрывают и губку.
Резекцию печени производят при размозжении участка печени, повреждении сегментарных (долевых) сосудов и желчных протоков, наличии нежизнеспособных участков паренхимы.
Иногда резекция печени необходима для обеспечения доступа к поврежденным печеночным и нижней полой венам.
Резекция печени является наиболее эффективным методом лечения билигемии как осложнения травм печеночных вен (G. Wit-trin и соавт., 1978).
При развитии некроза и секвестрации паренхимы печени в отдаленные сроки после травмы показана резекция печени в пределах здоровых тканей.
Первичная резекция печени при травме выполнена В. С. Шапкиным и Ж. А. Гриненко (1977) у 20,5 % больных.
Техника резекции печени при повреждении органа имеет свои особенности. Прежде всего необходимо правильно оценить объем поражения. Если для колото-резаных ран и закрытых травм печени границы разрывов паренхимы по сути являются границами повреждения, то при огнестрельных ранениях, помимо собственного раневого канала, имеется зона раневых контузий, в пределах которой ткани находятся в состоянии некроза. Недоучет этого фактора может привести к краевому некрозу и даже секвестрации паренхимы печени после ее резекции. Поэтому у пострадавших с огнестрельными ранениями при наличии показаний к резекции оправдано выполнение расширенных анатомических резекций.
Как отмечено выше, разрывы печени при закрытых повреждениях ее проходят по межсегментарным щелям. Поэтому после осмотра поверхности печени в области разрыва устанавливают ту трещину паренхимы, которая наиболее соответствует проекции межсегментарной щели. Расширяя место разрыва по типу фиссу-ральной резекции (см. главу «Опухоли печени»), подходят к сегментарным или долевым (в зависимости от характера поражения) сосудам и желчным протокам, перевязывают и пересекают их. Затем, ориентируясь по изменению окраски паренхимы, фиссуральным методом резецируют печень в пределах измененных тканей.
Направление раневого канала при колото-резаных ранах не совпадает с границами сегментов и долей. Поэтому, ориентируясь по направлению хода раневого канала, с учетом анатомического строения печени (см. главу «Опухоли печени»), устанавливают, какие долевые или сегментарные сосуды оказались пересеченными. Нередко задача облегчается изменением окраски паренхимы. Так как колото-резаные раны обычно имеют небольшие размеры, объем резекции печени чаще ограничивается удалением 1—2 сегментов, и редко возникает необходимость в гемигепатэктомии. Фиссуральным методом разделяют паренхиму печени по границам пораженного сегмента, пересекают и перевязывают сосуды и желчные протоки в плоскости резекции, пораженный сегмент удаляют. К месту ним через контрапертуру подводят 1 или 2 перчаточно-труб-чатых дренажа.
Зависимость летальности после резекций печени от объема операции и характера травмы представлены в табл. 4 (по М. Balasegavan, S. К. Joishy, 1981).

При сочетании травмы печени с повреждением воротной вены или при изолированных ее разрывах рекомендуется, если ушивание невозможно из-за образования большого дефекта, у больных, находящихся в критическом состоянии, исключающем длительную операцию, перевязывать ее проксимальнее и дистальнее места повреждения (G. F. Madding и соавт., 1977). Из 11 больных после перевязки воротной вены выжили 6 (U. L. Pachter и соавт., 1979). Среди причин смерти немаловажную роль сыграли тяжелые сопутствующие повреждения (у 4).
Анализ наблюдений показал, что непосредственно после перенизки воротной вены происходит падение артериального давления из-за задержки значительной части крови в брыжеечных сосудах, а также возникает тромбоз брыжеечных вен. Для коррекции артериального давления авторы рекомендуют внутривенное введение больших объемов жидкости. Оценку брыжеечного кровотока и при необходимости аутовенозное шунтирование между перевязанными концами вены авторы рекомендуют производить во время «контрольной» лапаротомии через 24 ч после первой операции.
Однако необходимо подчеркнуть, что перевязка воротной вены является крайней мерой, допустимой только в экстремальных ситуациях. При благоприятных условиях вену сшивают по типу «конец в конец» или перевязывают печеночный конец сосуда, а кишечный конец используют для наложения портокавального анастомоза по типу «конец в бок» (J. Fich, 1966). Описано наблюдение восстановления целости собственной печеночной артерии, воротной вены и общего желчного протока после их полного перерыва вследствие травмы; больной выздоровел (J. Scheele и соавт., 1982).
Инородные тела, внедрившиеся в паренхиму печени, обычно удаляют. Однако при отсутствии кровотечения можно оставить небольшие металлические предметы, если они находятся глубоко в паренхиме и извлечение их значительно усложнит операцию (G. F. Madding и соавт, 1977).
В поздние сроки после травмы в зависимости от течения процесса выделяют следующие группы больных с инородными телами печени (К. А. Грачев, 1972), у которых: 1) имеются кровотечения, абсцедирование, желчный свищ на фоне инородного тела; 2) инородное тело инкапсулировано, но отмечаются нарушения функции печени, гепатит с переходом в цирроз, ангиохолит; 3) при наличии субъективных жалоб объективных признаков болезни нет; 4) ни субъективных, ни объективных симптомов заболевания нет.
Наружный дренаж желчных путей путем холецистостомии или наружного дренирования общего желчного протока у больных с травмой печени рекомендуют В. С. Шапкин и Ж. А. Гриненко (1977).
Однако некоторые хирурги (С. Е. Lucas, A. M. Ledgerwood, 1978) считают такую меру излишней.
Мы считаем, что при обширной раневой поверхности печени, особенно при сочетанном повреждении других органов брюшной полости, нередко наблюдаются спазм сфинктера печеночно-поджелудочной ампулы и синдром желчной гипертензии, способствующие развитию холангита, просачиванию желчи в брюшную полость, появлению печеночно-почечной недостаточности и гемобилии. В этих случаях, наряду с основной операцией, необходима декомпрессия желчевыводящих путей. Для этой цели чаще всего используют холецистостомию (Б. В. Петровский, 1972) общего желчного протока. Декомпрессия желчных путей ведет к значительному улучшению функции печени, предотвращает развитие ряда тяжелых осложнений, снижает послеоперационную летальность.
Дренаж из желчных протоков мы удаляли с учетом восстановления перистальтики кишечника, количества отделяемой желчи, а также после получения достаточного пассажа контрастного вещества в двенадцатиперстную кишку при фистулографии. Если пассаж контрастного вещества свободен, восстановилась перистальтика кишечника, то дренаж удаляют независимо от количества истекающей по нему желчи. Желчный свищ в этих случаях быстро закрывается самостоятельно.
Интраоперационная летальность в большинстве случаев обусловлена массивной кровопотерей и составляет после закрытой травмы печени 9 %, после колото-резаных ранений — 1,4 °/о, после огнестрельных ранений — 3,5 % (R. U. Carmona и соавт., 1982).
Среди больных с признаками шока летальность достигает 34,2 % (J. S. Aldrete и соавт., 1979).
Корреляция кровотечения из раны печени и послеоперационной летальности показана в табл.5.

После обработки поврежденной печени обязательно выполняют ревизию других органов брюшной полости. Недостаточно тщательная ревизия может привести к оставлению неушитых повреждений кишки, почек, селезенки, что в свою очередь ведет к летальному исходу (Т. Т. Тунг, 1972).
Сопутствующие повреждения других органов значительно отягощают исходы хирургического лечения травмы печени. Если при изолированных повреждениях печени летальность составила 2,8 % (71 наблюдение), то при одновременном поражении еще трех органов—24,3 % (74 наблюдения) (R. U. Carmona и соавт., 1982).
Повреждение крупных сосудов — аорты, нижней полой вены, подвздошных артерий или вены — сочеталось с травмой печени у 82 больных, из них умерли 37, в то время как среди остальных 555 пострадавших летальность составила 10,5 % (С. Е. Lucas, Л. М. Ledgerwood, 1978). Авторы указывают, что сопутствующие повреждения ободочной кишки привели к возникновению внутрибрюшных абсцессов у 38 % из 103 пострадавших, в то время как из остальных 534 больных это осложнение развилось только У 6,2 %.
При спонтанных разрывах печени на фоне беременности обычно наступает летальный исход, несмотря на то что хирургическими методами удается достичь гемостаза (S. Aziz и соавт., 1983).
Послеоперационные осложнения. Тяжелые повреждения печени, сопровождающиеся большой кровопотерей, нередко вызывают развитие фибринолиза. При отрыве и размозжении участков паренхимы, повреждении печеночных и нижней полой вен частота фибринолиза достигает 51 % (W. R. Olsen, 1978). Авторы указывают, что препараты протромбина на фоне большой кровопотери могут провоцировать труднокорригируемые нарушения свертывания крови, поэтому считают противопоказанным использование их у больных с обширными повреждениями печени.
Неадекватный выбор метода первичного хирургического вмешательства при травме печени может сопровождаться рядом специфических осложнений. К ним относятся: 1) продолжающееся кровотечение через дренаж и (или) в брюшную полость, обнаруживаемое через 1—3 сут после травмы; 2) некроз и секвестрация участков паренхимы печени, проявляющиеся нарастанием симптомов печеночной недостаточности, внутрипеченочного абсцедирования и сепсиса; 3) аррозивное кровотечение из сосудов печени на фоне печеночной недостаточности и внутрипеченочного абсцесса; 4) гемобилия, билигемия; 5) нагноение внутрипеченочной гематомы; 6) внутренний или наружный желчный свищ; 7) посттравматические кисты печени; 8) поддиафрагмальный абсцесс.
Обнаружение этих осложнений требует повторного оперативного вмешательства.
Первые 4 вида осложнений обусловлены неправильной обработкой раны печени или неполным удалением нежизнеспособных участков паренхимы. Выбор объема оперативного вмешательства для устранения этих осложнений основывается на критериях, описанных выше, при рассмотрении методов первичной обработки повреждений печени.
Нагноение внутрипеченочной гематомы представляет, по сути, абсцесс печени. Методы его лечения рассмотрены в главе «Абсцессы печени».
Желчный свищ, исходящий из мелких протоков, не перевязанных при обработке раневой поверхности печени, закрывается самостоятельно под влиянием консервативной терапии, если обеспечено хорошее наружное дренирование выделяющейся желчи.
Желчные свищи, связанные с сегментарными желчными протоками, а также возникшие вследствие некроза и секвестрации печени, нагноения внутрипеченочной гематомы, не закрываются самостоятельно. Более того, если дренирование брюшной полости неадекватное или дренажи уже удалены, возможно образование внутреннего свища вследствие нагноения скапливающейся желчи и прорыва ее в другие органы — желудок, толстую кишку, через диафрагму в легкое.
Лечение таких свищей заключается в энергичной краткосрочной (в течение нескольких суток) интенсивной терапии, на фоне которой выполняют оперативное вмешательство: кратчайшим путем, желательно внебрюшинно, выделяют место выхода свища из паренхимы печени и дренируют его двумя перчаточно-трубчатыми дренажами, обеспечивая свободный отток отделяемого наружу.
Секвестры отторгнувшейся паренхимы печени удаляют. Опыт 10 подобных операций по поводу желчно-бронхиальных свищей показал их высокую эффективность. У всех больных наблюдались облитерация гнойной полости в печени и закрытие свища (О. Б. Милонов, В. А. Смирнов, 1982).
Лечение посттравматических кист печени описано в главе «Непаразитарные кисты печени».
Поддиафрагмальные абсцессы являются поздним осложнением, связанным с нагноением скопившейся под диафрагмой крови. Иногда нагноение поддерживает некротизированный сальник, который использовали с пластической целью.
О наличии поддиафрагмального абсцесса свидетельствуют боль в правой нижней половине грудной клетки с иррадиацией в лопатку, усиливающаяся при дыхании, болезненность и пастозность межреберных промежутков нижнего отдела грудной клетки справа, рентгенологически — высокое стояние диафрагмы справа и ограничение ее движений, нередко выпот в плевральной полости, повышение температуры тела, высокая СОЭ, лейкоцитоз.
Введение антибиотиков широкого спектра действия и дренирование абсцесса приводят к выздоровлению.
Из существующих способов дренирования поддиафрагмального абсцесса наилучшим является операция А. В. Мельникова (1923, 1924), преимуществом которой является внеплевральный доступ к поддиафрагмальному пространству.
Вскрытие поддиафрагмального абсцесса по Мельникову состоит в следующем: разрезом длиной 10 см обнажают и поднадкост-нично резецируют XII ребро. Между XII и XI ребрами обычно хорошо виден белесоватый плевральный листок синуса. Осторожно, преимущественно тупо, смещают плевральный синус кверху и подхватывают тупым широким крючком. Если при этом случайно повредили синус, отверстие его захватывают пеаном, перевязывают или зашивают, прихватывая для герметизации вышележащие межреберные мышцы и нижележащую диафрагму. Ниже плеврального синуса через диафрагму пунктируют и вскрывают абсцесс. В рану вводят корнцанг, которым расширяют отверстие. В полость абсцесса вводят марлевые и резиновые дренажи. Рану ушивают частично, до дренажей.
Из заднего доступа удобно вскрывать абсцессы, расположенные как в заднем внебрюшинном поддиафрагмальном пространстве, так и в задне-верхнем отделе внутрибрюшного поддиафрагмального пространства.
Вскрытие поддиафрагмального абсцесса из переднего доступа применяют тогда, когда абсцесс локализуется кпереди между диафрагмой и печенью. В большинстве случаев абсцессы подобной локализации вскрывают разрезом параллельно реберной дуге. Послойно рассекают кожу, подкожную клетчатку, мышцы до поперечной фасции, последнюю вместе с брюшиной тупо отслаивают кверху до флюктуирующей стенки абсцесса. После этого абсцесс вскрывают и широко дренируют.
Иногда абсцесс располагается высоко. В таких случаях его вскрывают разрезом параллельно и выше реберной дуги на протяжении 2—3 реберных хрящей. Последние обнажают и осторожно резецируют до перехода в костную часть ребер, чтобы не повредить расположенный под ними плевральный синус, который отсепаровывают от диафрагмы кверху. Рассекают диафрагму до брюшинного листка, реберные концы прикрывают верхним ее краем, фиксируя отдельными кетгутовыми швами. Абсцесс пунктируют иглой через брюшину и по игле вскрывают. В полость его вводят корнцанг, рану расширяют. Полость абсцесса дренируют марлевыми или резиновыми дренажами. Рану частично ушивают до дренажей.
Однако даже после тщательно выполненной первичной операции осложнения в ранний послеоперационный период возникают у 37,7 — 50 % больных, причем часто они множественные (В. С. Шапкин, Ж. А. Гриненко, 1977; R. U. Carmona и соавт., 1982). Большой удельный вес занимают гнойно-септические осложнения и осложнения, связанные с нарушением функции легких. Немаловажную роль в развитии осложнений играют сопутствующие повреждения, в первую очередь переломы ребер, а также разрывы желудка и кишечника.
L. M. Flint и соавторы (1977) отмечают, что развитие септических осложнений сопровождалось повышением уровня билирубина в крови до 51 мкмоль/л в течение не менее чем 5 сут у 13 из 19 больных, в то время как при отсутствии сепсиса желтуха выявлена только у 3 из 130 больных.
В клинике КНИИКЭХ оперированы 48 больных с изолированной закрытой травмой печени.
После вскрытия брюшной полости проводим интраоперационную ревизию. Если при этом выявляются повреждения печени, подводим турникет под гепатодуоденальную связку и пережимаем ее на срок до 15 мин. Это приводит к значительному уменьшению или полной остановке кровотечения из раневых каналов, что обеспечивает возможность тщательной ревизии с прицельным ушиванием атравматической иглой или лигированием сосудисто-секреторных элементов. Затем турникет снимаем и дальнейшую хирургическую тактику определяем, исходя из выраженности остаточного кровотечения, распространенности повреждения печени и сопутствующих поражений других органов. Если магистральные желчные протоки и крупные сосуды не повреждены, то изолированные трещины и неглубокие разрывы паренхимы органа ушиваем отдельными кетгутовыми швами.
Перед ушиванием глубоких разрывов печени удаляем некротически измененную паренхиму и производим ревизию раневого канала; при необходимости накладываем сосудистый шов в глубине раны. Выполнение перечисленных мероприятий считаем основным условием успешного лечения ранений печени.
При множественных, глубоких повреждениях отдельных долей и сегментов печени с нарушением целости сосудисто-секреторных элементов во многих местах считаем показанной резекцию печени (долевую, сегментарную и «резекцию-обработку»).
По поводу травм нами произведено 3 левосторонние гемигепатэктомии и 6 сегментарных резекций. В остальных наблюдениях выполнено ушивание раны, причем сосудистый шов стенки поврежденной воротной вены наложен у 3 и долевой печеночной артерии — у 1 больного.
Умерли 2 больных: один — от профузного кровотечения в результате аррозии стенки воротной вены при секвестрации девитализированных участков паренхимы и один — от тромбоэмболии легочной артерии. В разные сроки после первичного вмешательства оперированы 2 больных по поводу гнойных свищей. Они излечены путем удаления секвестрированных участков паренхимы печени. Таким образом, низкая летальность, благоприятные ближайшие и отдаленные результаты у абсолютного большинства больных подтверждают правильность выработанной тактики лечения.
Неполноценный гемо- и холестаз при обработке ран печени, оставление девитализированных участков паренхимы во время первичной операции, как правило, приводят к возникновению осложнений, лечение которых сопряжено с большими трудностями и подчас не уступает по сложности первичным вмешательствам.
Наиболее тяжелым осложнением является гемобилия, наблюдавшаяся у 8 больных в сроки от 12 дней до 4 мес после травмы. Кровотечение было упорным, рецидивирующим. Всем больным произведена селективная ангиография печени. При выявлении источника кровотечения методом выбора является эмболизация соответствующих ветвей печеночной артерии. Приводим наше наблюдение.
Больной Д., 21 года, поступил в клинику 09.09.85 г. с жалобами на приступообразную боль в правом подреберье, периодическую рвоту «кофейной гущей», дегтеобразный стул. 09.05.85 г. получил травму — был придавлен автоприцепом к стене. Оперирован в неотложном порядке по месту жительства: произведено ушивание раны печени. Впоследствии несколько раз поступал в хирургический стационар в связи с желудочно-кишечным кровотечением, которое купировали консервативными мероприятиями. Источник кровотечения не определен. С диагнозом язвенной болезни двенадцатиперстной кишки, осложненной кровотечением, больной оперирован 29.08.85 г. в районной больнице. Источник кровотечения не найден. 07.09.85 г. возникли приступообразная боль в правом подреберье, рвота с примесью крови, через сутки — желтуха. Переведен в КНИИКЭХ.
Состояние больного средней степени тяжести. Кожа бледная. Пульс 84 в 1 мин. Анализ крови: эр. 3,0-1012/л, Нв 80 г/л. Ультрасоноскопия 10.09.85 г.: печень умеренно увеличена, явления хронического гепатита. Желчный пузырь, селезенка без патологических изменений. Эзофагогастродуоденоскопия 10.09.85 г.: умеренно выраженные явления хронического гастродуоденита. Артериография общей печеночной артерии 11.09.85 г.: симптомы «ампутации» сегментарной ветви правой печеночной артерии и зона гиперваскуляризапии веретенообразной формы у места отхождения сегментарных ветвей размерами 12-7 см в виде «пропитывания» печеночной паренхимы контрастным веществом. Произведена транскатетерная эмболизация правой печеночной артерии эмболами из органосовместимого пенополиуретана. Осложнений не наблюдалось.
Послеоперационный период протекал без осложнений. Осмотрен через 8 мес. Практически здоров, кровотечение не рецидивировало, приступил к прежней работе.
Недостаточное удаление девитализированных тканей, неполноценный холестаз в зоне повреждения при неадекватном дренировании приводят также к образованию посттравматических кист, а при присоединении инфекции — абсцессов печени или стойких гнойных свищей. Решающее значение в диагностике этих осложнений играет двухмерная эхотомография с последующей пункцией выявленного образования под контролем ультразвука. Метод пункционной санации, а также чрескожное чреспеченочное дренирование полости абсцесса под контролем ультразвуковой эхотомоско-пии являются альтернативой полостному оперативному вмешательству. Только в том случае, если невозможна полноценная санация указанным способом, необходимо прибегнуть к оперативному вскрытию и широкому дренированию абсцесса. Более подробно принципы лечения посттравматических абсцессов и кист печени описаны в последующих главах.
Множественные желчные свищи, исходящие из долевых печеночных протоков, являются показанием к резекции печени. Путем левосторонней лобэктомии излечены 2 больных со свищами, исходящими из протоков левой доли печени. Если причиной развития свищей являются посттравматические рубцовые стриктуры желчных протоков, показано иссечение зоны стриктуры с наложением билиодигестивных анастомозов (4 наблюдения). Для профилактики рецидивов стриктур у 3 больных применили транспеченочное дренирование.
Успехи лечения травм печени в значительной мере зависят от своевременной доставки пострадавших в медицинское учреждение и полноценности реанимационных мер во время транспортировки. В первые 2—3 ч после травмы госпитализируют 71—87 % пострадавших (Г. Н. Гагаркин, 1978; С. В. Лохвицкий и соавт., 1982).
Своевременная и высококвалифицированная хирургическая помощь позволяет значительно уменьшить число осложнений и снизить летальность после травм печени. Поэтому всем больным с подозрением на повреждение печени показаны консультация специалиста и при необходимости перевод в специализированное отделение в 1-е сутки после травмы.
