
- •Часть I хирургия печени
- •Глава 1. Анатомия и физиология
- •Глава 2. Опухоли печени
- •Глава 3. Травматические повреждения печени
- •Глава 4. Абсцессы печени
- •Глава 5. Эхинококкоз и альвеококкоз печени
- •Глава 6. Непаразитарные кисты печени
- •Глава 7. Хронический гепатит, цирроз печени и синдром портальной гипертензии
- •Глава 8. Пересадка печени
- •Часть II
- •Глава 1. Анатомия и физиология
- •Глава 2. Аномалии развития желчевыводящих путей
- •Глава 3. Желчнокаменная болезнь и заболевания желчного пузыря
- •Глава 4. Непроходимость желчных протоков доброкачественной этиологии
- •Глава 5. Рак желчного пузыря и внепеченочных желчных протоков
Глава 4. Непроходимость желчных протоков доброкачественной этиологии
Проблема хирургического лечения патологии магистральных желчных протоков до настоящего времени остается нерешенной. По данным В. В. Виноградова и соавторов (1977), операции по поводу непроходимости желчных протоков составляют 32,4 % всех операций на желчевыводящих путях. Холедохотомия, как наиболее простая операция на магистральных желчных протоках, выполняемая при их непроходимости, составляет 14—41,3 % всех первичных операций на желчевыводящих путях (В. М. Ситенко и соавт., 1975; В. В. Родионов и соавт., 1976; Д. Л. Пиковский, В. И. Ефеб, 1977; А. А. Русанов и соавт., 1977; А. А. Волков и соавт., 1978; М. В. Данилов и соавт., 1989; А. А. Шалимов и соавт.,
1989; R. Schmidt и соавт., 1977). Поэтому неудивительно, что вопрос хирургического лечения патологии магистральных желчных протоков в настоящее время находится в центре внимания многих ученых п практических хирургов. В последнее 10-летие решен ряд частных вопросов, касающихся хирургического лечения непроходимости желчных протоков, но остаются спорными вопросы о том, В каких случаях необходимо выполнять холедохотомию, как лучше ее заканчивать — наложением глухого шва или наружным дренированием общего желчного протока, что предпочтительнее — хо-ледоходуодено-, холедохоеюностомия, прямые трансдуоденальные вмешательства на терминальном отделе желчного протока или эндоскопическая папиллотомия.
Далеко не решенной остается и проблема хирургического ле-чения рубцовых стриктур желчных протоков, несмотря на то что В последние годы достигнут определенный успех в этом разделе хирургии.
В связи с существованием общих принципов лечения разнообразных форм непроходимости внепеченочных желчевыводящих путей на различном уровне и в соответствии с оперативно-техническими и оперативно-тактическими задачами мы различаем 3 вида непроходимости в зависимости от уровня препятствия желчеоттоку:
1) непроходимость дистальных отделов общего желчного протока;
2) непроходимость супрадуоденальной части общего желчного и общего печеночного протоков;
3) непроходимость начального отдела общего печеночного протока и развилки печеночных протоков.
Необходимо отметить, что уровень непроходимости определяется по проксимальной границе, и, кроме того, непроходимость может быть одновременно на различных уровнях, поэтому лечение каждого больного должно быть индивидуализированным и проводиться с учетом причин поражения, локализации и протяженности вовлеченных в патологический процесс желчных протоков.
В зависимости от этиологии мы различаем следующие виды непроходимости: 1) обтурационную, обусловленную желчными камнями, инородными телами (нити, иглы, фрагменты дренажей), перевязкой протоков во время операции, сгустками крови при гемобилии, паразитами;
2) непроходимость при заболеваниях стенки желчных протоков— врожденных аномалиях (гипоплазия и кисты желчных протоков, атрезия желчных путей), воспалительных заболеваниях (стенозирующие папиллит и холангит), рубцовых стриктурах (посттравматические и воспалительные), доброкачественных опухолях желчных путей;
3) непроходимость вследствие внепротоковых заболеваний, вовлекающих в процесс желчные протоки: тубулярный стеноз общего желчного протока на почве хронического панкреатита, язвенная болезнь двенадцатиперстной кишки, парахоледохеальный лимфаденит, спаечная болезнь брюшной полости с деформацией общего желчного протока.
Врожденные аномалии, гемобилия, паразитарные и опухолевые поражения желчных протоков освещены в отдельных главах книги.
Нарушения проходимости желчных протоков за счет сдавления спайками и увеличенными лимфатическими узлами встречаются очень редко, поэтому всегда следует исключить другие причины заболевания.
Обобщая опыт 2994 операций у больных с полной или частичной непроходимостью желчных протоков доброкачественного характера, мы выявили следующие причины ее возникновения.
Холедохолитиаз. Наиболее частой причиной непроходимости желчных протоков (67,4 %, по нашим данным) являются желчные камни. Они встречаются чаще у женщин (В. В. Родионов и соавт., 1980; В. К. Гостищев и соавт., 1982; С. А. Шалимов и соавт., 1989, 1991, 1992).
Под нашим наблюдением находились 1477 больных с холедохолитиазом, которым выполнена 1481 операция. Летальность составила 2,3 %.
Этиология и патогенез. У большинства больных холедохолитиаз бывает вторичным — мелкие холестериновые камни мигрируют в общий желчный проток из желчного пузыря и там увеличиваются за счет отложения желчного пигмента. Крупные камни иногда попадают в общий желчный проток при образовании пузырно-хо-ледохеального свища. После холецистэктомии камни очень редко образуются в общем желчном протоке, и если их впоследствии все же обнаруживают, то в большинстве случаев потому, что они не были выявлены при первой операции.
Первичный холедохолитиаз отмечается только у 2—5 % больных и возникает обычно при гнойном холангите и нарушении оттока желчи вследствие Рубцовых сужений протока. После холецистэктомии, если не создаются условия для свободного оттока желчи, могут снова образоваться камни. Они обычно очень мягкие и встречаются в сочетании с желчным песком и замазкоподобной желчью. В некоторых случаях во время операции обнаруживают обычно единичный камень при отсутствии камней в желчном пузыре, но и в этих случаях нельзя диагностировать «бескаменный» холецистит и первичный холедохолитиаз. Как показывают опыт и исследование подобных камней, они имеют пузырное происхождение.
Иногда причиной образования желчных камней непосредственно в желчных протоках являются комочки пищи и инородные тела, проникающие из двенадцатиперстной кишки (И. Р. Рустамов и соавт., 1982; А. М. Тетдоев, В. Д. Подгайный, 1982; J. L. Ban и соавт., 1972). Как сообщают А. И. Нечай и соавторы (1989), L. Sava и соавторы (1978), с 1887 г. до настоящего времени описано более 100 случаев инородных тел общего желчного протока.
Причинами образования камней могут быть узелки нейлоновых и капроновых нитей (А. И. Нечай, 1975; В. В. Родионов и соавт., 1977, и др.), металлическая бранша зажима, марлевый тампон (С. Д. Попов, 1979).
Причиной внутрипеченочного образования камней является повышенная функциональная активность слизистых желез желчных протоков (К. Yamamoto, 1982). Слизь, выделяемая железами, препятствует свободному оттоку желчи и вокруг нее скапливаются кристаллы билирубина, других компонентов желчи, клеточный детрит. Наш опыт свидетельствует о том, что в подобных случаях развивается стеноз большого сосочка двенадцатиперстной кишки, который препятствует свободному оттоку желчи и способствует образованию камней. Холедохолитиаз не только создает механическое препятствие оттоку желчи, но и нарушает работу сфинктера ампулы большого сосочка двенадцатиперстной кишки, создавая предпосылки к появлению дуоденобилиарного рефлюкса.

Патологическая анатомия. Холедохолитиаз во всех случаях ведет к нарушению оттока желчи, вплоть до полной непроходимости желчных протоков, развитию холангита, тяжелым изменениям стенок желчных протоков с образованием перфорации, пролежней, внутренних свищей.
Перфорация желчных протоков сама по себе встречается редко. Следствием перфорации является желчный перитонит.
Иногда желчный перитонит возникает и без видимого перфорационного отверстия, однако неизменно диагностируют холедохолитиаз и нарушение оттока желчи естественным путем (R. Bozzocchi и соавт., 1978; G. Moscia, R. Seaglione, 1980).
Нарушение проходимости желчных протоков, как правило, связано с воспалительным процессом. Стенки протоков уплотняются, соединительнотканная пластинка становится толще. Количество бокаловидных клеток в слизистой оболочке резко увеличивается, она становится отечной, рыхлой, гиперемированной, в тяжелых стадиях происходит изъязвление, развивается холангит.
По степени изменения слизистой оболочки желчных протоков выделяют несколько форм холангита (В. В. Виноградова, В. Л. Занделов, 1981). Катаральный холангит проявляется гиперемией, отечностью слизистой оболочки, мелкоточечными кровоизлияниями в подслизистом слое. Фибринозный холангит характеризуется отложением фибрина на стенках и скоплением фибриновых пленок в просвете протоков, гиперемией и кровоизлияниями на стенках протоков. Фибринозно-язвенный холангит отличается резкой гиперемией и кровоизлияниями на стенках желчных протоков, истончением, образованием эрозий и изъязвлений слизистой оболочки, массивными отложениями фибрина. При гнойном хо-лангите в просвете желчных протоков обнаруживают зеленоватого цвета экссудат, гной на стенках протоков с участками р-асплавле-ния — сплошной налет фибрина, истончение стенок протоков. Морфологическими признаками хронического холангита являются атрофия и рубцовая деформация стенок желчных протоков.
При бактериологическом исследовании желчи у больных холангитом наиболее часто обнаруживают кишечную палочку, клебсиеллы, протей, синегнойную палочку, реже — стафилококк. Иногда при посеве желчи на питательные среды роста микроорганизмов не происходит, однако имеет место рост неспорообразующей анаэробной микрофлоры, для выявления которой необходимы специальные условия (Э. И. Гальперин и соавт., 1982; Б. В. Петровский, 1985; J. E. Thompson и соавт., 1982; N. J. Lygidokis, 1982). Несмотря на достижения современной интенсивной терапии и хирургии, летальность при гнойном холангите достигает 50 % (Kinoshita и соавт., 1984).
Гнойное воспаление внутрипеченочных желчных протоков может приводить к возникновению абсцессов печени. Это еще более осложняет лечение.
Обтурационная желтуха возникает в результате полной закупорки желчных протоков. При неполной обтурации желчных протоков развитию желтухи способствует нарушение функции гепатоцитов, провоцируемое холангитом, цирротическими изменениями печени.
Своеобразным видом нарушения проходимости желчных протоков являются свищи между двенадцатиперстной кишкой и дис-гальным отделом общего желчного протока. Причиной возникновения таких свищей может быть как холедохолитиаз с пролежнем стенок полых органов, так и язвенная болезнь двенадцатиперстной кишки (А. А. Гринберг, П. В. Наумов, 1981; Т. Juvara, С. Dragomiresch, 1981).
Нарушение проходимости желчных протоков в первую очередь отражается на их диаметре.
Принципиальное значение имеет установление диаметра общего желчного протока.
По данным Manenti и соавторов (1985), расширение желчных протоков до 12 мм и более у 60 % было связано с наличием холелитиаза, а у 40%—со стенозом сфинктера печеночно-поджелудоч-ной ампулы. Аналогичные данные представлены и другими хирургами.
Наш опыт свидетельствует о том, что нормальной шириной общего желчного протока следует считать при функционирующем желчном пузыре ширину до 9 мм, при нефункциопирующем или удаленном — до 10 мм. Ширина общего желчного протока от 10 до 12 мм у 50 % больных обусловлена нарушением проходимости желчных протоков, ширина общего желчного протока 12 мм и более всегда свидетельствует о наличии патологии. Застой желчи при непроходимости желчных протоков ведет к ее специфическим изменениям. Желчь становится мутной, с примесью хлопьев, состоящих из слизи, детрита бокаловидных клеток, солей кальция билирубината, лейкоцитов, микроорганизмов. При прогрессировании заболевания количество слизи, лейкоцитов в желчи настолько увеличивается, что по сути желчь представляет собой гной. Белая желчь в общем желчном протоке — редкое осложнение непроходимости. Мы отмечали его только у 8 больных. Причины образования белой желчи в протоках до настоящего времени не выяснены.
Следствием задержки оттока желчи являются воспалительные изменения печени по типу гепатита. Однако, если желтуха существует длительное время, то развивается билиарный цирроз печени.
Клиника и диагностика. Во всех случаях наличия желчного пузыря холедохолитиаз является осложнением острого или хронического холецистита. Поэтому клиническая картина складывается из проявлений холецистита и частичной или полной непроходимости желчных протоков. Клинические признаки непроходимости желчных протоков у больных с удаленным желчным пузырем являются ведущими.
Желтушность кожи и склер носит обтурациопный характер. Из-за нарушения выведения в двенадцатиперстную кишку желчь в большом количестве всасывается в кровеносное русло. Типично развитие желтухи через 1—2 сут после появления сильной боли в правом подреберье.
Иногда больные не обращают внимания на изменение цвета кожи, особенно если интенсивность и длительность желтухи небольшая. Правильной оценке состояния помогает выявление других признаков обтурации желчных протоков. Характерно темное окрашивание мочи («цвета пива»), а также бело-глинистое окрашивание каловых масс.
Желтуха при поступлении или в анамнезе установлена нами у 85 % больных с нарушением проходимости желчных протоков. Однако желтуха при нарушенной проходимости желчных протоков носит не только механический характер. Определенное значение имеет повреждение гепатоцитов вследствие застоя желчи и холангита.
Озноб, повышение температуры тела до 38 °С и более являются признаками холангита. Их мы отметили у 34 % больных. Появлялись они как в сочетании с болевыми приступами, так и вне их. Длительность температурной реакции колебалась от 1 до 14 сут. Вспомогательные исследования. Биохимические исследования крови выявляют признаки обтурационной желтухи и нарушения функции печени.
Уровень билирубина в крови более 20 мкмоль/л свидетельствует о затруднении оттока желчи. Для обтурационной желтухи характерно увеличение содержания в крови прямого билирубина, связанного с глюкуроновой кислотой,— билирубиндиглюкуронида. Несмотря на то что концентрация непрямого билирубина и били-рубинмоноглюкуронида повышается также вследствие нарушения функции гепатоцитов, соотношение форм билирубина сдвигается в сторону билирубиндиглюкуронида, который составляет 50—80 % и более.
Щелочная фосфатаза — фермент, содержащийся в печени и костях человека, выделяется с желчью. Нарушение проходимости желчных протоков сопровождается повышением уровня щелочной фосфатазы более 10 ед.
Повышение активности трансаминаз крови (аланиновой и ас-парагиновой) более 30 ед. указывает на нарушение проницаемости мембран гепатоцитов. В большей мере повышается активность аланиновой трансаминазы.
Если в норме коэффициент АсАТ/АлАт равен 1,3—1,4, то при желтухе он снижается.
Содержание общего белка крови при нарушении проходимости желчных протоков не снижается. Вместе с тем, значительно изменяется соотношение белковых фракций. Печеночная недостаточность вследствие желтухи и холангита приводит к снижению уровня альбумина до 30 г/л и менее, альбумино-глобулиновый коэффициент снижается и становится равным менее 1.
Свертывание крови нарушается только при тяжелой печеночной недостаточности, которая у больных с нарушением непроходимости желчных протоков доброкачественной этиологии бывает редко.
На основании обследования 112 больных с желтухой на почве обтурации желчных протоков доброкачественной этиологии М. И. Филимонов и В. А. Шестаков (1982) установили уменьшение свертывания крови за счет удлинения времени реакции при тром-боэластографии, снижения толерантности к гепарину, уменьшения содержания в крови фибриногена. Перечисленные показатели изменялись на 19—110% по сравнению с нормой. Однако при обострении холангита уровень фибриногена в крови был высоким.
Снижение свертывания крови при длительности желтухи 10— 14 сут, по данным авторов, не вызывало геморрагических осложнений во время операции.
Третья фаза свертывания крови (осадок внесгустковых кровяных телец, выпадающих на дно пробирки) у больных с обтурационной желтухой на почве холедохолитиаза составляет 0,1—0,25 мл при норме 0,4—0,8 мл, а время ее образования— ПО—240 мин при норме 180—240 мин (Г. В. Головин, К. М. Курбанов, 1981).
Углеводный о б м е н. У больных с непроходимостью желчных протоков снижается толерантность к глюкозе и уменьшается выделение инсулина (М. И. Филимонов и соавт., 1980). Выраженность нарушений углеводного обмена находится в прямо пропорциональной зависимости от степени тяжести основного заболевания.
Содержание микроэлементов (меди и железа) в крови при обтурационной желтухе изменяется в сторону увеличения концентрации меди.
Применяют две разновидности бромсульфалеиновой пробы. Первая связана с выявлением ретенции бромсульфалеина в крови, вторая — с результатами исследования дуоденального содержимого.
Первая проба широко известна как проба с нагрузкой бром-сульфалеином (проба Розенталя и Уайта, 1925). После внутривенного введения 5 % стерильного раствора бромсульфалеина (из расчета 5 мг/кг) через 2—3 мин в крови создается максимальная концентрация красителя, которую принимают за 100 %. Через 45 мин в кровяном русле в норме остается не более 5 % краски. Пробы крови из вены другой руки отбираются соответственно через 3 и 45 мин после инъекции препарата. Содержание бромсульфалеина в последней пробе крови более 5 % от исходной максимальной концентрации позволяет расценивать тест как положительный (патологический). Ретенция бромсульфалеина находится в прямо пропорциональной зависимости от тяжести поражения печени.
Более показательным и информативным является метод определения клиренса бромсульфалеина (А. С. Логинов, И. С. Клема-шев, 1969), который основан на динамической регистрации концентрации красителя в фазе быстрого поглощения бромсульфалеина гепатоцитами, продолжительность которой составляет 18— 20 мин (И. С. Клемашев, В. И. Фомичев, 1975). Графически закон очищения крови от бромсульфалеина изображается в виде экспоненты. Целесообразно сочетать определение ретенции красителя и его клиренс, для чего пробы крови берут через 5, 8, 11, 14 и 45 мин после инъекции бромсульфалеина. Полупериод поглощения (клиренс) рассчитывают с помощью специальных формул либо по номограммам.
Недостатком бромсульфалеиновой пробы является то, что скорость выделения красителя зависит от скорости его внутриклеточной конъюгации.
Другой препарат — индоциан — лишен указанного недостатка, поскольку проходит через печень в несвязанном виде и отражает в основном выделительную функцию гепатоцитов. В силу этого пробу с индоцианом можно применять и у больных с желтухой. Индоциан зеленый вводят внутривенно в дозе 0,5 мг/кг. В норме через 20 мин его концентрация не должна превышать 4 % от исходной.
Вторая проба с бромсульфалеином не получила еще достаточного распространения, но широко применяется в нашей клинике. Проба основана на определении так называемого бромсульфалеи-нового времени, то есть интервала времени от момента введения красителя в кровяное русло до появления бромсульфалеина в просвете двенадцатиперстной кишки. Является одной из самых чувствительных проб в выявлении холестаза и дает положительные результаты на ранних стадиях развития процесса, когда иные методы биохимического анализа крови оказываются неэффективными. Данную пробу целесообразно сочетать с определением ретенции бромсульфалеина. Техника выполнения ее в таком случае заключается в следующем: натощак в просвет двенадцатиперстной кишки вводят дуоденальный зонд. Расположение оливы контролируется рентгенологически. Из локтевой вены получают 5 мл крови и через ту же иглу вводят 5 % раствор бромсульфалеина (из расчета 5 мг/кг). Затем забирают из локтевой вены другой руки пробы крови через 3 и 45 мин. Одновременно с этим непрерывно собирают содержимое двенадцатиперстной кишки в емкость, содержащую 10 % раствор едкого натра или 10 % раствор едкого кали. Как только желчь, содержащая бромсульфалеин, начнет поступать в предназначенную для ее сбора емкость, она тотчас же окрасится в красноватый или лиловый цвет. Регистрируют время введения красителя в вену и момент появления желчи, содержащей бромсульфалеин. При нормальном давлении в желчных протоках этот интервал колеблется в пределах 8—15 мин, верхняя граница нормы — 24 мин. Замедление выявления бромсульфалеина свыше 24 мин свидетельствует о билиарной гипертензии. Наш опыт применения данной пробы подтверждает ее высокие диагностические возможности.
Выделительная холецистохолангиография. Методика исследования описана в предыдущей главе. При подозрении на нарушение проходимости желчных протоков наибольшей диагностической ценностью обладает инфузионно-капельная холангиография. При уровне билирубина в крови менее 34 мкмоль/л заключение о расширении общего желчного протока более 1 см было получено у 92,8 % наблюдаемых нами больных. Вместе с тем, холедохолитиаз не был обнаружен у 36 %, заключение о количестве камней в общем желчном протоке было неверным у 41 % больных. Следовательно, выделительная холецистохолангиография достаточно информативна для установления показаний к хирургическому лечению, но не дает четкого представления о причине нарушения проходимости желчных протоков.
Эндоскопическая ретроградная холангиография. Опыт более 6000 исследований, проведенных в клинике КНИИКЭХ (М. Д. Семин, 1991), свидетельствует о том, что их наиболее целесообразно выполнять у больных с клинически выраженной желтухой либо при непереносимости препаратов йода. Всем остальным больным на первом этапе обследования надо применять выделительную холангиографию.
Эндоскопическая ретроградная холангиография позволяет оценить диаметр желчных протоков с точностью до 1 мм, а также количество камней в них. Наши наблюдения свидетельствуют о совпадении до- и интраоперационных данных.
Такого плотного прижатия камней к стенкам желчных протоков, которое полностью исключало бы проникновение контрастного вещества выше места препятствия, мы не наблюдали ни у одного больного с холедохолитиазом. Всем больным удавалось ввести некоторое количество контрастного вещества выше места препятствия и таким образом определить характер и размеры последнего. Это обстоятельство служит важным подспорьем при проведении дифференциальной диагностики холедохолитиаза, руб-цовых стриктур и опухолей желчных протоков.
Результаты эндоскопической ретроградной холангиографии обеспечили правильную диагностику нарушения проходимости желчных протоков у 89 % обследованных.
В последнее время при эндоскопической ретроградной холангиографии стали использовать методику тугого наполнения желчных протоков, которое обеспечивает более четкое контрастирование всех отделов желчных и печеночных протоков. Такое исследование высокоинформативно также у больных, которым ранее были произведены вмешательства на большом сосочке двенадцатиперстной кишки или наложены билиодигестивные анастомозы. Методика исследования заключается в следующем (S. Ikeda и соавт., 1981). Катетер для канюлирования и контрастирования желчных протоков имеет вид двухканальной трубки. Один из каналов, диаметром 2,8 мм, используют для введения контрастного вещества, а второй, диаметром 1,67 мм,— для раздувания баллона, расположенного на расстоянии около 5 мм от конца катетера. После введения в желчные протоки баллон раздувают до полной обтурации протока, а затем выполняют холангиографию.
Эндоскопическая ретроградная холедохоскопия стала возможной благодаря дальнейшему развитию оптической техники. Сущность метода заключается в том, что после канюляции большого сосочка двенадцатиперстной кишки в желчные протоки вводят эндоскоп с наружным диаметром 5 мм и осматривают просвет протоков вплоть до внутрипеченочиых.
Ограничениями к применению метода служат нарушения проходимости дистального отдела желчного протока — стенозирующий папиллит, вколоченный камень большого сосочка двенадцатиперстной кишки, индуративный панкреатит.
Чрескожная чреспеченочная холангиография тонкой иглой показана тем больным, у которых два вышеописанных метода обследования желчных протоков невыполнимы либо-оказались недостаточно информативными. Эффективность чрескожной чреспеченочной холангиографии, по данным литературы, колеблется в пределах 91 —100% при расширенных протоках и 67—90% — при нерасширенных.
Радиологическое исследование. Для оценки проходимости желчных протоков используют препараты, меченные 99тТс. Методика исследования описана в предыдущей главе. R. Stoppa и соавторы (1981) применяли 2,6-диметил-ацетанилид или 2,6-диэтил-ацетанилид. Избирательное поглощение веществ из крови, быстрое выведение их желчью и отсутствие обратного всасывания в кишечнике позволили авторам оценивать проходимость как самих желчных протоков, так и наложенных ранее билиодигестивных анастомозов. При нормальной проходимости радиоактивность в области печени и желчных протоков незначительна, через 24 ч определяются следы радионуклида в ободочной кишке. Неполная блокада оттока желчи проявлялась высокой радиоактивностью в области печени, изображение желчных протоков сохранялось до 45 мин и более. Полная обтурация желчных протоков сопровождалась незначительным накоплением радионуклида в области печени, изображение желчных протоков отсутствовало.
Исследованиями Л. В. Бучневой (1989) доказано, что эхография является неинвазивным, легко доступным методом исследования, обеспечивающим возможность достоверной дифференциальной диагностики обтурационной и паренхиматозной желтух у 92,4 % больных.
Автор указывает, что все больные с желтухой, у которых на эхограммах ширина общего желчного протока больше 0,4 см, должны быть отнесены в группу риска. Для распознавания типа желтухи целесообразно применять динамическое ультразвуковое
исследование и другие инструментальные методы. Основными эхографическими признаками холедохолитиаза являлись умеренное расширение и нормальный просвет внутрипеченочных желчных протоков с одновременной дилатацией общего желчного протока, престенотическое ампуловидное расширение последнего, ровные очертания места его обрыва, а также эхографическое изображение одного или нескольких камней в его просвете.
Сцинтиграфию после внутривенного введения 300 мкКи бромсульфалеина или бенгальского розового, меченных 131J, применили для дифференциальной диагностики желтух D. J. Tapalaga и соавторы (1981). Последовательно производили 60 кадров продолжительностью по 10 с. Контролировали радиоактивность над областями сердца, печени, желчного пузыря и двенадцатиперстной кишки. В норме радиоактивность над областью сердца уже не определялась через 10 мин, а над кишечником она появлялась через 20—30 мин. Нарушение оттока желчи проявлялось накоплением радионуклида в области желчных протоков и замедлением выделения его в кишечник.
Ультразвуковое сканирование позволяет подтвердить обтурационный характер желтухи в 63—90 % наблюдений (Е. A. Deitch, 1981; Aebanesi и соавт., 1984). Нарушение проходимости внепеченочных желчных протоков обнаруживалось достоверно, если их диаметр превышал 1 см (Р>0,001), а внутрипеченочных — 0,5 см (Р>0,001). При диаметре внепеченочных желчных протоков менее 0,8 см, а внутрипеченочных — менее 0,4 см проходимость протоков была свободной (Р>0,001). В целом ультразвуковое сканирование позволило оценить диаметр внутрипеченочных желчных протоков у 81 %> а внепеченочных — у 62 % обследованных. Результаты измерений совпали с интраоперационными данными в 84 % наблюдений.
Поскольку информативность ультразвукового сканирования желчных протоков прямо пропорциональна их диаметру, считают, что оптимальными условиями для проведения исследования являются срок 1 нед после развития желтухи и уровень билирубина в крови более 51 мкмоль/л (Н. Lehr и P. Seer, 1981).
Приведенные данные, а также свойства ультразвукового сканирования позволяют отнести этот метод к числу ведущих при обследовании больных с нарушением проходимости желчных протоков.
Компьютерная томография по своей информативности несколько превосходит ультразвуковое сканирование (Н. Lehr и P. Seer, 1981). Однако из-за большой дороговизны исследование не получило широкого распространения.
Лапароскопию и лапароскопическую холангиографию широко применяли до появления эндоскопической ретроградной холангиографии и ультразвукового сканирования. В настоящее время их
применяют лишь в тех случаях, когда указанные выше методы не позволяют провести дифференциальную диагностику между скле-розирующим холангитом и билиарным циррозом печени. Однако и при этих заболеваниях лапароскопическое обследование не имеет существенных преимуществ перед чрескожной чреспеченочной холангиографией и биопсией печени тонкой иглой.
Релаксационная дуоденография. Больному вводят подкожно 4—6 мл 0,1 % раствора метацина и через 20—30 мин производят рентгенологическое исследование желудка и двенадцатиперстной кишки.
Рефлюкс контрастного вещества из двенадцатиперстной кишки в общий желчный проток и проток поджелудочной железы наблюдали у 7 из 147 больных М. А. Трунин и соавторы (1981). Они указывают, что рефлюкс — явление вторичное, обусловленное патологией желчных протоков и поджелудочной железы.
Информативность селективной ангиографии чревного ствола и верхней брыжеечной артерии, применяемой для диагностики нарушения проходимости желчных протоков доброкачественной этиологии, невысока, в связи с чем метод не получил распространения (В. И. Мамчич, 1979; В. М. Буянов и соавт., 1980).
Диагноз холедохолитиаза ставят на основании характерной клинической картины (приступы печеночной колики, сопровождающиеся желтухой, повышением температуры тела, ознобом), биохимических и специальных исследований.
Дифференциальная диагностика. Нарушение проходимости желчных протоков на почве холедохолитиаза дифференцируют с: 1) стенозирующим папиллитом; 2) Рубцовыми стриктурами желчных протоков; 3) склерозирующим холангитом; 4) врожденной кистозной трансформацией желчных протоков; 5) опухолями желчных протоков, желчного пузыря, органов панкреатодуоденальной зоны и печени; 6) паренхиматозной желтухой; 7) синдромом Gilbert; 8) гемолитической желтухой.
Перечисленные выше первые 5 заболеваний связаны с механическим нарушением проходимости желчных протоков, которые можно устранить с помощью хирургического вмешательства. В предоперационный период иногда достаточно выявить сам факт затрудненного оттока желчи, а точный нозологический диагноз устанавливают непосредственно во время операции. Однако надеяться на то, что во время операции станет все ясно, нельзя, поэтому в дооперационный период следует максимально уточнить характер патологии, используя для этого все современные способы диагностики.
Стенозирующий папиллит часто сочетается с холелитиазом и клинически мало отличается от последнего. Лишь эндоскопическая ретроградная холангиография позволяет быстро поставить правильный диагноз.
Рубцовые стриктуры желчных протоков несколько проще отдифференцировать от холедохолитиаза, хотя последний также часто сопровождается вторичным холедохолитиазом. Наиболее четкое представление об этой патологии можно получить путем эндоскопической ретроградной и чрескожной чреспеченочной холангио-графии, выполняя эти исследования раздельно или одновременно. Диагноз склерозирующего холангита можно уточнить путем эндоскопической ретроградной холангиографии и окончательно — во время операции, после гистологического исследования стенки желчного протока в месте поражения.
Врожденная кистозная трансформация желчных протоков может быть заподозрена до операции на основании типичного расширения желчевыводящих путей по данным прямой холангиографии. Однако окончательный диагноз устанавливают после гистологического исследования стенки протока (см. главу 2).
Опухоли желчных протоков и печени до операции диагностируют на основании результатов специальных исследований. Однако при малых размерах опухоли или развитии новообразования на фоне холедохолитиаза поставить правильный диагноз удается только во время операции.
Лечение. Существует два метода лечения холелитиаза — неоперативный и оперативный.
Неоперативные методы лечения холелитиаза применяют в первую очередь у больных, перенесших холецистэктомию. Холелитиаз у этих больных, как правило, является результатом «оставленных» конкрементов во время холецистэктомии и вопрос о повторной операции обычно нежелателен как для больного, так и для оперировавшего хирурга. Различают две группы таких больных: 1) с наличием наружного дренажа желчных протоков, когда «оставленный» камень обнаруживают вскоре после операции при первой же чресдренажной холангиографии;
2) с наличием одного или нескольких камней в желчных протоках, обнаруженных через некоторое время после оперативного вмешательства, проявляющихся холангитом, перемежающейся или стойкой желтухой на фоне приступов печеночной колики.
Неоперативные методы лечения у этих больных имеют свои отличия и особенности.
Наличие дренажа желчных протоков или желчного свища несколько облегчает задачу хирурга, так как имеется доступ к просвету желчных протоков. Лечение состоит в следующем: 1) удаление камней; 2) проталкивание их в просвет двенадцатиперстной кишки; 3) аспирация их мощным отсосом. Главным условием во всех случаях является наличие достаточно широкой трубки в желчных протоках или незакрывающегося желчного свища. Наличие широкой дренажной трубки в желчном протоке является наиболее удачным вариантом, позволяющим приступить к удалению камня вскоре после его обнаружения и улучшения общего состояния больного. В связи с этим в некоторых случаях при отсутствии полной уверенности в удалении всех камней из общего желчного протока его дренируют трубками достаточной ширины. При наличии наружного желчного свища возникает необходимость в расширении его просвета для введения соответствующего инструмента. С этой целью используют чаще всего эластические пластмассовые бужи различного диаметра. Перед бужированием их подогревают и оставляют в просвете свища на 24—48 ч. Бужирование надо проводить не сразу после операции, так как возможно создание ложного хода и повреждение соседних органов, а спустя 1—2 мес. Увеличение срока не имеет практического значения, успешное удаление желчных камней возможно и в более поздние сроки, через 1 год и более после операции. Бужирование свищевого хода редко достигается однократным приемом, чаще всего требуется терпеливое многократное бужирование.
Для удаления желчных камней используют различные инструменты: 1) изогнутые специальные щипцы; 2) петли или корзинки Дормиа, снабженные специальными катетерами-направителями; 3) катетеры Фогарти специальных конструкций; 4) различные зонды-проводники, расширители. Удаляют камни под контролем рентгенотелеэкрана с усилителем яркости изображения.
В самых простых случаях камень захватывают инструментом и извлекают часто вместе с дренажной трубкой. Если камни фиксированы в просвете общего желчного протока, в долевых протоках, в ампуле большого сосочка двенадцатиперстной кишки, применяют петли Дормиа и катетеры Фогарти максимально тонкого диаметра или специально сконструированные камнеулавливатели (И. Д. Прудков, М. И. Прудкова, 1978)—рис. 54.
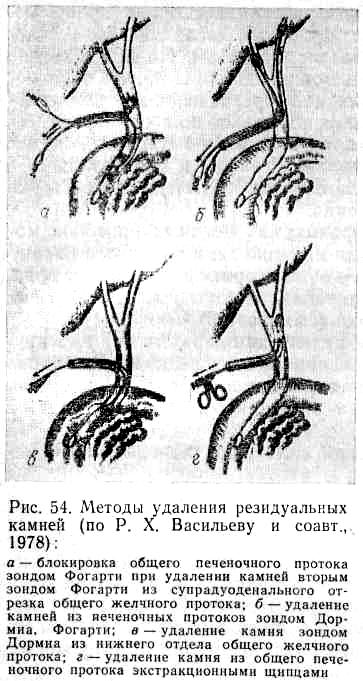
Иногда для дробления камней пользуются специальными щипцами и удаляют их по частям. При фиксировании камня в дистальных отделах желчных протоков более приемлем трансдуоденальный чреспапиллярный метод.
Проталкивание камней в просвет двенадцатиперстной кишки выполняют в редких случаях, когда для этого не требуется грубого усилия и не создается опасности повреждения дистальных отделов общего желчного протока камнем, его осколками после дробления или самим инструментом.
Отсасывание камней из желчных протоков удается редко из-за малого диаметра дренажной трубки или свищевого хода. Поддаются аспирации лишь мелкие камни диаметром 2—3 мм или раздробленные до такого размера более крупные камни.
Инструментальное удаление камней является лучшим консервативным методом, позволяющим извлекать камни диаметром до 3 см (Von Kemmel и L'Hermine, 1974). Более совершенным методом инструментального удаления камней является извлечение их под контролем холедохоскопа, введенного через дренажную трубку или свищевой канал. Используя фиброоптическии холедохоскоп фирмы Olympus, M. Д. Семин и соавторы (1991) удалили камни из общего желчного протока, «забытые» во время предыдущей операции, у 1086 больных.
Инструментальное удаление остаточных камней желчных протоков по данным некоторых авторов, было эффективным у 570— 643 (95—95,8%) больных (А. И. Нечай и соавт., 1987; N. Mozza-ziello, 1975; Н. Burhenne, 1976; Но, 1978). Опыт большинства хирургов ограничивается немногочисленными наблюдениями. Отрицательные результаты при этом методе (от 3,4 до 8,3 %, согласно данным А. И. Нечай и соавт., 1987; Н. Burhenne и соавт., 1980) объясняются слишком извилистым ходом желчного свища, вклинением камня в желчном протоке, стенозированием протоков, большим диаметром камней. В 5 % случаев развивались осложнения — панкреатит, образование ложного хода, скопление желчи в подпе-ченочном пространстве, обрыв катетера, оставление в протоке корзинки Дормиа. Летальных исходов не отмечено.
Таким образом, в пользу инструментального метода удаления камней свидетельствует высокая эффективность его, а также то, что характер осложнений при неоперативном удалении камней представляет гораздо меньшую опасность, чем повторные оперативные вмешательства, предпринимаемые по поводу резидуального холедохолитиаза.
Из других методов лечения больных с остаточным холелитиа-зом при наличии дренажа или свища известны промывания протоков с введением в их просвет различных препаратов в целях растворения камней и их удаления.
Для растворения камней применяют следующие препараты: гепарин (А. И. Нечай и соавт., 1978; М. В. Данилов и соавт., 1979; Tornaghi, Roberto, 1975; Но, 1978, и др.); хлороформ (Semb и соавт., 1974), эфир (Jhiele, 1977), раствор Рингера-лактата с добавлением глосцин-п-бутилбромида (Gerber, Heymann, 1977), раствор желчных солей (Way, 1972; Britton и соавт., 1975). Лучше растворяются холестериновые камни. Лечебный эффект удается достичь в 67 % случаев (Но, 1978). Количество описанных отдельными авторами наблюдений небольшое, поэтому судить об эффективности того или иного препарата трудно. Наиболее действенным считают гепарин, хотя действие его in vitro не дает никакого результата (Rowero, Butterfield, 1974). Применяют гепарин по 2500 ЕД в 250 мл изотонического раствора натрия хлорида, добавляют также спазмолитические средства (1 % раствор лигнокаина и др.). Этот раствор вводят через дренаж в общий желчный проток в течение 1 ч и затем каждые 8 ч на протяжении 6—7 дней, а иногда и дольше (15, 20, 35 дней). Происходит либо полное растворение, либо уменьшение диаметра камня, после чего он проходит в двенадцатиперстную кишку.
Хлороформ применяют по 5 мл в теплом виде (40 °С) и вводят в общий желчный проток в положении больного полусидя. Через 3 ч больному дают нитроглицерин и протоки промывают изотоническим раствором натрия хлорида. Этим методом Semb и соавторам (1974) удалось излечить 2 больных, а в 1 случае результат был отрицательным.
Для растворения желчных камней через дренаж вводят также вещества, изменяющие соотношение желчных кислот, холестерина и фосфолипидов в желчи.
Клофибрат (мисклерон) успешно применили у 1 больного Е. Gorcia-Romero и соавторы (1979). Авторы растворяли 1500 мг препарата в 10 мл спирта, смешивали с 250 мл изотонического раствора натрия хлорида, добавляли 4 мг дексаметазона и вводили через дренаж каждые 8 ч. Основанием для такой терапии послужили результаты экспериментальных исследований: 30 % раствор клофибрата полностью растворял камни, состоящие из холестерина (90 % и более), за 15 сут.
Раствор холевой кислоты применяли L. W. Way и соавторы (1972). Камни растворились у 12 из 22 больных через 3—14 дней.
Вследствие попадания большого количества желчных кислот в кишечник появилась диарея, для купирования которой был назначен холестирамин.
В стендовых испытаниях была установлена хорошая способность растворять желчные камни глицеридов со средней длиной углеродной цепи. Представителем этой группы веществ является монооктаноин, выпускаемый в виде эмульсии под названием Соpemel 8210. Монооктаноин вводили через дренаж со скоростью 4,5 мл/ч. Длительность лечения составляла 4—21 сут. Камни исчезли из желчных протоков у 28 из 35 больных (Е. A. Mock и соавт., 1978; J. L. Thistle и соавт., 1980; М. Uribe и соавт., 1981). Побочными свойствами препарата являются тошнота, рвота, понос, тупая боль в надчревной области.
Скорость растворения холестериновых камней in vitro изучал Т. R. Gadacz (1979). За 10-суточный период масса камней под действием гепарина уменьшилась незначительно, под действием холевой кислоты снизилась на 33 %, а под влиянием монооктаноин а — на 87 % за 4 сут.
Gerber и Heymann (1977) вводили раствор Рингера-лактата, подогретый до температуры тела, в количестве 500 мл со спазмолитическими средствами в желчные пути через дренаж и одновременно внутривенно. Лечебный эффект достигнут у 6 больных.
Для промывания желчных протоков в целях изгнания уменьшенных после медикаментозной терапии, раздробленных после инструментальных попыток удаления или вообще небольших камней вводят изотонический раствор натрия хлорида со скоростью 1000 мл за 30—45 мин (Costleden, 1976; Jennings и соавт., 1982) или 400—600 мл 0,5 % раствора новокаина под давлением 500— 600 мм вод. ст. в течение 2—3 дней (А. И. Нечай и соавт., 1978). Перед промыванием и во время него внутривенно вводят спазмолитические средства. Этот метод оказался эффективным у половины больных.
Во всех случаях промывания протоков и введения медикаментозных средств следует для профилактики побочного действия отсасывать растворы из двенадцатиперстной кишки с помощью введенного в нее зонда (И. Д. Прудков и соавт., 1978).
Мы не имеем достаточного опыта лечения больных с остаточным холелитиазом описанными методами, так как широкое применение эндоскопической или трансдуоденалыюй папиллосфинктеротомии у большинства больных с холелитиазом обеспечивает успех даже в тех случаях, когда вероятность удаления всех мелких камней во время операции остается сомнительной, например, при внутрипеченочном холелитиазе. В этих случаях камни, по-видимому, самостоятельно выходят в кишечник, так как остаточного холелитиаза после транспапиллярных операций мы не наблюдали. Мы применили консервативное лечение остаточного холелитиаза лишь у 3 больных, поступивших в клинику с дренажами общего желчного протока (2 больных) и наружным желчным свищом (1 больной). У 2 больных камни были растворены с помощью хлороформа, у 1 больного размеры камня уменьшились под воздействием гепарина, после чего он вышел в двенадцатиперстную кишку; желчный свищ закрылся самостоятельно.
Консервативное лечение при холедохолитиазе без наличия дренажа в желчных протоках или наружного желчного свища главным образом показано лицам, уже подвергавшимся операции либо с высоким риском вмешательства, в основном больным пожилого и старческого возраста в определенной ситуации, например, при отказе от хирургического лечения.
К этим методам лечения относят растворение камней в желчных протоках при помощи хенодезоксихолевой кислоты и эндоскопической папиллосфинктеротомии с последующим ожиданием отхождения камней из общего желчного протока или их извлечения с помощью петли Дормиа.
Попытки растворения камней хинодезоксихолевой кислотой предпринимались Celle и соавторами (1978), Peliscier и соавторами (1978), Но (1978) и другими исследователями. Препарат назначали по 8—15 мг/кг в течение 3—16 мес. Эффект отмечался только при наличии холестериновых камней и то в единичных
случаях.
Эндоскопическую папиллотомию (рис. 55) для лечения остаточного холедохолитиаза применяют с 1973 г. (Demling и соавт., 1974; Kawoi и соавт., 1974).

Так же, как и при эндоскопической ретроградной холангиографии, катетеризуют дистальный отдел общего желчного протока, вводят контрастное вещество и производят рентгенологический снимок. Затем катетер извлекают, а через эндоскоп проводят другой катетер, в котором находится специальная проволока из тугоплавкого металла. Этот катетер вновь вводят в общий желчный проток на глубину до 5 мм. Потягиванием за проволоку катетер изгибается в виде лука, а сама проволока выходит наружу через специальный разрез в виде тетивы. При пропускании тока высокой частоты через проволоку последняя «пропиливает» стенку большого сосочка двенадцатиперстной кишки, соприкасающуюся с ней. Эндоскопически контролируют отхождение желчи, гноя и камней в двенадцатиперстную кишку. При недостаточном рассечении большого сосочка двенадцатиперстной кишки манипуляцию повторяют с более глубоким введением электрода.
В КНИИКЭХ выполнена эндоскопическая папиллотомия по указанной методике более чем у 2500 больных (М. Д. Семин, 1991).
Некоторые авторы указывают, что длина разреза при эндоскопической папиллотомии должна быть не менее 15—20 мм; в отдельных случаях она достигает 25 мм (Kawoi и соавт., 1975; Reiter и соавт., 1978). Наш опыт свидетельствует о том, что длина разреза должна быть равна диаметру камня или может быть меньше его на 1—2 мм.
В то же время длина разреза при папиллотомии не может быть неограниченной. Так как на расстоянии 20 мм и более от устья сосочка двенадцатиперстной кишки желчный проток выходит из стенки двенадцатиперстной кишки, то превышение этого предела связано с опасностью развития забрюшиннои флегмоны.
В нашей клинике благодаря тщательному соблюдению техники операции, поэтапному методичному рассечению большого сосочка двенадцатиперстной кишки в ближайший период после вмешательства наблюдалось только одно осложнение — ущемление камня вместе с корзинкой Дормиа в дистальном отделе общего желчного протока, что вызвало необходимость срочной лапаротомии, холедохолитотомии.
В последние годы для лечения холелитиаза начали применять чрескожную чреспеченочную пункцию внутрипеченочных желчных протоков (Derer и соавт., 1979). После пункции тонкой иглой и контрастирования желчных протоков под рентгенологическим контролем осуществляли повторную пункцию толстой иглой с надетым на нее катетером. Иглу извлекали, а через катетер вводили петлю Дормиа, которой захватывали камень и осторожно выводили его в двенадцатиперстную кишку. Инструмент освобождали от камня, а затем ретроградно удаляли. Выполняли контрольную холангиографию, а затем в желчные протоки вводили перфорированный катетер для временной декомпрессии желчи, который удаляли через 10 дней. Мы выполнили такое вмешательство у 1 больной. Камни удалось вымыть из желчных протоков в двенадцатиперстную кишку после расширения рубцовосуженного общего печеночного протока.
Описанная методика не нашла широкого применения из-за сложности чрескожной чреспеченочной канюляции печеночных протоков.
Приведенные сведения позволяют сделать заключение, что извлечение камней через дренаж и эндоскопическая папиллотомия являются высокоэффективными методами лечения остаточного холедохолитиаза; которые дают относительно небольшое число осложнений.
Оперативное лечение. Холедохолитиаз, осложненный острым и хроническим холециститом, является показанием к хирургическому лечению.
Как и большинство хирургов, мы считаем, что верхне-средин-ная лапаротомия является лучшим доступом при первичных вмешательствах. При повторных вмешательствах используют тот разрез, который был применен при первой операции, за исключением тех случаев, когда использование бывшего разреза не обеспечивает достаточной ревизии всех органов брюшной полости.
Осмотр и пальпация. После вскрытия брюшной полости тщательно разделяют имеющиеся сращения, чтобы стали хорошо видимыми желчный пузырь, печеночно-дуоденальная связка, печень, желудок, желудочно-ободочная связка, поперечная ободочная, двенадцатиперстная кишки и начальные отделы тонкой кишки. Особую осторожность следует соблюдать при повторных операциях, чтобы не повредить органы, спаянные с париетальной брюшиной. Лучше всего захватить зажимами апоневроз по краям разреза и затем под контролем пальца, введенного в брюшную полость, и зрения рассекать острым путем и разъединять пальцем сращения по возможности ближе к париетальной брюшине, производя тщательный гемостаз. С особой тщательностью следует освобождать поперечную ободочную кишку, избегая малейших повреждений ее серозного покрова. Таким образом, в первую очередь освобождают переднюю и нижнюю поверхности печени, желудок, поперечную ободочную кишку. В связи с тем, что всякий воспалительный процесс в подпеченочном пространстве вызывает миграцию большого сальника, а при повторных операциях значительная его часть вообще часто находится в этой области, манипуляции должны быть щадящими. Большой сальник освобождают главным образом тупым путем вблизи прилежащих органов. И только при плотном его сращении, особенно при подозрении на прикрытую перфорацию полого органа, пересекают между двумя кровоостанавливающими зажимами с последующей перевязкой центрального участка во избежание кровотечения, которое становится особенно опасным при явлениях портальной гипертензии. От ткани сальника следует отличать круглую связку печени, которая часто интимно с ним сращена после повторных операций. Ее необходимо выделить и, если она мешает осмотру органов, пересечь, оставляя по возможности больший ее центральный участок для возможных последующих манипуляций на пупочных сосудах. Печеночный изгиб ободочной кишки, двенадцатиперстная кишка и желудок обычно бывают плотно сращены с нижней поверхностью печени. Эти органы легче отделять от печени острым путем вдоль переднего края органа справа налево. Отделение надо производить далеко кзади, чтобы подойти к сальниковому отверстию и к правой боковой стенке брюшной полости для последующего дренирования. Часто наблюдаются плотные спайки между двенадцатиперстной кишкой, пузырным ложем и воротами печени. Необходимо соблюдать особую осторожность, чтобы при отделении двенадцатиперстной кишки не нарушить ее серозный покров, не вскрыть желчные протоки и кровеносные сосуды.
Следует заметить, что при повторных операциях, когда имеются сращения передне-верхней поверхности печени с диафрагмой и нет необходимости в осмотре этой поверхности, стремиться к «кровавому» освобождению печени не следует во избежание образования гематомы и поддиафрагмальиого абсцесса.
После достаточного освобождения брюшной полости от спаек производят ревизию всех ее органов. Начинать осмотр и пальпацию следует с печени. Исследованию подлежат как видимая, так и невидимая области купола, правая печеночно-реберная область и левая доля. Определяют размеры печени, ее внешний вид и консистенцию, наличие различных образований на ее поверхности и в толще ткани. Тщательно исследуют желудок и двенадцатиперстную кишку (возможность язвенной болезни), пищеводное отверстие диафрагмы (для исключения диафрагмальной грыжи). Далее осматривают селезенку и почку. Затем приподнимают поперечную ободочную кишку и осматривают все отделы ободочной и тонкую кишку, червеобразный отросток, органы малого таза.
Приподнимая печень кверху и кпереди путем умеренной трак-ции за круглую связку, при первичных вмешательствах иногда удается приблизить внепеченочные желчные пути, желчный пузырь и связанные с ними сосуды к более видимой части операционной раны для их дальнейшего осмотра. Затем между печенью и печеночным изгибом ободочной кишки, двенадцатиперстной кишкой и правой почкой прокладывают большую влажную салфетку, а поверх нее кладут печеночное зеркало. Вторую салфетку прокладывают между печенью и дистальным отделом желудка и двенадцатиперстной кишкой. Ассистент, стоящий напротив хирурга, слева от больного, сильно оттягивает желудок и двенадцатиперстную кишку книзу, положив указательный палец слева, а остальные три пальца— справа от печеночно-дуоденальной связки. После этого тщательно осматривают желчный пузырь. Если патологические изменения отсутствуют, переходят к осторожной пальпации пузыря скользящим движением от шейки ко дну, но не наоборот, так как мелкие камни могут при этом мигрировать в общий желчный проток, что не только значительно осложняет оперативное вмешательство, но и ухудшает результат операции. Малейшее ощущение соприкосновения с камнем в сопоставлении с данными предоперационных исследований является сигналом к прекращению пальпации пузыря. Вопрос о холецистэктомии при этом обычно является решенным.
Во всех случаях подозрения на холедохолитиаз, когда необходимо контрастирование желчных протоков, выполняют пункцию пузырного протока в наиболее видимой его части и производят рентгеновские снимки, а пока последние проявляются, продолжают дальнейшие манипуляции для осмотра и пальпации желчных протоков.
Захватывая шейку желчного пузыря окончатым зажимом и слегка потягивая за нее, хирург начинает острым и тупым путем выделение магистральных желчных протоков. В первую очередь вскрывают брюшину над пузырным протоком и сдвигают ее в сторону. Препаровку продолжают книзу вдоль пузырного протока до его устья. Рассекают брюшину поверх общего желчного протока, подводя под нее изогнутый зажим и раздвигая его бранши. Диссекцию продолжают до тех пор, пока не будет совершенно изолирован пузырный проток и не станет хорошо видимым то место, где он сливается с общим печеночным протоком. Оценить истинную ширину протоков можно, лишь тщательно освободив их по передней поверхности от брюшины и идентифицировав пузырный проток, который, располагаясь вдоль желчных протоков под одним листком брюшины, часто создает видимость расширенных протоков.
После достаточно четкого выделения элементов печеночно-дуоденальной связки становится возможным определить их настоящую ширину, начиная с пузырного протока (в норме1он имеет диаметр 3—4 мм), общего желчного (диаметр — 4—8 мм) и общего печеночного (диаметр — 4—6 мм). Расширение пузырного протока и множественные мелкие камни в желчном пузыре свидетельствуют, в частности, о том, что эти камни скорее всего свободно проходят в общий желчный проток и необходим их тщательный поиск даже при нормальной ширине общего желчного протока и отсутствии клинических признаков холедохолитиаза. Расширение общего желчного протока свыше 10 мм следует рассматривать как явный признак желчной гипертензии. Если же диаметр общего желчного протока колеблется между 8 и 10 мм, то необходимо в дальнейшем тщательно его исследовать, так как очень вероятно наличие препятствия к оттоку желчи в области сфинктера печеночно-поджелу-дочной ампулы.
Иногда при нормальной ширине желчных протоков и сохраненной проходимости пузырного протока отмечается значительное увеличение размеров желчного пузыря. В этих случаях следует оценить состояние сфинктера большого сосочка двенадцатиперстной кишки, так как желчный пузырь, обладая функцией предохранительного клапана, расширяясь, предохраняет протоки от их расширения.
После тщательного осмотра всех элементов печеночно-дуоденальной связки хирург помещает указательный палец левой руки в сальниковое отверстие и пальпирует дистальный отдел пузырного протока и общий желчный проток между указательным и большим пальцами. Надо внимательно искать камни, которые могут быть мелкими и очень подвижными, замазкообразную желчь, а также определить пальпаторно толщину стенки общего желчного протока и ее напряжение. Хирург должен абсолютно точно идентифицировать общий желчный проток. При воспалении и повторных операциях это иногда сделать трудно, так как проток внешним видом мало отличается от воротной вены. Хорошим ориентиром может быть культя пузырного протока после холецистэктомии, которую следует иссечь, если она слишком длинная. В сомнительных случаях хирург должен путем аспирации желчи убедиться в том, что обнаружен общий желчный проток. Если нет желчной гипертензии, желчеистечение самостоятельно прекратится, а если она обнаружится, то ее устранение по ходу операции также не приведет к осложнениям. Ушивать точечное отверстие или накладывать заплату из серозного покрова, как это рекомендуют некоторые хирурги (Millen, Corr и соавт., 1976), мы считаем нецелесообразным из-за неоправданной травмы протока, которая может в дальнейшем привести к его Рубцовым изменениям. Случайная же пункция кровеносных сосудов ведет к незначительному кровотечению, которое легко останавливается легким прижатием тампона на 2—3 мин.
При обнаружении камней в магистральных желчных протоках или расширении последних необходимо тщательно исследовать терминальный отдел общего желчного протока. Манипуляции можно выполнять после удаления желчного пузыря, если для этого имелись конкретные показания. Одновременно оценивают состояние большого сосочка двенадцатиперстной кишки и головки поджелудочной железы. Для этого необходима мобилизация двенадцатиперстной кишки по Кохеру. Рассекают брюшину вдоль выпуклого края двенадцатиперстной кишки от места прикрепления брыжейки поперечной ободочной кишки до сальникового отверстия. Предварительно ножницами рассекают сращения и низводят печеночный изгиб ободочной кишки, чтобы освободить нисходящую часть двенадцатиперстной кишки от проходящей в поперечном направлении
брыжейки поперечной ободочной кишки. При этом следует остерегаться повреждения средней ободочной артерии. Расслаивая пальцами забрюшинную клетчатку и помещая 4 пальца левой руки позади двенадцатиперстной кишки, а большой палец впереди, хирург может пальпировать область большого сосочка двенадцатиперстной кишки и головку поджелудочной железы. В норме сосочек обычно не прощупывается. Фиброзно измененный сосочек пальпируется в виде отчетливого уплотнения. Камни определяются довольно четко. Можно попытаться сместить их кверху в общий желчный проток, но форсировать это мероприятие не следует. Рак большого сосочка двенадцатиперстной кишки иногда довольно трудно отличить от рубцового стеноза и камня.
Следует также пальпаторно исследовать и стенку общего желчного протока. Обычно толщина ее не превышает 0,5 мм и через нее просвечивает желчь, обусловливая специфический зеленоватый оттенок. Однако вследствие холангита стенка утолщается, иногда до 3 мм и более, становится непрозрачной и теряет эластичность. Описанные изменения стенки общего желчного протока наступают как на фоне холедохолитиаза, так и вследствие распространения воспалительного процесса с желчного пузыря.
Для более тщательного осмотра задней поверхности головки поджелудочной железы и ретродуоденальной части общего желчного протока широко расслаивают пальцами забрюшинную клетчатку, что позволяет приподнять двенадцатиперстную кишку и головку поджелудочной железы и отвернуть их влево.
Осмотру и пальпации желчевыводящих путей мы придаем особое значение, хотя для этого требуется большой опыт и хорошая релаксация. В ряде случаев единичные камни удается определить даже при отсутствии их на операционной холангиограмме. Но в то же время не следует полностью полагаться на результаты паль-паторного исследования, так как могут допускаться и ошибки, особенно в случаях наличия перихоледохеального лимфаденита. У этих больных мелкий лимфатический узел можно принять за холедохолитиаз, а камень в общем желчном протоке — за узел. Поэтому и необходим осмотр задней поверхности головки поджелудочной железы и области ретродуоденальной части общего желчного протока.
Функциональные методы, исследования включают холангиомано-метрию и дебитометрию.
Холангиоманометрия преследует три цели: 1) определение исходного давления, то есть давления в желчном протоке, которое регистрирует прибор при его подключении. В норме оно колеблется от 0 до 20 мм вод. ст.; 2) определение «давления прохождения», то есть давления, преодолевающего сопротивление сфинктера печеночно-поджелудочной ампулы; жидкость, при помощи которой повышалось давление (в норме оно колеблется от 100 до 180 мм вод. ст.), поступает в двенадцатиперстную кишку, после чего давление падает; 3) определение «остаточного давления», которое отражает уровень давления, возникшего после падения «давления прохождения». «Остаточное давление» задерживается на определенном уровне и указывает на прекращение поступления жидкости в кишечник. У здоровых людей оно равно 80—140 мм вод. ст.
Как оказалось на практике, наиболее удобным для холангио-манометрии является аппарат Вальдмана. В начале операции нулевую точку прибора устанавливают на уровне общего желчного протока, которому приблизительно соответствует середина боковой поверхности тела больного, лежащего на спине. После лапаротомии и удаления желчного пузыря, избегая излишней травматизации и зондирования общего желчного протока, которые могли бы вызвать отек и спазм сфинктера печеночно-поджелудочной ампулы, пузырный проток интубируют хлорвиниловой трубкой диаметром 2— 3 мм, на которой его временно перевязывают.
При повторных операциях, когда желчный пузырь был удален раньше, используют культю пузырного протока. Кроме того, можно пунктировать общий желчный проток толстой иглой, собственный дебит которой должен быть предварительно проверен.
После интубации общего желчного протока желчные протоки заполняют изотоническим раствором натрия хлорида под давлением 300 мм вод. ст. и трехкратно измеряют остаточное давление. Давление, равное 150—160 мм вод. ст., свидетельствует о наличии препятствия оттоку желчи и требует уточнения диагноза с помощью дальнейшего исследования. Давление выше 160 мм вод. ст. является достоверным признаком желчной гипертензии, требующей хирургической коррекции.
Дебитометрия. Принцип метода основан на том, что через определенное сечение (в данном случае — отверстие функционирующего большого сосочка двенадцатиперстной кишки) при определенном давлении оттекает определенное количество жидкости. Если при постоянном давлении изменяется сечение отверстия, то изменяется и количество оттекающей жидкости. Если же меняется площадь сечения, количество оттекающей жидкости остается неизменным и соответствующим образом изменяется давление.
Исходя из этого принципа, функциональное состояние сфинктера большого сосочка двенадцатиперстной кишки можно определить 2 путями: 1) при постоянном давлении измерять количество протекающей жидкости в единицу времени; 2) при постоянном оттоке жидкости в единицу времени регистрировать необходимое для этого давление.
Первый способ оказался практически более удобным. Поэтому, взяв за единицу постоянного давления 300 мм вод. ст., которое соответствует секреторному давлению печени, определяют количество жидкости, протекающей через большой сосочек двенадцатиперстной кишки за 1 мин при этом давлении, которое должно быть постоянным в течение всего времени исследования. Такой метод исследования и получил название дебитометрии. При нормальной функции сосочка двенадцатиперстной кишки дебит составляет 15— 20 мл/мин. Для дебитометрии необходимы аппарат Вальдмана, градуированный сосуд или шприц емкостью 20 мл. Если используют сосуд, то его устанавливают таким образом, чтобы уровень жидкости в нем соответствовал отметке 300 мм. Открывают трехходовый кран, что обеспечивает свободный отток изотонического раствора натрия хлорида из сосуда. Последний по мере вытекания жидкости перемещают вдоль шкалы вверх так, чтобы уровень жидкости постоянно соответствовал 300 мм. Отмечают объем жидкости, вытекающей из сосуда за 1 мин. Дебит ниже 20 мл/мин свидетельствует о затруднении оттока желчи и требует проведения холангио-графии, дебит ниже 15 мл/мин указывает на нарушение оттока, требующее лечения.
Если используют шприц (что гораздо проще), то его при помощи толстой иглы путем прокалывания резиновой трубки, идущей от шкалы аппарата Вальдмана к общему желчному протоку, подключают к системе. Нажимом поршня шприца вводят жидкость в общий желчный проток, постоянно следя, чтобы давление в течение 1 мин исследования оставалось постоянным на уровне 300 мм вод. ст. За этот отрезок времени определяют количество введенной жидкости, что и соответствует дебиту.
Как манометрия, так и дебитометрия являются очень чувствительными методами исследования и показатели их зависят от многих причин. Особенное влияние оказывает местная травма в области пузырного, общего желчного протоков и в области большого сосочка двенадцатиперстной кишки. Осторожная пальпация мало влияет на эти показатели, но препаровка пузырного и особенно общего желчного протоков сопровождается рассечением многочисленных ветвей печеночного сплетения. Это приводит к временному понижению тонуса сфинктера и, следовательно, к некоторому понижению остаточного давления и увеличению дебита. Зондирование общего желчного протока и большого сосочка двенадцатиперстной кишки вызывает отек последнего и спазм сфинктера печеночно-поджелудочной ампулы, то есть повышение остаточного давления и уменьшение дебита. Поэтому, если предполагается выполнение указанных функциональных исследований, необходимо, чтобы травма была наименьшей. Пузырный проток в таких случаях следует ка-нюлировать, надрезая его, и измерения производить до холецистэк-томии и холангиографии и тем более до мобилизации двенадцатиперстной кишки по Кохеру и пальпации головки поджелудочной железы и большого сосочка двенадцатиперстной кишки. Допускается лишь самое осторожное пальпаторное исследование желчевы-водящих путей.
Не следует также забывать о влиянии на показатели функциональных методов исследования препаратов, применяемых для подготовки больного к наркозу и во время проведения последнего. Так, отмечено, что остаточное давление в желчевыводящих путях повышается, а дебит уменьшается под действием морфина гидрохлорида, не изменяется под влиянием долантина, скополамина, фенерга-на, барбитуратов, сукцинилхолинхлорида, закиси азота, флюотана, под действием атропина сульфата, хлорпромазина, кураре, эфира и амилнитрита и претерпевают обратные изменения (И. Литтмаин, 1970). Исходя из этого, следует избегать применения тех препаратов, которые могли бы повлиять на результаты холангиоманомет-рии и дебитометрии.
Наш собственный опыт более чем 500 исследований, а также данные литературы позволяют сделать заключение о том, что метод манометрических исследований все же громоздок, занимает много времени во время операции и требует в ряде случаев привлечения посторонней помощи. Диагностическая точность метода в большинстве случаев сомнительна. Нормальные показатели манометрии могут иметь место и при наличии патологии в желчных протоках (Iverguean и соавт., 1974).
Дебитометрия является более чувствительным методом по сравнению с холангиоманометрией, так как нередко даже при нормальных показателях остаточного давления дебит оказывается пониженным. В то же время, когда остаточное давление повышено, дебит всегда ниже, чем в норме. В связи с этим мы, как правило, ограничиваемся дебитометрией как для определения проходимости большого сосочка двенадцатиперстной кишки, так и для выявления камней в общем желчном протоке. В тех случаях, когда камень не полностью закрывает просвет общего желчного протока («плавающий» камень), очень помогает многократное определение дебита. Оказалось, что в этих случаях имеют место противоречивые данные: при некоторых измерениях дебит нормальный, при некоторых— резко снижен, что отмечается в момент вклинения камня в узкую часть общего желчного протока. Именно эти «противоречивые» данные и свидетельствуют о наличии патологии.
Интраоперационная холангиография является важным дополнительным методом исследования, особенно в тех случаях, когда эндоскопическая ретроградная холангиография оказывается неэффективной.
Впервые об успешном применении прямой операционной холангиографии сообщил Mirizzi в 1931 г. на III Хирургическом конгрессе в Аргентине. Д. Н. Кузнецов (1935) применил ее впервые в Советском Союзе.
Информативность метода, по данным Д. Ф. Благовидова и соавторов (1982), Н. Lippert и соавторов (1988), М. И. Кузина и соавторов (1990), составляет 73—98 %. Диагностические ошибки, включая ложноположительные и ложноотрицательные результаты, составляют 4—15 % (В. К. Гостишев и соавт., 1985; В. В. Радионов и соавт., 1985; P. Doyle и соавт., 1990).
Таким образом, достоинствами интраоперационной холангиогра-фии являются высокая информативность и достоверность метода, недостатками — отсутствие гарантии от ошибок, увеличение продолжительности операции, денежных затрат на лечение, а также лучевая нагрузка на пациента и персонал. Отдельные исследователи (В. С. Помелов и соавт., 1982; А. Ф. Греджев и соавт., 1989; F. F. Fakynowicz и соавт., 1987) считают интраоперационную хо-лангиографию обязательной при всех операциях на желчевыводя-щих путях, другие (Э. И. Гальперин и соавт., 1988; Н. И. Кузин и соавт, 1990; J. L. Mills и соавт, 1985; A. Gerber и соавт, 1986) суживают показания к этому исследованию. Причиной более сдержанного отношения к интраоперационной холангиографии в последнее время стала разработка и внедрение в клиническую практику методов интраоперационного ультразвукового исследования (О. С. Шкроб и соавт, 1986; М. В. Данилов и соавт, 1989; P. J. Doyle и соавт, 1982).
М. И. Кузин и соавторы (1990) на основании анализа показаний к интраоперационной холангиографии с учетом факторов риска холедохолитиаза (наличие желтухи в анамнезе, расширение общего желчного и пузырного протоков, а также мелкие камни) доказали, что у 45—50 % пациентов можно отказаться от обязательного выполнения интраоперационной холангиографии. Авторы рекомендуют выполнять ее при наличии одного из вышеназванных факторов риска.
Мы считаем, что прямую интраоперационную холангиографию не следует производить всем больным, подвергающимся операциям на желчевыводящих путях. Показаниями к ее применению являются: 1) отсутствие дооперационной эндоскопической ретроградной холангиографии у больных с желтухой с клиническими проявлениями холангита, гепатита, острого панкреатита; при наличии в желчном пузыре мелких камней и широкого пузырного протока, если методом пальпации или зондирования эластическими зондами не обнаружено четких данных об определенном виде патологии, которая требует хирургической коррекции; 2) для определения функции сфинктера печеночно-поджелудочной ампулы, когда дооперацион-ная холангиограмма и операционные исследования (осмотр, пальпация, зондирование) оказались неинформативными; 3) для контроля полноты удаления камней после операционной холедохплито-томии; 4) при подозрении на наличие аномалий развития желчных протоков, если не удается идентифицировать их визуально; 5) при рубцовом или опухолевом поражении желчных протоков для определения сохранности вышележащих отделов и протяженности поражения; 6) для выявления случайного повреждения желчных протоков во время других операций (резекция желудка) или при травме печени в целях определения рациональной резекции органа (Atik, 1976).
По этим показаниям нами выполнено 470 интраоперационны.х холангиографии на 2916 (16,1 %) холецистэктомий. Такое небольшое, по сравнению с данными других авторов, количество исследований объясняется возможностями дооперационной диагностики.
Методика исследования. После измерения остаточного давления и дебита в желчевыводящие пути вводят водорастворимое контрастное вещество (верографин, билигност). Пути введения могут быть различными: в пузырный проток, в культю пузырного протока путем пункции общего желчного или общего печеночного протока (при невозможности отыскать на повторной операции остатки пузырного протока), или желчного пузыря, а также через большой сосочек двенадцатиперстной кишки после дуоденотомии (рис. 56).

Наиболее распространенный, самый безопасный и простой метод — это инъекция через пузырный проток или его культю. Пункция желчных протоков более опасна, так как при малейших явлениях желчной гипертензии наблюдается длительное желчеистечение. К введению контрастного вещества через желчный пузырь прибегают очень редко. Контрастирование желчного пузыря бывает необходимо при опухолях панкреатодуоденальной зоны,
когда возникает необходимость в использовании пузыря для создания билиодигестивного анастомоза и при этом нужно выяснить проходимость пузырного протока и локализовать место его впадения в общий желчный проток. Что касается введения контрастного вещества через большой сосочек двенадцатиперстной кишки то, по нашему мнению, этот метод вообще не следует применять, даже когда по тем или иным причинам оказывается вскрытой двенадцатиперстная кишка. Такой путь не исключает введения катетера и тем более контрастного вещества под повышенным давлением в главный проток поджелудочной железы с последующим развитием острого панкреатита. Мы считаем, что если уж возникла необходимость в его использовании, то проводить манипуляции следует только под контролем рентгенотелевизионного экрана. Теплый раствор контрастного вещества вводят под небольшим давлением (80—120 мм вод. ст.). Несоблюдение этого правила может привести к нарушению тонуса сфинктеров желчных протоков и ложным выводам. Сначала медленно вводят 10 мл контрастного вещества и производят первый рентгеновский снимок. Затем так же медленно, без значительного повышения давления, вводят еще 10 мл препарата, производят второй снимок. Третий снимок выполняют через 7 мин после второго.
Очень важным для оценки состояния желчных протоков является второй снимок, так как его выполняют при максимальном введении контрастного вещества, что дает наибольшую визуализацию всей системы желчных протоков вплоть до внутрипеченочных разветвлений.
Третий снимок уточняет скорость и полноту эвакуации контрастного вещества в кишечник.
При выполнении данной методики кассету с рентгеновской пленкой подкладывают под больного, если операционный стол не имеет специального приспособления для смены кассет.
В связи с тем что наиболее интересующая хирурга патология обычно локализуется в дистальном отделе общего желчного протока, была предложена методика интраабдоминальной контактной холангиографии (Pujol-Soler, Bru-Pigmer, 1965). Она заключается в следующем. После мобилизации двенадцатиперстной кишки по Кохеру пленку размерами 6,25x7,5 см, обернутую черной бумагой, заключенную в полиэтиленовый пакет и стерилизованную газом, помещают позади головки поджелудочной железы. Контрастное вещество вводят, как при обычной холангиографии. Производят 4 интраабдоминальные холангиограммы и 3 обзорные. Полученная серия рентгенограмм позволяет изучить малейшие патологические изменения в дистальном отделе общего желчного протока и начальном отделе протока поджелудочной железы благодаря очень четкому изображению, но, к сожалению, лишь одного из отделов желчных путей. Поэтому этот метод и не получил широкого распространения, хотя еще в 1975 г. Gvergneoux и соавторы обобщили опыт нескольких клиник, охватывающий 2 тыс. интраабдоминальных холангиографии.
Вместо кассет с рентгеновской пленкой при холангиографии можно пользоваться и обычной белой бумагой, применив метод электрорентгенографии (Н. Р. Палеев и соавт., 1971). Довольно четкое изображение желчных протоков можно получить через несколько минут после экспонирования.
Наибольшую ценность для выявления всех особенностей патологии желчных протоков имеет их визуализация путем контрастирования с использованием метода рентгенотелевизионного наблюдения. Благодаря применению рентгеновской аппаратуры с электронно-оптическим усилителем изображения и телевидением значительно сокращается время исследования. На экране телевизора в незатемненной операционной можно наблюдать сокращение сфинктера печеночно-поджелудочной ампулы и характер поступления контрастного вещества в двенадцатиперстную кишку. Для получения более четкого изображения можно изменять положение больного. Этот метод позволяет также получить видеозапись.
При выполнении операционной холангиографии может быть допущен ряд ошибок, которые ведут к неправильной трактовке полученных холангиограмм. К ним относятся: 1) слишком плотное контрастирование, перекрывающее патологические элементы. Избежать этого можно, применив разведенный раствор контрастных веществ (1:2 или 1:1) у тучных больных; 2) «плавающие» камни могут быть не видны при длительной экспозиции. Рекомендуется выполнять снимки с остановкой дыхания больного в состоянии апноэ; 3) недостаточное контрастирование всех желчевыводящих путей в связи с быстрой эвакуацией контрастного вещества в кишечник. В этих случаях необходимо пережать дистальный отдел общего желчного протока и повторно заполнить протоки контрастным веществом; 4) дополнительные тени. Во время выполнения снимков необходимо убрать все металлические инструменты с поля, захватываемого рентгеновской пленкой, повернуть больного на 15— 20° на правый бок для смещения тени позвоночника и придать положение Тренделенбурга для предотвращения накладывания внутрипеченочных протоков на внепеченочные. Еще лучше в этих случаях укладывать больного под контролем рентгенотелевизионного экрана; 5) неправильное положение кассеты. Рекомендуется делать один снимок для введения контрастного вещества; 6) пузырьки воздуха в желчном протоке, которые создают впечатление камней. Рекомендуется делать снимки в положении Тренделенбурга или после промывания желчных протоков теплым изотоническим раствором натрия хлорида. Чтобы избежать этой ошибки, ожидаем, пока катетер сам заполнится желчью, для чего опускаем его ниже уровня общего желчного протока, и затем присоединяем систему или шприц для контрастирования протоков; 7) ошибки в интерпретации. Избежать их можно, во-первых, путем получения хорошего контрастирования с четким изображением всех отделов желчных протоков и, во-вторых, путем совместного обсуждения всех непонятных моментов с рентгенологом.
Прямая интраоперационная холангиография представляет наибольшую информативность при получении серии снимков или в случае рентгенотелевизионного наблюдения. Достоверность одного снимка может быть сомнительной. Сделанный в фазе сокращения сфинктера печеночно-поджелудочной ампулы отдельный снимок может дать повод к гипердиагностике, так как холангиограмма в фазе сокращения имитирует его спазм или стеноз.
При помощи холангиографии удается определить истинный диаметр общего желчного протока, поместив рядом с ним рентге-ноконтрастный предмет известного диаметра. Так, Devic (1976) с успехом пользовался металлическим шардком диаметром 100 мм. Определение истинного диаметра общего желчного протока имеет немаловажное значение для выявления желчной гипертензии, а следовательно, и патологии терминального отдела. Визуальный осмотр общего желчного протока позволяет лишь приблизительно установить его диаметр. В большинстве случаев этого бывает достаточно, но при расхождении клинических симптомов и органических изменений, характерных для желчной гипертензии, точное знание диаметра общего желчного протока представляет уже не теоретический, а практический интерес. В настоящее время доказано, что чем шире общий желчный проток, тем больше вероятность его патологии (О. Б. Милонов и соавт., 1975, наши данные). Мы не можем согласиться с мнением Berk (1958), Gignoux (1965), которые утверждают, что диаметр общего желчного протока в норме может быть равен 12—15 мм. При диаметре общего желчного протока 7—8 мм мы определяли мелкие бессимптомные, с точки зрения клинических признаков, камни у 1 % больных, при диаметре 8—10 мм — у 25 % (по нашим данным), а по данным О. Б. Милонова и соавторов (1980), у 66 % больных. При диаметре общего желчного протока 15 мм почти у 90—100 % больных имеется патология, причем, как правило, сочетанная (холелитиаз и стенозирующий папиллит, холе-литиаз и хронический панкреатит). Диаметр общего желчного протока более 15 мм в 100 % случаев указывает на наличие препятствия в дистальном отделе. Следует отметить, что умеренное расширение общего желчного протока (до 10—12 мм) может быть и результатом перемежающейся хронической гипертензии, когда мелкие камни, попадая из желчного пузыря в общий желчный проток, создают лишь временную гипертензию, пока силой тока желчи не будут изгнаны в кишечник и пока не разовьется стенозирующий папиллит. В этих случаях, несмотря на наличие явных клинических признаков желчной гипертензии и расширенного общего желчного протока, патология на операции может отсутствовать. И хотя при этом требуется тщательная ревизия всего общего желчного протока, обычно выполняют лишь холецистэктомию.
Холангиография на операционном столе позволяет выявить в желчных протоках камни довольно малого диаметра. Так, Vergnean и соавторам (1974) удавалось обнаружить камни диаметром 1 мм. Безусловно, какими-либо другими методами обнаружить такие мелкие камни в общем желчном протоке практически невозможно. На основании собственного опыта мы пришли к заключению, что такие мелкие камни без почти полного стеноза сфинктера печеночно-поджелудочпой ампулы в общем желчном протоке быть не могут, а такой стеноз легко диагностируется с помощью холангиографии или зондирования. Устранение же такого стеноза является обязательным, независимо от того, есть мелкие камни или нет. После устранения стеноза такие камни свободно отойдут с желчью в кишечник. Таким образом, специально искать мелкие камни в подобных ситуациях нецелесообразно. И тем не менее холангиография позволяет добиться положительных результатов. По данным многих авторов, камни четко определяются в 83—85 % исследований, в 10—17 % результаты сомнительные, в 0,2—7 % —ложноотрицательные (камни просматриваются), в 1—6 % —ложноположи-тельные (камни определяются там, где их не оказалось при холедо-хотомии) (В. М. Ситенко, А. И. Нечай, 1972; В. В. Цвиркун, 1980; While, 1977; Voyre, Jost, 1981, и др.). Schulenbury (1974), располагающий опытом 1300 холангиографии, обнаружил камни в общем желчном протоке, когда они не пальпировались, в 4,1 % случаев; при отсутствии желтухи в анамнезе — в 6,7%; при нормальной ширине общего желчного протока — в 1,3 %. Такая обнадеживающая диагностическая картина при холангиографии позволила Gupto u Tolwor (1974) в 35 % случаев избежать холедохотомий, а Zollinger (1977) снизить их количество с 72 до 38 %. Как видно из сказанного, достижения значительные, если бы не ложноотрица-тельные, ложноположительные и сомнительные результаты, которые, по данным Millen и соавторов (1976), в целом составляют 13,8 % среди 281 интраоперационной холангиографии. Foris и соавторы (1974) произвели анализ результатов послеоперационных чрездренажных холангиографии у 302 больных. Оказалось, что у 41 больного имели место «оставленные» камни, причем у 30 из них они не были замечены на операционных холангиограммах.
Holl и соавторы (1973) вообще отмечали, что применение интраоперационной холангиографии не способствовало уменьшению числа просмотренных камней в желчных протоках.
Таким образом, операционная холангиография является в большинстве случаев ценным, широко доступным методом исследования, практически не имеющим прямых противопоказаний. При таких относительных противопоказаниях, как острый холангит, острый панкреатит, гипертиреоз, нарушение функции почек, стенокардия и инфаркт миокарда в анамнезе, вполне допустимо исследование, но при строгом выполнении всех требований методики.
Осложнения, возникающие при выполнении операционной холангиографии, встречаются редко. К ним относятся: 1) некроз стенки общего желчного протока вокруг места пункции в результате попадания контрастного вещества в толщу стенки; 2) длительное желчеистечение из пункционного отверстия. Мы считаем, что это осложнение не возникает, если устранена причина желчной гипертен-зии; з) введение контрастного вещества вместо пузырного протока в артерию (Zollinger, 1977). Осложнение может привести к летальному исходу, если у больного высокая чувствительность к препаратам йода; 4) билиопанкреатический рефлюкс. Некоторые хирурги (Stuller, 1974) считают билиопанкреатический рефлюкс, особенно при стенозирующем папиллите, противопоказанием к холангиографии. В ряде случаев рефлюкс действительно может привести к тяжелым осложнениям, о которых следует всегда помнить при выполнении исследования; 5) проталкивание камней во внутрипеченочные ходы. Это явление вполне возможно при относительно широких протоках, в которых камни могут свободно плавать и под давлением смещаться и даже застревать в печеночных протоках. В этих случаях следует удалить их под контролем рентгенотелеви-зионного экрана с помощью специального катетера Фогарти и устранить препятствие в дистальном отделе общего желчного протока.
К другим важным методам операционной диагностики относятся инструментальные: эхолокация, трансиллюминация и зондирование желчных протоков, холедохоскопия.
Интраоперационную эхолокацию желчных протоков выполнили Sigel и соавторы (1981) у 43 больных. Операционное поле заливали теплым изотоническим раствором натрия хлорида и погружали в него стерильный трансдусер аппарата. Чувствительность эхолокации на операционном столе составила 90 %, специфичность — 100 %. Для холангиографии, выполненной после эхолокации, перечисленные показатели составили соответственно 100 и 92,3 %.
Внеорганную трансиллюминацию желчных протоков осуществляют в пределах печеночно-доуденальной связки. В сальниковое отверстие помещают лампочку трансиллюминатора, соединенную с источником тока, гораздо удобнее пользоваться осветителем, применяемым для эндоскопии: пучок холодного света посредством световода из волоконной оптики поДается к задней поверхности печеночно-доуденальной связки. Диаметр световода, равный 3,5 мм, позволяет проводить не только вне-, но и внутрипротоковую трансиллюминацию (О. Б. Милонов и соавт., 1975; Г. И. Дряженков, 1978).
Камни желчных протоков обнаруживают при трансиллюминации по участкам неравномерного просвечивания их. Метод позволяет выявить мелкие камни (диаметром до 3 мм), а также замазкообразую желчь, не определяемые пальпаторно (Д. Ф. Благовидов и соавт., 1979). Рассмотрение в проходящем свете облегчает определение взаимоотношений желчных протоков и сосудов, позволяет оценить толщину стенок протоков.
Зондирование желчных протоков. Метод исследования желчных протоков зондом внедрил в практику хирургов Kehr еще в 1907 г. Для зондирования широко используют набор гибких металлических зондов Долиотти (рис. 57).
Применение металлических зондов позволяет не только установить правильный диагноз, но и выполнить некоторые лечебные манипуляции. Металлический зонд очень удобен в эксплуатации, жесткость его позволяет даже перфорировать печень через один из долевых протоков для выполнения чреспеченочного дренирования. Но в то же время жесткость зонда делает его в ряде случаев далеко не безопасным, особенно при исследовании дистальных отделов желчных протоков. Известны случаи перфорации желчных протоков и стенок двенадцатиперстной кишки, разрывы и даже отрывы большого сосочка двенадцатиперстной кишки при грубом проведении через него зонда. Стали известны и диагностические ошибки, связанные в одних случаях с невозможностью проведения зонда через анатомически нормально изогнутые желчные протоки (ложное впечатление непроходимости), а в других — с чрезмерным усилием, которое приводило к прохождению зонда через рубцово суженный большой сосочек двенадцатиперстной кишки из-за разрыва его стенки (ложное впечатление проходимости). Это привело к тому, что зондирование металлическими зондами стали применять гораздо реже. С 1973 г. в нашей клинике применяются специальные элас-
тические зонды различного диаметра из плотной резины и пластмассы. С помощью таких зондов выполнено более 500 диагностических исследований, определены показания и диагностические возможности. Опыт использования зондов позволил нам также разграничить показания к применению различных их видов.
Мы различаем следующие показания к зондированию желчных протоков: 1) расширение общего желчного протока более 8 мм; 2) мелкие камни в желчном пузыре; 3) «плавающие» камни в общем желчном протоке даже после их удаления; 4) застойная или замазкообразная желчь в общем желчном протоке; 5) рубцовые изменения стенки общего желчного протока; 6) рубцовые изменения печеночно-дуоденальной связки, маскирующие и деформирующие общий желчный проток; 7) подозрение на любую непроходимость в области большого сосочка двенадцатиперстной кишки; 8) затруднение в установлении локализации большого сосочка двенадцатиперстной кишки; 9) необходимость расширения большого сосочка двенадцатиперстной кишки; 10) необходимость чреспече-ночного дренирования.
Эти показания относятся к методу зондирования в целом, поэтому кратко остановимся на каждом из них отдельно.
1. Наличие расширенного (диаметром более 8 мм) общего желчного протока является признаком либо стенозирующего папиллита, либо «плавающего» камня, который периодически перекрывает просвет в более узкой части протока и ведет к хронической перемежающейся гипертензии, а также к расширению общего желчного протока. Зондирование выполняют эластическими зондами. Сначала вводят зонд диаметром 3 мм, так как прохождение такого зонда исключает наличие стенозирующего папиллита. После введения зонда в общий желчный проток легким нажатием его проводят в полость двенадцатиперстной кишки, что определяется по достаточной (более 8 см) длине ушедшей его части в общий желчный проток без всякого сопротивления либо по ощущению легкого сопротивления в момент прохождения большого сосочка двенадцатиперстной кишки (чем эластичнее зонд, тем четче определяется это сопротивление). Введение зонда прекращают. Положение его контролируют путем пальпации через стенку общего желчного протока после мобилизации двенадцатиперстной кишки по Кохеру. Если в общем желчном протоке имеется камень, не замеченный во время пальпации, то он в большинстве случаев четко определяется по ходу зонда, даже если его диаметр не превышает 1—2 мм.
2. Наличие мелких камней в желчном пузыре. При функционировании желчного пузыря и достаточной ширине пузырного протока в общем желчном протоке могут находиться «бессимптомные» камни. Определить их помогает пальпация на введенном зонде. В связи с этим мы стремимся при помощи эластических зондов определить степень проходимости большого сосочка двенадцатиперстной кишки даже при нормальной ширине общего желчного протока. Если зонд диаметром 3 мм проходит в двенадцатиперстную кишку, то пройдет и камень диаметром 1—2 мм, даже если он не будет обнаружен, а камень диаметром 3 мм и более обнаружится при зондировании. Если зонд диаметром 3 мм не пройдет в двенадцатиперстную кишку, то потребуется сфинктеропластика, после которой мелкие камни, не обнаруженные при исследовании, свободно пройдут в кишечник.
3. «Плавающие» камни в общем желчном протоке. Исследование дистального отдела общего желчного протока эластическими зондами в этих случаях обязательно для выявления незамеченных камней и стенозирующего папиллита. При этом мы следуем простому принципу: если бы не было стенозирующего папиллита, камень не застрял бы в желчном протоке.
4. Наличие в общем желчном протоке застойной или замазкообразной желчи. Мы считаем, что застоя желчи без стенозирующего папиллита или какого-либо другого препятствия в дистальном отделе общего желчного протока не бывает. Поэтому во всех случаях, когда из культи пузырного протока даже при нормальной ширине общего желчного протока поступает застойная или замазкообразная желчь, необходимо исследование дистальных его отделов эластическими зондами.
Исходя из сказанного, можно установить следующее правило. Эластические зонды необходимо использовать для манипуляций в дистальном отделе общего желчного протока. Для исследования проксимальных отделов желчных протоков более оправдано применение металлических зондов.
Для введения зондов в желчные протоки надо стремиться во всех случаях использовать культю пузырного протока; если она узкая, ее расширяют зондом или рассекают до места впадения в общий желчный проток. К холедохотомии прибегают лишь в тех случаях, когда обнаружить культю пузырного протока или ее остатки практически невозможно.
В последние годы мы все чаще стали применять в диагностических целях зондирование желчных протоков и вполне согласны с мнением О. Б. Милонова и соавторов (1975) о преимуществе этого метода над функциональными, особенно в тех случаях, когда руб-цовый стеноз устья большого сосочка двенадцатиперстной кишки распространился настолько глубоко, что его сфинктеральные зоны уже не способны к сокращению (функциональная недостаточность) и не могут создать гипертензии в желчных протоках. По данным Е. А. Петрова и Э. И. Гальперина (1971), даже значительное сужение (до 1 —1,5 мм) в области большого сосочка двенадцатиперстной кишки при малой скорости желчеистечения не ведет к развитию желчной гипертензии. Желчные протоки остаются не расширенными и использование зонда в этих случаях является незаменимым диагностическим методом.
В то же время нельзя считать, что диагностика патологии дистального отдела общего желчного протока после применения эластических зондов стала легкой. Зонд может задерживаться в изгибах просвета общего желчного протока, в складках слизистой оболочки самого сосочка, создавая ложное впечатление непроходимости, а иногда камень, располагаясь в дивертикулообразном углублении, не препятствует прохождению зонда и, следовательно, не диагностируется. Однако подобные случаи редки и по мере приобретения опыта эти ошибки сводятся к минимуму. Не следует также забывать, что метод зондирования — это не метод бужиро-вания и поэтому калибр зондов должен использоваться от большего к меньшему, а не наоборот. Не следует также забывать, что как бы ни было осторожно проведено зондирование, оно все же травмирует сфинктеральную зону большого сосочка двенадцатиперстной кишки, поэтому эту манипуляцию следует выполнять после проведения функциональных методов исследования и даже хо-лангиографии, а за больным в послеоперационный период вести наблюдение, учитывая возможность обострения или даже вспышки острого панкреатита. По нашим данным, в тех случаях, когда зондирование эластическими зондами проводилось по показаниям и только как диагностический метод, осложнений со стороны желчных протоков и поджелудочной железы не было.
Возможно также образование ложного хода, наиболее часто встречающиеся варианты которого изображены на рис. 58.

В последние годы применяют зонд для желчных протоков типа Фогарти (рис. 59) с одной или двумя раздувными манжетками.

Отстоящий от манжетки конец зонда имеет длину до 3—4 см и диаметр 2 мм; диаметр зонда на уровне манжетки составляет 4 мм. Зная эти параметры, мы довольно часто используем зонд для исследования дистального отдела общего желчного протока в диагностических целях, так как его жесткость не превышает жесткости эластических зондов. Кроме того, этот зонд с успехом применяют для извлечения камней даже из внутрипеченочных протоков.
Зонд вводят через культю пузырного протока, предварительно захватив ее тонким зажимом для фиксации. Вначале зонд вводят в дистальном направлении. Перемещение зонда производят при незначительном надавливании на него. Если зонд свободно проходит в просвет двенадцатиперстной кишки, значит проходимость большого сосочка двенадцатиперстной кишки свободная. Не извлекая зонд, повторно пальпируем желчные протоки.
Затем зонд медленно подтягиваем до уровня, когда дистальный конец его пройдет через большой сосочек двенадцатиперстной кишки в общий желчный проток. Этот момент хорошо контролируется пальпацией области сосочка, а также внезапно исчезающим сопротивлением движению зонда. Раздуваем баллон до таких размеров, чтобы зонд плотно прилегал к стенкам желчного протока, и постепенно извлекаем его. При этом первый ассистент, нагнетая шприцем воздух или раствор антисептика, поддерживает необходимое давление в баллоне зонда, а хирург правой рукой извлекает зонд, левой рукой пальпируя желчный проток над баллоном зонда. Камни можно удалить из желчного протока через культю пузырного протока. При малом диаметре последней производят продольный разрез культи пузырного протока с переходом па общий желчный проток.
После ревизии дистального отдела общего желчного протока первый ассистент несколько сдавливает печеночно-дуоденальную связку, а хирург проводит катетер Фогарти в проксимальном направлении, насколько это возможно. Затем, как описано выше, раздувают баллон зонда и постепенно извлекают его, постоянно увеличивая давление в баллоне, чтобы он плотно прилегал к стенкам протока. Эту процедуру повторяют, вводя катетер в другой печеночный проток.
Холедохоскопия является довольно старым методом операционной диагностики, который, однако, и до настоящего времени не получил широкого признания хирургов. Известно, что еще Bokes (1923) осматривал общий желчный проток изнутри при помощи тубуса и лобного зеркала, a Antonuell (1932) и Malver (1941) создали для этой цели оптический инструмент, подобный современным жестким холедохоскопам. Жесткие травматичные холедохоскопы были заменены в 1970 г. гибкими фиброхоледохоскопами (Nishimuта, 1970), а затем более совершенными фиброхоледохоскопами с полужесткой средней частью и гибким дистальным концом (Stotter и соавт., 1975). Наряду с ними применяют и современные жесткие холедохоскопы с изгибом под углом, так как они имеют хорошую оптику, а наружный диаметр их составляет 0,5 см. Несмотря на их практическое удобство, совершенствование идет по линии создания гибких холедохоскопов. Отечественные модели фиброхоледохоскопов были разработаны В. С. Качуркиным и соавторами (1974).
Холедохоскопия позволяет выявить мелкие камни в желчных протоках, в том числе и во внутрипеченочных, обнаружить опухоль протоков и выполнить биопсию, определить состояние слизистой оболочки общего желчного протока, выявить сужение в терминальном отделе желчных протоков, а также осуществить ряд лечебных манипуляций — удаление камней, промывание протоков, трансхоледохеальную папиллотомию (В. Р. Пурмалис, 1969). Холедохоскопия дает возможность получить натуральное фотографическое изображение патологии, и этим выгодно отличается от всех других методов операционной диагностики.
Показаниями к холедохоскопии являются неэффективность других методов исследования или отсутствие уверенности в устранении патологии во время операции. Некоторые хирурги считают холедо-хоскопию обязательным методом исследования во всех случаях первичной холедохолитотомии (Berci и соавт., 1977). О. Б. Милонов (1975) придерживается противоположного мнения и применяет более простые методы диагностики. Мы считаем, что холедохоскопию следует применять и как диагностический, и как лечебный метод, но при наличии определенных показаний и недостаточной информативности других методов исследования (пальпации, дебитометрии, зондирования эластическими зондами, холангиографии).
В зависимости от способа введения холедохоскопа в желчные протоки различают чреспузырную, чресхоледохеальную и чреспапиллярную холедохоскопию.
В основном холангиоскопию выполняют путем вскрытия общего желчного протока и только в редких случаях холедохоскоп удается ввести через расширенную культю пузырного протока. Чреспапиллярную холедохоскопию применяют только при выполнении трансдуоденальной папиллосфинктеротомии.
Для проведения холангиоскопии желчные протоки заполняют изотоническим раствором натрия хлорида, который вводят непрерывно.
Подачу раствора мы осуществляем с помощью системы для переливания крови, соединенной с холангиоскопом. Флакон с раствором устанавливаем на высоте до 30 см над уровнем операционного стола. Изливающийся в подпеченочное пространство раствор удаляем электроотсосом.
Изотонический раствор натрия хлорида растягивает стенки желчных протоков и позволяет хорошо осмотреть их. Предложения некоторых хирургов (W. Т. Griffin, 1976; P. F. Nora и соавт., 1977), создаватать давление внутри желчных протоков до 150—300 мм рт. ст. ( 20—39,9 кПа) для лучшей визуализации протока нецелесообразно. Мы отмечали хорошую эндоскопическую картину при давлении внутри протока не более 300 мм вод. ст. (2,9 кПа).
Опыт использования жестких и гибких холангиоскопов позволил более четко определить показания к их применению (Д. Ф. Благовидов и соавт., 1979). Жесткие аппараты удобны в эксплуатации, легко стерилизуются, имеют большое поле зрения, высокую светосилу. Инструментальный канал жестких холангиоскопов широкий, что дает возможность выполнять некоторые манипуляции под визуальным контролем (смещение или дробление камней, биопсия и др.). Однако из-за жесткости конструкции такие аппараты можно применять только в случаях значительного расширения желчных протоков, а осмотр желчных протоков может быть проведен только на участке от бифуркации печеночных протоков до большого сосочка двенадцатиперстной кишки. Недостатками гибких холангиоскопов являются ограниченность поля зрения, а также сложность стерилизации. Поэтому при значительном расширении желчных протоков осмотр их гибким холангиоскопом нерационален, так как можно не заметить мелкий камень. Однако такие аппараты высокоинформативны при диаметре желчных протоков до 15 мм, а также позволяют осмотреть долевые и устья сегментарных желчных протоков.
Холангиоскопия не гарантирует обнаружение абсолютно всех камней желчных протоков. Несмотря на отрицательные результаты холангиоскопии, J. M. Schmid de Gruneck и P. W. Loup (1982) диагностировали холедохолитиаз во время послеоперационной холангиографии у 2,5 % больных.
Учитывая возможность ложноположительных результатов по данным холангиоскопии, J. J. Boner и соавторы (1981) рекомендуют после нее проводить дополнительную интраоперационную холан-гиографню.
Поиск камней значительно затрудняют воспалительные изменения желчных протоков, хлопья фибрина, являющиеся проявлением холангита.
Визуальный осмотр внутренней поверхности желчных протоков не только улучшает диагностику холангита, но и позволяет выделить различные формы его в зависимости от характера изменений слизистой оболочки. В. В. Виноградов и В. Л. Занделов (1981) диагностировали холангит до эндоскопического исследования у 83 (37,2%) больных, а после холангиоскопии — у 140 (62,8%).
Выраженные воспалительные изменения стенки желчных протоков (флегмонозный или флегмонозно-язвенный холангит) не сопровождаются повышением тонуса сфинктера ампулы большого сосочка двенадцатиперстной кишки (С. И. Бабичев, А. В. Филонов, 1980). Более того, гипотонию сфинктера авторы отметили у 28, а атонию — у 10 больных с такой патологией. Гипертонус сфинктера, подтвержденный манометрией, сочетался с визуальной картиной катарального или хронического холангита.
В то же время на возможность затруднения желчетока, вызванную воспалительным отеком слизистой оболочки дистального отдела общего желчного протока, указывают Н. У. Усманов и Д. М. Кадыров (1980). Авторы отметили постепенное восстановление проходимости желчных протоков в послеоперационный период, по мере стихания холангита, у 14 больных.
На основании изложенного можно сделать вывод, что холангиоскопия жестким холедохоскопом целесообразна при диаметре общего желчного протока более 15 мм для контроля полноты удаления камней из дистального отдела протока, а также для дифференциальной диагностики холедохолитиаза и опухоли желчного протока. Гибкие холангиоскопы применяют для контроля полноты удаления камней из внутринеченочных желчных протоков, а также из общего желчного протока при диаметре его менее 15 мм.
Установление диагноза холедохолитиаза является показанием к удалению камней из протока, которое может быть осуществлено либо путем операционной холедохолитотомии, либо методом эндоскопической папиллотомии с последующей экстракцией камней.
Холедохотомия. Частота применения этой операции составляет в среднем 24,6 %. Впервые операцию выполнил Kummel в 1884 г. По мнению большинства авторов, показаниями к холедо-хотомии являются: механическая желтуха, перемежающаяся желтуха, холангит, сопутствующий панкреатит, расширение желчных протоков, камни в печеночных и общем желчном протоках, множественные мелкие камни в желчном пузыре при широком пузырном протоке, патологические изменения большого сосочка двенадцатиперстной кишки.
По данным В. М. Ситенко и А. И. Нечая (1972), лишь в 70 % случаев при холедохотомии обнаруживают препятствия для отхождения желчи в кишечник. Обращает на себя внимание и тот факт, что 6 % больных, перенесших холедохотомию, приходится оперировать повторно, причем у 54 % обнаруживаются остаточные камни (W. Hess, 1971).
Риск оставления камней в желчном протоке после холедохолитотомии резко возрастает, если удалено более 4 камней, и мало зависит от диаметра камней.
Отмечается также увеличение летальности после операций с применением холедохотомии до 7—11 % (В. В. Вахидов, И. А. Рябухин, 1965; 3. А. Топчиашвили, 1965), хотя Б. А. Петров (1972) указывал, что повышение летальности связано не столько с самой холедохотомией, сколько с патологическим процессом, по поводу которого ее производят.
На основании данных литературы и собственного опыта мы считаем, что холедохотомию не следует производить по всем перечисленным показаниям. Вопрос о том, необходима ли холедохотомия, должен решаться в каждом отдельном случае индивидуально. При этом учитываются в первую очередь данные анамнеза (постоянная или перемежающаяся желтуха), дооперационных методов исследования и в первую очередь ретроградной холангиографии, а также данные ряда операционных исследований, осмотра, пальпации, холангиоманометрии, дебитометрии, холангиографии, зондирования протоков с пальпаторным их исследованием. Как оказалось, в 95 % случаев все операционные исследования удается выполнить через культю пузырного протока, что позволяет избежать холедохотомии. Лишь у 20 % больных мы были вынуждены произвести холедохотомию.
Техника операции. Первоначальная длина разреза стенки общего желчного протока может быть различной в зависимости от цели холедохотомии и ширины самого протока. Чем уже общий желчный проток, тем меньше и разрез стенки, но вместе с тем он должен быть не менее 5 мм, так как совсем маленькое отверстие может привести к нежелательному надрыву стенок при дальнейших манипуляциях.
Разрез делают по передней стенке общего желчного протока, ближе к наружному краю его и на расстоянии около 5 мм от края двенадцатиперстной кишки. Это дает возможность завершить операцию холедоходуоденостомией, если она окажется необходимой.
В зависимости от ширины общего желчного протока и предполагаемого способа завершения холедохотомии разрез стенки может быть продольным (относительно узкий общий желчный проток — до 1,5 см), косым (умеренно расширенный — до 2 см) и поперечным (резко расширенный — более 2 см). Перед вскрытием общего желчного протока стенку по обеим сторонам от предполагаемого разреза захватывают 2 нитями-держалками, помещенными друг против друга поперек его передней стенки. Чтобы убедиться в том, что это действительно общий желчный проток, хирург пунктирует его тонкой иглой. Натягивая держалки, между ними вскрывают проток тонким (глазным) скальпелем (рис. 60).
Вытекающую из протока желчь немедленно отсасывают электроаспиратором, конец которого помещают у разреза. После этого делают ревизию общего желчного протока, чтобы решить вопрос о том, каким способом завершить операцию — холедоходуодегюстомией или папилло-сфинктеротомией. При необходимости разрез продлевают в нужном направлении при помощи тонких ножниц, изогнутых по ребру.
Дальнейшее исследование общего желчного протока лучше всего проводить при помощи изогнутых кровоостанавли-в'ающих зажимов с длинными браншами. Зажим вводят в проток, его бранши несколько раскрывают и в таком положении продвигают по протоку по направлению вначале к печени, а затем к большому сосочку двенадцатиперстной кишки. Применение зажима облегчает захват камней и сгустков желчного детрита и уменьшает опасность проталкивания их инструментом.
Исследование протоков приводят осторожно повторно и настолько глубоко, насколько возможно ввести зажим. Если обнаруживаются камни, которые не удается захватить зажимом, то, поместив четыре пальца левой руки позади печеночно-дуоденальной связки и мобилизованной головки поджелудочной железы, а большой палец — впереди них, хирург осторожными движениями смещает пальпируемые камни к
месту холедохотомии и удаляет. Перемещая камни, нельзя их сдавливать, так как мягкие камни под действием нажима могут раздробиться, что резко усложнит их удаление. Если камни самостоятельно не выходят через разрез стенки общего желчного протока, их извлекают пинцетом или мягким зажимом. Если в протоках имеются мелкие камни и нет уверенности в полном их удалении, то их можно извлечь путем аспирации и промывания с помощью шприца через катетер или хлорвиниловую трубочку, которые вводят в просвет протока кверху и книзу по несколько раз. Этот метод особенно ценен для удаления камней из внутрипеченочных протоков.
Для более полного удаления камней во время холедохотомии Wels и соавторы (1981) вводили в общий желчный проток фибрин. Методика операции заключалась в следующем. Через два раздельных катетера в общий желчный проток вводили раствор тромбина с кальция хлоридом и фибриногеном. В результате коагуляции образовывался сгусток, который заполнял общий желчный, общий печеночный и долевые печеночные протоки. Все мелкие камни, замазкобразная желчь оказывались заключенными в этот сгусток, через 7 мин, то есть после окончательного формирования сгустка, его удаляли через холедохотомическое отверстие. Авторы указывают на высокую эффективность удаления мелких камней и замазко-образной желчи таким способом.
камни большого сосочка двенадцатиперстной кишки обычно фиксированы за счет рубцового стеноза или располагаются в псев-
додивертикуле и их трудно сместить кверху, чтобы удалить через холедохотомическое отверстие. Не следует ценой грубых и опасных манипуляций пытаться это сделать. Гораздо безопаснее удалить камни и одновременно устранить стеноз терминального отдела общего желчного протока путем трансдуоденальной папилло-сфинктеротомии.
Ретродуоденальная и транспанкреатическая холедохотомия опаснее трансдуоденальной папиллосфинктеротомии и мы применяем ее только в тех случаях, когда камень фиксирован настолько прочно, что его невозможно сместить ни в супрадуоденальный, ни в дистальный отдел общего желчного протока.
Л. В. Поташов и соавторы (1982) для слепковой холангиолит-яктомии использовали затвердевающие смеси фибриногена и тромбина. Успешно применив этот метод у 2 больных, авторы считают его достаточно надежным способом санации желчных протоков, особенно при наличии мелких, трудно удалимых камней, и профилактики «забытых» камней.
После удаления камней и замазкообразной желчи из общего желчного протока обязательно проводят контрольное исследование протоков в дистальном направлении эластическими, а в проксимальном — металлическими зондами. Если же при небольшом нажиме зонд не проходит в двенадцатиперстную кишку, необходима трансдуоденальная ревизия большого сосочка и двенадцатиперстной кишки и соответствующая коррекция существующих нарушений.
Когда возникает вопрос об операционной ревизии желчных протоков или извлечении мелких камней, мы всегда стремимся выполнить эти манипуляции через культю пузырного протока. Но диаметр пузырного протока редко позволяет извлечь даже небольшие камни. В этих случаях мы пользуемся методом цистикохоледо-хотомии — рассекаем переднюю стенку пузырного протока с продолжением его на общий желчный проток у места впадения пузырного протока (рис. 61).
Преимущество такого вида холедохотомии состоит в том, что длина разреза общего желчного протока обычно не превышает половины его диаметра, так как устье пузырного протока само по
себе представляет значительное по размерам отверстие в стенке протока. В силу этого для зашивания холедохотомического отверстия достаточно наложить атравматической иглой несколько швов нитью 5/0, которые не приводят к сколько-нибудь значительной деформации протока.
Этот метод позволяет выполнить все инструментальные исследования и удалить камни диаметром до 1 см.
Способы завершения холедохотомии. Продолжительное время абсолютным правилом считалось введение Т-образного дренажа в общий желчный проток после каждой холедохотомии, так как после внутрипротоковых манипуляций всегда развивается «травматический холедохит» и отмечается выраженная желчная гипертензия (W. Hess, 1966, и др.).
В настоящее время, когда достаточно широко внедрены дренирующие операции, полностью устраняющие желчную гипертензию после холедохотомии и удаления камней, необходимость в дренировании общего желчного протока абсолютно у всех больных отпала. Частота наружного дренирования в настоящее время составляет, по данным одних авторов, от 6,7 до 17,8 % (Л. А. Авдей, Г. П. Шорох, 1975; А. Ф. Греднев и соавт., 1976; Л. А. Збыковская, А. С. Гофман, 1977; В. В. Радионов и соавт., 1977, и др.), других — 29—90 % (В. М. Ситенко и соавт., 1975,— 48%; Д. Л. Питковский и В. Е. Ефет, 1977,-90%, Л. М. Шор и соавт., 1977, - 73%; М. И. Лыткин и соавт., 1978,— 50 %; Д. Ф. Благовидов и соавт., 1979,-26,8 %; Mollet и Juy, 1977,-42,5 %).
Для дренирования используют дренажные трубки различных конструкций. Зарубежные и некоторые наши хирурги предпочитают Т-образный дренаж типа Кера с некоторыми изменениями (рис. 62).

Этот дренаж изготовлен из тефлона, что значительно облегчает его удаление.
Техника операции дренирования состоит в том, что через холедохотомическое отверстие вводят поперечное колено Т-образного дренажа, концы которого обрезаны на расстоянии 1—2 см от стыка, и отверстие герметически зашивают вокруг трубки с помощью непрерывного или П-образного кетгутового шва. Через 3—4 нед дренаж удаляют.
С. П. Федоров (1930) после одного несчастного случая, при котором потребовалась повторная операция из-за отрыва поперечной части дренажа, стал обвязывать ее шелковой нитью, которую выводил наружу вместе с длинным концом, и таким образом получал возможность извлекать без повторной операции короткое колено Т-образного дренажа в случае его отрыва.
В нашей стране получил широкое применение дренаж Вишневского. Он представляет собой простую резиновую трубку с косым срезом и боковым отверстием, расположенным на расстоянии 3— 4 см от конца. Ниже этого отверстия трубку обвязывают кетгуто-вой нитью, после чего конец трубки вводят через холедохотомическое отверстие по направлению к печени. Оба конца кетгутовой нити выкалывают изнутри кнаружи у верхнего края холедохотоми-ческого отверстия и завязывают. Благодаря этому дренажную трубку укрепляют так, что боковое отверстие располагается внутри протока. Холедохотомическое отверстие зашивают герметически вокруг трубки, а ее другой конец выводят через отдельный прокол брюшной стенки наружу. Пришивать дренаж к брюшной стенке не рекомендуется, так как при дыхательных движениях трубка может случайно выйти из просвета общего желчного протока в свободную брюшную полость.
Однако, как показали клинические наблюдения (П. А. Иванов, 1977), дренаж Вишневского имеет существенные недостатки. Вокруг него очень трудно или даже невозможно создать герметичность протока. Его трудно укрепить в общем желчном протоке, и часто при извлечении тампонов или даже самопроизвольно этот дренаж преждевременно выпадает и вызывает тяжелые осложнения из-за вытекания желчи в брюшную полость. Кроме того, при введении дренажа трудно проверить, как расположился его внутренний конец, а он может либо упереться в развилку и перегнуться, либо войти в один из печеночных протоков и перекрыть другой, вызывая тяжелые нарушения оттока желчи. И, наконец, дренаж Вишневского вызывает деформацию и перегиб протока и отдавливает внутрь нижнюю часть его стенки. Вследствие развития грануляционной и фиброзной ткани проток фиксируется в таком положении, и после удаления дренажа создается своего рода клапан, нарушающий отток желчи в кишку и создающий предпосылки для длительного желчеистечения и образования стойкого желчного свища (рис. 63).
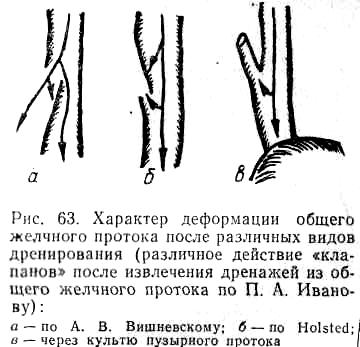
Некоторыми преимуществами обладает дренаж Hoisted, отличающийся от дренажа Вишневского тем, что его внутренний конец направлен вниз, в сторону большого сосочка двенадцатиперстной кишки. Под контролем пальпации дренаж устанавливают таким образом, чтобы его кончик приблизительно на 1 см не доходил до большого сосочка двенадцатиперстной кишки. Как подчеркивает П. А. Иванов (1972), при таком методе «обратного» дренирования общего желчного протока также образуется своеобразный клап.ан, но теперь он уже играет положительную роль, перекрывая ток желчи через свищ после удаления дренажной трубки.
R. Stith (1964) предложил своеобразный способ чреспеченочно-го дренирования печеночно-пузырного протока (рис. 64).
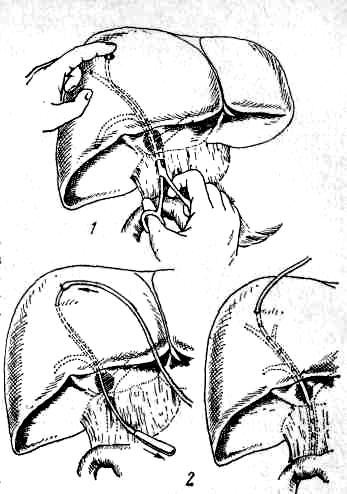

Этот способ в 1969 г. был применен в нашей стране В. В. Виноградовым. Для проведения дренажной трубки через печеночную ткань используют зонд Долиотти или специально созданные для этой цели зонды различной конструкции (рис. 65),

позволяющие проникнуть из левого печеночного протока на верхнюю поверхность печени. Зонд вводят в общий желчный проток после супрадуоденальнои холедо-хотомии, затем продвигают его в левый печеночный проток и выводят на поверхность печени. На конец зонда натягивают пластиковую трубку, которую при обратном движении зонда вводят в желчно-пузырный проток. Установив трубку на желаемом уровне, накладывают швы на разрез общего желчного протока. Трубку выводят на брюшную стенку через специальный разрез. Этот способ имеет большие преимущества перед другими.
Подобным чреспеченочным способом предлагают дренировать печеночно-желчный проток Soypol и Kurion (1969), но они применили еще и чресхоледохеальный наружный дренаж, получив возможность двойного дренирования. Однако, несмотря на утверждение авторов о безопасности проведения дренажа через паренхиму печени, подобные методы дренирования далеко не идеальны и не менее травматичны, чем описанные выше, в связи с чем применение их для уменьшения временной гипертензии в связи с холедохотомией или другими манипуляциями на общем желчном протоке нецелесообразно. Такие дренажи-каркасы используют в реконструктивной хирургии при стриктурах желчных протоков.
Диаметр дренажа выбирают в зависимости от целей дренирования. Если во время холедохолитотомии удалены единичные крупные камни, внутренняя поверхность желчных протоков и желчь не изменены, то целью дренирования является временная декомпрессия в протоках на период до 10—40 сут, то есть до заживления хо-ледохотомического разреза. В этой ситуации показано применение, дренажа диаметром не более 3 мм. Так как сроки дренирования невелики, дренаж фиксируют кетгутовой нитью. На расстоянии 3— 4 мм от конца трубки в ней делают 1—2 боковых отверстия. Кетгутовой нитью обвязывают дренаж на уровне фиксации, то есть отступя 1 —1,5 см от конца его. Концы кетгутовой нити проводят раздельно через культю пузырного протока на расстоянии 2—3 мм одна от другой. Дренаж направляют в общий желчный проток и, подтягивая кетгутовые нити, фиксируют, концы нитей завязывают. Затем зашивают холедохотомическое отверстие; шов переходит на культю пузырного протока, как описано выше.
К месту шва общего желчного протока подводят перчаточно-трубчатый дренаж, который выводят через отдельный разрез брюшной стенки в правом подреберье. Дренаж общего желчного протока укладывают непосредственно поверх дренажа брюшной полости и выводят наружу также через контрапертуру в правом подреберье. Оба дренажа фиксируют к коже отдельными швами.
В тех случаях, когда из желчного протока удалено несколько мелких камней и слизистая оболочка его воспалена, а желчь содержит примесь гноя, то есть, если во время операции диагностирован гнойный холангит и (или) существует угроза оставления камней в желчном протоке, то для дренирования применяют трубки диаметром 5—6 мм. Сроки дренирования при этом достигают 16—20 сут и более, поэтому для фиксации дренажа используют нить из хромированного кетгута. Холедохотомическое отверстие и культю пузырного протока зашивают, вводят и фиксируют дренажи, как это описано ранее.
В настоящее время, когда диагностика и способы хирургической коррекции вполне надежно обеспечивают выяснение и устранение причин желчной гипертензии, необходимость в дренировании общего желчного протока после каждой холедохотомии отпадает. К тому же известны и недостатки самого дренирования, не говоря уже о тех деформациях желчных протоков, которые возникают в результате механического воздействия самого дренажа. Во-первых, этот дренаж нефизиологичен, так как сопровождается потерей желчи и намного задерживает выздоровление больного. Во-вторых, дренаж, хотя и устраняет непосредственную угрозу желчной гипертензии и инфекции, все же не способствует окончательному излечению существующей патологии. Он устраняет застой желчи только до тех пор, пока не будет удален. Поэтому если желчные пути свободны, то дренаж не нужен, а если же на пути оттока желчи имеется какое-то препятствие, то дренаж не устраняет его. Описаны также случаи гемобилий в результате аррозии сосудистой стенки при применении дренажей большого диаметра (В. М. Данилов, Н. А. То-гонидзе, 1977; С. А. Шалимов и соавт., 1985).
Исходя из этих соображений, многие хирурги (В. В. Виноградов и соавт., 1972; Д. Ф. Благовидов и соавт., 1976; О. Б. Милонов и соавт., 1977; А. А. Волков и соавт., 1978) отказались от слепого применения дренажа протока и применяют либо глухой шов, если отток желчи свободный, либо внутреннее дренирование с помощью билиодигестивных анастомозов, если на пути оттока желчи остаются какие-либо препятствия, устранить которые не представилось возможным. Дренирование общего желчного протока они производят по определенным показаниям: для временного снятия желчной гипертензии при остром панкреатите, при неуверенности в радикальности билиодигестивного анастомоза или полного удаления всех камней, несмотря на свободный отток желчи и контроль с помощью операционной холангиографии, для лечебных целей при гнойном холангите, а также как временная мера при высоком риске радикального оперативного лечения, в ряде случаев в целях проведения исследования в послеоперационный период.
Еще в 1963 г. И. М. Тальман совершенно справедливо подчеркивал ошибочность мнения, что наружное дренирование общего желчного протока уменьшает, воспалительный процесс в желчевыводящих путях и улучшает отток в двенадцатиперстную кишку. Наши наблюдения свидетельствуют о том, что желтуха не может быть вызвана одним набуханием слизистой оболочки в области большого сосочка двенадцатиперстной кишки, которое может окончательно пройти после временного наружного отведения желчи. В подобных случаях всегда обнаруживаются необратимые изменения, требующие радикальной операции. Кроме того, изолированное наружное дренирование желчевыводящих путей, которое проводят обычно на протяжении 2—3 нед, как правило, не ликвидирует хронический холангит ' при наличии препятствия магистральному желчеоттоку — для излечения необходимо создание свободного и постоянного оттока желчи в кишечник. Дренирование общего желчного протока не всегда обеспечивает отхождение камней и замазкообразного детрита, оставшихся после холедохотомии, так же как и сама холедохотомия не гарантирует полного удаления камней. Учитывая изложенное, мы считаем, что показания к наружному дренированию общего желчного протока, как и вообще к любым другим паллиативным операциям на желчевыводящих путях, должны быть максимально ограничены.
Если после холедохотомии и извлечения единичных крупных камней обнаруживаются чистая желчь и свободная проходимость терминального отдела общего желчного протока, мы, как правило, накладываем глухой шов. Такая операция была выполнена у 288 больных. Кроме того, еще у 372 (42 %) больных ушито наглухо холедохотомическое отверстие после того, как были удалены камни и устранена непроходимость большого сосочка двенадцатиперстной кишки. Умерли 13 (2 %) больных.
Применение первичного глухого шва общего желчного протока («идеальная холедохотомия») у подавляющего большинства больных ведет к более быстрому заживлению послеоперационной раны
и значительному сокращению сроков пребывания больного в стационаре. Следует, однако, подчеркнуть, что первичный шов общего желчного протока таже не совсем безопасен. Риск небольшой, если оперировать с учетом всех дооперационных данных, включая результаты ретроградной холангиографии, под контролем операционной холангиографии, дебитометрии, зондирования калиброванными эластическими зондами, но если это требование нарушается, возможны летальные исходы. Мы у одной больной после холецистэк-томии и холедохотомии проверили проходимость большого сосочка двенадцатиперстной кишки лишь только с помощью металлического зонда и зашили наглухо общий желчный проток. Через 11 дней после операции больная умерла вследствие несостоятельности шва общего желчного протока и желчного перитонита, 5 больных умерли от причин, не связанных с ушиванием общего желчного протока.
В последние годы мы стали чаще применять декомпрессивный дренаж тонкой хлорвиниловой трубочкой, проведенной через культю пузырного протока. Этот способ предохраняет шов общего желчного протока от желчной гипертензии, не деформирует проток, позволяет вести тщательное рентгеноманометрическое наблюдение после операции и не влияет на сроки пребывания больного в стационаре, так как дренаж удаляют на 6—8-е сутки после операции.
Холедохотомическое отверстие ушивают двумя рядами швов тонкой непрерывной хромированной кетгутовой нитью на атравматической игле и отдельными П-образными капроновыми швами. Однако при достаточной уверенности в устранении всех причин желчной гипертензии желательно накладывать однорядный шов хромированным тонким кетгутом или капроном с расстоянием между стежками 1 —1,5 мм, не захватывая слизистую оболочку протока. Учитывая возможность прорезывания капроновой нити и выпадения ее конца в просвет общего желчного протока с последующим образованием камня, в последние годы применяют узловой шов стенки общего желчного протока тонкой капроновой нитью в расчете на то, что если какой-либо из узелков и прорежется, то он унесется током желчи в кишечник. Дополнительная перитонизация линии швов за счет брюшины печеночно-дуоденальной связки не обязательна, так как при отсутствии гипертензии подтекание желчи практически исключается.
Раньше мы чаще пользовались наружным дренированием общего желчного протока. Дренирование по Вишневскому произведено у 72 больных, по Халстеду—Пиковскому —- у 41 по следующим показаниям: острый гнойный холангит и холангитические абсцессы печени, острый панкреатит при наличии в общем желчном протоке камней, мутной желчи, мелких камней и замазкоподобной желчи, неустраненное препятствие в дистальном отделе общего желчного протока, тяжелое состояние больного, когда необходимо ограничиться кратковременным и минимальным оперативным вмешательством.
Умерли 15 (13,3 %) тяжелобольных; смерть не была связана с дренированием.
Результаты применения глухого шва общего желчного протока у 304 больных анализируют В. В. Родионов и соавторы (1980). Послеоперационные осложнения отмечались у 71 (23,4 %) больно-го. Значительное число осложнений (33,8 %) оказалось специфичным для данной техники оперативного вмешательства: несостоятельность швов желчного протока, холангит и печеночно-почечная недостаточность.
Сказанное позволяет прийти к заключению, что наружный дренаж общего желчного протока следует считать оптимальным методом завершения холедохолитотомии. При отсутствии признаков гнойного холангита специального ухода за дренажем общего желчного протока в послеоперационный период не требуется. Свободный конец дренажа помещаем в стерильную емкость, что дает возможность следить за количеством отделяемой желчи и ее свойствами.
В случаях осложнения холедохолитиаза гнойным холангитом необходимо обеспечить свободный отток желчи, а также санацию желчных протоков раствором антисептиков.
Изучение тяжести и динамики течения холангита с использованием прогностических критериев (по В. С. Савельеву и соавт., 1981) показало, что статистической достоверностью обладают пять клинических синдромов — клинико-анатомический (возраст более 70 лет, предшествующие оперативные вмешательства на желчных протоках, проявление острого процесса или атака холангита в анамнезе, потеря массы тела), гемодинамический (тахикардия, аритмия, артериальная гипотензия), интоксикационно-септический (гипертермия, пентрада Рейнольдса, септицемия), перитонеальный (перитонеальные признаки, пальпируемый инфильтрат, выпот в брюшной полости при лапароскопии), а также семь лабораторно-биохимических критериев: 1) лейкоцитоз выше 15-109/л; 2) гемато-критное число менее 30; 3) гипопротеинемия; 4) протромбиновый индекс менее 70; 5) гипербилирубинемия от 40 до 100 ммоль/л; 6) повышение уровня трансаминаз и 7) гиперкреатинемия.
На основании оценки приведенных прогностических клинических и лабораторно-биохимических критериев тяжести течения заболевания мы выделили 4 группы больных.
Первая группа — больные с благоприятным течением холангита. Прогностические клинические и лабораторные критерии отсутствуют либо обнаруживается лишь один из них. В эту группу входят лица с умеренными клиническими проявлениями холангита, эпизодами его или даже без явных клинических симптомов, но с наличием бактериологических и морфологических подтверждений диагноза.
Вторая группа — больные с холангитом средней степени тяжести. Отмечается один клинический и 1—2 лабораторных критерия. Наблюдается клиника острого холангита; в результате консервативной терапии острые явления купируются, состояние больных стабильно улучшается.
Третья группа — больные с тяжелым течением холангита. Отмечается 2—3 клинических и до 3—4 лабораторных критериев. Наблюдается септическое течение холангита. В результате интенсивной консервативной терапии состояние больных несколько улучшается, однако это улучшение не является стабильным.
Четвертая группа — больные с крайне тяжелым течением заболевания. Ее составляют лица с 3—4 клиническими и 5—7 лабораторными критериями. Наблюдается клиника септического холангита. Интенсивная реанимационно-консервативная терапия неэффективна и, несмотря на проведение ее в полном объеме, состояние больных не улучшается.
Разделение больных на группы по тяжести течения заболевания позволяет обосновывать сроки проведения оперативных или инструментальных вмешательств. Так, больным 1-й группы показано хирургическое лечение после полноценного дообследования, выяснения факторов, способствовавших развитию холангита (холедохоли-тиаз, стенозирующий папиллит и др.), коррекция соматической патологии. Сроки операции определяются полноценностью подготовки больного, так как воспалительный процесс в желчевыводя-щих путях не требует неотложных хирургических действий. Больным 2-й группы показано оперативное вмешательство в течение 3—4 сут. Стойкая стабилизация воспалительного процесса позволяет использовать этот промежуток времени для комплексного дообследования и предоперационной подготовки. Больным 3-й группы показано неотложное оперативное вмешательство в течение 24— 72 ч. Некоторое стабильное улучшение состояния больных в результате консервативных мероприятий позволяет провести кратковременную предоперационную подготовку. Если не удается достичь даже нестабильного улучшения состояния, то больным показано вмешательство в течение 1 сут. Больным 4-й группы показано экстренное оперативное вмешательство или инструментальная декомпрессия желчных протоков в течение нескольких часов с момента поступления на фоне продолжающейся интенсивной реанимационно-консервативной терапии.
Общая интенсивная терапия гнойной инфекции желчных протоков, продолжительность и интенсивность которой определяется тяжестью заболевания, включает внутривенное введение растворов, улучшающих реологические свойства крови, микроциркуляцию и обеспечивающих детоксикацию организма (гемодез, неокомпенсан, реополиглюкин и др.). По показаниям назначают гемотрансфузии, причем кровь подбирают индивидуально для каждого больного.
В процессе интенсивной терапии больным внутривенно переливают растворы альбумина, плазму крови, в том числе антистафилококко; вую и гипериммунную. Общий объем переливаемых растворов, крови и ее компонентов должен превышать суточный диурез на 10 %.
Для ускорения детоксикации организма применяют форсированный диурез, который проводят при обязательном контроле электролитного состава плазмы крови, содержания общего белка и фракций, центрального венозного давления. В случае проведения форсированного диуреза общий объем введенной жидкости в течение суток достигает 3—3,5 л, а суточный диурез — 2,5—3 л. Его поддерживают в течение 3—5 сут, после чего делают перерыв на несколько дней. Форсированный диурез проводят после предварительной подготовки больного. Вводят кристаллоиды и низкомолекулярные декстраны, а на фоне достигнутой гемодинамики осуществляют водную нагрузку путем внутривенного введения солевых растворов, 3 % раствора натрия гидрокарбоната (всего 1,5—2 л) и мочегонных средств.
Трансфузионную терапию проводят индивидуально с учетом тяжести процесса, его распространенности и состояния больного. Выбор средств зависит от степени интоксикации, основных показателей крови, состояния электролитного, белкового и водного обмена, гемодинамики.
В систему общих мероприятий входит и медикаментозная терапия, включающая парентеральное введение антибиотиков (в соответствии с чувствительностью микрофлоры гнойного очага), как правило, цефалоспоринов III и IV поколений, устойчивых к инактивирующему действию микробных ферментов и аминогликозидов, а также средств активной и пассивной иммуностимуляции, анатоксинов, иммунной плазмы, бактериофагов, продигиозана, метилурацила и т. д.
Учитывая, что большинство применяемых при антибактериальной терапии препаратов расщепляется в печени, целесообразно вводить их непосредственно в очаг воспаления.
Методы регионарной терапии дополняют адекватное оперативное вмешательство, повышают эффективность лечения и сокращают сроки купирования острого гнойного холангита.
Применяют две группы методов: активную санацию желчевыводящих путей на уровне внутри- и внепеченочных желчных протоков и внутритканевую (лимфотропную) и эндолимфатическую медикаментозную терапию. Первая группа включает следующие методы.
1. Инстилляционно-санационная декомпрессия желчевыводящих путей. Через просвет наружного дренажа в правый и левый внутри-печеночные протоки максимально вверх продвигают тонкие эластические катетеры с боковыми отверстиями на конце. Противоположные концы дренажей выводят на переднюю брюшную стенку. С первых часов послеоперационного периода осуществляют постоянную инфузионно-капельную инстилляцию по внутренним дренажам антисептических средств. Через наружный дренаж при этом выделяется желчь и вымываются хлопья фибрина, гной. При скоплении гнойных пробок в просвете наружного дренажа выполняют фракционное струйное промывание дренажной системы.
2. Инстилляционно-санационная декомпрессия. Используется в тех случаях, когда гнойный процесс развивается в незначительно расширенных желчных протоках. Использование указанного метода приводит к значительному сужению внутреннего просвета дренажа и затрудняет вымывание и эвакуацию детрита, фибрина и гноя из желчевыводящих путей. В подобных случаях конструкцию дренажной системы изменяют таким образом, чтобы дополнительные катетеры для печеночных протоков располагались пристеночно снаружи вдоль боковых стенок основной трубки и не вызывали сужения ее внутреннего просвета.
3. Внутрипротоковая сорбционная детоксикация. Через внутренний катетер двухпросветного наружного дренажа общего желчного протока желчевыводящие пути с помощью шприца заполняют сорбентом (3 % взвесью аэросила на фурацилине), который затем полностью вымывается после сеанса сорбции через внешнюю трубку в результате введения по внутривенному катетеру раствора антисептика. Сеансы внутрипротоковой сорбции проводят 2—3 раза в сутки по 20—25 мин.
Вторая группа методов включает внутритканевую (лимфотропную) и эндолимфатическую регионарную терапию. Под брюшинный покров круглой связки печени в направлении к воротам ее, а также между брюшинными листками треугольных связок устанавливают тонкие силиконовые катетеры (диаметром 1,5—2 мм) и фиксируют их атравматическим швом. Противоположные концы выводят через контрапертуру на переднюю брюшную стенку. Аналогично канюлируют увеличенные регионарные лимфатические узлы (перихоледохеальные, печеночные) катетерами (0,7—0,8 мм) с жесткими наконечниками. В послеоперационный период через катетеры вводят 10 % раствор маннита, гемодез или реополиглюкин (по 100—150 мл), 5000—10 000 ЕД гепарина, стимулирующих регионарный лимфоотток, а также антибактериальные средства (10 % раствор диоксидина, ампициллина тригидрат, гентамицина сульфат). Способ введения инъекционный (несколько раз в сутки) или инфузионно-капельный с частотой 8—10 капель в 1 мин.
У больных холангитом, вызванным анаэробными микроорганизмами, санацию желчевыводящих путей проводят 1 % водной взвесью адсорбента «Аэросил», обогащенного кислородом. При этом от 20 до 50 мл 1 % водной взвеси «Аэросила», обогащенного кислородом в концентрации не менее 20—30 мг/л, вводят через наружный дренаж в просвет желчевыводящих путей, предварительно обтури-ровав его резиновым баллоном для создания заданной экспозиции (2—3 мин). Внутрипротоковое давление, регулируемое аппаратом Вальдмана, не должно превышать 140 мм вод. ст. во избежание холангиовенозного рефлюкса инфицированной желчи. Обогащение 1 % водной взвеси кислородом производят путем пропускания через нее газообразного кислорода. Степень насыщения кислородом контролируется термооксиметром ИД-8404.
У больных с гнойным холангитом и механической желтухой особое значение имеет вопрос о целесообразности применения щадящих декомпрессионных вмешательств из чрескожного чреспеченоч-ного доступа.
Если препятствие оттоку желчи располагается в дистальном отделе общего желчного протока, а проходимость пузырного протока сохранена, то целесообразна декомпрессия желчевыводящих путей путем пункционной (под контролем ультразвукового исследования или лапароскопии) холецистостомии.
В клинике КНИИКЭХ разработана довольно простая, надежная, а главное, минимально травматичная методика чрескожной чреспеченочной холецистостомии под контролем двухмерных ультразвуковых аппаратов.
После визуализации на эхосканере увеличенного желчного пузыря выбирают точку для пунктирования. Пункционная игла должна проходить через край печени и находиться в проекции дна желчного пузыря. Место предполагаемой пункции обезболивают 0,21 % раствором новокаина с обязательной инъекцией всех слоев передней брюшной стенки. С помощью троакара прокалывают дерму. Затем готовят катетер. К катетеру предъявляются особые требования: 1) при небольшом наружном диаметре внутренний диаметр должен быть максимальным (то есть трубка должна быть тонкостенной) ; 2) катетер должен быть надежно фиксирован в желчном пузыре в течение заданных сроков.
Наиболее простым способом фиксации дренажа в полости желчного пузыря является создание «свиного хвостика». Для этого полиэтиленовый катетер с наружным диаметром 3—4 мм надевают на медную проволоку соответствующего диаметра. Дистальный конец катетера вместе с проволокой наматывают на круглый предмет диаметром 6—8 мм, делая 3—4 витка. Для фиксации катетера в таком положении его вместе с проволокой подогревают на пару или кипятят 10—15 мин, после чего охлаждают, извлекают проволоку и с помощью специального пробойника делают 2—3 отверстия в боковых стенках диаметром 1—2 мм. Катетер впоследствии сохраняет форму «свиного хвостика» даже после расправления. Катетер надевают на иглу Chiba таким образом, чтобы острие иглы выглядывало на 2—3 мм, и под контролем ультразвукового аппарата проводят в просвет желчного пузыря через край печени, убирают стилет иглы, отсасывают содержимое, затем извлекают иглу, оставляя в просвете пузыря катетер. Дренаж укрепляют на коже с по-
мощою лигатуры и отдельных полосок лейкопластыря. При высоких блоках желчевыводящих путей декомпрессия последних осуществляется путем чрескожной чреспеченочной холангиостомии. При этом под контролем ультразвукового исследования визуализируют внутрипеченочные желчные протоки. Под проекцией аппарата пунк-тируют желчный проток. Не извлекая иглы, вводим через нее в просвет желчных путей проводник и по нему — дилататор для более быстрой и удобной установки катетера, и лишь потом — дренажный катетер. Для лучшего отхождения желчи в боковых стенках дренажной трубки делают 3—4 отверстия.
Высокоэффективным методом профилактики и лечения гнойной инфекции желчевыводящих путей является местное применение иммобилизованных противомикробных лекарственных средств и ферментных препаратов. Известно, что при парентеральном введении указанных лекарств добиться поддержания их терапевтической концентрации в очаге нагноения в течение достаточно длительного периода времени практически невозможно. Из-за быстрой биодеградации под воздействием тканевых, микробных ферментных систем и клеточных факторов воспаления они теряют свою активность в течение 2—4 ч после введения. Противоопухолевые препараты утрачивают активность еще раньше.
Поэтому более перспективным является местное применение противомикробных и ферментных препаратов, иммобилизованных на различных природных или синтетических носителях. Наиболее приемлемой матрицей для иммобилизации лекарственных препаратов служит кремнийорганический полимер полиметилсилоксан (ПМС). Он представляет собой гидрогель, который после высушивания на воздухе при комнатной температуре превращается в легкосыпучий белый гидрофобный порошок без вкуса и запаха. ПМС обладает высокой адсорбционной активностью по отношению к гидрофобным кислым метаболитам, билирубину, липопротеидам, жидким молекулам и другим биологически активным веществам со свойствами токсинов. При контакте с микроорганизмами ПМС повреждает липопротеидный комплекс их оболочек, благодаря чему повышается эффективность антимикробных средств, а в ряде случаев удается преодолеть и барьер антибиотикорезистентности.
Таким образом, действие иммобилизирующей матрицы ПМС складывается из трех процессов: замедления биодеградации иммобилизованного лекарства, угнетения роста и размножения микроорганизмов и повышения их чувствительности к лекарству, местного детоксицирующего действия благодаря поглощению токсических веществ из раневого содержимого.
Иммобилизацию лекарственного вещества осуществляют следующим образом: гидрогель ПМС смешивают с соответствующим лекарственным препаратом из расчета 1 терапевтическая доза на 2 г гидрогеля и высушивают в течение 12—14 ч. После этого иммобилизованная форма готова к употреблению.
Полученный порошок после окончания основного этапа операции наносят на ткани общего желчного протока, ложе желчного пузыря, внутреннюю стенку полости абсцесса.
Дозировку препарата определяют из расчета 1,5 терапевтической дозы действующего начала. После этого операцию заканчивают обычным способом.
Этот прием значительно снижает число послеоперационных гнойно-воспалительных осложнений. В послеоперационный период 1—2 раза в сутки вводят через дренажи гидрогель метилсилоксана, содержащий противомикробный или противоопухолевый препарат с последующим удалением его путем отмывания через дренаж.
Профилактика гнойной инфекции желчных путей. Основными факторами, ухудшающими результаты лечения больных с воспалительными заболеваниями желчевыводящих путей, являются:
1) продолжительное консервативное лечение в амбулаторных условиях, запоздалые и неадекватные по объему оперативные вмешательства;
2) неполноценная (без учета характера возбудителя и чувствительности его к антибактериальным препаратам) антибиотикотерапия;
3) консервативная тактика при отдельных формах острых воспалительных заболеваний желчевыводящих путей.
Профилактика гнойно-септических осложнений заключается в следующем:
1) унификация показаний к различным видам операций с учетом характера патологии и исходного состояния больного;
2) наименее травматичное оперирование, тщательный гемостаз;
3) более широкое применение наружного дренирования желчных протоков. Использование интрахоледохеального дренажа для регионарной терапии в послеоперационный период;
4) технически правильное выполнение билиодигестивных анастомозов (выключение 80 см петли тонкой кишки по Ру при гепатикоеюностомии; отказ от холедоходуоденостомии и трансдуоденальных папиллосфинктеротомий при дуоденостазе, использование микрохирургической техники при наложении соустий);
5) более широкое использование щадящих методов декомпрессии желчевыводящих путей (чрескожная чреспеченочная холецис-то- и холангиостомия, эндоскопическая сфинктеротомия) и методов комбинированного наружно-внутреннего дренирования;
6) промывание подкожной основы операционной раны растворами антисептиков и антибиотиков, аппликация в рану антибактериальных препаратов, введение в рану магнитотвердых гранул с последующим воздействием переменного магнитного поля;
7) предупреждение вторичного инфицирования желчевыводящих путей через наружные дренажи (создание изолированных замкнутых стерильных систем, содержание свободного конца дренажа в растворе антисептика).
Антибактериальная профилактика показана:
1) при операциях по поводу деструктивного холецистита;
2) больным с механической желтухой;
3) при повторных операциях по поводу резидуального холедо-холитиаза, рубцовых стриктур общих желчных протоков;
4) больным старческого и пожилого возраста при наличии сопутствующих заболеваний.
Наиболее целесообразным является комбинированный метод антибактериальной профилактики, при котором один из антибиотиков (цефалоспоринового ряда или аминогликозиды) вводят внутривенно в суточной дозе за 2 ч до операции. Через 6 и 12 ч вводят максимальную разовую дозу.
При подозрении на анаэробный характер возбудителей в комплекс профилактических мероприятий целесообразно включить клион, метроджил внутривенно 1 раз до операции в суточной дозе или метронидазол в суппозиториях по 1 г 3 раза в сутки в течение 3 дней.
Манометрия и измерение сопротивления току жидкости в общем желчном протоке после холедохолитотомии показали, что показатели нормализуются на 6—8-е сутки после операции (S. Jab-lonka, E. Dacka, 1967). Поэтому в указанный период нужно обеспечить беспрепятственный отток желчи через дренаж. В более поздние сроки временное пережатие дренажа желчного протока не только безвредно, но и играет важную роль в подготовке к его удалению.
Контрольную дебито- и манометрию у больных с гнойным хо-лангитом производим только тогда, когда через дренаж начинает оттекать чистая желчь, без примеси гноя, но не раньше чем через 9 сут после операции. Результаты дебито- и монометрии не являются решающими при определении показаний и сроков удаления дренажа общего желчного протока. Окончательно тактика лечения больных с нарушенным дренажем желчных путей определяется после контрольной фистулохолангиографии.
Для выполнения контрольной холангиографии контрастное вещество подогревают до 25—30 °С и вводят через дренаж медленно, контролируя прохождение его под рентгенотелевизионным экраном. Если рентгенотелевизионной установки нет, то медленно вводят не более 2 мл контрастного вещества и производят снимок. Если дренаж сместился, то контрастное вещество попадает в подпеченочное пространство, что вызывает резкую воспалительную реакцию, вплоть до образования подпеченочного абсцесса. Подобное осложнение мы отметили у 1 больного. Убедившись в правильном положении дренажа, вводят остальную порцию контрастного вещества и выполняют снимки, как при интраоперационной холангиографии.
Дренаж из общего желчного протока удаляют на следующий день после контрольной холангиографии.
Так как дренаж фиксирован к общему желчному протоку только кетгутовой нитью, а к моменту его удаления (не менее 7 сут) прочность фиксации значительно ослабевает, удаление дренажа обычно происходит нетравматично и безболезненно.
Не удалось извлечь дренаж при первой попытке только у 7 больных.
Наружное дренирование общего желчного протока после холедохолитотомии трубкой диаметром 2—3 мм имеет следующие преимущества: 1) вследствие свободного оттока желчи через дренаж нет условий для гипертензии в общем желчном протоке и поэтому нет угрозы недостаточности швов желчного протока. Дренаж диаметром 3 мм создает возможность беспрепятственного заживления по месту разреза, даже если стенка протока очень тонкая, а шов наложен только в один ряд и через всю толщу стенки; 2) наличие дренажа позволяет провести через 6—7 сут после операции контрольную дебито- и манометрию желчных протоков, холангиографию и тем самым подтвердить адекватность операции и полноту удаления камней; 3) к моменту удаления дренажа из желчного протока вокруг него формируется канал, отграниченный от свободной брюшной полости. Кроме того, оставшаяся культя пузырного протока способствует быстрому закрытию отверстия. Восстановившаяся моторика сфинктера ампулы двенадцатиперстной кишки способствует выделению желчи естественным путем. Перечисленные факторы обусловливают безопасность и легкую переносимость удаления дренажа. Незначительное промокание повязки желчью мы наблюдали у 8,2 % больных только в первые 1—2 сут после удаления дренажа, при этом общее состояние их не нарушалось.
Вместе с тем выписывали больных из стационара на 11—14-е сутки, то есть в те же сроки, что и после холедохолитотомии с глухим швом протока.
Следовательно, дренирование общего желчного протока после холедохолитотомии трубкой диаметром 2—3 мм по примененной нами методике способствует неосложненному течению послеоперационного периода, не удлиняет сроков стационарного лечения больных.
Необходимо еще раз подчеркнуть, что холедохолитотомия является окончательным вмешательством на желчных протоках только у тех больных, у которых после удаления камней установилась свободная проходимость дистального отдела общего желчного протока. В противной ситуации в дополнение к холедохолитотомии выполняют так называемое внутреннее дренирование желчных протоков.
Возможные осложнения после холедохотомии связаны с наружным дренированием общего желчного протока.
Подтекание желчи в свободную брюшную полость проявляется как нарастание симптомов перитонита и (или) выделения желчи через дренаж, установленный в подпеченочном пространстве. Причинами такого осложнения может быть недоста-гочность швов желчного протока или неправильная установка и фиксация дренажа, когда одно из боковых отверстий его открывася а подпеченочное пространство или он выпал из общего желчного протока и др. Клиническая картина этого осложнения, а тактактика и методы его лечения описаны выше.
Отсутствие выделения желчи через дренаж обнаруживается сразу после операции. Если дренаж установлен правильно, он без промедления заполняется желчью, что проверяется во время вмешательства и перед зашиванием брюшной полости. Отсутствие желчи в дренаже может наблюдаться при выпадении дренажа из общего желчного протока, пережатии его лигатурой во время фиксации к коже или перегибе его в брюшной полости. Для уточнения причины отсутствия поступления желчи через дренаж снимают лигатуру, фиксирующую дренаж общего желчного протока к коже, и слегка подтягивают дренаж до ощущения сопротивления. Это способствует расправлению трубки, если она перегнулась в брюшной полости. Затем шприцем медленно вводят через дренаж 4—5 мл изотонического раствора натрия хлорида. В том случае, если раствор не проходит через дренаж, следует полагать, что последний деформирован в брюшной полости (при условии, что во время операции он заполнялся желчью). Однако чрезмерно сильное потягивание за дренаж может привести к извлечению его, а это вызовет более тяжелое осложнение— желчеисте-чение в свободную брюшную полость. Поэтому в данной ситуации целесообразно вновь фиксировать дренаж отдельным швом к коже и оставить его на 7—9 сут, а затем удалить.
Если изотонический раствор натрия хлорида свободно поступает через дренаж, то отсутствие в нем желчи связано с тем, что дренаж выпал из общего желчного протока. В этой ситуации необходимо проверить проходимость подпеченочного дренажа и контрапертуры вокруг него. При непроходимости дренажа или недостаточности контрапертуры под внутривенным наркозом расширяют разрез и под контролем пальца проводят в подпеченочное пространство дополнительный трубчатый дренаж.
Таким образом, основным методом хирургического лечения холедохолитиаза является холедохотомия с последующим ушиванием холедохотомического отверстия и декомпрессионным дренированием общего желчного протока тонкой полихлорвиниловой трубкой, желательно через культю пузырного протока. При значительном расширении общего желчного протока — до 2 см и более — лишь у 23 (14 %) из 160 больных не обнаружено патологии со стороны большого сосочка двенадцатиперстной кишки, у остальных 85,6 % больных наблюдался частичный или полный его стеноз, который корригировали с помощью трансдуоденальной папиллосфинктеротомии либо с одновременным созданием холедоходуоденостомии (у 27 больных, или 16,9%). В редких случаях при наличии выраженного дуоденостаза создавали холедохоеюностомию (у 10 больных, или 6,3 %), у большинства же больных (123, или 76,9%) накладывали широкий холедоходуоденоанастомоз. Стеноз большого сосочка двенадцатиперстной кишки. Основной причиной непроходимости дистального отдела желчных протоков является стеноз большого сосочка двенадцатиперстной кишки. Частота этой патологии колеблется в довольно широких пределах. Так, по данным W. Hess (1961), она составляет 29,4 % всех заболеваний желчных протоков неопухолевого характера, по данным же P. Mallet-Guy (1962), выявляется всего у 7,2 % оперированных на желчевыводящих путях.
Стеноз большого сосочка двенадцатиперстной кишки может развиваться и без каких-либо явных патологических изменений со стороны желчевыводящих путей. В таких случаях говорят о первичном стенозе сфинктера. W. Hess (1961) наблюдал 10% первичных стенозов без желчных камней и 90 % вторичных, сочетающихся с хо-лелитиазом. По данным П. Н. Напалкова (1979), первичный стеноз встречается лишь у 1 % больных. На рис. 66 представлены наиболее часто встречающиеся типы стеноза большого сосочка двенадцатиперстной кишки.
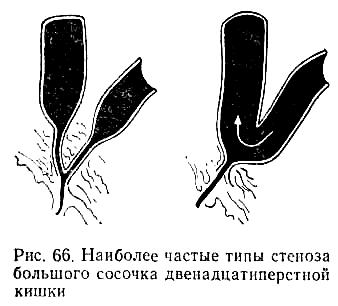
Этиология и патогенез. Несмотря на многочисленные исследования, этиология стеноза большого сосочка двенадцатиперстной кишки остается невыясненной. По-видимому, наиболее частой причиной стеноза служит воспаление, возникающее вследствие прохождения желчных камней. Немаловажное значение имеют склерози-рующие воспалительные процессы в результате ущемления камней в сосочке, хронический холангит, дуоденит, операционная травма при удалении камней и особенно бужирование. Не удается установить причину рубцовых изменений сосочка только у 10 % больных. Некоторые авторы считают, что у лиц пожилого и старческого возраста закономерно наступает склероз мышц сфинктера печеноч-но-поджелудочной ампулы (W. Hess, 1961).
Патологическая анатомия. Патологические изменения в области сосочка обычно заключаются в сужении его просвета и ограничении подвижности мускулатуры сфинктера леченочно-поджелудочной ампулы Для обозначения этих изменений предложено несколько терминов: «папиллосклероз», «папиллостеноз», «стенозирующий
папиллит", «фибротический оддит», «склерозирующий оддит», «стенозирующий оддит», «терминальный холедохит» и др. Мы различаем патологические состояния, связанные с пораже-нием только слизистой оболочки (стенозирующий папиллит) и мус-кулатуры сфинктера (стеноз сфинктера печеночно-поджелудочнои ампулы). Однако чаще всего патологическим изменениям подвергается одновременно и слизистая оболочка, и мускулатура сфинктера. В связи с этим мы называем патологию, связанную с воспалительными и рубцовыми сужениями в области сосочка, стенозирующим оддитом, а протяженное сужение дистального отдела общего желчного протока, возникающее на почве хронического панкреатита,— стреловидным или тубулярным стенозом. Эти стенозирующие про-цессы могут протекать самостоятельно (первичный стеноз) или со-четаться с холелитиазом.
Несмотря на то что клинически наличие стенозирующего одди-та обычно не вызывает сомнений, патологическая картина его является неоднородной и трудной для диагностики, так как отсутствуют характерные признаки. Изменения могут быть различными — от преходящего воспалительного отека до плотного рубцового кольца.
Обращает на себя внимание то обстоятельство, что при гистологическом исследовании кусочков большого сосочка двенадцатиперстной кишки не всегда определяются патологические изменения.
Чаще определяются аденоматозные разрастания и кистозное перерождение папиллярных желез, рубцы, фиброз (склероз) сфинктера печеночно-поджелудочнои ампулы и ангиоматозные расширения сосудов со значительным преобладанием аденоматозной мышечной ткани. При фиброзе толстые коллагеновые пучки разделяют и замещают мышцу сфинктера.
Наличие в каждом препарате острого или хронического воспаления с преобладанием одного из патологических признаков позволило Acosto и соавторам (1970) классифицировать оддит следующим образом: язвенный, гранулематозный, аденоматозный и фиброзный, или склерозирующий. Авторы пришли к заключению, что оддит является хроническим заболеванием, возникающим на почве повторных острых приступов воспалительных заболеваний желчевыводящих путей и поджелудочной железы.
Но клиническим и патоморфологическим признакам Megyeri (l970) выделяют 3 вида доброкачественных стенозов большого сосочка двенадцатиперстной кишки: хроническое воспаление при сравнительно нормальной анатомической структуре, гиперплазия желез в области сфинктера, гипертрофия мускулатуры сфинктера (с хронической воспалительной инфильтрацией или без нее). Чаще
всего встречается гиперплазия желез (44,9 %), иногда она сочетается с гипертрофией мышц сфинктера.
Стенозирующий процесс может локализоваться только в слизистой оболочке у устья сосочка. В таких случаях определяются точечное отверстие в самой слизистой оболочке на верхушке сосочка, расширение ампулы и образование «общего канала». Однако стенозирующий процесс поражает и мускулатуру; сфинктера, причем бывают следующие формы стеноза: стеноз сфинктера печеночно-поджелудочной ампулы с застоем в обеих протоковых системах и образованием «общего канала», стеноз всех 3 отделов сфинктера печеночно-поджелудочной ампулы с изолированным застоем в обеих протоковых системах; стеноз сфинктера общего желчного протока, вызывающий застой желчи, без застоя в протоковой системе поджелудочной железы; изолированный стеноз сфинктера протока поджелудочной железы с развитием хронического панкреатита, без застоя в желчевыводящих путях, стеноз сфинктера общего желчного протока и печеночно-поджелудочной ампулы при изолированном впадении общего желчного и главного протока поджелудочной железы (в таких случаях возникает застой желчи без хронического панкреатита).
Как уже упоминалось, стеноз сфинктера печеночно-поджелудочной ампулы развивается чаще всего как осложнение желчнокаменной болезни. Но, с другой стороны, и сам стеноз способствует образованию камней. Так образуется своеобразный порочный круг, отягощающий течение заболевания. Стеноз и спазм сфинктера печеночно-поджелудочной ампулы приводят к нарушениям анатомического и функционального соотношения между системами желчных и панкреатических протоков, вызывают развитие холангиогепатита и хронического или острого панкреатита. Развитию панкреатита способствуют, кроме застоя панкреатического сока, также рефлюкс концентрированной и инфицированной желчи, который обусловлен существованием «общего канала» при наличии стойкого препятствия в области сфинктера печеночно-поджелудочной ампулы.
Клиника и диагностика. Клинически стеноз большого сосочка двенадцатиперстной кишки проявляется явлениями частичной непроходимости желчных протоков и только полная обтурация ампулы сосочка камнем проявляется полной непроходимостью его.
Наиболее характерным признаком стеноза является желтуха, стойкая при полной непроходимости сосочка и перемежающаяся при частичной, появляющаяся после болевого приступа и сопровождающаяся повышением температуры тела и ознобом. Так, по нашим данным, из 667 больных, которым были выполнены операции на большом сосочке двенадцатиперстной кишки, у 77 % к моменту поступления в клинику была желтуха или указания на нее в анамнезе. У 11 % больных была субклиническая желтуха, то есть отмечалось повышение уровня сывороточного билирубина без видимой желтушной окраски кожи и конъюнктивы, у 12% больных при поступлении и в анамнезе ее не было. У 89 % больных были отмечены явления холангита, сопровождающиеся желтухой.
Если же эти явления имеются у больных наряду с острым и хроническим холециститом, они трактуются обычно как холелитиаз, если больные уже перенесли холецистэктомию, указанные явления являются ведущими.
Для решения вопроса о вмешательстве на большом сосочке двенадцатиперстной кишки одних клинических данных недостаточно, необходимы специальные методы диагностики как в дооперационный период, так и во время операции.
В дооперационный период наиболее достоверные данные можно получить путем эндоскопической ретроградной холангиографии (рис. 67).

На рис. 68 представлена ретроградная эндоскопическая холангиограмма у больных со стенозирующим папиллитом и фиксированным камнем в большом сосочке двенадцатиперстной кишки.
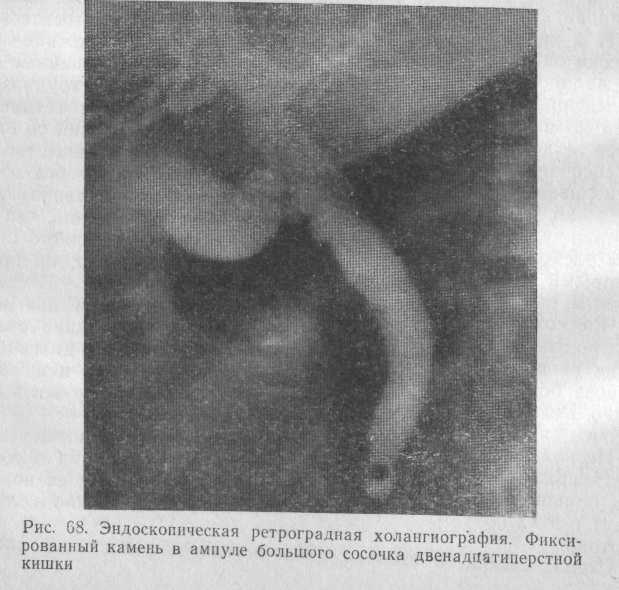
Кроме того, при эндоскопическом исследовании двенадцатиперстной кишки производят осмотр самого сосочка, что помогает установить или исключить его опухолевое поражение. Следует иметь в виду тот факт, что стенозирующий папиллит рентгенологически определяется по косвенным признакам (расширение общего желчного протока, плавающие камни, фиксированные или ущемленные камни). До операции установить диагноз трудно. Так, нами отмечено, что канюляция сосочка при оддите технически более легко осуществима, чем при отсутствии изменений со стороны сосочка, а введенное под давлением контрастное вещество часто изливается обратно в двенадцатиперстную кишку без особой задержки. То же можно сказать и об определении стеноза устья протока поджелудочной железы. Поэтому неудивительно, что частота расхождения клинического диагноза, подтвержденного операционными методами, и рентгенологического достигает, по нашим данным, около 30 %.
Чрескожную чреслеченочную холангиографию для диагностики стеноза большого сосочка двенадцатиперстной кишки практически не применяют. Ультразвуковое сканирование в диагностике стеноза большого сосочка двенадцатиперстной кишки неинформативно. Релаксационная дуоденография позволяет обнаружить лишь сосочек диаметром 1,5 см.
Несколько более информативной является выделительная холангиография. Однако она не дает четкой информации о состоянии большого сосочка двенадцатиперстной кишки и о стенозе его судят в этих случаях по наличию расширения печеночно-желчного протока.
Стеноз большого сосочка двенадцатиперстной кишки следует дифференцировать с так называемым тубулярным стенозом дистального, а точнее, интрапанкреатического отдела общего желчного протока. Эта патология возникает в результате сдавления общего желчного протока фибротической тканью поджелудочной
железы при хроническом псевдотуморозном панкреатите. По нашим данным, тубулярный стеноз встречается реже. Соотношение частоты тубулярных стенозов и стенозов сфинктера печеночно-под-желудочной ампулы составляет 1 : 10. Тубулярный стеноз, как и стеноз сфинктера большого сосочка двенадцатиперстной кишки, практически никогда не приводит к полной облитерации протока, если одновременно нет закупоривающего камня. В этом состоит главное отличие его от опухолей большого сосочка двенадцатиперстной кишки и головки поджелудочной железы, при которых быстро возникает тотальная и стойкая непроходимость общего желчного протока.
Кроме тубулярного стеноза стенозирующий папиллит необходимо дифференцировать с обтурациями общего желчного протока, фиксированными в различных его отделах (ретродуоденальном, интрапанкреатическом, устье сосочка).
Диагностика. Сходность клинических симптомов стеноза большого сосочка двенадцатиперстной кишки и таких заболеваний, как калькулезный холецистит, холедохолитиаз, подострый и хронический гепатит, рубцовый стеноз желчных протоков, склерозирующий холангит, опухоли желчных протоков, не позволяют поставить точный диагноз без применения методов прямого контрастирования желчных путей (ретроградная эндоскопическая и чрескожная чреспеченочная холангиография, а также фистуло-холангиография при наличии наружного желчного свища или наружного дренажа желчного протока). Только прямая контрастная холангиография позволяет решить вопрос о необходимости оперативного вмешательства и о его характере.
Методы лечения. В зависимости от механизма нарушения проходимости большого сосочка двенадцатиперстной кишки и дистального отдела общего желчного протока различаем 3 группы патологических состояний, объединенных общностью клинико-рент-генологической семиотики и сходностью принципов хирургического лечения.
I группа — воспалительно-фиброзные изменения стенки большого сосочка двенадцатиперстной кишки (стенозирующий папиллит или папиллооддит). Нарушается сократительная способность мышц дистального отдела общего желчного протока и большого сосочка двенадцатиперстной кишки с последующим развитием воспалительно-склеротических изменений сосочка.
II группа — сдавление дистального отдела общего желчного протока увеличенной и фиброзно измененной поджелудочной железой при хроническом панкреатите. Большой сосочек двенадцатиперстной кишки, как правило, сохраняет проходимость, однако из-за воспалительно-склеротического поражения стенок общего желчного протока в сосочке наступают вторичные функциональные нарушения.
III группа — обтурационные нарушения проходимости большого сосочка двенадцатиперстной кишки и дистального отдела общего желчного протока. Наиболее частая причина — фиксированные в нем камни.
В настоящее время стеноз большого сосочка двенадцатиперстной кишки лечат только оперативным путем. Оперативные вмешательства можно разделить на радикальные, направленные на прямое вмешательство на сосочке, и паллиативные, при которых стеноз не устраняется, но создается отток желчи в двенадцатиперстную или в тонкую кишку.
Радикальные методы оперативного лечения включают: 1) эндоскопическую ретроградную папиллосфинктеротомию; 2) чрескожную чреспеченочную папиллосфинктеротомию и 3) трансдуоденальную папиллосфинктеротомию.
Эндоскопическая ретгоградная папиллосфинктеротомия. Впервые ее применили Classen и Demlin (1974), Canoi и соавторы (1974). С этого времени операцию стали быстро внедрять в практику и уже в 1977 г. Reiter и соавторы сообщили о 955 подобных вмешательствах.
Эндоскопической папиллосфинктеротомии подлежат все больные со стенозом большого сосочка двенадцатиперстной кишки как в сочетании с холелитиазом, так и без него. Выполняют ее сразу после эндоскопической ретроградной холангиографии, то есть после установления окончательного диагноза. Противопоказанием к этому вмешательству является только коматозное состояние, исключающее контакт с больным. По данным М. Д. Семина и соавторов (1989, 1992), П. В. Огородника (1992), успешная катетеризация сосочка возможна у 93—95 % больных. Неудачи с каню-лированием сосочка объясняются либо анатомическими особенностями его, либо расположением его устья в полости парапапилляр-ного дивертикула, либо недостаточным опытом эндоскописта.
Чрескожная чреспеченочная папиллосфинкте-р о т о м и я относится к рентгенохирургическим методам лечения. Она представляет собой новый и оригинальный вид вмешательства на большом сосочке двенадцатиперстной кишки и применяется в тех случаях, когда эндоскопическая папиллосфинктеротомия не может быть выполнена по техническим причинам (резекция желудка по Бильрот-П и др.) Мы располагаем пока 3 наблюдениями. В основу метода положено электрорассечение стриктур желчных протоков с помощью эндоскопического папиллотома, введенного в общий желчный проток из чрескожного чреспеченочного доступа. Методика операции заключалась в следующем. У больного во время чрескожной холангиографии диагностирован стеноз большого сосочка двенадцатиперстной кишки, который не был устранен во время ранее выполненной холецистэктомии. Учитывая, что ранее больному произведена резекция желудка по Бильрот-П, выполнение эндоскопической папиллотомии не представлялось возможным. Третье оперативное вмешательство в возрасте 71 года при наличии тяжелого сопутствующего заболевания было нежелательным. Чрескожная чреспеченочная дилатация эффекта не дала, что послужило показанием к чрескожной чреспеченочной папиллотомии. Для ее осуществления контрастировали желчевыводящие пути, транспеченочно по проводнику ввели тонкостенный катетер диаметром 4 мм без боковых отверстий, через который провели эндоскопический папиллотом в двенадцатиперстную кишку, расправленную воздухом. Больного перевели в левую косую позицию для того, чтобы проекция большого сосочка двенадцатиперстной кишки совпала с изображением дистального отдела общего желчного протока. Катетер подтягивали в общий желчный проток, а папиллотом приводили в рабочее положение до плотного соприкосновения режущей струны с тканями большого сосочка двенадцатиперстной кишки. Полноту папиллотомии определяли по характеру поступления контрастного вещества в двенадцатиперстную кишку, а также с помощью катетера Gruntrig с баллоном диаметром 5 мм. В двенадцатиперстной кишке раздували баллон, который при подтягивании свободно проходил в общий желчный проток. Если баллон удерживается большим сосочком двенадцатиперстной кишки, папиллотомию повторяют. В профилактических целях в правом печеночном протоке оставлен тонкий наружный дренаж на 24 ч. Через 8 мес состояние больного хорошее.
Трансдуоденальная папиллосфинктеротомия. Несмотря на огромный успех эндоскопической папиллосфинктеротомии, которая стала операцией выбора при холедохолитиазе и стенозе большого сосочка двенадцатиперстной кишки, трансдуоденальную папиллосфинктеротомию применяют и до настоящего времени, хотя более 90 °/о больных со стенозом сосочка в специализированных клиниках уже не оперируют, а подвергают эндоскопической папиллосфинктеротомии. В тех же клиниках и хирургических отделениях, где выполнить эндоскопическую папиллосфинктеротомию невозможно, применяют трансдуоденальный метод коррекции стеноза сосочка. Следует также отметить, что не всем больным по техническим причинам можно выполнить каню-ляцию большого сосочка двенадцатиперстной кишки, а поэтому хирург, обнаруживший во время операции стеноз сосочка, не может быть абсолютно уверенным в успешной эндоскопической папиллосфинктеротомии и ограничиться лишь наружным дренированием общего желчного протока.
Идея применения трансдуоденальных вмешательств при патологии большого сосочка двенадцатиперстной кишки принадлежит Longenbuch (1884). Впервые операцию выполнил McBurney (1891, 1898). Таким же способом Kocher в 1894 г. удалял камни из дистального отдела общего желчного протока, назвав эту операцию ампулодуоденостомией. С. П. Федоров (1934), отмечая преимущества этого вмешательства при поражении дистального отдела общего желчного протока, назвал его трансдуоденальной холедохотомией. Перспективность таких операций при хроническом рецидивирующем панкреатите признана В. А. Жмур и В. М. Работни-ковым (1960). Большой вклад в изучение проблемы сфинктерото-мии внесли Н. А. Захаров (1962, 1964, 1967), Я.. Р. Бялык (1964, 1968), К. Т. Овнатанян и В. В. Минин (1969). В настоящее время эту операцию применяют практически все хирурги.
Показаниями к трансдуоденальной папиллосфинктеротомии, являются: 1) стеноз сфинктера печеночно-поджелудочной ампулы (стенозирующий оддит); 2) ущемление или фиксация камня в области большого сосочка двенадцатиперстной кишки; 3) холедохолитиаз; 4) хронический панкреатит, обусловленный стенозом устья протока, при невозможности корригировать указанную патологию методом эндоскопической папиллотомии.
Как правило, у одного и того же больного имеется сочетание нескольких факторов, указывающих на необходимость вмешательства, но основным всегда является стенозирующий оддит, который может сочетаться с холелитиазом, холангитом, панкреатитом. Так, обнаружение мелких камней в общем желчном протоке, замазко-образной желчи, холангита является прямым указанием на наличие стенозирующего оддита. Однако и сам стенозирующий процесс в большинстве случаев является результатом травмы, возникающей при прохождении через него мелких камней, попавших в общий желчный проток из желчного пузыря. Такие камни часто задерживаются в области большого сосочка двенадцатиперстной кишки, вызывая спазм его сфинктера. Вспышки холангита даже после отхождения камня в кишечник способствуют прогрессированию воспалительного процесса, и патологический круг замыкается. Первичный стенозирующий оддит, вызванный переходом воспалительного процесса двенадцатиперстной кишки, поджелудочной железы, также впоследствии ведет к повышению давления в желчных протоках, застою желчи, вспышкам холангита и образованию камней. Как и при вторичном оддите, возникает тот же замкнутый круг, разорвать который как в первом, так и во втором случае можно, лишь устранив стеноз в области сфинктера печеночно-поджелудочной ампулы.
Стенозирующий оддит является абсолютным показанием к па-пиллосфинктеротомии эндоскопической либо операционной.
Наличие камней в желчных протоках может являться как абсолютным, так и относительным показанием к папиллосфинктеротомии. Абсолютные показания возникают при наличии ущемленного или фмксированного камня в области большого сосочка двена-дцатиперстной кишки. Эта патология является вторым наиболее частым показанием к операции (В. С. Савельев, М. И. Филимонов. 1978; С. А. Шалимов и соавт., 1988, 1991). Относительные показания возникают в тех случаях, когда в общем желчном протоке имеются плавающие камни, легко удалимые через культю пузырного протока при помощи цистикохоледохотомии или ограниченной супрадуоденальнои холедохотомии. В этих случаях после удаления камней вопрос о необходимости папиллосфинктеротомии решается в зависимости от того, имеется стенозирующий оддит или его нет, а холедохолитиаз является самостоятельным проявлением патологии. Обычно обнаружение мелких камней, диаметром до 0,5 см, всегда свидетельствует о наличии стенозирующего оддита, более крупные камни могут находиться в общем желчном протоке и без стенозирующего оддита. В этих случаях обычно нет значительного расширения протоков, и операция заканчивается удалением камня. Следует отметить, что если в общем желчном протоке имеется камень пузырного происхождения, то стенозирующего оддита может и не быть, но если камень мягкий, состоит из комочков замазкообразной желчи или имеет вид слепка из желчи, что свидетельствует о наличии выраженного желчестаза и холангита, всегда имеется стеноз в дистальном отделе общего желчного протока.
Одной из трудных задач является хирургическое лечение внутрипеченочного холелитиаза (болезнь Кароли). Папиллосфинкте-ротомия в этих случаях является единственной эффективной лечебной мерой, так как позволяет максимально полно удалить через папиллотомическое отверстие, используя промывание, катетер Фогарти, петлю Дормиа, камни из всех отделов желчных протоков. В то же время эта операция является и профилактической, обеспечивающей свободное прохождение мелких камней вместе с желчью из внутрипеченочных желчных протоков в полость двенадцатиперстной кишки. Папиллосфинктеротомию при наличии внутрипеченочного холелитиаза мы выполнили у 3 (0,4 %) больных, получив хорошие результаты. К этой же операции в подобных случаях прибегали и другие хирурги (О. Б. Милонов и соавт., 1982).
Наибольшее значение в этиологии и патогенезе острого и хронического панкреатита имеет затруднение оттока панкреатического сока. Провоцирующим фактором является рефлюкс желчи в проток поджелудочной железы.
Поэтому как стойкий спазм сфинктера печеночно-поджелудочной ампулы, так и его рубцовый стеноз играют немаловажную роль в развитии панкреатита. Воспалительный процесс, распространяющийся на устье протока поджелудочной железы и его
сфинктер, еще больше усугубляет течение заболевания. Таким образом, может наблюдаться 2 типа поражения, требующего выполнения папиллосфинктеротомии. Первый тип — стеноз общего сфинктера печеночно-поджелудочной ампулы и собственного сфинктера общего желчного протока. В таких случаях после папиллосфинктеротомии устье протока поджелудочной железы становится свободным и широко зияет, так как оно было лишь сдавлено в рубцовом кольце общего сфинктера, но само по себе не стенози-ровано. Это означает, что панкреатит был вызван билиопанкреатическим рефлюксом и гипертензией в протоках поджелудочной железы, возникающих во время приступов желчной гипертензии. Второй тип — истинный стеноз отверстия протока поджелудочной железы. Чаще всего он сочетается со стенозом сфинктера печеночно-поджелудочной ампулы, но бывает и изолированным.
Подозрение на доброкачественную или злокачественную опухоль большого сосочка двенадцатиперстной кишки возникает при рентгенологическом, эндоскопическом или пальпаторном исследовании. Только с помощью трансдуоденальной папиллосфинктеротомии с иссечением участка сосочка для срочной биопсии можно обнаружить раннюю стадию опухоли. Шаблонное наложение желчно-кишечных анастомозов в подобных случаях может быть оправдано лишь как выполнение первого этапа лечения при наличии тяжелого состояния в связи с желтухой, холангитом, печеночно-почечной недостаточностью; во всех остальных случаях такой подход таит в себе опасность нераспознавания либо операбельной опухоли, либо доброкачественного поражения, легко устранимого трансдуоденальным путем.
Осложненная гидатидная киста печени у отдельных больных также может быть показанием к трансдуоденальной сфинктеропластике. Эта операция показана также при прорыве кисты в крупные желчные ходы и наличии стойкого послеоперационного желчного свища.
Мы с успехом применили трансдуоденальную сфинктеропластику у 1 больного с желчнобронхиальным свищом, сформировавшимся на почве холедохолитиаза и панкреонекроза.
Противопоказания к трансдуоденальной папиллосфинктеротомии встречаются крайне редко. К ним относятся резко выраженные явления дуоденостаза. Во всех остальных случаях можно лишь говорить о состояниях, при которых операция не рекомендуется или не может быть выполнена.
Весьма осторожно следует выполнять папиллосфинктеротомию как первичную операцию, когда в общем желчном протоке имеется один или несколько крупных камней, но желчь чистая, проходимость большого сосочка двенадцатиперстной кишки нарушена, отсутствует вторичный панкреатит. В этих случаях можно рекомендовать лишь холедохолитотомию.
При фиброзе головки поджелудочной железы с тубулярным стенозом дистального отдела общего желчного протока трансдуоденальная папиллосфинктеротомия не обеспечивает надежного дренирования желчи, если стеноз распространяется более чем на 2,5 см от отверстия большого сосочка двенадцатиперстной кишки,так как рассечение всего суженного участка оказывается невозможным. В таких случаях мы накладываем обходной холедоходуоденальный анастомоз. Обходное анастомозирование показано и
при атонии общего желчного протока с его резким расширением (более 2,5 см).
Не оправдана папиллосфинктеротомия и при множественных стриктурах протока поджелудочной железы.
Относительными противопоказаниями к трансдуоденальной папиллосфинктеротомии являются тяжелые случаи дискинезии, грубые воспалительные изменения стенки двенадцатиперстной кишки, создающие опасность возникновения дуоденального свища после дуоденотомии, преклонный возраст и тяжелое состояние больного.
Разрез брюшной стенки. Производят верхне-срединную лапаротомию при первичном вмешательстве и используют старый разрез, если он был в области правого подреберья.
Исследования во время операции. В первую очередь необходимо оценить ширину общего желчного протока, поэтому его надо освободить от спаек и сращений. Нами установлено, что при функционирующем желчном пузыре диаметр общего желчного протока не должен превышать 8 мм, увеличение же диаметра до 10 мм указывает на вероятность наличия стеноза большого сосочка двенадцатиперстной кишки, а более 10 мм — на явный стеноз сосочка при отсутствии в общем желчном протоке камней. При не функ-ционирующем желчном пузыре или при его отсутствии диаметр общего желчного протока может доходить до 10 мм и без наличия патологии в дистальном отделе протока; при диаметре более 10 мм следует искать причину гипертензии.
Для дальнейшего уточнения диагноза во всех случаях необходима мобилизация двенадцатиперстной кишки по Кохеру. Пальпаторно патологию большого сосочка двенадцатиперстной кишки можно установить лишь в том случае, если в нем находится фиксированный камень, обычный стеноз пальпаторно не определяется.
Обнаружив увеличение диаметра общего желчного протока, выполняют специальные методы исследования — дебитометрию, холангиографию, зондирование, холедохоскопию.
Методика дебитометрии описана выше, поэтому остановимся лишь на результатах исследований. Показатель дебитометрии 15 мл/мин может свидетельствовать о наличии стеноза большого сосочка двенадцатиперстной кишки, 20 мл/мин — о необходимости дальнейшего исследования.
Холангиография, особенно интраабдоминальная, помогает выявить стенозирующие процессы в терминальном отделе общего желчного протока, определить их протяженность и характер. Сужение терминального отдела общего желчного протока следует дифференцировать прежде всего с раком большого сосочка двенадцатиперстной кишки. В то время как рубцовый стеноз имеет на холангиограмме конусовидные очертания, для рака характерно поперечное расположение линии обрыва контрастной тени с изъеденными краями. Стеноз сфинктера никогда не приводит к полной непроходимости сосочка, если одновременно нет ущемленного камня. Карцинома же вызывает полную закупорку протока. Конусовидный (стреловидный) стеноз при панкреатите с выраженным фиброзом головки поджелудочной железы имеет протяженность более 2,5—3 см. Иногда обнаруживается трубчатый стеноз, который начинается у верхнего края головки поджелудочной железы и протяженность его значительно больше, чем стеноза сфинктера печеночно-поджелудочной ампулы. Сосочек в подобном случае может быть нормальным. Панкреатический трубчатый стеноз даже в далеко зашедших случаях не бывает тотальным, и это отличает его от непроходимости общего желчного протока при карциноме головки поджелудочной железы и раке дистального его отдела. Весьма ценным признаком является рефлюкс контрастного вещества во внутрипеченочные желчные ходы. При нормальной проходимости большого сосочка двенадцатиперстной кишки и обычной методике введения контрастного вещества последнее свободно оттекает в двенадцатиперстную кишку и не забрасывается в печеночные протоки. Лишь при чрезмерном повышении давления могут заполняться главные протоки. При стенозе сфинктера печеночно-поджелудочной ампулы контрастное вещество легче затекает в проксимальные отделы, чем в двенадцатиперстную кишку, и туго заполняет даже мелкие внутрипеченочные желчные ходы.
При холангиографии нередко определяется билиопанкреатиче-ский рефлюкс. Мы наблюдали его почти у 40 % больных со стено-зирующим папиллитом. Обнаружение такого рефлюкса при холангиографии дает возможность оценить ширину протока поджелудочной железы и определить состояние его терминального отдела, хотя в целом билиопанкреатический рефлюкс с забросом контрастного вещества в проток поджелудочной железы может вызвать острый панкреатит. Поэтому специально добиваться получения этого рефлюкса во время холангиографии не следует, тем более, что наличие рефлюкса не всегда указывает на патологию в области большого сосочка двенадцатиперстной кишки, так же как и его отсутствие не всегда свидетельствует о том, что такой патологии нет. С. А. Шалимов и соавторы (1983), выполнившие-700 операционных холангиографии, установили, что при стенозирующем папиллите рефлюкс возникает только в 25,6 % случаев, а при вклинившихся камнях в 17 % А. С. Шпонтак (1988) доказал, что при повышении давления нагнетания контрастного вещества возможность появления рефлюкса увеличивается. У 54,9 % больных имел место
физиологический рефлюкс при отсутствии каких-либо препятствий к прохождению контрастного вещества в двенадцатиперстную киш-
ку. Такие же наблюдения описали Я. С. Котигер (1967) и А. П. Багателия (1967). Однако мы на основании своих многочисленных операционных и послеоперационных исследований с использовани-
ем рентгенотелевидения и кинематографии пришли к выводу, что подобный рефлюкс все же связан с нарушениями тонуса сфинкте-ральной зоны большого сосочка двенадцатиперстной кишки. По нашему мнению, при осторожном и медленном заполнении желчных протоков контрастным веществом его регургитации в проток поджелудочной железы не должно быть, так как давление в нем выше, чем в желчевыводящих путях. Однако в норме при быстром и тугом заполнении общего желчного протока может наступить спазм сфинктера печеночно-поджелудочной ампулы с рефлюксом желчи в проток поджелудочной железы. Если же такой рефлюкс наблюдается при введении контрастного вещества под давлением не выше 120—180 мм вод. ст. («давление прохождения»), а манометрический контроль в этих случаях обязателен, его следует рассматривать как патологический и, если не свидетельствующий, то во всяком случае и не исключающий наличия стенозирующего па-пиллита или стойкого спазма сфинктера печеночно-поджелудочной ампулы. Аналогичное мнение высказывают В. И. Петров и О. Б. Порембский (1964), В. П. Захаров (1971), А. В. Смирнов и соавторы (1972).
Следует отметить, что при далеко зашедших стенозах с резким расширением общего желчного протока билиопанкреатический рефлюкс на холангиограммах не выявлялся; он наблюдался лишь у больных с легким или умеренным расширением общего желчного протока, то есть в ранних стадиях стеноза сфинктера печеночно-поджелудочной ампулы. На этом основании можно сделать вывод, что рефлюкс в проток поджелудочной железы является ранним признаком нарушения проходимости сфинктера, когда стенозирую-щий процесс локализован вблизи отверстия большого сосочка двенадцатиперстной кишки.
Зондирование желчных протоков. Подробно этот вопрос уже рассматривался выше. Следует отметить, что метод зондирования эластическими зондами является наиболее ценным в определении стеноза большого сосочка двенадцатиперстной кишки. Сначала применяют зонд диаметром 3 мм, учитывая, что зонд большего диаметра не пройдет и через нормальный сосочек, а меньшего— может пройти и через стенозированный сосочек. В основу такого подхода положено представление о том, что если большой сосочек двенадцатиперстной кишки пропускает зонд диаметром 3 мм, то гипертензия в желчных протоках отсутствует. Очень важно пальпаторно определить положение кончика зонда. Если зонд прошел в двенадцатиперстную кишку, его легко определить скользящим движением пальцев от кончика к центральной части; легко определяются также большой сосочек двенадцатиперстной кишки, его эластичность и величина. Если зонд диаметром 3 мм не прошел через сосочек, то дистальнее кончика четко определяется причина непроходимости — камень, опухоль или рубцовое утолщение. В этих случаях показаны дуоденотомия на уровне сосочка и визуальное его исследование. В случае обнаружения опухоли выполняют биопсию, а затем радикальную операцию; если определяется стенози-рующий папиллит, простой или осложненный фиксированным в ампуле камнем, производят сфинктеропластику. Однако для выполнения последней необходима четкая идентификация устьев желчного протока и протока поджелудочной железы, чтобы не начать сфинктеротомию с рассечения протока поджелудочной железы. Поэтому если зонд диаметром 3 мм не проходит через сосочек и последний не поражен опухолью, мы проводим через общий желчный проток более тонкий зонд, диаметром 2 или 1,5 мм, который может более легко пройти суженную часть сосочка. Следуя теперь ретроградно по ходу зонда, вышедшего из общего желчного протока, выполняем сфинктеротомию.
Зондирование необходимо еще и для того, чтобы четко определить сосочек даже после вскрытия двенадцатиперстной кишки. Возникает такая ситуация чаще всего при полной непроходимости сосочка (ущемленный камень, резкий стеноз). Если же самый тонкий эластический зонд не может проникнуть в двенадцатиперстную кишку, то, чтобы не рассекать сосочек вслепую, надо выпятить его в просвет кишки, найти на зонде супрапапиллярную часть общего желчного протока, продольно рассечь ее либо рассечь сосочек вдоль над препятствием, и только затем вскрыть сосочек до его устья и устранить препятствие. Такая папиллотомия менее опасна, чем рассечение со стороны устья сосочка вслепую, когда легко можно травмировать проток поджелудочной железы. Для подобных манипуляций более пригодны металлические зонды.
Холедохоскопия. При осмотре терминального отдела общего желчного протока удается оценить состояние большого сосочка двенадцатиперстной кишки. В норме устье его имеет вид звездчатой щели и отмечаются ритмические его сокращения. При наличии стенозирующего папиллита видно конусовидное сужение в виде воронки; сокращения либо замедлены, либо отсутствуют вовсе.
Техника трансдуоденальной папиллосфинктеротомии. Со времени внедрения в практику папиллосфинктеро-томии было разработано 4 основных способа ее выполнения: транс-холедохеальный, ретродуоденальный, изолированный трансдуоденальный и комбинированный трансхоледохеальный в сочетании с трансдуоденальным.
Впоследствии, в связи с частыми осложнениями, первые два способа перестали использовать. В настоящее время применяют открытое трансдуоденальное рассечение сфинктера печеночно-поджелудочной ампулы, иногда с треугольной его резекцией, с после-дующим шовным соединением слизистых оболочек двенадцатиперстной кишки и общего желчного протока или без него.
Операция заключается в выполнении следующих технических приемов: 1) локализация сосочка в полости двенадцатиперстной кишки; 2) вскрытие двенадцатиперстной кишки; 3) выведение большого сосочка двенадцатиперстной кишки в рану; 4) папиллосфинк-теротомия; 5) шовное соединение слизистых оболочек общего желчного протока и двенадцатиперстной кишки; 6) дренирование протока поджелудочной железы; 7) вирзунготомия; 8) трансназальное дренирование двенадцатиперстной кишки; 9) шов раны двенадцатиперстной кишки; 10) дренирование общего желчного протока; 11) дренирование брюшной полости.
Локализация сосочка в полости двенадцатиперстной кишки необходима для определения места вскрытия кишки, так как дуоденотомию следует стремиться выполнить напротив сосочка и она должна быть по возможности минимальной. После мобилизации двенадцатиперстной кишки по Кохеру пальпаторно определяют положение большого сосочка двенадцатиперстной кишки. При выраженном его уплотнении или наличии в нем камней пальпация обычно успешна. Однако более удобно определять положение сосочка на эластическом зонде (мы пользуемся печеночным зондом Фогарти), введенном через культю пузырного протока или через холедохотомическое отверстие в ограниченной супрадуоденальной части.
Некоторые авторы рекомендуют использовать анатомические ориентиры для отыскания сосочка. Так, Р. В. Кузнецов (1963, 1965) установил, что наиболее точным ориентиром является корень брыжейки поперечной ободочной кишки, который пересекает нисходящую часть двенадцатиперстной кишки на 10—15 мм ниже сосочка. В этом месте автор и рекомендует выполнять дуоденотомию.
Применять какие-либо грубые инструменты или манипуляции для локализации сосочка не следует, так как вскрытие кишки на 1—2 см ниже или выше сосочка не имеет практического значения.
Вскрытие двенадцатиперстной кишки. После уточнения расположения большого сосочка двенадцатиперстной кишки над ним между двумя нитями-держалками рассекают переднюю стенку двенадцатиперстной кишки на протяжении около 1,5 см. Направление разреза (поперечное, косое или продольное) не имеет существенного значения, так как небольшой разрез легко ушить, в каком бы направлении он не проходил. Нижний конец
разреза должен быть на некотором расстоянии от места прикрепления брыжейки поперечной ободочной кишки — это облегчает последующее ушивание дуоденотомического отверстия. Мы отдаем предпочтение продольной дуоденотомии (рис. 69, а). Преимущество ее состоит в том, что при необходимости разрез может быть продлен до 2—3 см. W. Hess (1961) применял разрез длиной 4 см. Кишку не следует широко вскрывать в проксимальном направлении, так как сосочек чаще всего находится ниже. Продольный разрез не вызывает большего кровотечения, чем поперечный. Кровоточащие сосуды тщательно перевязывают тонким кетгутом, содержимое двенадцатиперстной кишки аспирируют. Доступ к сосочку обеспечивают разведением краев разреза стенки двенадцатиперстной кишки с помощью двух ретракторов Фарабефа, помещенных в верхний и нижний углы дуоденотомического отверстия (рис. 69, б). Кверху и книзу в просвет кишки могут быть введены марлевые тампоны, высушивающие операционное поле и закупоривающие приводящий и отводящий сегменты двенадцатиперстной кишки, что предохраняет операционное поле от загрязнения желудочным и кишечным содержимым.
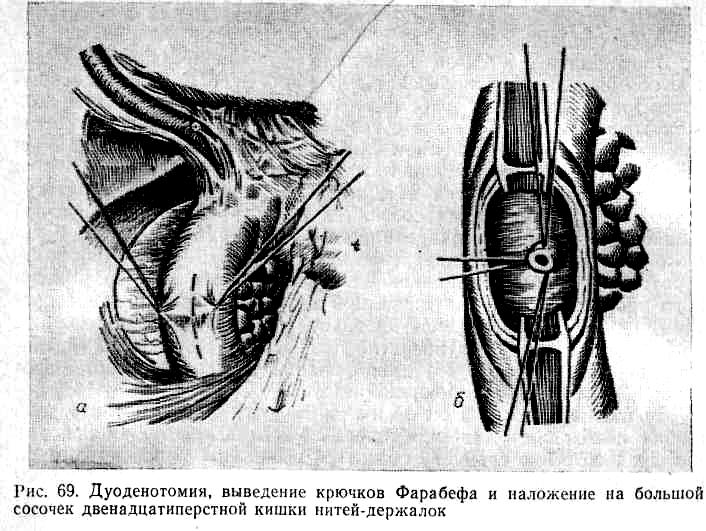
Выведение большого сосочка двенадцатиперстной кишки в рану. После вскрытия двенадцатиперстной кишки внимательно осматривают слизистую оболочку в поисках сосочка. Если через него проведен зонд и кончик его находится в просвете кишки, поиски сосочка трудностей не представляют. Зонд за кончик протягивают в просвет кишки. Расширенная его часть, которая не проходит через суженный сосочек, способствует подтягиванию его в рану. Мы используем печеночный зонд Фогарти, в котором, после проведения его через культю пузырного протока, можно расширить нагнетанием жидкости манжетку до нужного диаметра и плотно фиксировать ее в большом сосочке двенадцатиперстной кишки. При этом нет необходимости в холедохотомии, так как зонд Фогарти со спавшейся манжеткой легко проходит через культю пузырного протока. Используют и другие типы зондов: пластмассовый проводник с конической металлической оливой (О. Б. Милонов и соавт., 1976, рис. 70, а), конусообразный зонд (Д. Ф. Благовидов и соавт., 1976, рис. 70, б), специальный зонд с пуговкой и оливой из органического стекла (А. Л. Шор, 1978; рис. 70, в).
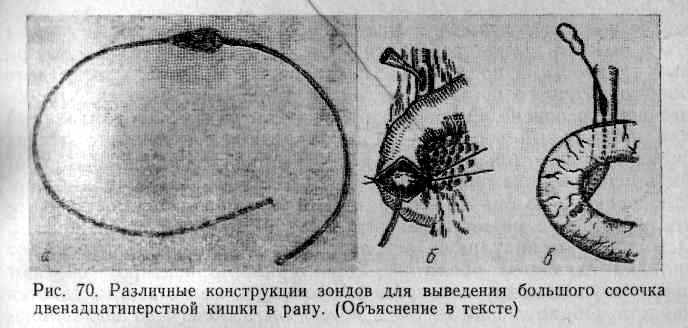
Эти зонды имеют определенные преимущества, так как на них можно рассекать сосочек. Общим их недостатком является необходимость холедохотомии, так как диаметр оливы не позволяет провести зонд через культю пузырного протока.
После подтягивания сосочка в дуоденотомическую рану по обеим сторонам от него накладывают нити-держалки на заднюю стенку двенадцатиперстной кишки (см. рис. 69, б). Нити должны пройти достаточно глубоко, чтобы захватить не только слизистую, но и мышечную оболочки кишки, иначе они легко прорезаются. Третью держалку накладывают на задне-нижнюю полуокружность (губу) большого сосочка двенадцатиперстной кишки. Потягиванием за нити-держалки область сосочка легко выводится в отверстие двенадцатиперстной кишки, после чего сосочек становится хорошо доступным для любых операций на нем.
В тех случаях, когда сосочек непроходим для зонда или операция выполняется исключительно трансдуоденальным путем, поиски его в полости двенадцатиперстной кишки представляют значительные трудности. Иногда зонд, находящийся в дистальном отделе общего желчного протока, несколько выпячивает сосочек, что облегчает его поиски. Особенно трудно обнаружить малоизмененный или нормальный сосочек — он легко теряется в многочисленных складках слизистой оболочки двенадцатиперстной кишки. Может быть использована прямая пальпация через разрез двенадцатиперстной кишки, но она не всегда эффективна. Принимаемое за сосочек уплотнение может оказаться долькой поджелудочной железы. Осторожно манипулируя ретракторами Фарабера, расправляют складки слизистой оболочки. Характерным ориентиром считают продольную складку слизистой оболочки, но ее не всегда удается увидеть. Обнаружение сосочка может быть облегчено выдавливанием желчи из желчного пузыря или введением раствора метилено-вого синего в общий желчный проток. Обычно большой сосочек двенадцатиперстной кишки находится ниже того места, где его ищут (Leger, 1958).
После обнаружения сосочка вокруг него накладывают 2 нити-держалки.
Папиллосфинктеротомия является наиболее ответственным этапом операции. Особенности техники папиллосфинктеротомии зависят от патологического состояния большого сосочка двенадцатиперстной кишки.
Большой сосочек двенадцатиперстной кишки частично проходим. Этот вариант является наиболее удачным. Дело в том, что во время папиллосфинктеротомии необходимо быть совершенно уверенным в том, что рассекается стенка именно общего желчного протока, а не протока поджелудочной железы. Избежать такой ошибки можно всегда, если через сосочек из общего желчного протока проходит самый тонкий эластический катетер. Если нельзя использовать культю пузырного протока, следует даже выполнять ограниченную супрадуоденальную холедохотомию. Определив истинное положение желчного протока, рассекают сосочек в правом верхнем квадранте его в направлении расположения 10— 11 ч на циферблате.
Для того чтобы режущий инструмент следовал именно по ходу канала общего желчного протока, используют несколько приемов.
В том случае, если введенный зонд имеет оливу и последняя фиксирована в области сосочка, рассечение выполняют над ней электроножом (Stefonini и соавт., 1977), «лазерным скальпелем» (Д. Ф. Благовидов и соавт., 1976) или обычным скальпелем или ножницами.
Если используется обычный эластический катетер, мы к его концу, выведенному через сосочек в полость двенадцатиперстной кишки, привязываем тонкую капроновую нить. Эту нить захватываем зажимом с тонкими изогнутыми концами так, чтобы они были как бы продолжением хода нити. Затем, извлекая зонд, протягиваем пить кверху, чтобы кончик зажима проник в отверстие сосочка. При дальнейшем протягивании нити зажим проникает в ампулу сосочка, а затем в интрамуральную часть общего желчного протока на глубину 2—2,5 см. Чтобы сосочек вместе с задней стенкой диспадцатиперстной кишки не уходил в глубину, ассистент фиксирует его с помощью держалок. После этого раскрываем зажим в поперечном направлении, чтобы расширить отверстие сосочка и стенозированный сфинктер до состояния, позволяющего свободно ввести браншу тонких ножниц. Постепенно рассекая кольцо сфинктера изнутри кнаружи, одновременно раскрываем зажим, определяя этим полноту папиллосфинктеротомии.
Сразу после рассечения сосочка на глубину 5—6 мм следует тщательно осушить операционное поле, найти устье протока поджелудочной железы и убедиться в том, что разрез направляется в сторону общего желчного протока, а проток поджелудочной железы остается в стороне. Чаще всего мы его находим в левом нижнем квадранте частично рассеченного сосочка соответственно расположению 5—6 ч на циферблате и определяем по периодическому поступлению из него прозрачной жидкости. Такая предосторожность далеко не излишняя, так как, по данным П. Н. Напалкова и Н. Н. Артемьева (1976), проток поджелудочной железы у 21 % больных располагается впереди желчного протока и у 1 % — справа от него. По нашим данным, отклонения от обычного места расположения устья протока поджелудочной железы встречаются лишь в 4 % случаев, но учитывать такую возможность следует всегда. Мы иногда не выполняем полной папиллосфинктеротомии и тем более не накладываем швов на слизистые оболочки, пока не убедимся в том, что проток поджелудочной железы находится в неопасной зоне и не будет поврежден или прошит при дальнейших манипуляциях.
Описанная классическая папиллосфинктеротомия выполнена у большинства наблюдаемых нами больных. У некоторых больных с частичной проходимостью сосочка мы применяем следующую тактику. Зонд, проведенный через сосочек, извлекаем, а вслед за ним в просвет общего желчного протока вводим зажим-москит, которым несколько расширяем сосочек. Зонд снова выводим через сосочек и по нему дважды в передне-правом и в передне-левом участках сосочка иглой проводим две нити-держалки. Опять вводим в сосочек зажим и, раскрыв его бранши, одновременно подтянув сосочек с помощью держалок, производим папиллосфинктеротомию. Перед рассечением введение зажима не обязательно, можно сразу пользоваться ножницами с тонкими, но не острыми, концами и изогнутыми браншами.
Большой сосочек двенадцатиперстной кишки непроходим. Под этим состоянием мы понимаем непроходимость сосочка лишь для эластического зонда, частичная же анатомическая проходимость может быть сохранена. Сюда относятся также все формы полной анатомической непроходимости, сопровождающиеся стойкой желтухой.
Причины непроходимости в основном могут быть следующие: 1) выраженный рубцовый стеноз сфинктера печеночно-поджелудоч-ной ампулы; 2) вколоченный или фиксированный камень в области большого сосочка двенадцатиперстной кишки; 3) тубулярный стеноз общего желчного протока на почве хронического панкреатита; 4) опухоль большого сосочка двенадцатиперстной кишки.
Особенно важно исключить наличие тубулярного стеноза. Дооперационная ретроградная панкреатохолангиография и эндоскопический осмотр с прицельной биопсией сосочка, а иногда и поджелудочной железы, как правило, помогают поставить правильный диагноз, но при неудачных исследованиях, особенно при полной анатомической непроходимости сосочка (вколоченный камень, опухоль), диагноз необходимо уточнять во время операции. Если головка поджелудочной железы плотная, эластический зонд в полость двенадцатиперстной кишки не проходит, но нет стойкой желтухи, в анамнезе — приступы панкреатита, имеется расширение общего желчного протока, позволяющее создать надежный отток желчи путем билиодигестивного анастомоза, то ставят диагноз тубулярного стеноза общего желчного протока и операцию заканчивают наложением холедоходуоденоанастомоза. При отсутствии у хирурга достаточного опыта диагноз следует уточнить с помощью операционной холангиографии. При вышеописанной ситуации, но без наличия расширенного общего желчного протока, холангиография на операционном столе обязательна, так как протяженность стеноза может быть небольшой, в пределах 2—2,5 см, и его можно устранить папиллосфинктеротомией; кроме того, операцию можно дополнить вирзунготомией. Вмешательство в этих случаях будет более радикальным и надежным.
Рубцовый стеноз сфинктера печеночно-поджелудочной ампулы может настолько сузить терминальный отдел большого сосочка двенадцатиперстной кишки, что отверстия практически не видно даже при визуальном осмотре сосочка после дуоденотомии. Канюляция такого сосочка при фибродуоденоскопии обычно не представляет больших трудностей и в дооперационный период удается получить достаточно ясную картину. Полагаться же на данные экскреторных рентгеноконтрастных методов исследования можно лишь при получении достаточно четкого изображения общего желчного протока, что при наличии даже частичной непроходимости желчных протоков всегда представляет большие трудности. Окончательно устанавливают диагноз во время операции. Хирург, определив эластическим зондом непроходимость в области дистального отдела общего желчного протока, должен исключить наличие тубулярного стеноза. После этого можно приступить к выполнению папиллосфинктеротомии. После вскрытия двенадцатиперстной кишки следует попытаться провести хотя бы кончик зонда в полость кишки. Если это удается, операцию выполняют по описанному выше плану. Если зонд в полость кишки не проводится, выполняют следующее вмешательство. После дуоденотомии, осторожно расправляя складки слизистой оболочки на задней стенке двенадцатиперстной кишки, отыскивают сосочек. При частично сохраненной анатомической проходимости сосочка желчь, выходя из отверстия, указывает на место его нахождения. Обнаружение сосочка может быть облегчено посредством инъекции в общий желчный проток через зонд раствора метиленового синего.
Сосочек берут на держалки и подтягивают к разрезу передней стенки двенадцатиперстной кишки. Отверстие сосочка и его ампулу расширяют тонким пуговчатым зондом на глубину не более 5— 10 мм, так как зонд проходит в проток поджелудочной железы легче, чем в общий желчный. После этого снова следует попытаться провести кончик эластического зонда, находящегося в общем желчном протоке. Если эта попытка не приносит успеха, в терминальный отдел общего желчного протока со стороны сосочка вводят тонкий желобоватый зонд (рис. 71).
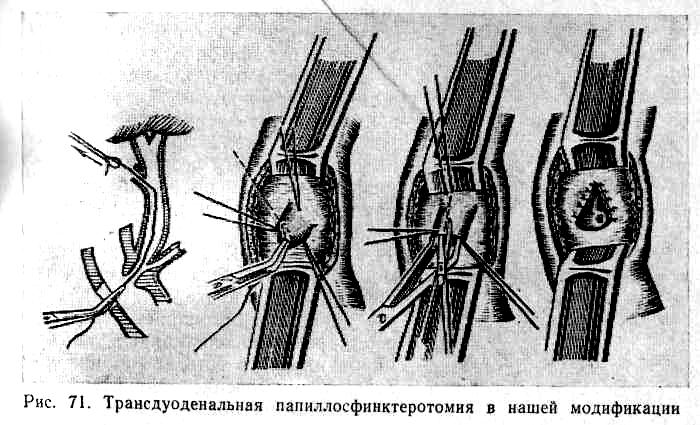
Введению его не препятствует даже стенозированный сфинктер печеночно-поджелудоч-ной ампулы, но остается опасность попадания и травмирования протока поджелудочной железы с последующим развитием панкреатита. Чтобы избежать ошибки, следует придерживаться направления терминального отдела общего желчного протока и, продвигая зонд вперед, пальпаторно определить, действительно ли он находится в общем желчном протоке. Желобоватый зонд ротируют латерально и по желобу вводят скальпель с направленным вверх острым лезвием. Проталкивая скальпель по желобу, рассекают сфинктер на необходимую длину в положении циферблата 10— 11 ч (см. рис. 71). Вместо скальпеля можно использовать остроконечные ножницы. И все же нам кажется, что удобнее и безопаснее перевести изолированную операцию в комбинированную, то есть, выполнив частичное рассечение сфинктера по желобоватому зонду, извлечь его и снова провести из общего желчного протока в полость кишки, четко определив положение общего желчного протока, а затем продолжить сфинктеротомию. Изолированный ретроградный подход может быть с успехом применен лишь при ущемленных камнях сосочка.
Вколоченный или фиксированный камень в большинстве случаев создает полную непроходимость большого сосочка двенадцатиперстной кишки. При наличии фиксированного камня в сосочке кончик эластического зонда все же проникает в полость двенадцатиперстной кишки, что значительно облегчает выполнение операции. В тех случаях, когда зонд доходит до камня, он выпячивает сосочек в просвет кишки, облегчая этим его обнаружение и выбор места для дуоденотомии. Наличие камня в сосочке упрощает также задачу обнаружения его пальпаторно. После подтягивания такого сосочка с помощью держалок и рассечения скальпелем его стенки над камнем в направлении 10—11 ч на циферблате последний извлекают инструментом.
В некоторых случаях камень находится несколько выше (на 5—10 мм) от отверстия сосочка. В этих случаях выполняют супра-папиллярную холедохотомию (рис. 72),
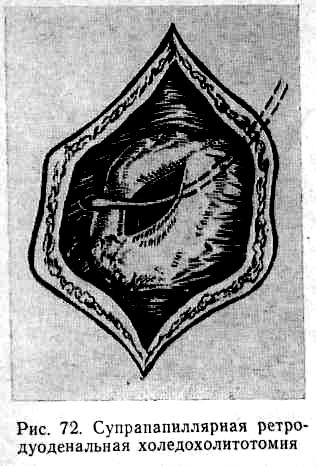
камень удаляют, а стенку сосочка рассекают со стороны имеющегося уже разреза. Разрез продлевают до конечного отверстия сосочка, превращая таким образом операцию в ту же папиллосфинктеротомию, совмещенную с трансдуоденальной холедоходуоденостомией.
Рассечение терминального отдела сосочка мы считаем обязательным, так как необходимо устранить стеноз устья протока поджелудочной железы.
Опухоли большого сосочка двенадцатиперстной кишки в принципе не являются показанием к трансдуоденальной папиллосфинктеротомии, однако, вызывая непроходимость его в начальных стадиях, могут симулировать стенозирующий оддит, вколоченный камень сосочка, поэтому необходима как дифференциальная диагностика этих заболеваний, так и соответствующая хирургическая коррекция. Опухоль может быть нераспознана лишь тогда, когда хирург пренебрегает трансдуоденальными вмешательствами на большом сосочке двенадцатиперстной кишки. Если же, обнаружив непроходимость общего желчного протока на уровне сосочка и определив наличие в нем уплотнения, хирург его осматривает, вскрыв двенадцатиперстную кишку, ошибки быть не может. При выполнении папиллосфинктеротомии иссекают часть ткани и подвергают ее срочному гистологическому исследованию. В случае обнаружения опухолевого процесса необходимо произвести радикальную операцию. Паллиативная операция обрекает больного на повторное вмешательство.
Мы считаем, что длина разреза не может быть критерием адекватности сфинктеротомии, так как протяженность интрамурального хода протока имеет значительные индивидуальные различия, а разрез должен проходить через всю суженную часть сфинктера. В противном случае остается опасность неполного устранения стеноза.
Рассечение экстрамуральных волокон собственного сфинктера общего желчного протока не является обязательным, если нет стеноза, но разрез должен доходить до самого широкого участка протока. Это значит, что после сфинктеротомии диаметр отверстия сосочка должен быть равен диаметру общего желчного протока. Чем больше разрез сфинктера, тем больше гарантия профилактики рес-теноза и отхождения незамеченных камней. Исходя из этих соображений, мы полагаем, что протяженность разреза сфинктера должна быть равной в среднем около 15 мм. Если же стеноз распространяется выше, то и разрез сфинктера продлевают кверху, стараясь не повредить поджелудочную железу. Протяженность выполненной папиллосфинктеротомии мы определяем либо при помощи катетера Фогарти, как это было описано выше, либо при помощи зажима, вставляя его конец в образовавшееся щелевидное отверстие и раздвигая его края. При достаточной сфинктеротомии желчь и детрит свободно вытекают в двенадцатиперстную кишку. Камень удаляют корнцангом или простым выдавливанием книзу через расширенное отверстие большого сосочка двенадцатиперстной кишки. После этого общий желчный проток обследуют ретроградно катетером Фогарти и вводят полиэтиленовую трубку для промывания желчевыводящих путей теплым раствором новокаина.
В исключительно редких случаях, когда в сосочке находится вколоченный камень или стриктура локализуется только в пределах слизистой оболочки у отверстия сосочка, мы ограничиваемся простой папиллотомией (разрез не более 5 мм). В основном такое вмешательство производят у лиц старше 60 лет. Во всех остальных случаях мы прибегаем к более широкому рассечению сфинктера. Клиновидное иссечение сегмента большого сосочка двенадцатиперстной кишки мы производим только при подозрении на опухолевое его поражение для срочного гистологического исследования. Различные варианты рассечения большого сосочка двенадцатиперстной кишки в зависимости от протяженности стеноза (П. Н. Напалков, 1980) представлены на рис. 73.
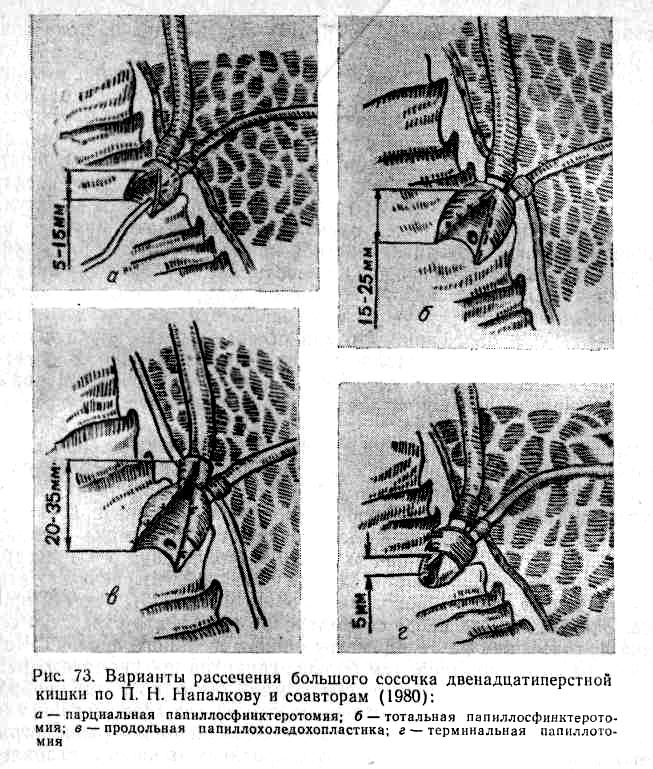
Шовное соединение слизистых оболочек общего желчного протока и двенадцатиперстной кишки по краям рассеченного сфинктера является обязательным завершающим этапом сфинктеротомии. Такое соединение облегчает гемостаз и укрывает линию разреза мышечного слоя сфинктера, уменьшая размеры последующего рубца.
Особенно тщательное наложение швов требуется у верхушки разреза, потому что при правильно выполненной сфинктеротомии разрез может выходить за пределы стенки двенадцатиперстной кишки. Если не наложить швов, возможно образование свища на задней стенке двенадцатиперстной кишки с развитием ретропери-тонеальной флегмоны.
Мы считаем, что в тех случаях папиллотомии или ограниченной сфинктеротомии, когда сшивание слизистых оболочек общего желчного протока и двенадцатиперстной кишки невозможно произвести анатомически, лучше отказаться от него, чем повредить стенку и слизистую оболочку желчного протока и вызвать образование рубца.
При наложении швов на края папиллосфинктеротомического разреза всегда следует помнить о возможности прошивания и последующей перевязки протока поджелудочной железы. Чтобы избежать этого, предварительно находят отверстие протока и осторожно вставляют в него пуговчатый зонд или полихлорвиниловый катетер. Устье протока поджелудочной железы обычно удается найти после сфинктеротомии, раздвигая зажимом края сосочка и рассматривая заднюю стенку ампулы. Оно чаще всего располагается в непосредственной близости от отверстия большого сосочка двенадцатиперстной кишки в направлении 5 ч на циферблате и обнаруживается по выделению бесцветного панкреатического сока. В норме отверстие протока поджелудочной железы совершенно свободно пропускает зонд или катетер диаметром 1,5—2 мм.
Уточнив таким образом место расположения протока поджелудочной железы, приступают к наложению швов. Легче всего наложить нижние швы по обеим сторонам рассеченного сосочка. Потягивая за них, как за держалки, раскрывают поле для наложения более высоких швов.
В качестве шовного материала используют тонкий хромированный кетгут, стерилен, супрамид, тонкие нити из капрона или шелка, применяемые в сосудистой хирургии. Накладывают узловые швы в количестве от 3 до 9 в зависимости от протяженности разреза сфинктера. М. В. Данилов и соавторы (1979) предложили сшивать слизистые оболочки односкобочным сшивающим аппаратом СТП-1.
Мы применяем тонкий дексон или хромированный кетгут на атравматической игле и накладываем узловые швы. В некоторых случаях, при широком папиллотомическом отверстии, допустимо наложение обвивного шва внахлестку.
Дренирование протока поджелудочной железы. Одна из методик введения дренажа предложена Donbilet (1956). После папиллосфинктеротомии и ушивания краев разреза через устье протока поджелудочной железы в него вводят тонкий катетер на глубину до 3 см. Катетер фиксируют отдельным швом к краю сосочка или стенке двенадцатиперстной кишки вблизи сосочка. Другой конец катетера через общий желчный проток выводят в подпеченочное пространство, а затем — наружу. Отдельным швом фиксируют дренаж к коже.
Другая методика дренирования предложена Leger (1958). Внутренний конец катетера вводят в проток поджелудочной железы, как описано выше, а наружный выводят через стенку двенадцатиперстной кишки. В месте выхода катетера из кишки формируют канал по Витцелю протяженностью 2 см. Наружный конец дренажа выводят через контрапертуру в правом подреберье, фиксируя его к коже. Часть трубки, проходящей в брюшной полости от стенки кишки до брюшной стенки, окутывают сальником.
Возможно выведение наружного конца дренажа протока поджелудочной железы через желудок и пищевод трансназально, а также через временную гастростому (П. Н. Напалков и соавт., 1980). Авторы указывают, что при всех видах дренирования протока поджелудочной железы необходимо соблюдать следующие правила. В той части дренажа, которая расположена в протоке, нужно сделать несколько боковых отверстий. В двенадцатиперстной кишке дренаж должен лежать свободно в виде петли, без перегибов. Перечисленные требования важны для обеспечения беспрепятственного тока панкреатического сока. В противном случае дренаж превратится в обтуратор протока.
Мы не прибегаем к дренированию протока поджелудочной железы после папиллосфинктеротомии, так как, по нашему мнению, это может способствовать развитию острого послеоперационного панкреатита.
Вирзунготомия. После окончания манипуляций на сосочке необходимо убедиться в проходимости протока поджелудочной железы. На медиальной стенке сосочка отыскивают устье протока и в течение 1—2 мин наблюдают за выделением секрета. Если за указанный период времени поступления сока нет, то нужно проверить проходимость протока путем зондирования его мягким эластичным катетером диаметром не более 2 мм.
В тех случаях, когда нарушение проходимости протока поджелудочной железы связано с характером заболевания (распространение стеноза сосочка на устье протока, хронический панкреатит с нарушенной проходимостью протока и др.), производят соответствующую хирургическую коррекцию.
Трансназальное дренирование двенадцатиперстной кишки. Введение трансназального дренажа перед ушиванием дуоденотомического отверстия является обязательным. Подобный декомпрессионный дренаж кишечника является профилактикой острого панкреатита, дуоденальных свищей, он служит для контроля кишечного кровотечения, поступления желчи и восстановления перистальтики. Зонд представляет собой термопластическую трубку диаметром до 0,5 см с множественными отверстиями на том конце, который предназначен для интубации желудка И двенадцатиперстной кишки. Его вводят антеградно через нос, пищевод, желудок и под контролем глаза — в нисходящий отдел двенадцатиперстной кишки. После соответствующего расположения наружный конец зонда фиксируют тесемкой вокруг головы. Как правило, такой зонд мы вводим на 3—4 сут, то есть до появления перистальтики кишечника и уменьшения отделяемого через зонд. Ежедневно, а в первые 2 сут по 3—4 раза, промываем двенадцатиперстную кишку и желудок раствором натрия гидрокарбоната.
Ушивание раны двенадцатиперстной кишки. Дуоденотомическое отверстие мы, как и большинство хирургов, ушиваем двухрядным швом (непрерывным вворачивающим швом Коннеля тонким хромированным кетгутом на атравматическои игле и серо-серозными узловыми, но чаще П-образными швами тонким капроном). Для удобства наложения швов натягивают нити-держалки, одну влево, другую вправо, и дуоденотомическое отверстие превращают из продольного в поперечное.
Дренирование общего желчного протока. С самого начала применения трансдуоденальной папиллосфинктеротомии и до настоящего времени идет спор о необходимости дренирования желчевыводящих путей после этой операции. Был предложен ряд транспапиллярных дренажей. Подавляющее число трансдуоденальных папиллосфинктеротомии мы выполняем без наружного дренирования общего желчного протока, тем более транспапиллярного; лишь у 76 (11,4 %) из 667 больных было применено дренирование через культю пузырного протока. Для этого использовали тонкую диаметром 3 мм хлорвиниловую трубку, применяемую во время операционной холангиоманометрии, дебитометрии и холан-гиографии. Трубку укрепляли в культе пузырного протока 2 лигатурами, следя за тем, чтобы конец ее был расположен препапил-лярно. Другой конец трубки выводили наружу через отдельный прокол брюшной стенки таким образом, чтобы сама трубка проходила вдоль ложа желчного пузыря, и прикрепляли ее к коже шелковым швом.
В послеоперационный период проводили контрольные измерения. Трубку начинали пережимать с 4-х суток. На 7—8-е сутки выполняли кинохолангиографию, а на 8—9-е сутки дренажную трубку удаляли. Желчь после удаления дренажа не выделялась, отверстие заживало через 1—2 сут. Не наблюдалось каких-либо осложнений, связанных с дренированием общего желчного протока этим способом.
Главной предпосылкой для применения такого дренажа было проведение исследований для оценки функционального состояния сфинктера печеночно-поджелудочной ампулы после его рассечения. Но, как показали наши наблюдения, при использовании микродренажа послеоперационный период протекает более спокойно. Учитывая это, а также возможность надежного послеоперационного контроля и выявления случайных ошибок при выполнении операции, можно считать очень полезным введение микродренажа через культю пузырного протока после трансдуоденальной папиллосфин-ктеротомии, в особенности когда нет полной уверенности в том, что удалены все камни из желчевыводящих путей или рассечен весь и без лишней травмы стенозированный сегмент сфинктера. Если же после сфинктеротомии отмечается свободный отток желчи в двенадцатиперстную кишку, то применение микродренажа не показано.
На основании собственных наблюдений мы пришли к выводу, что при трансдуоденальной папиллосфинктеротомии по поводу первичного стеноза сфинктера печеночно-поджелудочной ампулы необходима холецистэктомия, даже если желчный пузырь почти не изменен. Поскольку наполнение и сокращение желчного пузыря регулируется сфинктером печеночно-поджелудочной ампулы, то после сфинктеротомии пузырь превращается в подобие пассивного желчного дивертикула, в котором поддерживается воспаление и могут формироваться камни.
Дренирование брюшной полости мы считаем обязательным. Причем трубочно-перчаточный дренаж мы располагаем в правом подпеченочном пространстве, а один из пальцев перчаточного дренажа подводим к месту ушитого дуоденотомического отверстия. Выводим дренаж через отдельный небольшой разрез брюшной стенки в правом фланке живота и фиксируем к коже. Такой дренаж мы оставляем на 3—8 сут в зависимости от наличия отделяемого из брюшной полости.
После окончания операции правое подпеченочное пространство промываем раствором антибиотиков. Затем рану передней брюшной стенки ушиваем наглухо.
Послеоперационные осложнения. Осложнения, связанные с трансдуоденальной папиллосфинктеротомией, могут быть двух видов: 1) наступающие во время визуализации большого сосочка двенадцатиперстной кишки и уточнения его патологии; 2) связанные с самой операцией.
Наиболее частым осложнением первого вида является образование ложного хода во время зондирования дистального отдела общего желчного протока металлическими зондами. Как правило, перфорация происходит в терминальном отделе общего желчного протока и зонд (или другой инструмент), пройдя через ложный ход, Проникает в просвет двенадцатиперстной кишки выше сосочка. Если используемый инструмент тонкий, то лечение осложнения не представляет трудностей: отыскав отверстие сосочка, сфинктерото-мию производят так, чтобы соединить оба отверстия. Иногда для этого требуется довольно большой разрез. При ушивании этого от-верстия необходимо тщательно сопоставить стенки общего желчного протока и двенадцатиперстной кишки.
Применение грубых инструментов в целях зондирования иногда может привести даже к отрыву большого сосочка двенадцатиперстной кишки. Мы наблюдали такое осложнение у 1 больного, которому была наложена холедохоеюностома.
Большинство хирургов в настоящее время полностью отказались от зондирования дистального отдела общего желчного протока металлическими зондами и применяют эластические пластмассовые или резиновые зонды, поэтому подобные осложнения практически не наблюдаются.
Осложнения, связанные с самой операцией, встречаются редко, но они являются главной причиной летальных исходов.
К таким осложнениям относятся: 1) образование ложного хода в подслизистом слое двенадцатиперстной кишки; 2) образование сквозного дефекта в задней стенке двенадцатиперстной кишки; 3) кровотечение из рассеченной слизистой оболочки; 4) острый панкреатит; 5) образование дуоденального свища; 6) остаточный холе-литиаз; 7) желудочный стаз.
Образование ложного хода в подслизистом слое двенадцатиперстной кишки встречается редко. Оно наблюдается в случаях ретроградного зондирования большого сосочка двенадцатиперстной кишки при изолированной трансдуоденальной папиллосфинктеротомии. При небрежном зондировании зонд через подслизистый слой кишки может легко выйти в свободную брюшную полость или забрюшинное пространство. Мы наблюдали подобное осложнение у 2 (0,3 %) больных. У одного из них ложный ход был ушит при ушивании слизистых оболочек общего желчного протока и двенадцатиперстной кишки после папиллосфинктеротомии, у другого образовались дуоденальный свищ и забрюшинная некротическая флегмона, ставшая причиной летального исхода.
Клинически забрюшинная флегмона проявляется нарастающими признаками интоксикации, рвотой, угнетением перистальтики, выделением через дренаж дуоденального содержимого.
Лечение забрюшинной флегмоны должно включать в себя наружное дренирование общего желчного протока с максимально полным отведением желчи наружу, постоянное отсасывание содержимого двенадцатиперстной кишки путем проведения в нее дренажа через гастростому или резекции желудка по способу Бильрот-II, если нет признаков перитонита, а также широкого дренирования забрюшинного пространства перчаточно-трубчатыми дренажами в области сальникового отверстия и у горизонтальной части двенадцатиперстной кишки.
С внедрением в практику исследования проходимости желчных протоков зондом Фогарти, выведения сосочка на металлическом зонде большого диаметра, а также тщательного ушивания разреза сосочка мы не наблюдали случаев забрюшинной флегмоны после папиллосфинктеротомии.
Сквозной дефект в задней стенке двенадцатиперстной кишки образуется при стремлении хирурга слишком глубоко рассечь собственный сфинктер общего желчного протока. Такое рассечение допустимо, если этого требует протяженность стеноза, но ушивание стенок общего желчного протока и двенадцатиперстной кишки, особенно в верхнем углу сфинктеротомического-отверстия, должно быть особенно тщательным. Необходимо придерживаться следующего правила: чем больше протяженность папиллосфинктеротомии, тем тщательнее должен быть шов слизистых оболочек и стенок общего желчного протока и двенадцатиперстной кишки.
Мы наблюдали это осложнение у 1 (0,1 %) больного, которое привело к летальному исходу вследствие образования ретродуоденальной флегмоны и очагового панкреонекроза в области головки поджелудочной железы.
Кровотечение после трансдуоденальной папиллосфинктеротомии встречается также редко — в 0,3—1,1 % случаев (М. И. Филимонов, И. М. Рудаков, 1978; Sery и соавт., 1977, и др.). Наиболее частой причиной его является недостаточный гемостаз после рассечения большого сосочка двенадцатиперстной кишки, связанный с отказом от наложения швов, соединяющих слизистые оболочки общего желчного протока и двенадцатиперстной кишки. Однако все больше хирургов убеждаются в необходимости наложения таких швов, в связи с чем и количество кровотечений становится меньше. К летальным исходам эти кровотечения, как правило, не ведут. В ряде случаев прибегают к коагуляции сосудов эндоскопическим методом и к гемостатической терапии. Мы наблюдали подобное кровотечение у 3 (0,4 %) больных, излеченных консервативными методами.
Осложнения, связанные с развитием острого воспаления поджелудочной железы, наиболее часто ведут к летальным исходам. Частота острого панкреатита после папиллосфинктеротомии колеблется от 0,6 до 7,9 % (по данным К. Д. Тос-кина и соавт., 1977,-0,6%; Arianoff и соавт., 1977,-0,7%; В. С. Савельева, М. И. Филимонова, 1978,-4,4 %; М. И. Филимонова, И. М. Рудакова, 1978,-7,9 %). Мы наблюдали острый панкреатит у 8 (2,7 %) больных; 12 из них умерли. Тяжесть осложнения объясняется быстрым прогрессировавшем процесса и развитием деструкции железы (М. И. Филимонов, И. М. Рудаков, 1978). Причинами развития острого панкреатита, по нашему мнению, являются травма основного протока поджелудочной железы во время папиллосфинктеротомии (случайное ее рассечение, необоснованно глубокое зондирование, прошивание во время наложения швов на Слизистые оболочки общего желчного протока и двенадцатиперстном кишки), а также излишняя травматизация головки поджелудочной железы при ее мобилизации, поисках большого сосочка двенадцатиперстной кишки и грубых попытках смещения ущемленного в сосочке камня. Особого внимания требуют больные, у которых в анамнезе есть указания на неоднократные приступы острого перитонита, и больные, у которых папиллосфинктеротомия была дополнена вирзунготомией. После вирзунготомии умерли 4 из 31 больного, а у 10 наблюдалось обострение хронического панкреатита.
Хотя истинную частоту «чистого» послеоперационного панкреатита трудно установить, так как у многих больных он развивается как обострение хронического рецидивирующего заболевания, мы считаем, что основную роль в его возникновении играет все же операционная травма протока поджелудочной железы.
Исследуя содержание амилазы, липазы и трипсина в дооперационный период и в первые дни после вмешательства на общем желчном протоке и сфинктере печеночно-поджелудочной ампулы, мы часто обнаруживали функциональные и органические изменения поджелудочной железы, однако острый панкреатит развивался далеко не у всех больных. Следует помнить, что папиллосфинктеротомия может осложняться острым панкреатитом даже при безукоризненном ее выполнении, поэтому с первого же часа после вмешательства на большом сосочке двенадцатиперстной кишки надо проводить медикаментозную профилактику этого заболевания.
Диагностика острого панкреатита после сфинктеропластики трудна, особенно в ранние сроки после операции. Прогрессирующее падение артериального давления, необъяснимое снижение гемоглобина, появление метгемоглобина, снижение уровня кальция в сыворотке крови, сильная боль, плохо купирующаяся наркотиками, олигурия, возбуждение, частая рвота или большое количество отсасываемого из желудка содержимого должны наводить на мысль о развитии этого осложнения. Систематическое исследование панкреатических ферментов в первые дни после операции позволяет судить о состоянии поджелудочной железы и своевременно предупредить острый панкреатит.
Наиболее важными мерами профилактики острого панкреатита при трансдуоденалыюй папиллосфинктеротомии являются следующие: выполнение операции комбинированным способом, рассечение большого сосочка двенадцатиперстной кишки только под визуальным контролем общего желчного протока и протока поджелудочной железы, зондирование протока поджелудочной железы строго по показаниям (стеноз устья, рецидивирующий панкреатит в анамнезе), не накладывать швы в зоне расположения протока поджелудочной железы, наружное его дренирование после вирзунготомии, медикаментозная профилактика во время операции сразу после рассечения сосочка с обязательным назначением ингибиторов ферментов поджелудочной железы (фторурацила и контрикала), обязательное трансназальное дренирование двенадцатиперстной кишки с частым ее промыванием раствором натрия гидрокарбоната.
Проведение такого комплекса мероприятий позволило нам в последние 1,5 года (65 операций) полностью избежать развития тяжелых форм острого панкреатита и летальных исходов.
Образование дуоденального свища. Такие свищи, как правило, связаны с дуоденотомией. Возникают редко. Johes (1973) наблюдал это осложнение у 1,7 % больных, М. И. Филонов и И. М. Гудаков (1978) —у 0,9 %.
Мы наблюдали недостаточность швов двенадцатиперстной кишки у 4 (0,6 %) больных. У 1 больного дуоденальный свищ был небольшим и зажил самостоятельно, у 1 развился перитонит (летальный исход), у 2 свищ сочетался с панкреонекрозом и ложным ходом с забрюшинной флегмоной, которые послужили причиной летального исхода.
У всех этих больных образование дуоденального свища было связано с техническими погрешностями во время операции. При правильном наложении двухрядного шва опасности образования дуоденального свища не существует. Полезным профилактическим мероприятием является систематическая аспирация желудочного и дуоденального содержимого в первые 3—5 сут после операции через трансназальный зонд.
Остаточный холелитиаз. Наблюдается очень редко. Применяя широкое рассечение сфинктера большого сосочка двенадцатиперстной кишки, мы ни разу не обнаруживали оставленных в общем желчном протоке камней, хотя чаще всего папиллосфинк-теротомию выполняли именно у больных с холелитиазом.
Желудочный стаз. Это состояние развивается у всех больных в первые дни после операции вследствие частичной непроходимости двенадцатиперстной кишки. Аспирация желудочного содержимого через зонд устраняет стаз в течение 3—4 сут. Продолжительность желудочного стаза в большой степени зависит от техники ушивания дуоденотомического разреза. Стеноз, вызванный неадекватным ушиванием двенадцатиперстной кишки, наблюдается очень редко, ему способствуют слишком длинная вертикальная дуо-денотомия и грубое ушивание.
Среди других осложнений, не связанных непосредственно с трансдуоденальной папиллосфинктеротомией, наблюдаются разлитой и ограниченный перитонит (подпеченочный абсцесс); нагноение раны, образование послеоперационных инфильтратов; расстройства сердечно-сосудистой деятельности и дыхания.
Осложнения преходящего характера, не связанные непосредственно с операцией, мы наблюдали у 42 (6,3 %) больных. Все они были излечены.
Таким образом, мы наблюдали осложнения после трансдуоденальной папиллосфинктеротомии у 70 (10,5%) больных. По данным литературы, они встречаются в 4,6—13,6 % случаев (М. В. Данилов, В. А. Вишневский; 1978; В. С. Савельев и М. И. Филимонов, 1978; Jones, 1973; Gorranigo и соавт., 1976; Arionoff и соавт., 1976, 1977, и др.).
Послеоперационная летальность. Из 667 оперированных нами больных умерли 17 (2,5 %). У 11 (1,6 %) из них причиной смерти были технические погрешности во время операции.
Паллиативные и реконструктивные операции. К ним относятся:
1) бужирование большого сосочка двенадцатиперстной кишки;
2) холедоходуоденостомия; 3) холедохоеюностомия. Бужирование большого сосочка двенадцатиперстной кишки предложено Hoffmeister в 1913 г. (цит. по И. М. Тальман, 1963). Через холедохотомическое отверстие вводят бужи Гегара возрастающего диаметра до № 6—8, смазанные вазелиновым маслом. Для бужирования применяют также уретральные катетеры и специальные дилятаторы.
Противопоказанием к бужированию сосочка является холангит со значительным разрыхлением стенки общего желчного протока (высокий риск перфорации протока).
Мы выполнили бужирование сосочка 29 больным. Показаниями к такому вмешательству служили клинические признаки печеночной колики, а также выявленные во время операции остаточное давление на уровне 160—190 см вод. ст. и дебит 15—20 в 1 мин. Перфорация дистального отдела общего желчного протока произошла у 1 больного, что вынудило выполнить трансдуоденальную па-пиллосфинктеротомию и таким образом ушить дефект стенки. Острый послеоперационный панкреатит развился у 5 больных, 1 из них умер.
Через 6—12 мес после бужирования рецидив стеноза сосочка диагностировали у 8 больных.
Анализ наших наблюдений свидетельствует о высокой травматичности и низкой эффективности бужирования большого сосочка двенадцатиперстной кишки по сравнению с другими методами лечения. Минимальный диахчетр бужа равен 3 мм, и если такой буж проходит через сосочек, то органического препятствия оттоку желчи фактически нет, поэтому ожидать стойкого отдаленного эффекта после такой операции нет оснований. В наших наблюдениях хорошие и удовлетворительные отдаленные результаты вмешательства
можно объяснить тем, что во время операции был воспалительный отек и спазм сфинктера и слизистой оболочки сосочка, которые претерпели обратное развитие после холецистэктомии и холедохо-литотомии, выполненных одновременно с бужированием сосочка. Учитывая изложенное, бужирование большого сосочка двенадцатиперстной кишки применять не следует.
Холедоходуоденостомия. Из всех предложенных ранее операций по созданию холедоходуоденального соустья в настоящее время применяют лишь две: трансдуоденальную супрапапил-лярную холедоходуоденостомию и супрадуоденальную холедоходу-оденостомию.
Впервые анастомоз общего желчного протока с двенадцатиперстной кишкой по типу «бок в бок» произвел в 1888 г. Riedel. В 1894 г. холедоходуоденостомию трансдуоденальным путем выполнил Kocher. Впоследствии Sosse (1913) и Florcken (1923) предлагали применять такой анастомоз как автоматическое завершение каждой холедохотомии вместо Т-образного дренажа. Finsterer (1932) рекомендовал выполнять холедоходуоденостомию при тяжелом гнойном холангите. Он считал, что наружное дренирование приводит к резкому истощению больных, так как оно должно быть длительным. Многие хирурги отдают предпочтение холедоходуоденостомии при стенозе сфинктера печеночно-поджелудочной ампулы или даже при подозрении на него, при стенозе ретропанкреатического отдела общего желчного протока, при наличии множественных мелких камней, песка и замазкообразной желчи в желче-выводящих путях. Эту операцию широко применяют при непроходимости дистального отдела желчных протоков. Главные преимущества холедоходуоденостомии состоят в том, что она является простой и безопасной операцией, а оставшиеся незамеченными камни желчных протоков могут свободно выходить через широкий анастомоз.
Частота применения супрадуоденальной холедоходуоденостомии, по данным различных авторов, составляет от 10 до 15 % среди всех операций на желчевыводящих путях, до 61,2 % —при патологии дистального отдела общего желчного протока, до 46,2 % — при повторных операциях по поводу холелитиаза. Мы выполнили эту операцию у 24 % больных с непроходимостью дистального отдела общего желчного протока.
В настоящее время создалось совершенно правильное представление об операциях наложения холедоходуоденального соустья как вынужденых, имеющих определенные показания и совершенно не конкурирующих с основными операциями при патологии дистального отдела общего желчного протока — эндоскопической и трансдуоденальной папиллосфинктеротомией, так же как и последние в этих случаях не могут конкурировать с холедоходуоденостомией. И все же, поскольку еще большое количество хирургов стремятся
заменить холедоходуоденостомией транспапиллярные операции, мы считаем необходимым остановиться на некоторых общих ее недостатках.
1. Действительно, при широком общем желчном протоке наложение холедоходуоденоанастомоза является легко.выполнимой операцией для большинства хирургов. Однако это бывает лишь в далеко зашедших случаях. Обычно стеноз сфинктера не сопровождается значительным расширением общего желчного протока, позволяющим хирургу решиться на холедоходуоденостомию, а наложение анастомоза при узком общем желчном протоке ведет к быстрому стенозированию соустья и повторной операции. Представляется очень сомнительным, чтобы при нормальном калибре или небольшом расширении общего желчного протока холедоходуоденостомия являлась бы технически более простой операцией, чем трансдуоденальная папиллосфинктеротомия и тем более эндоскопическая.
2. Несомненно, что широкий холедоходуоденоанастомоз эффективно разгружает общий желчный проток, но возникает опасность восходящего холангита, так как никакими техническими вариантами невозможно предотвратить рефлюкс кишечного содержимого. Сторонники холедоходуоденостомии утверждают, что широкое отверстие анастомоза исключает холангит. Это мнение справедливо, но края любого анастомоза имеют тенденцию к рубцеванию. Если возникает стеноз анастомоза, развивается упорный холангит. Рубцовое сужение анастомоза обычно развивается в тех случаях, когда холедоходуоденостомию предпринимают при относительно узком общем желчном протоке. Отдаленные результаты холедоходуоденостомии в большой мере зависят от проходимости сфинктера печеночно-поджелудочной ампулы: чем больше выражено органическое сужение в области большого сосочка двенадцатиперстной кишки, тем больше возникает осложнений даже после хорошо выполненного анастомоза.
3. Основным недостатком холедоходуоденостомии является то, что она не устраняет стеноз сфинктера печеночно-поджелудочной ампулы. Этот недостаток имеет принципиальное значение при панкреатите. Если устье протока поджелудочной железы оказывается сдавленным в фиброзном кольце сфинктера ампулы, то холедоходуоденостомия, как способ разгрузки протоков поджелудочной железы, является проблематичной. И совершенно лишена смысла холедоходуоденостомия при панкреатите, обусловленном стенозом устья протока поджелудочной железы, который открывается отдельным отверстием на верхушке большого сосочка двенадцатиперстной кишки. К излечению может привести только прямая операция на сфинктере общего желчного протока и устье главного протока поджелудочной железы. Холедоходуоденостомии недостаточно, так как она разгружает только желчевыводящие пути и не приводит к декомпрессии в системе протоков поджелудочной железы.
4. При холедоходуоденостомии выключаются большой ретродуоденальный и интрапанкреатический отрезки общего желчного протока и образуется так называемый слепой мешок. В этом месте возникают стаз, воспаление, оседают желчный песок, замазкообраз-ная желчь и образуются камни. Теоретически этот стаз незначительный. Отдельные авторы даже считают, что «слепой мешок» опорожняется либо через суженный сосочек, либо ретроградно через анастомоз. Мы не разделяем этого мнения. Очевидно, отток из ретродуоденального «слепого мешка» через сфинктер не обеспечивается, так как при рентгеновском исследовании бариевая взвесь задерживается здесь длительное время. Развитие инфекции в этом месте неизбежно. Воспаление распространяется лимфогенным путем непосредственно на головку поджелудочной железы. Кроме того, загрязнение «слепого мешка» еще больше затрудняет отток панкреатического сока и способствует прогрессированию панкреатита.
5. Вследствие холедоходуоденостомии образуются перегибы и деформация двенадцатиперстной кишки, что сопровождается нарушением ее моторики и проходимости, застоем и рефлюксом кишечного содержимого в желчные протоки, нарушением оттока панкреатического сока, а также способствует возникновению и дальнейшему развитию панкреатита.
6. При шаблонном применении холедоходуоденостомии существует опасность не диагностировать рак большого сосочка двенадцатиперстной кишки в тех случаях, когда он может быть, и диагностировать его при доброкачественном стенозе сфинктера. Эти же замечания в основном относятся и к операции трансдуоденальной супрапапиллярной холедоходуоденостомии. Хотя при этой операции и остается значительно меньший участок выключенного общего желчного протока («слепого мешка»), но стенозирующий оддит является тем основным недостатком, который заставляет нас вообще не применять этой операции, так как, вскрыв двенадцатиперстную кишку, проще и надежней выполнить папиллосфинктеротомию, чем по тем же показаниям накладывать супрапапиллярный холедоходу-оденоанастомоз. Нецелесообразно и наложение трансдуоденального холедоходуоденоанастомоза при тубулярном стенозе общего желчного протока на почве панкреатита. Гораздо проще в этих случаях и менее опасно для больного наложить супрадуоденальный холедо-ходуоденальный анастомоз.
В связи со сказанным мы не считаем необходимым подробно останавливаться на технике создания трансдуоденальных холедо-ходуоденоанастомозов; некоторые хирурги применяют эти операции и до настоящего времени (В. И. Ташкинов, 1978; А. Л. Шор, 1978, и др.) — рис. 74.
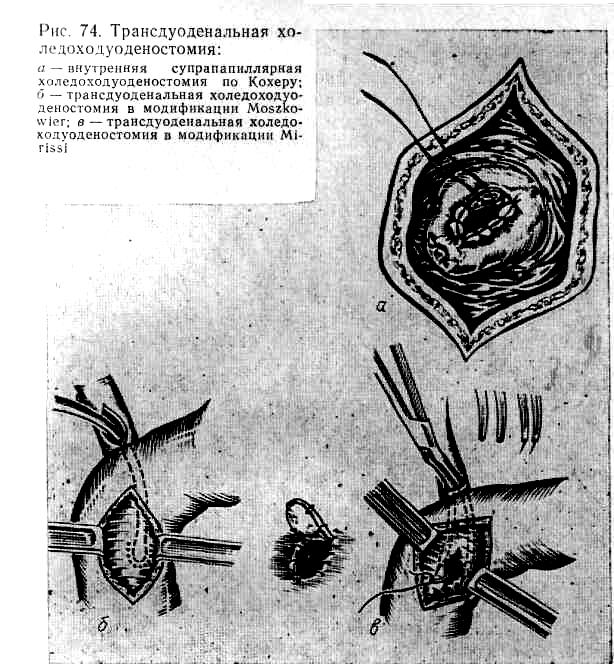
Как мы уже отмечали, радикального отказа от холедоходуоденостомии по поводу заболеваний терминального отдела общего желчного протока неопухолевого характера не должно быть, но ее следует применять так же, как и эндоскопическую или трансдуоденальную папиллосфинктеротомию, по строгим показаниям. Если показания к обеим операциям возникают у одного и того же больного, то их выполняют одновременно. Мы также согласны с теми хирургами, которые крайне сдержанно относятся к созданию холе-доходуоденостомы у больных более молодого возраста (до 50 лет). В этих случаях мы отдаем предпочтение непосредственным вмешательствам на большом сосочке двенадцатиперстной кишки, так как расширенный общий желчный проток в этом возрасте легко сокращается до нормальных размеров, в то время как у больных в возрасте старше 50 лет он остается расширенным и папиллосфинктеротомия у них не может полностью устранить стаз желчи в общем желчном протоке и впоследствии развивается холангит. Поэтому при расширении общего желчного протока до 1,5 см необходимо
выполнять холедоходуоденостомию, дополнив ее при необходимости папиллосфинктеротомией.
Мы применяем холедоходуоденостомию только при обширном стенозе терминального отдела общего желчного протока, распространяющемся более чем на 2,5 см от отверстия большого сосочка двенадцатиперстной кишки, стреловидном или тубулярном стенозе интра- и ретропанкреатической части общего желчного протока на почве псевдотуморозного панкреатита, атонии общего желчного протока с его дилатацией до 2 см и более при стенозе большого сосочка двенадцатиперстной кишки, часто сочетающемся с холели-тиазом. Во всех остальных случаях мы предпочитаем эндоскопическую или трансдуоденальную папиллосфинктеротомию.
Противопоказаниями к холедоходуоденостомии являются: 1) гнойный холангит с язвенно-некротическими изменениями стенки желчных протоков; 2) резко выраженные воспа-лительно-инфильтративные изменения стенки двенадцатиперстной кишки (например, при перитоните); 3) рубцово-язвенная деформация двенадцатиперстной кишки; 4) дуоденостаз.
В первых двух случаях вынужденно ограничивают объем операции холедохолитотомией и наружным дренированием общего желчного протока. При сочетании рубцово-язвенной деформации двенадцатиперстной кишки и расширения общего желчного протока до 20 мм и более (или расширения до 15 мм, вызванном уплотнением и увеличением головки поджелудочной железы) показана холедохоеюностомия с проксимальной селективной ваготомией. При холедохолитиазе, сочетающемся с расширением общего желчного протока до указанных величин на фоне дуоденостаза, применяют холедохоеюностомию. Из многочисленных методов холедоходуоденосто-мии наибольшее распространение получила супрадуоденальная холедоходуоденостомия по типу «бок в бок». Реже применяют супрадуоденальную холедоходуоденостомию по типу «конец в бок».
Супрадуоденальная холедоходуоденостомия по типу «бок в бок». Создание анастомозов такого типа предусматривают методики Финстерера, Флеркена, Юраша в модификации В. В. Виноградова.
Создание холедоходуоденального соустья по методике Финстерера (1932) требует хорошей мобилизации двенадцатиперстной кишки во избежание ее натяжения и деформации (рис. 75).
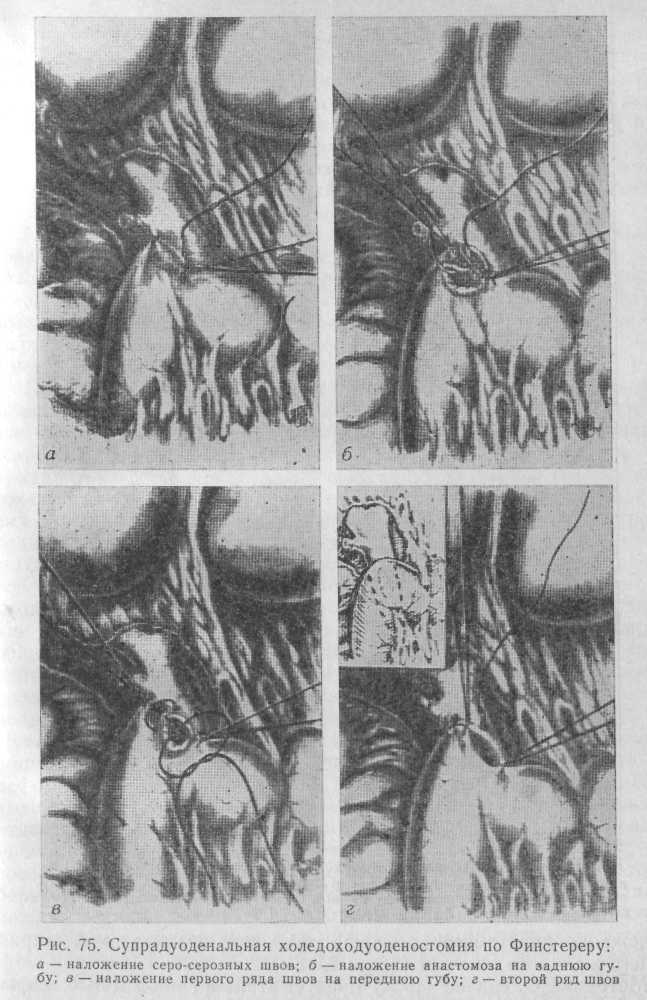
Формирование анастомоза начинают с наложения серозно-мышечных швов непосредственно у места соприкосновения протока и кишки. Просветы вскрывают на протяжении не менее 2—2,5 см, причем общего желчного протока — в поперечном, а кишки — в продольном направлении. Края разреза ушивают непрерывным обвивным кетгутовым швом через все слои стенки. Накладывают серозно-мышечные швы по передней полуокружности анастомоза. Брюшную полость зашивают наглухо. Недостатком методики является то, что наложение анастомоза возможно лишь при значительной ширине общего желчного протока (более 2,5 см).
Методика Флеркена (1926) предусматривает продольное вскрытие общего желчного протока и двенадцатиперстной кишки во взаимно перпендикулярных направлениях, причем разрез общего желчного протока должен приходиться на середину разреза кишки (рис. 76).
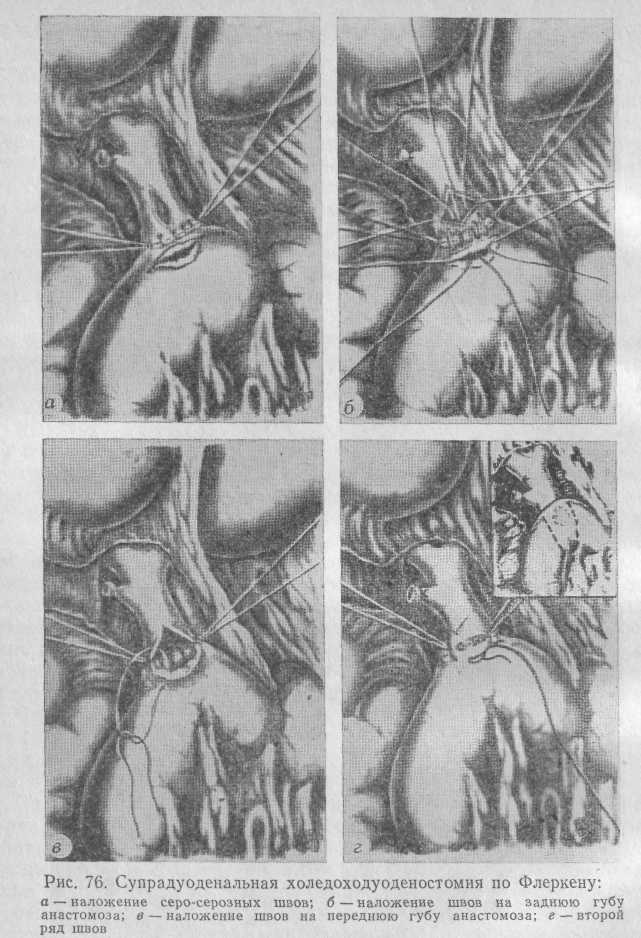
По мнению автора, такое соустье предотвращает стено-зирование. Техническое выполнение этой операции не представляет больших трудностей, но следует соблюдать осторожность при наложении швов на стыках разрезов. По мере наложения швов продольный разрез общего желчного протока постепенно превращается в поперечный, в связи с чем эту методику используют при менее широком протоке, когда методика Финстерера не может обеспечить создания достаточно широкого соустья.
Методика Юраша (1923) в модификации В. В. Виноградова предусматривает наложение соустья после продольного рассечения общего желчного протока и поперечного вскрытия двенадцатиперстной кишки. Наложение такого анастомоза возможно и при небольшом расширении общего желчного протока, но технически выполнить его сложно из-за натяжения тканей при наложении швов у верхней части анастомоза.
При необходимости создания супрадуоденального холедоходуоденоанастомоза мы применяем методику, принцип которой заключается в следующем: чем шире общий желчный проток, тем больше его разрез должен приближаться к поперечному и чем уже — к продольному (рис. 77, 78).


Так, при ширине общего желчного протока 2,5 см и больше вскрываем его сразу же после принятия решения о наложении холедоходуоденоанастомоза в поперечном направлении как можно ближе к краю двенадцатиперстной кишки, чтобы оставляемый «слепой мешок» был по возможности меньших размеров. При ширине общего желчного протока 1,5 см вскрываем его продольно с таким расчетом, чтобы нижний конец его находился как можно ближе к краю двенадцатиперстной кишки. При ширине общего желчного протока 1,5—2,5 см разрез его проходит в косом направлении. Перед рассечением общий желчный проток берем по краям предполагаемого разреза на 2 держалки, между которыми и делаем разрез в нужном направлении длиной не менее 15—20 мм. Предварительное наложение задних серо-серозных швов между общим желчным протоком и кишкой не обязательно, так как они деформируют проток и кишку и приводят к уменьшению диаметра анастомоза. При необходимости наложения таких швов используем отдельные тонкие нити и атравматическую иглу. Швы не должны проникать в просвет общего желчного протока. Затем нити коротко срезаем, оставляя длинными только первую и последнюю, которые берем на зажимы. Обе держалки удаляем. Вскрываем двенадцатиперстную кишку всегда в продольном направлении, на расстоянии около 3 мм от линии швов или нижнего угла разреза общего желчного протока. Разрез двенадцатиперстной кишки должен быть немного короче линии швов, иначе отверстие в стенке двенадцатиперстной кишки получится больше, чем требуется. Подслизистые сосуды двенадцатиперстной кишки тщательно перевязываем. Накладываем внутренний задний шов при помощи тонкой кетгутовой или синтетической нити на атравматической игле. Обычно мы накладываем отдельные узловые швы, но если отверстие в общем желчном протоке достаточно широкое, то можно наложить непрерывный шов. Шов должен захватывать все 3 слоя общего желчного протока и двенадцатиперстной кишки. Часто приходится предварительно ножницами срезать выступающую слизистую оболочку кишки, что- бы не получился слишком толстый валик по линии швов. После завязывания всех нитей их срезаем и накладываем передний ряд узловых швов через все слои протока и двенадцатиперстной кишки. Швы накладываем таким образом, чтобы края слизистых оболочек хорошо сопоставлялись и вворачивались внутрь; нити завязываем со стороны просветов. Стежки делаем через каждые 2 мм поочередно то с правого, то с левого угла анастомоза, по направлению к его середине. Остающееся в середине небольшое отверстие закрываем П-образным швом. Завершаем анастомоз передним наружным рядом серо-серозных швов, широко захватывая серозно-мышечные слои двенадцатиперстной кишки и совсем поверхностно прокалывая наружные слои общего желчного протока. Если сохранилась серозная оболочка двенадцатиперстной кишки, то ее тоже захватываем, чтобы перекрыть линию шва. Целесообразно применять однорядный шов из рассасывающегося материала — ветрила или ден-сока. Для разгрузки швов анастомоза накладываем несколько дополнительных швов между гепатодуоденальной связкой и двенадцатиперстной кишкой.
При создании подобных билиодигестивных анастомозов следует всегда учитывать, что диаметр их обычно сокращается на '/з и даже 2/з по сравнению с первоначальным и поэтому он должен быть не менее 15—20 мм. Необходимо владеть всеми методиками наложения анастомоза. Только в этом случае можно избежать повторных операций, связанных со стенозированием наложенного соустья.
Супрадуоденальная холедоходуоденосто-мия по типу «конец в бок». Операции этого типа, как самостоятельные, в настоящее время применяют редко, чаще при полной непроходимости большого сосочка двенадцатиперстной кишки на почве опухоли при выполнении панкреатодуоденальной резекции или при полном пересечении общего желчного протока в супрадуоденальной его части во время выполнения операций на соседних органах. Тем не менее, методики таких операций были предложены в свое время при доброкачественном поражении желчных протоков и знание их при выполнении вмешательств на органах панкреатобилиарной зоны необходимо.
При выполнении операций подобного типа общий желчный проток пересекают над верхним краем двенадцатиперстной кишки и верхний конец его анастомозируют с передней поверхностью двенадцатиперстной кишки посредством простого двуслойного шва. Дистальную культю общего желчного протока следует перевязать, хотя некоторые авторы считают это излишним, потому что там, где требуется применение анастомоза по типу «конец в бок», большой сосочек двенадцатиперстной кишки бывает полностью непроходим.
Существует несколько методик операций по созданию холедоходуоденостомии по типу «конец в бок», среди которых наибольшего внимания заслуживают методики Стерлинга и сосочковая инвагинационная Кохера—Маммана. Мы обычно применяем разработанный нами инвагинационный способ по типу манжета (А. А. Шалимов, 1970). Заключается он в следующем. Проксимальный конец пересеченного общего желчного протока, захваченный пинцетом за край задней стенки, натягивают кпереди и тонкими ножницами отделяют от воротной вены на протяжении не менее 3 см. При этом необходимо сохранять сосуды, питающие общий желчный проток, чтобы не вызвать его ишемии. Если общей желчный проток не расширен или незначительно расширен, его заднюю стенку обычно рассекают в продольном направлении на глубину до 10 мм, что до некоторой степени способствует увеличению диаметра последующего анастомоза. Дистальную культю протока прошивают и перевязывают. Проксимальный конец протока низводят так, чтобы он располагался поперек передней стенки кишки и соединялся с ней путем наложения серо-серозных швов поперек задней стенки протока, а также по его боковым краям. Затем вскрывают двенадцатиперстную кишку в продольном направлении в соответствии с шириной общего желчного протока и на уровне его конца. Накладывают узловые швы через все слои общего желчного протока и двенадцатиперстной кишки узелками внутрь, добиваясь тщательного сопоставления слизистых оболочек. После ушивания задней и передней губ анастомоза проток инвагинируют посредством наложения 3—4 се-розно-мышечных швов на переднюю стенку двенадцатиперстной кишки.
Существенным недостатком анастомозов подобного типа, независимо от методики их создания, является то, что они всегда имеют ширину, равную поперечному сечению общего желчного протока, в то время как анастомоз «бок в бок» можно увеличить до желаемого размера. При анастомозе «конец в бок» чаще наблюдаются случаи холангита, так как происходит значительное сморщивание соустья с последующим вторичным холестазом. Опасность холангита настолько существенная, что некоторые авторы считают оправданным комбинировать холедоходуоденосто-мию по типу «конец в бок» с резекцией желудка по способу Бильрот-П. Однако, по нашему мнению, лучше достичь той же цели посредством холедохоеюностомии. Холедоходуоденостомия при нерасширенном общем желчном протоке особенно рискованна и поэтому многие хирурги считают целесообразным создание анастомоза поверх дренажа. Чаще всего применяют дренаж по Voelc-ker, который выводят через двенадцатиперстную кишку и контрапертуру на брюшной стенке и оставляют в протоке на несколько недель или месяцев. При широком соустье применение такого дренажа является излишним, как и дренирование протока.
Летальность после холедоходуоденостомии составляет, по данным различных авторов, от 3 до 17,7 %, по нашим данным,— 1,4%.
Отдаленные результаты подобных операций в целом удовлетворительные. Однако у ряда больных наблюдаются холангит, панкреатит, стеноз анастомоза. В связи с подобными состояниями нам пришлось у 22 больных снять ранее наложенный холедохо-дуоденоанастомоз и выполнить трансдуоденальную папиллосфинктеротомию, а у 4 дополнить холедоходуоденостомию папилло-сфинктеротомией.
Благодаря эндоскопическим исследованиям двенадцатиперстной кишки у оперированных больных удалось выяснить, что если соустье между общим желчным протоком и двенадцатиперстной кишкой имеет диаметр менее 0,5 см, то, как правило, развивается холангит; бариевая взвесь задерживается в общем желчном протоке при рентгенологическом исследовании желудка и кишечника более 24 ч. Такие больные подлежат повторной операции. Подобные наблюдения описали также Т. П. Макаренко и соавторы (1977), В. В. Радионов и соавторы (1979), М. И. Филимонов и соавторы (1979), И. К. Рабкин и соавторы (1979), другие исследователи.
Мы обследовали в отдаленный период (в сроки от 6 мес до 12 лет) 164 человека. Результаты операции оценены как хорошие у 21% больных, удовлетворительные — у 69%, неудовлетворительные— у 10%. К неудовлетворительным результатам мы отнесли случаи развития стеноза анастомоза (10 больных), рецидивирующего холангита (2 больных) и рецидивирующего панкреатита (5 больных). Повторно оперированы 9 больных: у 5 создан рехоледоходуоденоанастомоз, у 4 выполнена папиллосфинктеро-томия.
Холедохоеюностомия. Некоторые хирурги (А. И. Краковский, Ю. К. Дунаев, 1970) полагают, что лучшим методом лечения доброкачественного стеноза дистального отдела общего желчного протока является не холедоходуоденостомия, а холедохоеюностомия на выключенной петле, как операция, которая меньше всего связана с риском развития восходящего холангита. Однако еще в 1971 г. McArtur и Longmire обнаружили тесную взаимосвязь между пептической язвой и анатомической перестройкой после холедохоеюностомии. Авторы изучили результаты холедо-хоеюностомии по Ру у 97 больных с доброкачественным стенозом желчевыводящих путей. У 10 из них развилась пептическая язва двенадцатиперстной кишки (9 больных) и желудка (1 больной). Кроме того, 10 других больных отмечали боль, которая вызывала подозрение на язвенную болезнь. Диагноз пептической язвы был установлен либо рентгенологически (3 больных), либо при повторной операции (5 больных), либо на аутопсии (2 больных).
Ни один из этих больных не имел язвенной болезни или ее симптомов до операции по поводу желчной гипертензии. У 8 из 10 больных с послеоперационной язвой были кровотечения; 4 из них перенесли повторные операции в связи с язвенной болезнью (1—3), 2 умерли от кровотечения. У 3 больных кровотечение было в ранний послеоперационный период, у 1 — в течение первого года и у 4 — в течение 2—5 лет и более после операции. Авторы, ссылаясь на исследования O'Malley и соавторов (1951), которые также наблюдали 4 больных с язвенным кровотечением после холедохоеюностомии по Ру, предполагают, что отключение щелочной желчи из двенадцатиперстной кишки усиливает предрасположенность к пептическому изъязвлению ее с последующим кровотечением. Возможность послеоперационной язвенной болезни заставила авторов, являющихся приверженцами холедохоеюностомии, рекомендовать у больных с повышенной желудочной секрецией профилактическое применение ваготомии и пилоропластики.
Авторы доказали, что холедохоеюностомия не имеет преимуществ по сравнению с холедоходуоденостомией в плане лечения и профилактики восходящего холангита. В отдаленный период холангит диагностирован у 15 из 97 оперированных ими больных. Мы вынуждены были прибегнуть к холедохоеюностомии у 10 больных с непроходимостью дистального отдела общего желчного протока, что составило 0,4 % по отношению ко всем операциям, выполненным при непроходимости желчных протоков, и 0,6 % по отношению к больным со стенозом большого сосочка двенадцатиперстной кишки.
Показаниями к холедохоеюностомии при первичном лечении нарушений проходимости желчных протоков доброкачественной этиологии являются: 1) расширение общего желчного протока до 20 мм и более, обусловленное холедохоли-тиазом или тубулярным стенозом протока в сочетании с дуоде-ностазом; 2) расширение общего желчного протока более 10 мм, вызванное стенозирующим папиллитом или хроническим панкреатитом, в сочетании с дуоденостазом; 3) невозможность выполнения холедоходуоденостомии из-за рубцово-язвенной деформации двенадцатиперстной кишки или перенесенной резекции желудка по Бильрот-П. В последнем случае холедохоеюностомию сочетают с селективной проксимальной ваготомией.
В связи с тем что холедохоеюностомию чаще применяют при Рубцовых стриктурах желчных протоков, методика ее выполнения описана в соответствующем разделе.
Операции наложения анастомозов желчного пузыря с желудком, двенадцатиперстной или тощей кишкой при доброкачественном стенозе общего желчного протока имеют общий недостаток — происходит инфицирование желчного пузыря. Желчный пузырь
теряет способность сокращаться, наполняется желудочно-кишечным содержимым и, как правило, развивается хронический холецистит с образованием камней и восходящим холангитом (W. Hess, 1965). При наложении билиодигестивных анастомозов, как и после папиллосфинктеротомии, желчный пузырь всегда следует удалять.
Таким образом, при холедохолитиазе и неопухолевых обструкциях дистального отдела общего желчного протока мы применяли холедохолитотомию, которую при наличии стеноза дистального отдела общего желчного протока дополняли оперативными вмешательствами на самом сосочке (папиллосфинктеротомия и папиллосфинктеропластика), а также различные виды шунтирующих операций (холедоходуодено- и холедохоеюностомию). Трансдуоденальную папиллосфинктеропластику выполняли при наличии фиксированных камней в дистальном отделе общего желчного протока и большом сосочке двенадцатиперстной кишки, стенозирующего папиллита, множественных мелких камней в ретродуоденальной и интрапанкреатической частях общего желчного протока, замазкообразной желчи, гноя и супрастенотического расширения протока не более 1,8—2 см. Указанная операция произведена 867 больным, причем 31 из них — в сочетании с вирзунгопластикой. Холецистэктомия одновременно с трансдуоденальной папиллосфинктеропластикой выполнена у 287 больных, у 68 операции предшествовало снятие наложенных ранее билиодигестивных анастомозов.
После папиллосфинктеропластики умерли 17 (1,9%) больных. Причиной смерти были панкреонекроз, свищ двенадцатиперстной кишки, забрюшинная флегмона, отрыв большого сосочка двенадцатиперстной кишки, острая печеночно-почечная недостаточность, пневмония.
В отдаленные сроки после трансдуоденальной папиллосфинктеропластики хороший и удовлетворительный результаты отмечены у 89,2 % больных. Неудовлетворительные результаты лечения были обусловлены восходящим холангитом, неполным рассечением сфинктера большого сосочка двенадцатиперстной кишки, остаточными явлениями панкреатита в результате длительного консервативного лечения стенозирующего папиллита.
При стенозе дистального отдела общего желчного протока протяженностью более 2,5 см и супрастенотической дилатации его более 2 см выполняли супрадуоденальную холедоходуоденосто-мию. Операция произведена 305 больным, умерли 3 (0,95%). хорошие и удовлетворительные отдаленные результаты отмечены у 88,5 % оперированных, однако в течение первых 2 лет после операции 2 больных умерли от множественных абсцессов печени. Холедохоеюностомию выполнили 10 больным с нарушением проходимости дистального отдела общего желчного протока. По-
казаниями к операции были гнойный холангит при недостаточности сфинктера печеночно-поджелудочной ампулы, стеноз дистального отдела общего желчного протока, вызванный язвенной болезнью двенадцатиперстной кишки, дуоденостаз.
Для лечения холедохолитиаза, который является наиболее частой причиной непроходимости печеночно-желчного протока, ранее применяли холедохотомию, которую в зависимости от характера сопутствующих изменений большого сосочка двенадцатиперстной кишки и дистального отдела общего желчного протока завершали наложением глухого шва на общий желчный проток, наружным дренированием его или билиодигестивным анастомозом. Всего произведено 445 подобных операций; летальность составила 3,2 %.
При наличии крупных камней в последние годы мы применяем поэтапную тактику оперативного лечения, основанную на интра-операционной литотрипсии, с помощью аппарата «Байкал-2» или механического устройства с последующим удалением фрагментов камней через дренаж либо путем эндоскопической папиллотомии. При этом через культю пузырного протока или холедохотомический разрез вводили зонд диаметром 3,5—4 мм. Подводили электрод до соприкосновения с камнем. Аппаратом «Байкал-2» создавали ультразвуковой разряд, а при его неэффективности — электрический разряд в жидкой диэлектрической среде, который разрушал камень.
С 1979 г. в клинике широко внедрен метод эндоскопической папиллосфинктеротомии, что коренным образом изменило тактику лечения больных с неопухолевой патологией дистального отдела общего желчного протока. Эндоскопическую папиллосфинк-теротомию мы рассматриваем как альтернативу оперативных вмешательств на большом сосочке двенадцатиперстной кишки, за исключением тех случаев, когда ее выполнить нельзя по техническим причинам. При помощи специально сконструированной петли, являющейся модификацией корзинки Дормиа, удается фрагментировать и извлекать из желчных протоков камни диаметром до 2 см.
К. настоящему времени по поводу стенозирующего папиллита (изолированного или в сочетании с холедохолитиазом, но без гнойного холангита) произведено 1380 эндоскопических папиллосфинктеротомии. Летальность составила 0,2 %. Единственным показанием к супрадуоденальной холедоходуодеиостомии считаем тубулярный или стреловидный стеноз общего желчного протока на протяжении свыше 2,5 см без дуоденостаза и при мобильной двенадцатиперстной кишке. При сопутствующем дуоденостазе хо-ледоходуоденостомия, как и прямое вмешательство на большом сосочке двенадцатиперстной кишки, противопоказана. В этих случаях выполняем холедохоеюностомию. К операционной холедохолитотомии в настоящее время прибегаем только после неудачных попыток произвести эндоскопическую папиллосфинктеротомию или при невозможности фрагментировать и извлечь камни диаметром свыше 2 см.
При лечении больных, у которых холедохолитиаз осложнился гнойным холангитом, стойкой или нарастающей обтурационной желтухой, печеночной недостаточностью, применяем следующую тактику, разработанную в клинике. При неэффективности консервативной терапии через 1—2 сут после госпитализации производим эндоскопическую ретроградную холангиографию и эндоскопическую папиллосфинктеротомию. Забираем желчь для бактериологического контроля, визуально контролируем отхождение камней, замазкообразной желчи и гноя. Через рассеченный большой сосочек двенадцатиперстной кишки крупные и мягкие камни фрагментируем и извлекаем при помощи специально сконструированной петли или корзинки Дормиа. Желчные протоки промываем раствором антисептиков. При резко выраженном гнойном холангите операцию заканчиваем назобилиарным дренированием. Интенсивную терапию, включающую сеансы холесорбции, эндо-холедохеальное и эндолимфатическое введение антибиотиков, продолжаем в течение 2 сут. После нормализации общего состояния больного производим оперативное вмешательство — холецистэкто-мию при наличии камней в желчном пузыре, холедохотомию — если не удается полностью удалить камни.
По поводу холедохолитиаза, осложненного гнойным холангитом и печеночной недостаточностью, произведено 268 эндоскопических папиллосфинктеротомий. Относительно высокая послеоперационная летальность (2,9 %) обусловлена особой тяжестью исходного состояния больных, декомпенсацией функции печени.
Наш опыт показывает, что применение эндоскопической па-пиллотомии позволяет резко ограничить показания к трансдуоденальным оперативным вмешательствам при неопухолевой непроходимости желчевыводящих путей, а также способствует улучшению результатов лечения больных холедохолитиазом, осложненным гнойным холангитом.
Начиная с 1979 г., эндоскопическая папиллосфинктеротомия произведена 1648 больным, трансдуоденальная сфинктеротомия — только 18 больным без летальных исходов. При тубулярном стенозе общего желчного протока за этот период произведено 143 супрадуоденальные холедоходуоденостомии.
Следовательно, наш клинический опыт позволяет утверждать, что способ лечения холедохолитиаза и непроходимости дисталь-ного отдела общего желчного протока следует выбирать с учетом характера обтурации, протяженности стеноза, степени престеноти-ческой дилатации желчных протоков и выраженности холангита.
Внедрение в клиническую практику эндоскопической папиллосфинктеротомии позволяет резко ограничить показания к трансдуоденальным оперативным вмешательствам и существенно улучшить результаты лечения холедохолитиаза, осложненного гнойным холангитом.
Рубцовые стриктуры желчных протоков в 7,2—41,4 % случаев являются причиной повторных вмешательств на желчевыводящих путях (В. Н. Климов и соавт., 1980; И. М. Григоровский, 1980; Franke и соавт., 1981; Inbansi и соавт., 1984).
Мы располагаем опытом лечения рубцовых стриктур желчных протоков у 276 больных, которым выполнено 320 операций, что составляет 0,6 % всех оперативных вмешательств на желчевыводящих путях и 13,3 % операций по поводу непроходимости желчных протоков доброкачественной этиологии. Произведено 79 (24,7%) восстановительных и 241 (75,3%) реконструктивная операция Общая послеоперационная летальность составила 5,4%.
Этиология и патогенез. Наиболее частой причиной развития Рубцовых стриктур желчных протоков является их травматическое повреждение. Главным образом оно возникает после хирургических вмешательств на органах брюшной полости (холецистэктомии, резекции желудка) и крайне редко (у 1 % больных, по данным Г. Н. Цыбуляк, 1985) — при проникающих ранениях или тупой травме живота. В среднем, по данным многих хирургов, на 400—500 холецистэктомий приходится 1 повреждение желчного протока.
По данным нашей клиники, наиболее часто повреждения магистральных желчных протоков, которые впоследствии привели к Рубцовым сужениям, возникали во время холецистэктомий (85,1 %) и составляли при остром холецистите 31,5 %, хроническом — 53,6 %. После операций на желудке (чаще резекции) они развивались у 9,1 % больных, в результате воспалительного процесса и механических воздействий — у 4,3%. Рубцовые стриктуры желчных протоков могут возникать также после холедохото-мии, выполненной без показаний, особенно при диаметре желчного протока не более 10 мм, при неправильно выбранном направлении или слишком большой длине разреза, при разрыве стенки протока в результате грубого нарушения техники интраопераци-онной холангиоскопии и зондирования, а также при попытках насильственного удаления дренажей, фиксированных к стенкам протока нерассасывающимся шовным материалом, склерозировании клетчатки печеночно-дуоденальной связки при просачивании в нее желчи после холецистэктомий.
Среди общих причин интраоперационных повреждений желчных протоков McAllister и соавторы (1976), Burlui и соавторы (1982) О. Ю. Кушниренко и Г. Н. Суетин (1985) выделяют четыре основные: неадекватные условия операции, анатомические
вариации сосудов и протоков, плохо контролируемое кровотечение, невозможность идентификации тканевых структур в результате активного воспалительного процесса. Под условиями операции авторы подразумевают глубину наркоза и мышечную релаксацию, удобный доступ, достаточное освещение, проведение интраопера-ционной холангиографии.
Таким образом, наиболее частой причиной образования Рубцовых стриктур желчных протоков является ятрогенное повреждение их во время различных вмешательств на органах брюшной полости (по нашим данным, 97,4 %, по данным Э. И. Гальперина и соавторов (1982) и Littman (1982),—90— 99 %).
Характер повреждений желчных протоков во время операций на органах брюшной полости может быть различным. Иногда это захват протока в лигатуру при выполнении холецистэктомии (рис. 79, а), пересечение и перевязка протока при ошибочной идентификации элементов печеночно-дуоденальной связки (рис. 79, б).
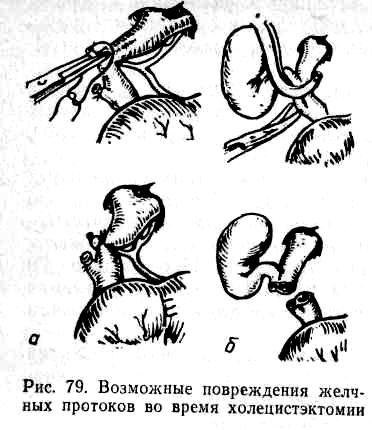
Желчный проток может быть травмирован во время операции на желудке (резекции, гастрэктомии, дренирующих операций после ваготомии). Риск таких осложнений особенно велик при пенетрации язвы в печеночно-дуоденальную связку, инфильтрации связки, низком расположении язвы в двенадцатиперстной кишке, когда ушивание культи производится атипично. При закрытой и открытой травмах живота среди повреждений органов брюшной полости повреждения внепеченочных желчных протоков составляют 2,2 % (Fartmann, Kirchner, 1982).
Под нашим наблюдением находились 4 (1,5%) больных, у которых образование рубцовой стриктуры желчных протоков можно было связать с травматическим повреждением, вызванным закрытой травмой живота. Подобные повреждения желчных протоков встречаются в 0,7—1 % случаев (Г. Н. Цыбуляк, 1985; Д. В. Усов, И. В. Литвиненко, 1985; Cavaliere и соавт., 1987, и др.).
Факторы, определяющие интенсивность и сроки эпителизации и образования соединительнотканного каркаса поврежденных участков стенки протока, еще недостаточно изучены. Экспериментальные исследования, проведенные Э. И. Гальпериным и соавторами (1980), показали, что при пластическом замещении желчных протоков васкуляризированным аутовенозным трансплантатом эндотелий на участке пересадки не образуется даже через 2 года после операции. Эпителизация по линии билиодигестивного анастомоза отмечена только через 1,5—2 года после операции (Э. И. Гальперин, Н. Ф. Кузовлев, 1978). Развитие соединительной ткани на месте повреждения желчного протока происходит путем формирования грубого рубца, резко деформирующего просвет протока.
Считают, что рубцовая стриктура желчных протоков развивается в результате задержки процессов созревания соединительной ткани, а последнее происходит вследствие постоянного действия желчи и инфекции (Э. И. Гальперин и соавт., 1982).
Следствием рубцового сужения желчного протока является нарушение желчеоттока. Именно с этим обстоятельством связывают наступающие в дальнейшем патологические изменения — холан-гит, холелитиаз, печеночную недостаточность. Вопрос о том, какая степень сужения желчных протоков вызывает существенное нарушение оттока желчи, изучен недостаточно. Ясно одно — чем уже проток, тем выраженней признаки холангита, тем быстрее развиваются холелитиаз и билиарный цирроз печени.
Длительность течения заболевания зависит от степени сужения желчных протоков, компенсаторных возможностей организма, а также от проводимого лечения. Нелеченый гнойный холангит уже через 1—3 мес приводит к возникновению множественных холангиогенных абсцессов печени. Сроки формирования билиар-ного цирроза печени колеблются в пределах 1 года — 2 лет, если сужение протоков осложнилось желтухой, а хирургическая коррекция не адекватна или не проводилась вовсе.
Холангит протекает более бурно, если сужение развилось на фоне уже созданного билиодигестивного анастомоза. Причинами этого служат рефлюкс кишечного содержимого в протоке, инфицирование желчи и раздражение слизистой оболочки желчных протоков кишечным соком.
Патологическая анатомия. Рубцовое сужение желчных протоков представлено утолщением и уплотнением стенки протока на ограниченном участке. Обычно идентификация такого участка не вызывает затруднений. Однако иногда, чтобы отличить доброкачественное сужение от злокачественного новообразования, приходится прибегать к гистологическому исследованию.
При изучении стриктур нужно обращать внимание на распространенность суженного участка, его диаметр, а также локализацию его по отношению к различным отделам желчных протоков. При степени сужения протока более 1/3 его диаметра возникают клинические проявления холестаза. Сужение протока на 2/3 его диаметра позволяет еще выполнить более простую пластическую операцию и восстановить проходимость протока. Сужение протока более чем на 2/3 его диаметра уже резко затрудняет выполнение восстановительных операций, а если протяженность поражения достигает 3 см и более, восстановительные операции становятся нерациональными. Поэтому целесообразно различать повреждения и сужения желчных протоков, захватывающие менее1/3 и более 2/3 диаметра.
Гистологические изменения на участке стриктуры характеризуются отсутствием эпителия и гиперплазией соединительной ткани с большим количеством коллагеновых волокон.
Изменения в печени зависят от степени нарушения желчеотто-ка и представлены холангиогенным гепатитом в различных стадиях развития, вплоть до билиарного цирроза печени.
Клиника и диагностика. Первичные повреждения желчных протоков во время операции проявляются обильным желчеистечением в месте травмы, а при полном пересечении становится видным просвет протока. Опытный хирург непременно заметит это осложнение. В тех случаях, когда нарушение целости стенки остается незамеченным или недостаточно тщательно произведено устранение повреждения, развивается перитонит или в послеоперационный период формируется наружный желчный свищ. Если пересеченный проток перевязывают, как, например, культю пузырного протока, в послеоперационный период сразу развивается интенсивная желтуха, которую не следует рассматривать как гепатит.
Повреждение желчных протоков вследствие закрытой травмы или ранения живота характерных клинических проявлений не имеет, а выявляется во время операции, предпринятой по поводу перитонита или в ходе обработки и ревизии раны.
Сформировавшиеся рубцовые стриктуры желчных протоков проявляются желтухой и холангитом. Быстрота появления и интенсивность желтухи прямо пропорциональны степени нарушения желчеоттока. Стриктура, занимающая 1/3 диаметра желчного протока, вызывает желтуху через несколько месяцев, когда присоединяется гнойный холангит, а в застойной желчи образуются хлопья и камни. Одновременно с иктеричностью кожи и склер появляются и другие признаки обтурационной желтухи — темная моча, обесцвеченный кал. Холангит проявляется ознобами с повышением температуры тела до 39—40 °С. В промежутках между приступами температура тела может быть нормальной или субфебрильной.
Непрерывное нарастание желтухи и холангита отмечается только при полной закупорке желчных протоков. В остальных случаях течение болезни приобретает волнообразный характер — периоды обострения чередуются с периодами купирования всех клинических проявлений. Однако благополучие при этом мнимое — холангит продолжает существовать, а поэтому неизбежно возникает рецидив.
Диагностика рубцовых стриктур желчных протоков обычно не вызывает затруднений: операция в прошлом, перемежающаяся желтуха с постепенным переходом в стойкую, ознобы с повышением температуры тела до 39—40 °С, в ряде случаев наличие наружного желчного свища, спонтанное закрытие которого быстро ведет к прогрессированию желтухи. Обязательными являются ретроградная холангиография (рис. 80) и фистулография (рис. 81), позволяющие определить степень поражения желчных протоков и уровень непроходимости.
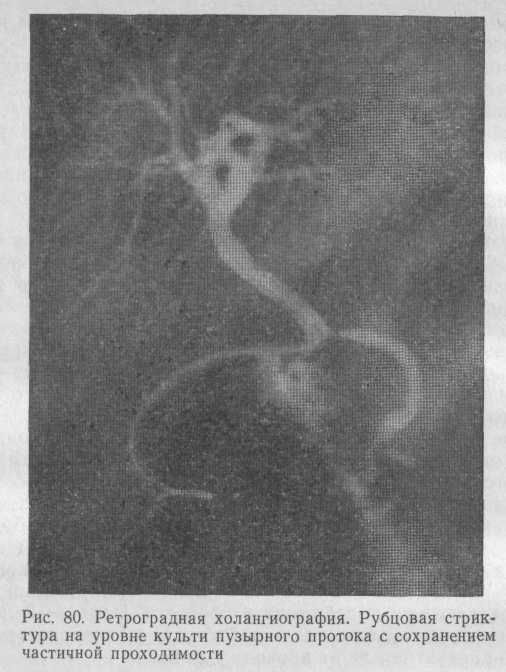
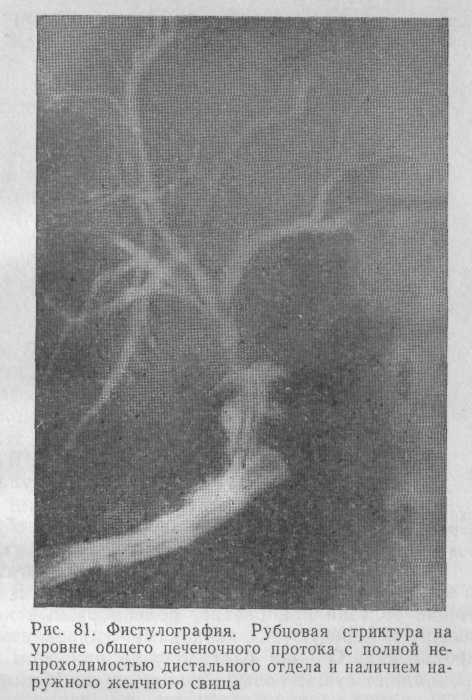
Однако иногда выполнение ретроградной холангиографии невозможно по техническим причинам (резекция желудка по способу Бильрот-П, анатомические особенности расположения большого сосочка двенадцатиперстной кишки или его дряблость в связи с отсутствием функции и др.), не всегда имеется желчный свищ. Во всех этих случаях можно воспользоваться чрескожной чреспеченочной холангиографией (рис. 82).

Перечисленные методы исследования дают лишь одностороннее представление о непроходимости желчных протоков, но не позволяют определить степень поражения протоков рубцовым процессом. Только при одновременном выполнении фистулографии или чрескожной чреспеченочной холангиографии и эндоскопической ретроградной холангиографии, когда контрастируются оба конца желчных протоков, картина рубцового поражения становится более ясной (рис. 83).
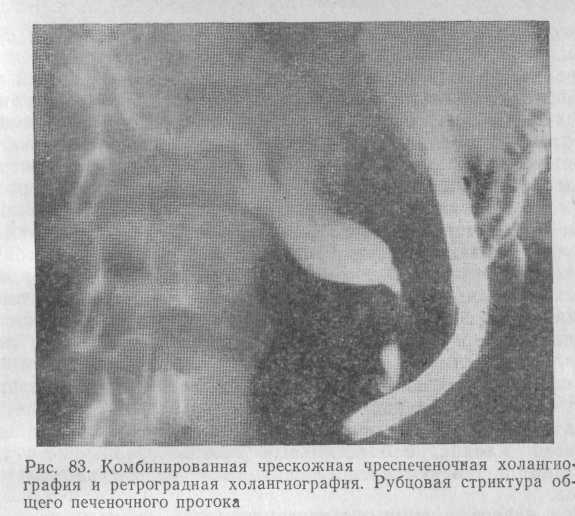
Но, к сожалению, все эти исследования, кроме фистулографии, можно выполнить лишь при наличии определенной аппаратуры и специалистов высокой квалификации, поэтому нередко в дооперационный период ограничиваются лишь клиническим представлением о диагнозе.
Классификация. Из множества предложенных классификаций Рубцовых стриктур желчных протоков наиболее удачна классификация Э. И. Гальперина и соавторов (1982), но излишняя детализация усложняет ее практическое использование.
Мы пользуемся классификацией А. А. Шалимова (1975), в которой рубцовые стриктуры желчных протоков различаются по характеру поражения: низкие, средние, высокие и по характеру оперативного лечения: 1) рубцовые стриктуры, требующие применения восстановительных операций; 2) рубцовые стриктуры, при которых необходимо выполнение реконструктивных операций.
К низким мы относим стриктуры, располагающиеся в супра-дуоденальной части общего желчного протока, к средним — стриктуры, захватывающие область гепатикохоледоха на 0,5—1 см выше края двенадцатиперстной кишки и на 0,5 см ниже места слияния долевых печеночных протоков (зона ворот печени), к высоким— все поражения общего печеночного протока, располагающиеся на расстоянии 0,5 см от места слияния долевых протоков и выше с переходом на последние. Все операции, выполненные на различном уровне поражения желчных протоков, делят на восстановительные и реконструктивные. Под первыми мы подразумеваем пластические операции, направленные на замещение дефектов при пристеночных поражениях, и операции создания прямых билиоби-лиарных анастомозов по типу «конец в конец» после циркулярного иссечения Рубцовых тканей. Эти операции предусматривают восстановление непрерывности протока и нормального оттока желчи в двенадцатиперстную кишку с сохранением запирательного механизма сфинктера печеночно-поджелудочной ампулы. Под вторыми мы подразумеваем операции, предусматривающие создание анастомоза между культей протока и каким-либо отделом пищеварительного канала. Все остальные методы оперативного лечения стриктур являются модификациями одного из этих двух способов.
Такая классификация отвечает принципам хирургической коррекции и последующей реабилитации больных с рубцовыми стриктурами желчных протоков.
Мы специально не выделяем группы больных с желтухой, хо-лангитом, циррозом печени, так как считаем, что у каждого больного с рубцовой стриктурой желчных протоков имеются признаки этих состояний. Это тяжелобольные с высоким риском оперативного вмешательства. Явления печеночной недостаточности, которые часто наблюдаются у таких больных, должны быть по возможности устранены в дооперационный период.
Лечение. Единственным методом лечения Рубцовых стриктур желчных протоков является своевременная и полноценная хирургическая коррекция. Консервативная терапия может проводиться лишь как подготовительный этап к оперативному лечению. Главным образом это относится к больным с явлениями печеночно-по-чечной недостаточности. X. X. Мансуров (1972) выделяет следующие формы ее: А — печеночная недостаточность преимущественно с явлениями экскреторных нарушений (повышение содержания билирубина, холестерина и щелочной фосфатазы в крови); Б — печеночная недостаточность преимущественно с васкулярными нарушениями (портальная гипертензия); В — печеночная недостаточность преимущественно с нарушениями на уровне гепатоцитов (изменение белковосинтезирующей функции печени, геморрагический диатез, коматозное состояние); Г — смешанные проявления недостаточности печени (А + Б, А + В, Б + В).
Больных с явлениями печеночной недостаточности переводят на диету, которая включает 20 % белков, 75 % углеводов и 5 % жиров и содержит 8374—12 560 кДж в сутки. Для восполнения запасов гликогена в печени ежедневно внутривенно вводят до 100 г глюкозы с соответствующим количеством инсулина (1 ЕД на 4 г глюкозы). Своевременное восполнение запасов гликогена уменьшает интоксикацию, повышает устойчивость печени к операционной травме, гипоксии, ацидозу. При наличии асцита прием натрия хлорида ограничивают до 0,5 г в сутки, так как вследствие гиперальдосте-ронизма происходит повышенная реабсорбция натрия в дисталь-ных канальцах почек.
Наиболее часто печеночная недостаточность сопровождается гипоксией смешанного типа, включающей элементы гипоксической, циркуляторной, гемической и гистотоксической гипоксии. Соответственно этому применяют патогенетически обоснованные меры лечения.
Для устранения гипоксической гипоксии производят коррекцию гипопротеинемии, вследствие чего уменьшается интерстициальный отек и улучшаются условия для альвеолярно-капиллярной диффузии.
По данным реогепатографии, полученным в нашей клинике (А. Е. Дубицкий, 1986), быстро развивающаяся обтурационная желтуха сопровождается уменьшением притока крови к печени, а длительно нарастающая — одновременно и ухудшением оттока. Повышение тонуса средних и мелких сосудов печени, снижение скорости их кровенаполнения прямо пропорциональны длительности холестаза. Все это свидетельствует о резком ухудшении кровообращения в печени.
Циркуляторная гипоксия корригируется назначением препаратов, улучшающих микроциркуляцию печеночной ткани,— эуфил-лина, но-шпы, питуитрина, компламина, пентоксифиллина, гепарина, декстранов в общепринятых дозах.
Гемическая гипоксия у больных с Рубцовыми стриктурами желчных протоков обычно мало выражена в предоперационный период, однако значение ее резко возрастает во время операции и непосредственно после нее. В профилактике и лечении гемической гипоксии решающее значение имеет своевременное и адекватное восполнение кровопотери. Считаем недопустимым снижение гемоглобина менее 80 г/л при гематокритном числе не менее 35.
Наиболее эффективным методом удаления гистотоксических соединений является гемосорбция. Однако она связана с риском развития сепсиса при наличии в организме недренированных гнойных очагов, которыми могут являться абсцессы при гнойном холангите. Поэтому в качестве предоперационной подготовки гемо-сорбцию следует проводить только у тяжелобольных, когда другие лечебные мероприятия не эффективны.
Обтурационная желтуха также вызывает увеличение продукции и выделения лимфы печенью. Поэтому временное дренирование грудного протока и лимфосорбция патогенетически обоснованы как до операции, так и после нее. Максимальный лечебный эффект этих методов отмечается через 1—2 сут, и именно в этот период производят основную операцию.
Форсированный диурез — назначение мочегонных средств после водной нагрузки — также способствует выведению токсических продуктов метаболизма. Во время форсированного диуреза необходима коррекция уровня калия в крови. Последнее особенно важно, так как желтуха сопровождается гипокалиемией.
Для коррекции окислительно-восстановительных процессов в печени назначают внутривенно аскорбиновую кислоту до 800 мг в сутки, цианокобаламин — до 500 мг в сутки, кальция пангамат — до 400 мг в сутки, кокарбоксилазу — до 150 мг в сутки. Для коррекции дефицита янтарной кислоты — одного из продуктов межуточного обмена — назначают натрия сукцинат по 50—-100 мг/кг в сутки.
Повышению дезинтоксикационной функции печени способствует введение глутаминовой кислоты до 3 г в сутки. Последняя принимает участие в обезвреживании аммиака, способствует синтезу ацетилхолина и переносу ионов калия через клеточные мембраны.
Для предотвращения жировой инфильтрации печени назначают метионин по 0,5—1 г внутрь 3 раза в сутки, липокаин по 0,5 г 3 раза в сутки.
Нормализации синтеза фосфолипидов в печени способствует эссенциале, вызывающий регенерацию липидных комплексов митохондрий. Непосредственно перед введением разводят 10 мл препарата в 250—500 мл 5 % раствора глюкозы или фруктозы либо аутокровью 1 : 1 и вводят внутривенно в дозе 2000 мг со скоростью 40—50 капель в 1 мин. В сутки делают 2—3 такие инфузии.
Обязательным компонентом предоперационной подготовки является викасол (до 30 мг в сутки) как источник витамина К, необходимого для синтеза протромбина.
При наличии цирроза печени показано применение гормонов (40—80 мг преднизолона в сутки).
Улучшение кислородного кровоснабжения печени вызывает гипербарическая оксигенация при давлении 1,8—2 атм с продолжительностью сеансов 50—90 мин.
Особенности анестезиологического обеспечения операции состоят в том, что из числа препаратов, используемых для преме-дикации, исключают производные фенотиазина, для вводного наркоза применяют виадрил 500—1000 мг или натрия оксибутират по 50—100 мг/кг массы тела и седуксен по 10—20 мг. В качестве основного анестезирующего средства используют натрия оксибутират в сочетании с закисью азота или дроперидолом (0,2 мг/кг) и фентанилом (0,008 мг/кг).
Хирургическое лечение. Повреждения желчных протоков во время операции подлежат немедленной коррекции, если не развился перитонит. В противном случае производят наружное дренирование желчных протоков, а основное вмешательство выполняют через 6—8 нед после ликвидации перитонита и формирования наружного желчного свища.
Все сформированные стриктуры желчных протоков независимо от степени сужения, сопровождающиеся холангитом и желтухой, даже перемежающейся, подлежат хирургическому лечению. Чем раньше оно будет выполнено, тем благоприятнее исход. Операцию производят обычно незамедлительно после предоперационной подготовки и выполнения специальных диагностических методов исследования.
Противопоказаний к хирургическому лечению рубцовых стриктур желчных протоков нет. Однако в зависимости от тяжести состояния больного операция может быть паллиативной или радикальной.
Паллиативные операции у больных со стриктурами желчных протоков выполняют для создания временного наружного дренирования желчных протоков. Спустя 1—2 мес после устранения явлений холестаза и печеночно-почечной недостаточности производят радикальную операцию.
Радикальные операции предусматривают одномоментное устранение патологии и создание оттока желчи в кишечник путем восстановительных или реконструктивных вмешательств.
Операционный доступ. При операциях, связанных с повреждением желчных протоков, производят широкую лапаро-томию для ревизии органов брюшной полости в связи с травмой. Если повреждение желчных протоков наступило во время операции, специального доступа не требуется. При операциях по поводу сформированных стриктур желчных протоков мы предпочитаем пользоваться тем доступом, который был применен во время первой операции.
Оперативные вмешательства у больных с Рубцовыми стриктурами желчных протоков требуют высокой техники и большой осторожности уже при вскрытии брюшной полости.
Длительно существующее нарушение проходимости желчных протоков, особенно у больных, перенесших неоднократные операции, наряду с развитием мощных рубцов, приводит к значительным нарушениям свертывающей системы крови. Разделение сращений вызывает значительную кровопотерю уже в начале операции. Такая кровопотеря особенно опасна у больных с желтухой, так как переливание крови у них связано с определенной опасностью. Поэтому следует постоянно тщательно перевязывать и коагулировать все кровоточащие сосуды.
После вскрытия брюшной полости отыскиваем и выделяем из сращений правый нижний край печени. Затем, разделяя сращения, постепенно освобождаем всю нижнюю поверхность печени. Определяем место нахождения печеночной артерии и ее разветвлений, расположение воротной вены. Освобождаем печеночно-дуоденальную связку и приступаем к идентификации желчных протоков. Ориентиром могут быть культя пузырного протока, остатки шовного материала, подтекание желчи при случайном ранении желчного протока или через свищевое отверстие после иссечения свищевого хода. Через образовавшееся отверстие с помощью металлических зондов легче продолжать выделение и ревизию желчных протоков из зоны рубцового сужения. В сомнительных случаях прибегаем к операционной холангиографии. Однако почти у половины больных со стриктурами желчных протоков поиски последних представляют огромные. трудности и занимают много времени. Часто приходится прибегать к нежелательным пункциям тканей печеночно-дуоденальной связки, которые повторяют, пока не будет получена желчь. После этого выполняем холангиографию, по игле производим ограниченное вскрытие протока, содержащего желчь, затем по зонду, введенному в просвет протока, выделяем остальную часть протока и отыскиваем его рубцово суженную часть. При рубцовом сужении в области слияния долевых желчных протоков в зоне ворот печени для идентификации протоков приходится рассекать паренхиму печени на глубину 0,5—1,5 см. Иногда найти желчные протоки из-за мощных сращений вообще не удается. В этих случаях необходимо произвести холангиографию, пунктируя желчный проток через паренхиму печени или выделив его в области III сегмента печени. План дальнейшего вмешательства составляют после изучения полученных холангиограмм.
После выделения хотя бы небольшого участка желчных протоков дальнейшую идентификацию проводят по имеющемуся ориентиру и металлическому зонду, введенному внутрь протока. Для решения оперативно-тактической задачи необходимо иметь полное представление о протяженности стриктуры, степени циркулярного поражения, состоянии проксимального и дистального отрезков желчных протоков. Если состояние проксимального отдела можно изучить путем зондирования или холангиографии, то представление о дистальном отделе можно получить только после визуального исследования, выделив его из окружающих тканей, что представляет значительные трудности и требует хорошего знания анатомии и опыта выполнения подобных операций, так как этот отдел желчного протока не содержит желчи, он спавшийся и мало чем отличается от окружающих его Рубцовых тканей. В целях более быстрого выявления дистального отдела некоторые хирурги рекомендуют производить вскрытие просвета двенадцатиперстной кишки и ретроградное введение катетера в желчный проток (Dragstedt, Woodward, 1952). Однако такая методика не оправдывает себя, так как если концы желчных протоков выше и ниже стриктуры не удается четко идентифицировать простой диссек-цией элементов печеночно-дуоденальной связки, то использовать нижележащий участок протока для восстановления оттока желчи естественным путем практически не удается из-за значительной протяженности стриктуры. Кроме того, вскрытие двенадцатиперстной кишки и катетеризация большого сосочка ее — достаточно травматичные манипуляции и их не следует выполнять только в диагностических целях.
Изложим общие принципы, лежащие в основе выполнения восстановительных и реконструктивных операций. Наиболее важным является принцип соединения тканей при создании анастомозов любого типа. Идеальным является бесшовный анастомоз, однако создать его нам удалось лишь при выполнении реконструктивных операций и наличии определенных условий. В остальных случаях анастомозирование производили шовным способом, так как клеевые методики еще не нашли достаточного применения в хирургии желчевыводящих путей. Шовный способ предусматривает использование достаточно тонких (3/0, 4/0) нитей из рассасывающихся материалов на атравматической игле. Соединять ткани следует без всякого натяжения, тщательно сопоставляя их края. Все анастомозы с узкими протоками (диаметром 0,6 см и меньше) создают на каркасно-дренажной трубке, один конец которой выводят через ткань печени, другой — через прокол протока или кишки в зависимости от способа операции (возможны и другие варианты). Шов тканей должен быть узловым. Все каркасно-дренажные трубки должны быть управляемыми. Необходимо стремиться к периодическому расширению созданных анастомозов в целях профилактики рецидива заболевания. Доступ к созданному анастомозу должен сохраняться до окончания лечения. Для этого в канале, идущем к анастомозу, оставляют управляемую трубку меньшего диаметра, чем дренажная трубка, но достаточного для того, чтобы сохранился канал, позволяющий провести дилататор.
Успех операции во многом зависит еще и от того, какая часть проксимального отдела желчных протоков пригодна для анасто-мозирования. Чем короче этот участок, тем труднее выполнить операцию и тем хуже прогноз. Если культя протока лежит глубоко в зоне ворот печени или в ее паренхиме, то операция оказывается в высшей степени трудной, анастомоз малонадежным, процент рецидивов и летальность высокими, а процент полного выздоровления крайне низким. Если же культя протока находится вне зоны ворот печени, то выполнить операцию гораздо легче, а прогноз более благоприятный.
Наиболее физиологичным методом хирургического лечения больных с рубцовыми стриктурами желчных протоков является создание билио-билиарных анастомозов, то есть выполнение восстановительных операций, что, к сожалению, не всегда бывает возможным. Тем не менее каждый хирург должен стремиться использовать все возможности, чтобы восстановить естественный желчеток. Преимущества этого метода очевидны: при этом сшивают однородные ткани, восстанавливаются физиологические условия для оттока желчи, воссоздается вся нормальная система защиты вне- и внутрипеченочных желчных протоков от рефлюкса в них пищи и проникновения микроорганизмов из кишечника. Однако такие операции возможны только при ограниченных стриктурах печеночно-желчного протока. Критерием является величина дефекта желчного протока после иссечения рубцовой стриктуры. По данным нашей клиники, для успешного выполнения этих операций дефект не должен превышать 25—30 мм. При выполнении этих операций необходима также полная уверенность в достаточной проходимости большого сосочка двенадцатиперстной кишки. В сомнительных случаях, но при наличии хороших условий для восстановительной операции, оправданным является одновременное выполнение трансдуоденальной или эндоскопической папил-лосфинктеротомии.
Если дефект печеночно-желчного протока превышает 30 мм, то возникает серьезная опасность создания анастомоза с большим натяжением тканей, что является недопустимым, так как возникает угроза расхождения швов, подтекания желчи и рецидива заболевания. В этих случаях или когда дистальный отдел желчных протоков вовсе не удается обнаружить, применяют реконструктивные операции.
Следует также подчеркнуть, что при наложении анастомоза необходимо сшивать здоровые ткани, а значит, величина дефекта должна быть определена после иссечения рубцовых тканей, так как первое зрительное впечатление о протяженности стриктуры до ее иссечения, как правило, бывает неправильным.
В последние годы появился еще один способ лечения всех видов рубцовых стриктур желчных протоков, который применяют независимо от их локализации, протяженности и даже состояния больного. Имеется в виду чрескожная чреспеченочная дилатация суженных участков желчных протоков, обусловленных либо рубцовой стриктурой, либо возникшим сужением ранее созданного анастомоза в результате восстановительной или реконструктивной операции. Возможности этого метода наглядно демонстрируют рентгенограммы, представленные на рис. 83 и 84.

Таким образом, хирургическое лечение больных с рубцовыми стриктурами желчных протоков объединяет в себе закрытый способ — чрескожную чреспеченочную дилатацию и открытый, включающий восстановительные и реконструктивные операции.
Чрескожная чреспеченочная дилатация. Впервые операцию выполнили при рубцовых стриктурах желчных протоков Molnar и Stockum в 1978 г.
Мы выполнили эту операцию у 4 (1,5 %) женщин в возрасте от 29 до 75 лет. У всех больных причиной стриктуры желчных протоков были технические ошибки, допущенные во время холецистэктомии. Трем больным дважды выполняли реконструктивные операции с формированием гепатикоеюноанасто-моза. Все больные поступили в клинику института с механической желтухой и хроническим рецидивирующим холангитом. Продолжительность основного заболевания составляла в среднем 3,5 года. После общеклинических и лабораторных исследований всем больным выполнена чрескожная чреспеченочная холангиостомия с последующей дилатацией.
Операцию производили в рентгеноперационной под контролем рентгенотелевизионной установки. За 20 мин до исследования назначали промедол — 2 мл 2 % раствора, атропина сульфат — 0,5 мл 0,1 % раствора, димедрол — 1 мл 1 % раствора, реланиум или седуксен — 2 мл. Под местной анастезией 0,25 % раствором новокаина с добавлением 0,1 % раствора адреналина гидрохлорида через восьмое межреберье по средней подмышечной линии справа иглой Chiba выполняли чрескожную чреспеченочную хо-лангиографию. Для уменьшения повреждающего действия контрастного вещества на стенки протоков для контрастирования применяли разбавленный в 2 раза 76 % раствор верографина. После определения уровня непроходимости и ширины внутрипеченочных
протоков производили чрескожную чреспеченочную холангиостомию. Если при выполнении холангиографии были пунктированы протоки первого или второго порядка и игла по отношению к ним образовывала тупой угол, в нее вводили металлический проводник диаметром 0,45 мм, а иглу извлекали. На проводник насаживали иглу с пункционным катетером диаметром 1,5 мм и вращательными движениями продвигали через ткань печени до введения катетера в проток. После извлечения иглы и проводника под давлением поступала желчь, которую брали для бактериологического исследования. В катетер вводили проводник диаметром 0,8 мм с мягким изогнутым концом, который продвигали к месту обтурации вместе с пункционным катетером. Заменив узкий проводник более широким (с диаметром 0,95 мм), проходили через суженную часть стриктуры. Пункционный катетер извлекали, канал в печени и отверстие в стенке протока расширяли тефлоно-вым дилататором. По проводнику вводили дренирующий катетер диаметром 2,1 мм с множественными боковыми отверстиями в дистальном отделе и с загнутым в виде кольца концом. Катетер устанавливали таким образом, чтобы отверстия находились выше и ниже стриктуры, положение их контролировали введением контрастного вещества. Катетер фиксировали к коже специальным фиксатором. В случае, когда холангиография была выполнена через проток третьего или даже четвертого порядка либо положение иглы по отношению к долевым протокам не позволяло направить проводник к области стриктуры, иглой Chiba контрасти-рованные протоки пунктировали повторно в необходимом направлении. На 2-е — 3-й сутки под местной анастезией заменяли катетер диаметром 2,1 мм на дренирующий катетер диаметром 3,5 мм. В целях ликвидации симптомов холангита и снижения билирубинемии всем больным в течение 7 сут проводили наружное дренирование желчных протоков. Параллельно назначали противовоспалительную терапию, включающую антибиотики с учетом чувствительности к ним высеянной микрофлоры (карбенициллина динатриевая соль, цефатриксил, диоксидин, полимиксина М сульфат, гентамицина сульфат, фурагин). Впоследствии отверстие дренажа закрывали. Пассаж желчи осуществлялся только в кишечник. После улучшения состояния больных и основных функциональных показателей печени, снижения лейкоцитоза производили чрескожную чреспеченочную дилатацию стриктуры — 3 сеанса с интервалом 5 сут. Дилатацию также выполняли в рентгенопе-рационной после премедикации. Для дилатации применяли катетер Gruntrig с длиной баллона 30 мм и диаметром 10 мм. Катетер вводили по проводнику и устанавливали его таким образом, чтобы область стриктуры располагалась в средней части баллона. Через манометр катетер соединяли со шприцем емкостью 10 мл и вводили разбавленное контрастное вещество в баллон, создавая в нем давление 6 атм, которое удерживалось в течение 1—3 мин. При первом раздувании баллона стриктура деформировала его стенку, при двух последующих отмечалось полное расправление баллона. Во время первого сеанса дилатации почти все больные жаловались на сильную тупую боль, которую снимали внутривенным наркозом. Последующие 2 сеанса дилатации были менее болезненны, больным вводили внутривенно аналгетики и седатив-ные средства. После сеанса дилатации катетер Gruntrig заменяли дренирующим катетером диаметром 3 мм и вводили рентгеноконт-растное вещество для контроля эффективности расширения стриктуры. В течение всего периода дренирования состояние больных было удовлетворительным.
Из 3 больных с Рубцовым сужением гепатикоеюноанастомоза у 2 описанная методика была эффективна. Диаметр анастомоза увеличился в среднем до 6 мм. У этих больных были оставлены тонкие дренажи без отверстий для последующего контроля ширины анастомоза и профилактики возможного повторного сужения. Холангиография, выполненная через 7 мес, свидетельствовала о сохранении размеров анастомоза. У третьей больной ширина анастомоза после дилатации составляла 5 мм, однако во время сеансов дилатации баллон ни разу не удалось полностью расправить. Больная отказалась от дренажа и дальнейшего лечения. Через 4 мес у нее возобновились симптомы холангита, а спустя 6 мес появилась перемежающаяся желтуха. Ретроспективно оценивая это наблюдение, следует отметить, что в подобных случаях показано электрорассечение стриктуры с последующей дилатацией.
У 1 больной с рубцовой стриктурой печеночно-желудочного протока, возникшей после пластики общего желчного протока, дилатация оказалась наиболее эффективной. Уже во время второго сеанса баллон расправился полностью. Оставлен дренаж диаметром 3 мм, который был удален через 2,5 мес. При контрольном исследовании ширина печеночно-желчного протока в области стриктуры составляла 6 мм. Спустя 1,5 года состояние больной удовлетворительное, жалоб не предъявляет.
Анализируя полученные результаты, мы пришли к выводу, что чрескожная чреспеченочная дилатация является безопасным и надежным методом лечения различных видов Рубцовых стриктур желчных протоков и с него необходимо начинать хирургическую коррекцию этой патологии. Применение чрескожной чреспеченоч-ной дилатации при первичных стриктурах желчных протоков наиболее эффективно. При ригидных стриктурах гепатикоеюноанастомоза целесообразно комбинировать дилатацию с электрорассечением. При сомнительных результатах чрескожной чреспеченоч-ной дилатации показан транспеченочный дренаж. В тех случаях, когда удается выполнить лишь канюлирование внутрипеченочных
желчных протоков (полное заращение), операцию заканчивают наружным дренированием и она является подготовительным этапом для оперативного лечения после уменьшения билирубинемии и явлений холангита.
Несмотря на перспективность описанного метода лечения, выполнить его можно лишь в условиях специализированного отделения при наличии рентгенотелевизионных аппаратов, соответствующего инструментария и определенном навыке. В обычных условиях можно рассчитывать только на выполнение чрескожной чрес-печеночной холангиографии.
Восстановительные операции. К ним относятся: 1) пластическая операция типа Гейнеке—Микулича, 2) билио-билиарные анастомозы, 3) пластическое закрытие дефектов печеночно-желчного протока с использованием аутоткани, 4) бужирование. Нами выполнено 79 (23,5 %) подобных операций у 65 больных (табл. 14).
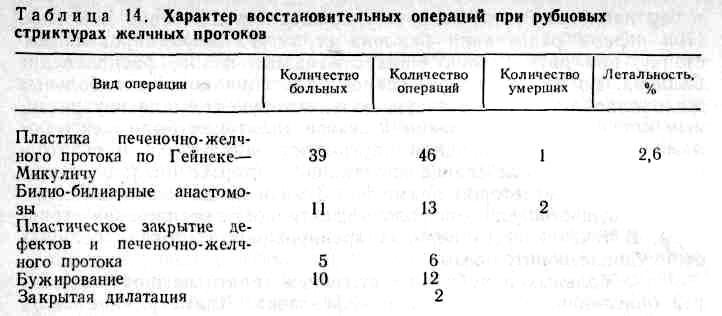
Пластика печеночно-желчного протока по Гейнеке — Микуличу — наиболее распространенная операция при выполнении восстановительных вмешательств. По нашим данным, она составляет 58,2 %. Операция может быть выполнена на любом уровне печеночно-желчного протока, если циркулярное поражение рубцовым процессом охватывает не более 2/з его диаметра, а протяженность стриктуры составляет не более 10 мм (рис. 85).

Обычно такие стриктуры возникают вследствие захвата части стенки желчного протока в лигатуру при перевязке культи пузырного протока во время холецистэктомии или при грубых манипуляциях во время прошивания или перевязки пузырной артерии. Образующиеся пристеночные рубцовые стриктуры располагаются главным образом на уровне культи пузырного протока (95%), реже в области общего печеночного протока и выше, вплоть до места слияния долевых печеночных протоков и даже в области одного из них, чаще правого (5 %).
Техника операции заключается в следующем. После выделения желчных протоков на уровне стриктуры и на 4—5 мм выше и ниже нее на переднюю стенку протока посередине участка сужения накладывают 2 нити-держалки. Подтягивая их вверх, скальпелем рассекают переднюю стенку протока на всем протяжении стриктуры с таким расчетом, чтобы полностью иссечь рубцовую ткань (рис. 86, а), либо выкраивают треугольный лоскут за счет расширенной части желчного протока (рис. 86, б). Удаляют камни и замазкообразную желчь из проксимальных отделов желчных протоков. С помощью холангиографии и зондирования эластическим катетером проверяют проходимость дистального отдела общего желчного протока. От такой проверки можно отказаться только в том случае, если до операции выполнена эндоскопическая ретроградная холангиография и сомнений в свободной проходимости протока нет. В противном случае необходимо четко установить характер патологии и устранить ее сразу во время операции путем трансдуоденальной папиллосфинктеротомии или после операции путем эндоскопической папиллосфинктеротомии. Растягивая держалки в противоположные стороны, превращают продольный разрез протока в поперечный. Затем решается вопрос о необходимости каркасного дренирования. Как показал опыт, лишь в редких случаях можно обойтись без него, хотя операция без дренажа является идеальным вариантом. Мы не применили каркасное дренирование у 19,6 % больных (рис. 86, в, г), у которых циркулярное поражение занимало менее 1/3 диаметра протока, а сам диаметр протока был не менее 10 мм. Нами использованы различные виды каркасного дренирования при восстановительных операциях (рис. 86, д, е, ж, з, и). Наименее травматичным для печени и желчных протоков оказался нисходящий дренаж. Введение такого дренажа не представляет сложностей. Металлический зонд вводят в просвет дистального отдела общего желчного протока со стороны вскрытой его части и выпячивают им латеральную стенку протока над местом вхождения его в ткань поджелудочной железы. В этом месте проток рассекают скальпелем на протяжении 2—3 мм и дренаж ретроградно втягивают в проток. После установления дренажа в нужном положении отверстие в ретродуоденальной части общего желчного протока герметизируют вокруг дренажа кисетным швом за счет окружающих тканей и частично стенки протока прочной нерассасы-вающейся нитью. Ею же фиксируют и сам дренаж для предотвращения его смещения во время операции. Нисходящее дренирование мы применили у 26 (56,5 %) больных. Следует отметить, что этот вид дренирования является и самым неуправляемым. Дренаж часто смещается, преждевременно выскальзывает из желчного протока, а придать ему прежнее положение практически невозможно, что в большинстве случаев приводит к рецидиву заболевания. Чтобы превратить этот дренаж в управляемый, мы стали фиксировать его проксимальный конец нитью (см. рис. 86, ж), проведенной через прокол левого печеночного протока на переднюю брошную стенку и фиксированную к коже специальным фиксатором. Для большей атравматичности нить перед ее выведением из протока проводят через тонкую хлорвиниловую трубочку. Образующееся гладкое покрытие предотвращает прорезывание нити через ткани в процессе длительного лечения. Такой дренаж можно оставлять в нужном положении длительное время и при необходимости заменять другим. Диаметр каркасного дренажа подбирают во время операции. Он должен соответствовать диаметру дистального отдела общего желчного протока (обычно 5— 7 мм). Больший диаметр трубки не позволяет провести ее через дистальный, всегда суженный отдел общего желчного протока, резко деформирует проток и требует создания большего отверстия в ретродуоденальной части протока для проведения трубки.
Учитывая то обстоятельство, что установить на уровне пластики протока трубку диаметром, который полностью соответствовал бы диаметру протока, практически невозможно при использовании обычных трубчатых дренажей (каркасный дренаж, к сожалению, всегда имеет диаметр меньше желаемого), мы применили дренаж с раздувным баллоном. Баллон устанавливают на уровне пластики протока, диаметр же самого дренажа уже не имеет существенного значения и может быть меньше обычного — 3— 4 мм (см. рис. 86, з). Устанавливают баллон при помощи фиксирующей нити на таком уровне, чтобы середина его находилась напротив шовного соединения стенок протока. После ушивания отверстия в протоке баллон заполняют контрастным веществом без особого давления, но так, чтобы стенки его плотно прилегали к стенкам протока. Отток желчи осуществляется через отверстия в дренажной трубке выше и ниже баллона. Таким образом, сразу после пластики протока на ее уровне устанавливают каркас нужного диаметра и формирующийся анастомоз достигает максимальной ширины. Кроме того, при использовании баллона появляется возможность постоянной дилатации анастомоза в процессе его формирования. Дилатацию осуществляет сам больной через 8— 10 сут после операции путем периодического отсасывания из баллона и нагнетания в него жидкости до появления болезненного ощущения. Дилатацию производят 2 раза в день в течение 3 мес. Затем дренаж после рентгенологического контроля удаляют. Дренаж такого типа при пластике печеночно-желчного протока по Гейнеке—Микуличу мы использовали у 3 (6,6 %) больных. Это позволило значительно сократить сроки дренирования (с 12—18 мес при обычных дренажах до 3—6 мес с применением дилатации).
Несмотря на положительные свойства нисходящего каркасного дренирования, применение его ограничено теми случаями, когда пластика протока выполняется в нижней, средней и частично в верхней частях печеночно-желчного протока, где проксимальный конец дренажа можно зафиксировать выше уровня пластики протока. К сожалению, чем выше линия швов, тем труднее установить нисходящий дренаж и тем меньше эффективность его каркасной функции. В этих случаях приходится прибегать к транспеченочному проведению каркасных дренажей. Часто хирурги, и мы в том числе, применяют дренирование по Smith (17,4 % — см. рис. 86, е). Этот вид дренирования предусматривает более устойчивое положение каркасного дренажа, хотя он и является полууправляемым. Остается опасность его смещения и выскальзывания, а смена его всегда сопряжена с риском невозможности поставить новый дренаж на прежнее место. Для устранения этих недостатков мы фиксируем его дистальный конец ниткой-держалкой, которую выводим на кожу боковой поверхности брюшной стенки через прокол в ретродуоденальной части общего желчного протока. При наличии стриктур, располагающихся в месте слияния долевых печеночных протоков или в области одного из них, в случае выполнения пластики по Гейнеке—Микуличу для большей надежности приходится применять дренирование по Saypol (6,5 % — см. рис. 86, д), когда один конец дренажа выводят транспеченочно, а другой — через разрез ретродуоденальной части общего желчного протока. Такое дренирование рассчитано на длительное время (2 года и более). Дренаж полностью управляем и легко подлежит замене, которую производят каждые 6 мес в связи с инкрустацией его желчными солями и одеревенением. Трубку для транспеченочного дренирования подбирают во время операции. Обычно она имеет диаметр 5 мм. Во всех каркасных дренажах делают боковые отверстия, обеспечивающие хорошую циркуляцию оттекаемой по печени желчи.
Стремление создать более надежный и стойкий каркас при выполнении восстановительных операций, сократить сроки лечения до минимальных (10—15 дней), исключить инвалидизацию больных (больные с каркасными дренажами обычно являются инвалидами II группы) заставило нас искать новые пути решения этой задачи. Нами изобретен сетчатый трубкообразный каркас из танталовой проволоки толщиной 0,1 мм (см. рис. 86, и). Каркас подбирают на операции по диаметру протоков и устанавливают на уровне пластики. Временно (на 6—8 сут) в желчный проток вводят тонкую трубочку для рентгеновского контроля. Такой каркас при восстановительной операции применен нами у 1 больной с хорошим результатом в течение 8 лет.

После решения вопроса о способе дренирования или введения каркаса края протока по периметру иссеченной ткани сшивают в поперечном направлении узловыми швами из тончайшего (3/0, 5/0) рассасывающегося материала (хромированного кетгута, дек-сона и др.) на атравматической игле. При отсутствии нитей из рассасывающихся материалов можно использовать синтетическую нить типа синтофила и др. Обязательным является тщательное сопоставление краев протока. Если позволяет толщина стенок протока, не следует прокалывать слизистую оболочку. Применяют П-образный шов с выворачиванием краев по типу сосудистого шва при сшивании «конец в конец», но для этого нужен дополнительный участок стенки протока. Операцию заканчивают подведением к месту пластики протока в подпеченочное пространство перчаточно-трубчатого дренажа.
Пластику желчного протока по Гейнеке—Микуличу производят также при свежей травме, когда повреждение не превышает 2/3 диаметра его. На противоположные края дефекта накладывают держалки и, растягивая их, превращают участок повреждения в линию, расположенную поперек оси протока. Устанавливают дренаж и сшивают края протока, как это описано выше. Подпеченочное пространство дренируют перчаточно-трубчатым дренажем.
Билио-билиарные анастомозы по типу «конец в конец» представляют собой второй вид наиболее распространенных восстановительных операций при рубцовых стриктурах желчных протоков и составляют, по нашим данным, 16,5 %.
Показаниями к созданию билио-билиарных анастомозов являются рубцовые стриктуры желчных протоков, поражающие более 2/з окружности, то есть стриктуры, не подлежащие операциям типа Гейнеке—Микулича. Протяженность стриктуры определяет принципиальный характер вмешательства. Лучше ориентироваться по расстоянию между проксимальным и дистальным концами после иссечения рубца в пределах здоровых тканей. Обычно при диастазе более 30 мм создание билио-билиарного анастомоза, даже несмотря на мобилизацию двенадцатиперстной кишки по Ко-херу, невозможно без натяжения по линии швов, что создает угрозу недостаточности соустья и впоследствии — рецидива более грубой стриктуры. Таким образом, диастаз не должен превышать 30 мм. При большем диастазе дистальный конец протока перевязывают и выполняют реконструктивную операцию.
Такую же тактику применяют и при свежих повреждениях желчных протоков, когда иссекают часть наружных желчных протоков полностью.
Билио-билиарный анастомоз может быть создан при поражении любых желчных протоков, вплоть до долевых, однако эффективность вмешательства уменьшается по мере приближения анастомоза к зоне слияния долевых протоков и тем более в случае перехода на последние. В связи с этим мы не стремимся к созданию билио-билиарных анастомозов при поражении долевых протоков, за тем редким исключением, когда диаметр их составляет 5 мм и более и удается сшить внутренние стенки без натяжения. В основном билио-билиарные анастомозы создавали при поражении печеночно-желчного протока. Обязательным условием их создания являлась полная проходимость большого сосочка двенадцатиперстной кишки. В противном случае производили коррекцию.
Техника операции. Вначале выделяют переднюю поверхность и боковые края суженного участка. Не следует пытаться сразу отделить и заднюю поверхность стриктуры от воротной вены из-за опасности ее повреждения. Надо вскрыть печеночно-желчный проток и рассечь его вдоль всего участка, намеченного для резекции. Разрез должен проксимально и дистально захватывать проходимые сегменты протока. Вскрытие проксимального отдела сопровождается выделением желчи и мелких камней. Через образовавшееся отверстие зондом исследуют печеночные протоки и удаляют остатки замазкообразной желчи. Затем тонким металлическим зондом проверяют проходимость суженной части. Если проходимость имеется, то переднюю поверхность рубцовой части вскрывают по зонду, и поиски дистального отдела протока не представляют особых трудностей. Если рубцовый участок непроходим, находят начало дистального отдела, который обычно имеет гораздо меньший диаметр и не содержит желчи. Иногда поиски его не приносят успеха, но на ретроградной дооперацион-ной холангиограмме определяется достаточная его длина. В этих редких случаях можно проводить эластический зонд в общий желчный проток со стороны большого сосочка двенадцатиперстной кишки, одновременно выполняя и папиллосфинктеротомию. Обнаружив тем или иным способом дистальный отдел общего желчного протока, следует сразу же оценить возможность сближения концов протока и в принципе решить вопрос о создании билио-билиарного анастомоза. После обнаружения дистального отдела общего желчного протока его вскрывают на небольшом протяжении и убеждаются в проходимости большого сосочка двенадцатиперстной кишки.
Если создание билио-билиарного анастомоза необходимо у места вскрытия обоих концов желчного протока в поперечном направлении, перерезают его переднюю стенку, а затем под контролем зрения и пальца, введенного в сальниковое отверстие, медленными пилящими движениями скальпеля на тех же уровнях пересекают и заднюю стенку протока. Затем верхний край удаляемой части протока захватывают зажимом и натягивают кпереди. Постепенно продвигаясь сверху вниз, разделяют ножницами или скальпелем сращения между протоком и воротной веной. Если участок стриктуры небольшой (до 10 мм) и имеет просвет, а задняя стенка протока мало изменена, то можно оставить небольшой мостик ткани в этой области, но явно измененные ткани следует удалить.
Оба конца желчного протока еще раз промывают и вновь оценивают возможность создания анастомоза без натяжения. Если мобилизация двенадцатиперстной кишки выполнена правильно и достаточно тщательно, то сопоставление концов протока удается без труда даже в тех случаях, когда резецирована часть печеночно-желчного протока длиной 30 мм. Необходимо подчеркнуть, что дистальную культю общего желчного протока следует мобилизовать вместе с панкреатодуоденальным комплексом, а не пытаться выделить ее из ткани поджелудочной железы, что опасно вследствие де-васкуляризации протока и последующего рубцового сморщивания.
Поскольку при стриктурах нижняя культя протока обычно уже верхней, мы делаем дополнительные продольные разрезы в боковых стенках протока в 5—8 мм от линии пересечения. При одинаковых диаметрах дистального и проксимального протоков мы стараемся увеличить их на 5—7 мм, надсекая в продольном направлении. Таким образом анастомоз становится значительно шире (в послеоперационный период наблюдается стенозирование анастомоза до 1/2 и даже 3/4 его первоначального диаметра).
После этого приступают к созданию анастомоза по типу «конец в конец». Прежде всего сшивают заднюю стенку отдельными стежками тонких нитей из рассасывающегося материала или синтетическими нитями на атравматической игле (рис. 87, а). Швы накладывают узелками наружу по типу сосудистого шва. После сшивания задней стенки в просвете протока устанавливают каркасный дренаж. При создании билио-билиарного анастомоза по типу «конец в конец» такие дренажи являются обязательными. У 11 из 13 больных мы применили нисходящий дренаж как наименее травматичный. Управляемость дренажа обеспечивали фиксирующей нитью, а достижение максимально широкого анастомоза— применением раздувного баллона (рис. 87, б). При создании такого же анастомоза на уровне слияния долевых печеночных протоков или на одном из них мы применяли дренирование в первом случае по Smith и во втором — по Snypol в наших модификациях в связи с необходимостью длительного дренирования. Перспективным является использование каркасного сетчатого дренажа из танталовой проволоки.
После установления каркасного дренажа накладываем шов на переднюю губу анастомоза, как при операции Гейнеке—Микулича. Обычно ограничиваемся одним рядом швов. У линии анастомоза помещаем резиновый «улавливающий» дренаж, который выводим из брюшной полости через отдельный прокол на брюшной стенке справа.
Пластическое закрытие дефектов печеночно-желчного протока. Как уже было сказано, восстановительные операции являются идеальным вариантом лечения Рубцовых стриктур желчных протоков. Сложность состоит в поисках дистального, плохо дифференцирующегося отдела желчного протока и в наложении циркулярного шва. В связи с этим многие хирурги не стремятся к выполнению восстановительных операций, что является в корне неправильным.

В целях увеличения возможностей восстановительных операций разработан ряд методик, предусматривающих использование различных естественных тканей. Так, Larsen и соавторы (1980) для замещения дефекта стенки желчного протока размером 1,5— 2X0,6—0,8 см в эксперименте на собаках использовали листок брюшины. Заплату вшивали на Т-образном дренаже, который удаляли через 6—8 нед. Через 1 год после операции со стороны просвета протока отмечалась ровная слизистая оболочка без рубцов. Трансплантат уменьшился и составлял 10 первоначального размера.
Пластику желчного протока участком стенки тощей кишки применили у 3 больных Landes и соавторы (1980). Методика операции заключалась в следующем. Продольным разрезом по противобрыжеечному краю вскрывали кишку на небольшом протяжении и выкраивали лоскут, сохраняя связь с сосудами брыжейки. Проходимость кишки восстанавливали анастомозом «конец в конец», а трансплантат на сосудистой ножке подводили к желчному протоку и вшивали в дефект его стенки. Хорошие результаты отмечены через 1—3 года после операции у всех больных.
Для закрытия больших дефектов печеночно-желчного протока мы использовали висцеральную поверхность стенки кишки, выключенной из пищеварения по Ру или Брауну. Обязательным условием в этом случае является полная проходимость большого сосочка двенадцатиперстной кишки (при необходимости выполняем папиллосфинктеротомию). Кишку подшиваем без натяжения поочередно к задней боковой и передне-боковой стенкам дефекта серо-серозными одиночными швами с промежутками между ними 1,5 мм. Как правило, закрытие дефекта трудностей не представляет. Этот способ позволяет создать естественный пассаж желчи с сохранением запирательной функции сфинктера печеночно-поджелудочной ампулы (рис. 88).

Пластику осуществляем на нисходящем дренаже, фиксированном нитью. Как показал опыт 3 операций подобного типа, размеры дефекта не влияют на техническое выполнение операции. Таким образом нам удавалось закрывать дефекты протяженностью 30—40 мм, полностью сохраняя конфигурацию желчных протоков. Каркасное дренирование про-
должалось от 3 до 6 мес. Результаты в сроки наблюдения до 5 лет хорошие.
При ограниченных дефектах печеночно-желчного протока на уровне культи пузырного протока используют ее как естественный материал для закрытия дефектов протяженностью 5—10 мм, образовавшихся после иссечения рубцовых сужений на ограниченном участке. Мы смогли воспользоваться этой методикой лишь у 2 больных.
Попытки полного замещения желчных протоков относятся еще к 1909 г., когда А. Ф. Башкиров предложил для этих целей использовать аутовену. Однако дальнейшие исследования показали, что венозный трансплантант подвержен сморщиванию и не всегда полностью эпителизируется. Поэтому в клинике этот метод не нашел применения. Для предотвращения некробиотических и деструктивных процессов в стенке вены О. М. Горбунов и соавторы (1982) предложили предварительное консервирование вены в специальной среде при температуре 3—4 °С в течение 7 сут. В этих же целях Э. И. Гальперин и соавторы (1980) предложили метод васкуляризации аутовены путем ее окутывания большим сальником после вшивания в качестве протеза желчного протока или его стенки (рис. 89).

Авторы применили метод у 6 больных, сочетая аутовенозную пластику с длительным транспеченочным дренированием. После операции умер 1 больной, еще у 1 больного через 1 мес наступило аррозивное кровотечение и трансплантат был удален во время повторной операции. У остальных 4 больных через 1—2 года после операции признаков рецидива стриктуры не обнаружено, однако у всех имеется транспеченочный дренаж.
Попытка протезирования желчных протоков крыс лиофилизированной и силиконизированной твердой мозговой оболочкой оказалась неудачной (Gagni и соавт., 1979). Неудачные результаты получены и при замещении участка желчного протока политетрафлюороэтиленовыми протезами (Mendelowitz, Beal, 1982).
Бужирование как самостоятельный метод лечения Рубцовых стриктур во время восстановительных операций в настоящее время не применяется. Нами выполнено бужирование лишь 12 (15,2 %) больным. У 4 из них в среднем через 17 мес наступили рецидивы: у 2 — в связи с отсутствием каркасного дренирования и еще у 2 — с его кратковременностью. У остальных бужирование сочеталось с длительным дренированием по методике Smith (у 5) и при помощи нисходящего дренажа (у 3).
Мы считаем, что бужирование при восстановительных операциях может быть применено только у больных с тяжелым поражением печени в результате длительной желтухи и холангита после неоднократных операций на желчных протоках и при наличии частичной проходимости в области рубцовой стриктуры. Такие операции должны сопровождаться длительным каркасным дренированием при помощи управляемых дренажей.
Техника операции. Выделяют лишь дистальный отдел общего желчного протока ниже стриктуры. В супрадуоденальной части делают продольный разрез и с помощью тонкого пуговчатого зонда исследуют место сужения, пытаясь пройти зондом в проксимальный отдел желчного протока. Если такая попытка удалась, сразу начинают поступать желчь и замазкообразная масса. После этого область сужения расширяют металлическими бужами возрастающего калибра или зажимом, постепенно раскрывая его бран-ши. В последние годы вместо этого примитивного метода бужиро-вания применяют метод дилата-ции. Через суженную часть протока проводят специальный металлический проводник и по нему вводят пластмассовый дилататор (рис. 90, а). Постепенно увеличивая силу дилатации, дилататор продвигают вверх с таким расчетом, чтобы его основная часть (баллон) находилась в суженной части протока. После этого создают максимально высокое давление и суженную часть расширяют до диаметра дилататора (5, 7, 9 мм), который подбирают заранее по рентгенограммам. Естественно, что одноразовой дилатации недостаточно для получения стойкого эффекта, поэтому после извлечения дилататора устанавливают либо каркасный управляемый дренаж по одной из описанных методик, либо полиэтиленовую трубку без боковых отверстий и с наружным диаметром на 1—2 мм меньше диаметра использованного дилататора. Такая трубка, с одной стороны, поддерживает суженную часть в расширенном состоянии, с другой — позволяет продолжить сеансы дилатации в послеоперационный период (рис. 90, б, в).
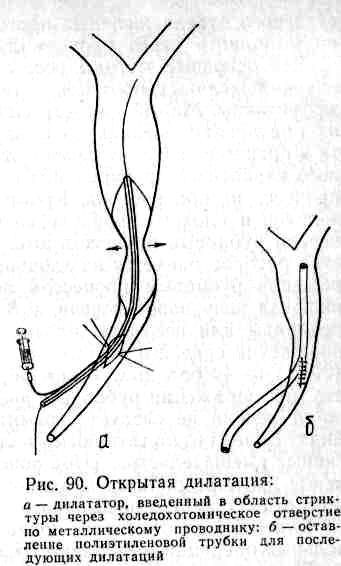
В последнее время мы отдаем предпочтение последнему методу. После установления дренажно-каркасной трубки холедохотомическое отверстие ушивают в продольном направлении нитью из рассасывающегося материала на атравматической
игле.
Следует отметить, что при затруднениях с отыскиванием дистального отдела желчных протоков подобные манипуляции можно выполнить через проксимальный отдел выше стриктуры.
Все основные методы восстановительных операций на уровне слияния желчных протоков и тем более на долевых протоках не эффективны. Малый диаметр сшиваемых протоков, травмирование их при препарировании зоны ворот печени, технические сложности в процессе создания самого анастомоза, необходимость длительного каркасного дренирования ведут к распространению рубцового процесса на оба протока. Кроме того, из-за отсутствия мышечных волокон и плохого кровоснабжения стенки протоков в зоне ворот печени рубцовый процесс в этой области особенно выражен и быстро распространяется на здоровые участки протоков. Так, при поражении рубцовым процессом верхней трети желчных протоков, включая зону ворот печени, у 8 (31 %) из 21 больного возникли рецидивы или получены плохие результаты, в то время как при поражении среднего отдела желчных протоков рецидив возник у 9 (20 %) из 44 больных. Таким образом, мы пришли к заключению, что при поражении рубцовым процессом желчных протоков в зоне ворот печени не следует стремиться к восстановительным операциям. Более результативными являются в этих случаях реконструктивные вмешательства. (Под зоной ворот печени мы понимаем долевые протоки, область их слияния и часть — 5 мм—проксимального отдела общего печеночного протока).
Как мы уже отмечали, подавляющее большинство восстановительных операций выполняют на каркасных дренажах.
В последнее время оптимальным сроком дренирования принято считать 2 года (Э. И. Гальперин и соавт., 1982), поэтому и были предложены травматичные, но надежные методы дренирования по Smith и Saypol. По нашему мнению, на срок дренирования при восстановительных операциях влияет главным образом длина циркулярного шва. Если шов наложен на Уз окружности протока, достаточно 6 мес, менее чем на УЗИ — можно вообще обойтись без дренирования, более чем на 1/3, вплоть до циркулярного шва — дренирование должно продолжаться не менее 2 лет. Это касается всех видов операций (Гейнеке—Микулича, по типу «конец в конец», пластика дефектов), так как при каждой из них шов накладывают по окружности протока. Это место и является наиболее подверженным сужению. Утверждение о том, что чем шире линия анастомоза, тем меньшее наступает сужение, не совсем верно. Практика показывает, что все анастомозы сужаются и особенно быстро в первые месяцы после операции. Об этом свидетельствует огромное количество рецидивов после операций, которые выполнялись неквалифицированно, без дренирования, даже при первичном сшивании протоков после свежих повреждений. Таким образом, необходимо сразу во время операции создавать каркас, диаметр которого соответствовал бы диаметру протока на уровне анастомоза или пластики, с последующей тренировкой его на растяжение в течение первых 3—6 мес. Впоследствии такую тренировку можно проводить периодически до стабилизации процесса на протяжении 6 мес лишь при подозрении на прогрессирование сужения. Этим целям отвечает дренаж с баллоном, которому можно придать форму, максимально выгодную для формирования анастомоза и последующего его растяжения. Как показала практика, срок дренирования в этих случаях можно сократить в 2 раза.
Во всех остальных случаях, когда во время операции установить баллон на уровне анастомоза невозможно, дренирование выполняют обычными хлорвиниловыми трубками соответствующего, максимально приближенного к просвету протока диаметра на уровне анастомоза. Спустя 1 мес после операции по каналу трубки вводят пластмассовый дилататор и производят максимально возможное расширение анастомоза. Такие манипуляции выполняют 1 раз в 3 мес. Через 6 мес обычную трубку с боковыми отверстиями заменяют трубкой, диаметр которой на 1 мм меньше и не имеющей отверстий. Как оказалось, отток желчи по пространству вокруг трубки осуществляется беспрепятственно, но в то же время прекращается инфицирование протоков за счет разобщения их с внешней средой, что также благоприятно сказывается на формировании анастомоза. Кроме того, отпадает необходимость в промывании трубки и прекращается выделение желчи наружу. Концы трубки соединяют между собой в виде кольца.
При использовании дилатационного метода лечения Рубцовых стриктур желчных протоков срок дренирования сокращается до 1 года.
Результаты восстановительных операций. У 65 больных выполнено 79 операций. После операции умерли 3 (4,6 %) больных от прогрессирующей печеночно-почечной недостаточности на почве хронического холангиогепатита, хронического холестаза. Неоднократные операции у этих больных, длительные курсы консервативной терапии и неадекватность оперативных вмешательств на первых этапах лечения привели к тяжелым и необратимым изменениям печени, почек и миокарда.
Непосредственные результаты восстановительных операций у всех больных, как правило, хорошие. Неудовлетворительные результаты появляются через 6—12 мес после удаления каркасного дренажа. При выполнении операции без дренажей или при их преждевременном удалении неудовлетворительные результаты появляются значительно раньше. Следовательно, и результаты лечения должны оцениваться, начиная с 6 мес и до 3 лет после операции, то есть примерно через 1 год после максимального срока дренирования. Появление неудовлетворительных результатов через 3 года — 5 лет и более чаще всего связано с вторичным холестазом, мешающим нормальному оттоку желчи через естественно суженное кольцо билио-билиарного анастомоза. В связи с этим мы рекомендуем всем больным после любых операций на желчных протоках 1 раз в год в течение первых 3—5 лет посещать бальнеологические курорты для промывания желчных протоков. Такое лечение можно проводить даже при наличии в протоках дренажных трубок.
Количество неблагоприятных исходов является основным показателем качества хирургического лечения рубцовых стриктур. Можно выделить 2 группы больных: 1) с неудовлетворительными результатами и 2) с рецидивами. Практически больные первой группы являются кандидатами во вторую, но по различным причинам отказываются от повторной операции. Это больные с частыми приступами желтухи и проявлениями холангита. У больных второй группы, помимо этих признаков, наблюдается стойкая желтуха, и они согласны на операцию.
Количество рецидивов, по данным различных авторов, составляет в среднем 20—30 %.
Мы изучили результаты 67 восстановительных операций в сроки от 6 мес до 14 лет (табл. 15).

Хорошие и удовлетворительные результаты получены у 75,6 % больных. Из 25 % больных с неудовлетворительными результатами 21 % составили больные, подвергнутые повторным вмешательствам ввиду рецидива заболевания.
К реконструктивным вмешательствам при рубцовых стриктурах желчных протоков относятся: 1) гепатикохоледоходуоденостомия; 2) гепатикохоледохоеюностомия; 3) бужирование рубцово суженных анастомозов.
Нами выполнена у 211 больных 241 реконструктивная операция, что составило 76,4 % всех операций при рубцовых стриктурах желчных протоков (табл. 16).
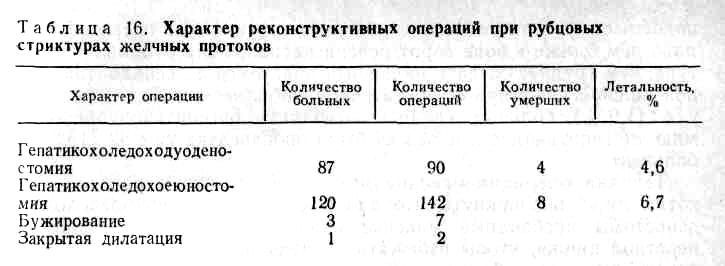
Гепатикохоледоходуоденостомия. При операциях по поводу рубцовых стриктур о чистых холедоходуоденальных анастомозах говорить не приходится в связи с тем, что как бы низко по ходу общего желчного протока не располагалась стриктура, в процессе создания анастомоза обязательно захватывают и часть общего печеночного протока. Печеночно-дуоденальные анастомозы создают гораздо чаще (табл. 17).

Показаниями к такого рода вмешательствам являются рубцовые стриктуры желчных протоков, располагающиеся в области общего желчного протока и в силу своей протяженности (более 20— 30 мм) не позволяющие выполнить восстановительную операцию либо полиостью поражающие супра- и ретродуоденальную части общего желчного протока. Наиболее частой причиной возникновения стриктур в этой области являются рубцовые стенозы общего желчного протока после ранее созданных гепатикохоледоходуоденостомий (46,8%); в результате повреждений при холецистэкто-мии по поводу хронического холецистита (21,1 %); вследствие повреждений при холецистэктомии по поводу острого холецистита и резекции желудка (19,3 %); на почве околопротоковых воспалительных процессов (4,4 %) и закрытой травмы (1,1 %).
Нет необходимости доказывать, что все анастомозы желчных протоков с двенадцатиперстной кишкой являются более физиологичными, чем любые другие билиодигестивные соединения. Поэтому многие хирурги и мы в том числе стремимся создавать подобные соустья при выполнении реконструктивных операций. Однако чем ближе к зоне ворот печени расположена рубцовая стриктура, чем труднее создать надежный анастомоз с двенадцатиперстной кишкой даже при ее достаточной мобилизации. Так, нам лишь у 4 (1,9 %) больных удалось выполнить бигепатикодуоденостомию, но гепатикодуоденостомия была произведена уже 32 (15,2 %) больным.
Техника операции описана нами в предыдущем разделе. Мы хотим лишь подчеркнуть, что для создания гепатикохоледоходуоденостомы необходима максимальная мобилизация двенадцатиперстной кишки, чтобы избежать натяжения тканей. Следует также отметить, что в большинстве случаев, когда вопрос о невозможности выполнения восстановительной операции решен, нет необходимости в полной мобилизации проксимального отдела общего желчного протока и полном иссечении старых Рубцовых тканей в дистальном направлении. При этом обычно создают анастомоз по типу «бок в бок» по одному из ранее описанных способов. И только тогда, когда проксимальный конец общего печеночного или желчного протока мобилизован полностью и иссечена рубцовая ткань в надежде выполнить восстановительную операцию, но она оказалась невозможной из-за резкой рубцовой деформации дистального конца общего желчного протока, создают гепатикодуоденальный анастомоз по типу «конец в бок» по методике А. А. Шалимова.
Лишь у 12 (13,3 %) больных созданы анастомозы по типу «конец в бок»: у 4— бигепатикодуоденостомия, у 5 — гепатикодуоде-нальный и у 3 — холедоходуоденальный.
Одним из преимуществ операций данного типа является то, что у подавляющего большинства больных (86,7 %) удалось обойтись без каркасных дренажей. Каркасное дренирование понадобилось при повторных операциях и вмешательствах в зоне ворот печени. У 6 (6,7 %) больных было применено дренирование по Smith, у 3 (3,3 %) использован нисходящий дренаж, у 1 (1,1 %) больной выполнено дренирование по Saypol. Дважды (2,2 %) был применен скрытый дренаж, который отошел самостоятельно, но рекомендовать его для практического использования в связи с полной неуправляемостью мы не можем.
Значительную группу составили больные со стенозом ранее наложенного холедоходуоденального соустья. Этим больным операции были выполнены не по показаниям, при выраженных явлениях гнойного холангита. Это вызвало быстрое рубцовое заращение анастомоза, с одной стороны, и рубцовые изменения желчных протоков—с другой. Повторные операции выполняли через 2—12 мес после первой. Операция в клинике была в большинстве случаев уже третьей. Повторные операции заключались в том, что после лапаротомии выделяли место ранее наложенного холедоходуоденоанастомоза и желчный проток на 10—15 мм выше него (рис. 91).
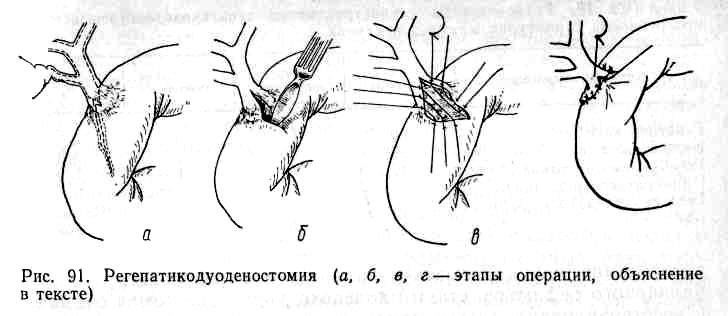
Продольным разрезом вскрывали желчный проток непосредственно вверх от анастомоза. Длина разреза составляла 15—20 мм. Из желчного протока удаляли камни, замазкообразную желчь. Затем, продолжая разрез вниз, рассекали суженную часть старого анастомоза с переходом на здоровую стенку двенадцатиперстной кишки также на протяжении 15—20 мм. Разводя края разреза в стороны с помощью нитей-держалок, оценивали состояние задней стенки анастомоза. Рубцовую ткань обычно иссекали на передней губе анастомоза, так как она мешает созданию нового анастомоза путем сшивания неизмененных тканей. В дальнейшем ход операции не отличается от такового при операции Юраша—Виноградова. Обычно удается создать анастомоз без натяжения тканей шириной не менее 15 мм, поэтому к дренированию желчных протоков мы не прибегаем. Лишь в 3 наблюдениях, когда диаметр проксимального отдела желчных протоков достигал только 10—11 мм, а стенка его была тонкой и могла возникнуть реальная угроза недостаточности швов анастомоза и рецидивы стриктуры, мы вынуждены были прибегнуть к установлению транспеченочных (2) и нисходящего (1) дренажа. Поскольку при такой реоперации в анастомоз входит часть общего печеночного протока, она называется регепатикохоледоходуоденостомией.
При подобного рода реоперациях обязательной является ревизия дистального отдела общего желчного протока после вскрытия надстенотического отдела его. Прежде всего оценивают проходимость большого сосочка двенадцатиперстной кишки. Если он непроходим и эту непроходимость нельзя устранить во время операции (тубулярный стеноз, резкая деформация ретродуоденальной части общего желчного протока), то вмешательство продолжают выполнять обычным способом. Если большой сосочек двенадцатиперстной кишки оказывается проходимым, а клиническую картину
заболевания можно связать с холангитом в результате дуодено-билиарного рефлюкса, старый холедоходуоденоанастомоз снимают и восстанавливают естественный пассаж желчи. В тех случаях, когда большой сосочек двенадцатиперстной кишки оказывается непроходимым, но непроходимость его может быть легко устранена (стенозирующий папиллит, камни в дистальном отделе общего желчного протока с вклинением их в сосочек), выполняют трансдуоденальную папиллосфинктеротомию и анастомоз снимают. После разъединения старого холедоходуоденоанастомоза и иссечения рубцовой ткани, как правило, возникает дефект передней стенки общего желчного протока на ограниченном участке. В этих случаях выполняют операцию Гейнеке—Микулича или пластику протока стенкой кишки.
Мы восстановили таким образом естественную проходимость желчных путей у 11 больных.
Общим противопоказанием к наложению гепатикохоледоходуоденоанастомоза является дуоденостаз. Если его нельзя устранить по ходу операции, прибегают к анастомозу с тонкой кишкой.
Это наиболее частый вид восстановления желчеоттока при Рубцовых стриктурах желчных протоков. Нами выполнена 141 (59 %) операция у 120 больных (табл. 18), которые подвергались реконструктивным вмешательствам.
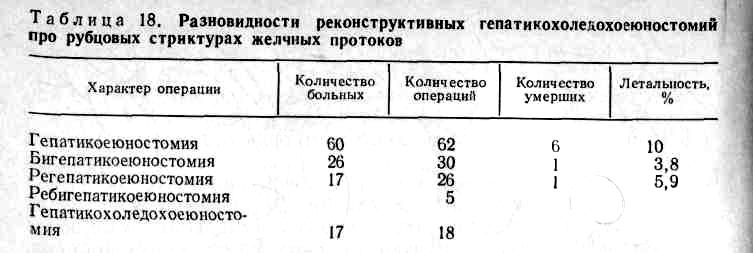
Они составили 43,5 % больных с Рубцовыми стриктурами желчных протоков. К этим видам вмешательств относятся: 1) гепатикохоледохоеюностомия, 2) гепатикоеюностомия, 3) регепатикоеюностомия, 4) бигепатикоеюностомия, 5) ребигепатикоеюностомия.
Создание того или иного вида анастомоза зависит главным образом от уровня поражения желчных протоков.
Показанием к созданию подобного рода анастомозов является невозможность прибегнуть ко всем вышеописанным операциям. Основным же критерием является диастаз между концами желчных протоков, полученный в результате иссечения рубцовой ткани. Величина последнего в этих случаях превышает 20—30 мм, что не позволяет выполнить восстановительную операцию, а высокое расположение проксимальной культи печеночного протока не позволяет наложить и билиодуоденальный анастомоз.
Противопоказаний к выполнению гепатикохоледохоеюностомий практически нет, так как эту операцию, как и вообще вмешательства при рубцовых стриктурах, выполняют по жизненным показаниям. В некоторых случаях операцию производят в 2 этапа. Такое лечение показано больным с высокой билирубинемией, выраженным холангиогепатитом или гнойным холангитом. На первом этапе производят наружное дренирование желчных протоков. Затем, после нормализации биохимических показателей сыворотки крови и функции печени, выполняют второй, реконструктивный, этап лечения. Наружное дренирование может быть выполнено либо при помощи чрескожной чреспеченочной холангиостомии при крайне тяжелом состоянии больного, либо во время операции, после иссечения рубцовых тканей и выделения проксимальной культи печеночного протока при помощи трубки максимально приближенного к протоку диаметра, чтобы сохранить ширину протока для создания анастомоза на втором этапе. Обычно между этапами проходит 10—40 дней. Как показал опыт 23 операций, выполненных в 2 этапа, такое лечение у определенной группы больных является вполне оправданным.
Гепатикохоледохоеюностомия — наиболее благоприятный вид реконструктивных вмешательств при наличии обширных дефектов желчных протоков — длиной 20—30 мм и более, которые образовались в результате иссечения рубцовой стриктуры в области печеночно-желчного протока с сохранением задней стенки протока или восстановлением ее целости путем сшивания. Эта операция во многом напоминает восстановительную операцию пластического замещения дефекта стенкой кишки при нормальной или восстановленной проходимости большого сосочка двенадцатиперстной кишки. При наличии же сомнений в нормальной проходимости сосочка или невозможности восстановления проходимости создают гепатикохоледохоеюноанастомоз по типу «бок в бок».
Техника операции. Выделяют печеночно-желчный проток на уровне стриктуры и на 20—30 мм выше и ниже ее (рис. 92, а). Рубцовые ткани по краям стенок протока иссекают. Если концы протока отстоят один от другого, то отдельными швами или непрерывным швом по типу сосудистого атравматической иглой с интервалом 1 мм сшиваем задние стенки проксимального и дистального концов протока по периметру на возможно большем протяжении, чтобы образовалось начало боковых стенок. В тех случаях, когда выполнено сшивание задней стенки или диаметр проксимального отдела менее 8 мм, через область будущего анастомоза проводят каркасный дренаж любого типа (рис. 92, б). Далее берут петлю тонкой кишки, выключенную из пищеварения по Ру или Шалимову. При создании заглушки приводящей петли по Шалимову кишку не только перевязывают двумя лигатурами, но и инвагинируют таким образом, чтобы создать клапан, препятствующий пассажу кишечного содержимого в том случае, если произойдет реканализация заглушки. При правильной инвагинации прохождения кишечного содержимого по заглушённой петле кишки мы не отмечали даже через 20 лет после операции.
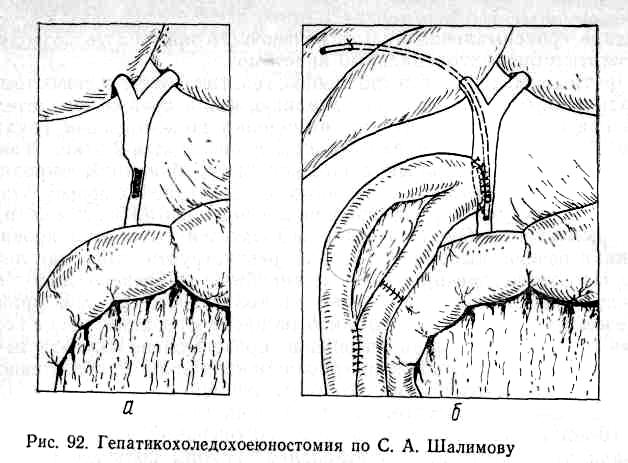
Однако, как показывает практика, рефлюкс кишечного содержимого происходит даже в антиперистальтическом направлении. Поэтому важно, чтобы длина отводящей петли тощей кишки (от желчных протоков до межкишечного соустья) была не менее 40— 60 см (Moosa и соавт., 1976). В то же время регургитационный холангит при такой технике оперирования все же возникает. Э. И. Гальперин и соавторы (1982) указывают, что надежное предупреждение рефлюкса достигается только при длине отключенной петли 80—100 см. Мы стремились отключать до 80 см отводящей петли, но и при этом рефлюкс полностью не исчезал. Заброс кишечного содержимого в область анастомоза и желчные протоки является одним из неблагоприятных факторов, так как, поддерживая холангит, он способствует рецидиву заболевания вследствие быстрого рубцевания билиодигестивных анастомозов. Поэтому пренебрегать длиной выключенной петли нельзя ни в коем случае.
Обычно выключенную из пищеварения петлю кишки проводят к месту анастомоза с желчным протоком позади поперечно-ободочной кишки. Однако при наличии укороченной или резко деформированной брыжейки кишки допустимо и впередиободочное проведение.
Просвет кишки вскрывают на участке, по длине соответствующем размерам дефекта стенки протока, и отдельными швами из рассасывающегося материала на атравматической игле формируют анастомоз между кишкой и желчным протоком по всему периметру дефекта, добиваясь тщательного сопоставления краев слизистых оболочек. Затем отдельными швами сшивают серозную оболочку кишки с брюшиной и остатками рубцовых тканей печеночно-дуоденальной связки, укрывая линию анастомоза. Выше и ниже анастомоза подпеченочное пространство дренируют перчаточно-трубча-тым дренажем. Таким образом сохраняется пассаж желчи естественным путем и, кроме того, появляется новый путь оттока желчи в тощую кишку. Нами выполнено 18 подобных операций, что составило 7,5 % всех операций реконструктивного характера. В 9 случаях каркасный дренаж не понадобился, в 5 использовано дренирование по Smith, в 4 применен нисходящий дренаж. Срок дренирования составил в среднем 5,5—6 мес. Летальных исходов, связанных с основным заболеванием, не было. Умер 1 больной на 6-е сутки после операции от инфаркта миокарда. Отдаленные результаты прослежены у 14 человек в сроки от 1 года до 8 лет: у 7 человек получен хороший результат, у 4 — удовлетворительный, у 3 возник рецидив через 7—8 мес после операции в связи с кратковременным дренированием (0,5; 1,5; 2 мес).
Условия для выполнения операций подобного рода возникают сравнительно редко. В наших наблюдениях такая возможность возникла у 6 % больных по отношению ко всем больным с рубцовыми стриктурами желчных протоков.
Гепатикоеюностомия является вторым наиболее частым видом реконструктивных вмешательств при рубцовых стриктурах желчных протоков. Нами выполнено 62 такие операции, что составило 25,7% по отношению ко всем реконструктивным вмешательствам и 5,6 % ко всем операциям при стриктурах желчных протоков.
К гепатикоеюностомии прибегают во всех случаях, когда невозможно выполнить какую-либо другую операцию, то есть при полном разрушении большей части печеночно-желчного протока. Эта операция сохраняет свое название при наличии остатка общего печеночного протока, позволяющего создать билиодигестивный анастомоз в непосредственной близости от слияния долевых печеночных протоков, то есть с захватом зоны ворот печени. Характер операции мало чем отличается при ее выполнении на всем участке остатка общего печеночного протока, длина которого обычно не превышает 10 мм.
В данной ситуации мы применяем 2 типа вмешательств. Операции первого типа предусматривают анастомоз с максимально длинной культей протока —6— 10 мм. Это более простые операции, часто не требующие каркасного дренирования. Операции второго типа предусматривают анастомоз уже в зоне ворот печени с остатком печеночного протока длиной до 5 мм. Эти вмешательства более сложные и всегда требуют применения каркасного дренирования.
Операции первого типа. После иссечения руб-цовых тканей и освобождения дистального конца общего печеночного протока производят его мобилизацию в проксимальном направлении, постепенно и осторожно освобождая
от рубцовых напластований, предварительно взяв его на 2 держалки. Мобилизацию выполняют как острым, так и тупым путем. Особую осторожность следует соблюдать при выделении передней поверхности протока, так как нередко его здесь пересекает правая печеночная артерия, часто находится культя пузырной артерии и реже — общая печеночная артерия. Повреждение любого из этих сосудов вызывает сильное кровотечение.
Техника операции. Обязательным условием выполнения этой операции является наличие свободного (мобилизованного) конца общего печеночного протока длиной от 5 до 10 мм. При меньшей культе создание анастомоза по типу «конец в бок» возможно, но надежность его уменьшается, поэтому для успешной операции нужны уже другие технические приемы. Петлю тощей кишки, необходимую для анастомоза, выключают по Ру или Шалимову, подводят к задней поверхности протока так, чтобы последний ложился поперек кишки по длине всей своей свободной части (рис. 93, а). При малом диаметре протока (5 мм и менее) по задней поверхности его делают продольный разрез длиной 5—8 мм. Непосредственно перед культей протока продольно вскрывают просвет тощей кишки в соответствии с диаметром протока и разрезом его. Отдельными 3—4 швами с интервалом между ними 1,5 мм нитью из нерассасывающейся ткани фиксируют боковые стенки протока к стенке кишки поперек нее. Так же отдельными швами нитью из рассасывающегося материала на атравмэтической игле сшивают края протока и кишки при точном сопоставлении слизистых оболочек. Затем серо-серозными швами анастомоз инвагини-руют в складку кишки для уменьшения регургитационного рефлюкса из кишечника.
В тех случаях, когда удается создать анастомоз шириной 15 мм и более, необходимость в каркасном дренировании, как правило, отпадает. При меньшей ширине анастомоза используют любой из управляемых каркасных дренажей (рис. 93, б).
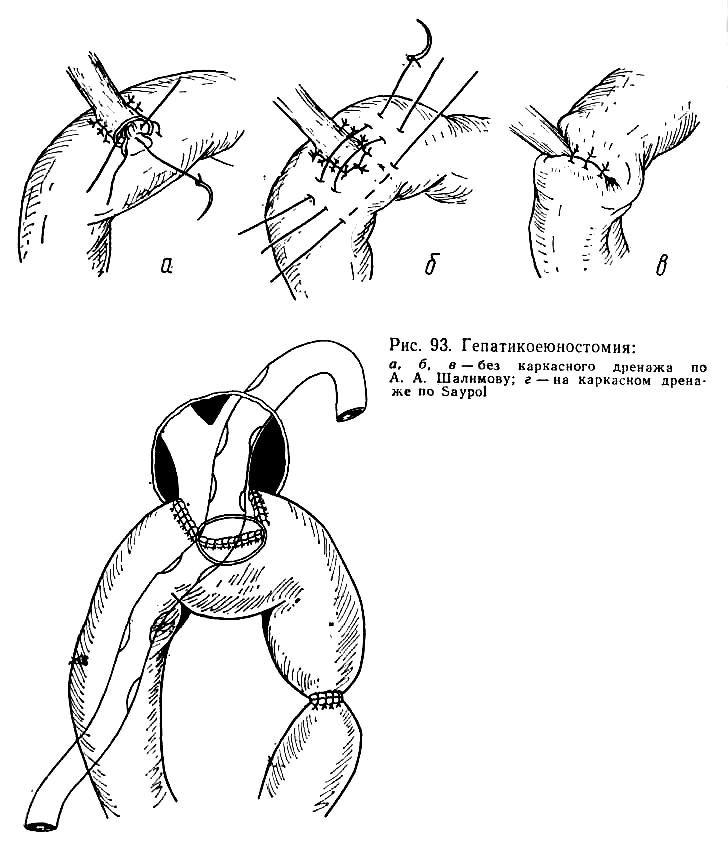
Этот наиболее рациональный вариант операции мы применяем в клинике в подобных ситуациях. Наиболее близкой к описанной является гепатикоеюностомия, предложенная А. Н. Великорецким (1959) (рис. 94).

Smith и Grassi (1964—1969) предложили оригинальную методику гепатикоеюностомии, заключающуюся в том, что культю печеночного протока прошивают лигатурами; в тощей кишке, выключенной по Ру, делают отверстие, диаметр которого соответствует диаметру печеночного протока, и через него проводят лигатуры к неушитой культе кишки. Потягивая за лигатуры, инвагинируют проток в кишку и в таком положении фиксируют. Накладывают дополнительные серо-серозные швы для герметизации анастомоза и ушивают культю кишки.
Создание гепатикоеюностомии без иссечения рубцовой ткани при значительном расширении проксимального отдела печеночного протока, когда возможно создание анастомоза по типу «бок в бок», предлагают Э. И. Гальперин и соавторы (1982). Анастомоз прост по техническому исполнению и надежен, но для его создания необходимо расширение протока не менее чем до 20 мм, что при высоких стриктурах бывает чрезвычайно редко.
McAlister и Hicken (1976) предложили при сохраненном общем желчном протоке рассекать вдоль протока рубцовую ткань и создавать гепатикоеюностомию с двойным дренированием.
К сожалению, в случае применения двух последних методик оставление рубцовой ткани протоков ведет к прогрессировнию рубцового процесса и к рецидиву заболевания. В техническом же плане эти методики не упрощают операцию и поэтому мы считаем, что более приемлемой является методика в нашей модификации.
Анастомозы желчных протоков с желудком в настоящее время не накладывают.
Операции второго типа предусматривают создание билиодигестивного анастомоза при наличии культи общего печеночного протока длиной 5 мм и менее. Операции в этих случаях являются сложными, травматичными и менее результативными, но, к сожалению, они составляют 54,4 % всех операций реконструктивного характера и 40,1 % всех операций, выполняемых по поводу Рубцовых стриктур желчных протоков.
К этим операциям относятся: 1) гепатикоеюностомия в зоне ворот печени, или гепатоеюностомия; 2) бигепатикоеюностомия.
Гепатикоеюностомия. Операции в зоне ворот печени представляют наибольшие трудности, связанные, во-первых, с невероятной сложностью идентификации элементов желчных протоков, во-вторых, с тяжестью состояния больных, перенесших, как правило, 2—3 и более операций па тех же желчных протоках.
В разное время было предложено много различных вариантов создания билиодигестивных анастомозов в этих условиях. Остановимся на некоторых из них.
Рассечение латеральных поверхностей желчных протоков с подшиванием их к капсуле печени предложил Kirtley (1960). Выделенную по Ру петлю тощей кишки подшивают к печени вокруг отверстия желчного протока (рис. 95).

Существуют различные модификации гепатикоеюностомий (см. рис. 97—100).
Однако при этих операциях невозможно обеспечить точное сопоставление тканей в анастомозе и, кроме того, в анастомоз вовлекается рубцовая ткань, что ведет к быстрому рубцовому сужению созданных анастомозов и требует очень длительного каркасного дренирования. Более рациональными являются методики, предусматривающие втяжение слизистой оболочки тонкой кишки в просвет культи печеночного протока в процессе создания гепатикоеюноанастомоза. Такую методику предложил Cole еще в 1948 г. (рис. 96).

При этом муфту слизистой оболочки тонкой кишки на «потерянном» дренаже вводят в просвет печеночного протока, а саму кишку фиксируют к капсуле печени и рубцовым тканям. Практически впервые был создан билиодигестивный анастомоз без швов. Однако «потерянный» дренаж не создает тесного контакта слизистой оболочки кишки и желчного протока, быстро инкрустируется и становится помехой для нормального формирования соустья. Smith (1967) заменил в методике Cole «потерянный» дренаж на полууправляемый транспеченочный (рис. 97);

втяжение слизистой оболочки стало более эффективным и контакт слизистых оболочек более надежным. В дальнейшем Smith начал осуществлять втяжение слизистой оболочки при помощи того же транспеченочного дренажа, но с раздувным баллончиком. Такая методика обеспечивала тесный контакт слизистых оболочек и максимальное прижатие самой кишечной петли к протоку и фиброзной оболочке печени. Кроме того, внедрение части баллончика вместе со слизистой оболочкой в культю протока способствовало формированию анастомоза с более широким просветом.
Изучив все виды анастомозов, мы пришли к заключению, что последняя методика при создании гепатикоеюностомии в зоне ворот печени является наиболее рациональной. По методике Smith через 3 нед после операции баллон спускают и удаляют, чего, по нашему мнению, явно недостаточно для надежного формирования анастомоза и профилактики сужения анастомоза впоследствии. Исходя из сказанного и на основании собственного опыта операций при Рубцовых стриктурах желчных протоков, мы разработали и внедрили в практику дилатационный метод лечения и профилактики оубцовых
стриктур, в основе которого лежат предложения Smith.
Техника операции. После выделения культи общего печеночного протока из рубцовых тканей и по возможности иссечения их до неизмененной слизистой оболочки внутри культи протока боковые поверхности протока рассекают в сторону ворот печени на 3—4 мм для получения более широкого билиодигестивного соустья. На петле тонкой кишки, предназначенной для создания анастомоза и выключенной из пищеварения по Ру или Шалимову, у места создания анастомоза выкраивают серозно-мышечный диск диаметром 10—15 мм, в зависимости от ширины культи печеночного протока. В центре этого диска в обнаженной слизистой оболочке делают небольшое отверстие (диаметром 2—3 мм). Такое же отверстие делают на боковой поверхности стенки отводящей петли кишки на 10—15 см ниже выкроенного диска. Через оба отверстия проводят хлорвиниловую трубку с раздувным баллончиком. Выше и ниже баллончика делают 5—6 боковых отверстий для оттока желчи. Диаметр трубки подбирают в соответствии с шириной культи печеночного протока и на 0,5—1 мм меньше его. Проксимальный конец трубки выводят через отверстие, созданное в диске слизистой оболочки, и затем через один из печеночных протоков и печень— на переднюю брюшную стенку наружу. Над баллончиком кисетным швом из тончайшего рассасывающегося шовного материала на атравматической игле край слизистой оболочки фиксируют вокруг трубки. Баллончик на трубке раздувают до диаметра 2—2,5 см. Потягиванием за наружный проксимальный конец труб-
ки диск слизистой оболочки в виде муфты имеете с прилежащей частью стенки кишки вводят в просвет протока на глубину 2— 5 мм, остальная часть кишки прижимается к протоку и фиброзной оболочке печени, притом настолько плотно, что наложение дополнительных швов становится излишним. И таком натянутом положении проксимальный конец трубки фиксируют на коже специальным фиксатором. Дистальный конец трубки вместе с воздуховодом баллончика герметизируют у выхода из кишки двумя кисетными швами и выводят на боковую поверхность брюшной стенки (рис. 98) по типу дренажа Saypol.
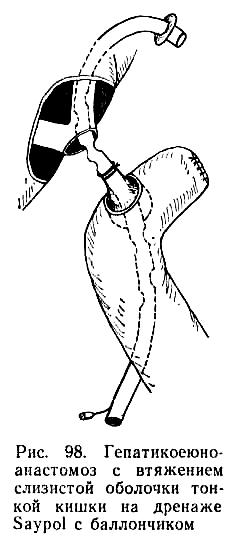
Таким образом, дренаж становится полностью управляемым, анастомоз формируется без швов и максимально большого диаметра соответственно ширине культи печеночного протока. Отток желчи осуществляется как наружу через проксимальный и дистальный концы трубки, так и в кишечник, через имеющиеся в трубке отверстия. Спустя 15 сут, когда петля кишки в достаточной степени срастается с фиброзной оболочкой печени, а слизистая оболочка кишки — со слизистой оболочкой протока, из баллончика удаляют жидкость или воздух и трубку вместе с баллончиком смещают в дистальном направлении до тех пор, пока в просвете анастомоза останется часть трубки без отверстий. Оба конца трубки укорачивают и соединяют между собой поверх брюшной стенки. Отток желчи в кишечник осуществляется, как оказалось, беспрепятственно через анастомоз вокруг трубки, так как диаметр анастомоза всегда больше диаметра трубки на 1—2 мм. Отсутствие отверстий в трубке исключает сообщение желчных протоков с внешней средой, что уменьшает опасность инфицирования желчи, развития холангита и анастомозита. На этом первый этап лечения заканчивается. На втором этапе каждые 1—2 мес проводят дилатацию анастомоза стандартными пластмассовыми дила-таторами, применяемыми для ангиодилатации. Дилатацию выполняют под давлением 4—5 атм одноразово в течение 3—5 мин, расширяя таким образом анастомоз в процессе его формирования до диаметра печеночного протока, а возможно, и больше, который был анастомозирован в процессе операции. Сеансы дилатации прекращают тогда, когда для расширения анастомоза не требуется высокого давления и у больного отсутствуют болевые ощущения. Обычно достаточно 3—4 сеансов дилатации, что занимает 6 мес. Техника
самой дилатации заключается в следующем: по трубке через анастомоз проводят проводник, трубку удаляют и по проводнику вводят дилататор. Под контролем рентгенотелевизионного экрана манжетку дилататора устанавливают на уровне анастомоза. После расширения анастомоза дилататор удаляют и по тому же проводнику устанавливают старую трубку или новую такого же диаметра, если в этом есть необходимость (отложение желчных солей, жесткость трубки).
После окончания второго этапа лечения (6 мес после операции) старую трубку заменяют тонкой, диаметром 3 мм, для проведения контрольных исследований ширины анастомоза с помощью дилататора в последующие месяцы (1 раз в 3 мес). По истечении 12— 24 мес со дня операции в зависимости от степени рубцовых изменений желчных протоков, обнаруженных во время операции, удаляют последнюю трубку, и лечение считается законченным. В тех случаях, когда нет уверенности в стабилизации процесса рубцевания в области анастомоза (увеличение давления при контрольных проверках ширины анастомоза), последнюю трубку заменяют трубкой диаметром 2 мм и оставляют на неограниченное время для дилатации в случае стойкого сужения анастомоза, избегая тем самым повторной операции. Такая тонкая трубка не беспокоит больного, не вызывает вспышек холангита и позволяет больному приступить к обычной для него работе; значительно сокращается срок инвалидности.
Описанный метод лечения позволяет сократить срок каркасного дренирования и добиться более стойких результатов. Однако он громоздкий, требует постоянного контроля за состоянием больных, периодической госпитализации для проведения дилатации, которую часто необходимо проводить под рентгеновским экраном, что заставляет облучать больного и самого исследователя.
Мы разработали более простой метод лечения тех же поражений желчных протоков. В основу метода положено наблюдение, заключающееся в том, что участок сужения анастомоза при рецидиве заболевания имеет ограниченную протяженность (2—3 мм) и относительно легко поддается расширению дилататором, но так же легко, хотя и не полностью, возвращается в прежнее состояние после удаления дилататора. Поэтому достаточно в область анастомоза в процессе его формирования ввести какой-либо каркас из инертного материала, который бы не позволил рубцовым тканям вызвать сужение анастомоза, и рецидива заболевания не будет. В связи с этим был изобретен сетчатый каркас из тонкой танталовой проволоки специально для создания билиодигестивного анастомоза по типу «зонтика».
Техника операции. Иссекают рубцовую ткань, мобилизуют культю печеночного протока и, если культя имеет длину 2—3—5 мм, то выполняют ту же операцию по типу вышеописанной гепатикоеюностомии на транспеченочном дренаже с баллончиком, но с введением в область анастомоза сетчатого металлического каркаса. Для этого через отдельный разрез в подготовленной для анастомоза петле кишки вводят сетчатый каркас, который надевают на проксимальный конец транспеченочного дренажа и располагают над баллончиком. Затем, как и в предыдущей методике, проксимальный конец дренажа проводят через диск слизистой оболочки и транспеченочно выводят наружу. Баллончик раздувают, над трубчатой частью каркаса кисетным швом фиксируют слизистую оболочку в трубке. Потягиванием за проксимальный конец трубки петля кишки вместе с баллончиком и сетчатым каркасом, окутанным слизистой оболочкой, внедряется в культю печеночного протока. При более сильном потягивании кишка плотно прижимается к протоку и фиброзной оболочке печени. В таком натянутом положении проксимальный конец трубки фиксируют на коже передней брюшной стенки (рис. 99).


Отток желчи осуществляется по трубке как в кишечник, так и наружу. Через 15 дней баллончик спускают и удаляют вместе с трубкой в дистальном направлении. К этому времени шов, фиксирующий слизистую оболочку кишки к трубке, рассасывается или прорезывается, каркас,участка желчных протоков при всегда увеличенной печени создает и без того большие трудности в формировании билиодигестивного анастомоза. Значительным препятствием к адекватному созданию анастомозов в этой области является, как правило, малый диаметр долевых протоков, которые, в отличие от остальных желчных протоков, при окклюзии дистальных отделов расширяются очень незначительно (до 4—5 мм) или вообще не изменяются, особенно при наличии наружного желчного свища. Создание анастомоза обычным шовным способом представляет значительные трудности еще и потому, что толщина слизистой оболочки кишки в 3 раза больше толщины стенки печеночных протоков и в этих условиях точное сопоставление слизистых оболочек невозможно. Поэтому всю надежду возлагают на каркасный дренаж с неограниченным сроком дренирования. Такое положение спасает жизнь больного, но делает его инвалидом на долгие годы или навсегда. В тех случаях, когда тщательная препаровка и иссечение рубцовой ткани в зоне ворот печени приводят к мобилизации отдельных долевых протоков либо места их слияния, задача хирурга состоит в создании общего желчного канала, который затем уже соединяют с тонкой кишкой (первый, более легкий, вариант операции). Если место слияния долевых протоков оказывается в ткани печени на глубине 10—15 мм, то достичь его можно лишь пункцией через рубцовую и измененную ткани печени; затем по игле вскрывают полость (второй вариант операций). Такая патология является наиболее тяжелой и наименее перспективной в смысле излечения.
Первый вариант операций применяют в тех случаях, когда зона слияния долевых протоков сохранена либо разрушена, но удается выделить долевые протоки, которых может быть 2, 3, 4 и более. К ним относятся: бигепатикоеюностомия с рассечением левого печеночного протока и бигепатикоеюностомия без его рассечения.
Бигепатикоеюностомия с рассечением левого печеночного протока. Выделенные долевые протоки берут на боковые и верхние держалки, освобождают от замазкообразной желчи, гноя и мелких камней. Металлическим пуговчатым зондом исследуются оба протока. Левый проток, расположенный более поверхностно, рассекают продольно влево от места слияния протоков на 10—15 мм (рис. 102).
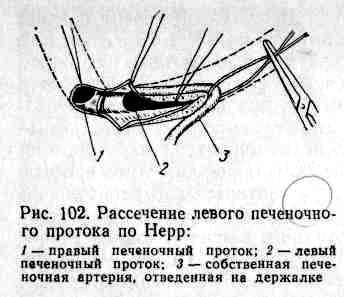
Края рассеченного протока берут на верхние держалки. Очень часто в 5—6 мм от места слияния протоков левый проток перекрещивает собственная печеночная артерия или левая ее ветвь. Если последняя мешает продлить линию разреза, ее следует мобилизовать, взять на держалку и сдвинуть влево. Если этого выполнить нельзя из-за рубцового процесса, от дальнейшего рассечения протока следует отказаться. Полученное таким образом отверстие диаметром 10—15 мм уже пригодно для создания бигепатикоеюностомы даже без каркасного дренирования (каркасный дренаж можно использовать для правого протока окутанный слизистой оболочкой, остается фиксированным в печеночном протоке (рис. 99—101).

По описанной методике выполнена гепатикоеюностомия у 6 больных с рубцовой стриктурой желчных протоков в зоне ворот печени. В течение 8 лет после операции признаков рецидива заболевания не обнаружено.
Бигепатикоеюностомия. Если все реконструктивные операции в зоне ворот печени составляют 40,1 %, то из них на долю бигепатикоеюностомий приходится 29 %, то есть почти у каждого третьего больного в рубцовый процесс вовлекается зона слияния долевых печеночных протоков. Высокое расположение этого (рис. 103).
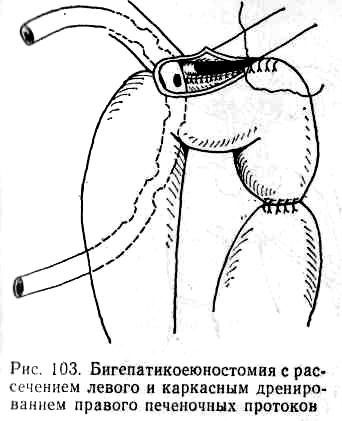
Чаще всего в этих случаях применяют транспеченочное дренирование по Smith или Saypol. Анастомоз формируют двухрядными швами: вначале се-розно-мышечную оболочку тонкой кишки отдельными швами из нeрассасывающихся нитей фиксируют к рубцовым тканям и фиброзной оболочке печени ниже места зияния долевых протоков, затем вскрывают просвет кишки на расстояние, равное диаметру обоих протоков, и создают заднюю губу анастомоза швами из рассасывающегося материала на атравма-тической игле. Обычно применяют отдельные швы, которые накладывают на расстоянии 1,5—2 мм друг от друга; допустим и непрерывный шов без захлестки. После установления каркасного дренажа создают переднюю губу анастомоза по типу задней узелками внутрь и укрепляют вторым рядом швов, фиксируя петлю кишки к капсуле печени и рубцовым тканям.
Бигепатикоеюностомия без рассечения левого печеночного протока. Этот вид вмешательства применяют при невозможности освободить и рассечь левый печеночный проток из-за мощных рубцовых напластований, содержащих сосуды. Если место слияния долевых протоков сохранено, создают обычный бигепатикоеюноанастомоз, но уже обязательно на 2 транспеченочных дренажах, по Smith или Saypol (рис. 104).
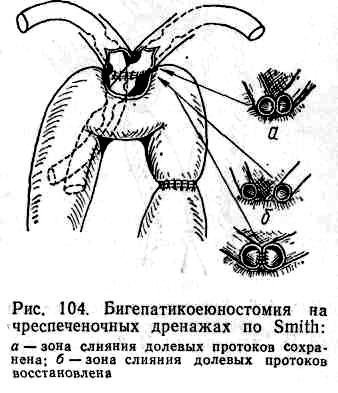
В тех случаях, когда устье долевых протоков разрушено, но тщательная препаровка все же позволила обнаружить оба протока, следует стремиться к созданию анатомической ситуации, близкой к естественной, путем сшивания внутренних стенок долевых протоков (рис. 105).
В остальном операция не отличается от предыдущей. Предложенный в этих случаях U-образный транспеченочный дренаж (Э. И. Гальперин, Н. Ф. Кузовлев, 1982), хотя и обеспечивает наружный отток желчи, но мало препятствует стено-зированию соустья, так как петля дренажа находится в центре печеночного соустья и не может служить достаточной защитой анастомоза со стороны кишечного соустья (анастомоз может полностью отшнуроваться от зоны слияния протоков).
Наиболее рациональным в этих случаях, по нашему мнению, является бесшовный анастомоз с втяжением слизистой оболочки тонкой кишки на 2 транспеченочных дренажах по Saypol с баллончиками (рис. 106). Техника операции состоит в следующем: на стенке петли тонкой кишки, выключенной из пищеварения по Ру или Шалимову, соответственно 2 протокам выкраивают 2 серозно-мышечных диска, в центре каждого делают отверстие диаметром 2 мм и через него проводят пластмассовую перфорированную трубку с баллончиком. Проксимальные концы трубок выводят через соответствующие долевые протоки транспеченочно, дистальные — через отводящее колено тонкой кишки раздельно. При потягивании за проксимальные концы трубок слизистая оболочка, фиксированная к трубке выше раздувных баллончиков, в виде муфты втягивается в проток. В это время слизистая оболочка по окружности выкроенного диска вместе со стенкой кишки плотно прижимается к раневой поверхности печени и ее фиброзной оболочке. Наложение дополнительных швов не обязательно. Дальнейшая тактика такая же, как при создании гепатикоеюностомы.
Второй вариант операций применяют в тех случаях, когда выделить долевые протоки путем препаровки невозможно. Внутрипеченочное расположение протоков определяют путем пункции и перфорации тканей по игле зажимом. Говорить о какой-либо адаптации слизистых оболочек протока и тонкой кишки при создании билиодигестивного анастомоза в этих условиях не приходится. Создается максимально тесный контакт между вскрытой полостью, содержащей желчь, и кишкой. Такие ситуации встречаются редко. Как правило, они возникают у больных, перенесших несколько неудачных реконструктивных операций на желчных протоках, с тяжелым циррозом печени. Операция заключается в создании бесшовного анастомоза с втяжением слизистой оболочки кишки на
дренаже Saypol с баллончиком. Методика создания соустья ничем не отличается от вышеописанных.
Резекцию участков печени или целой доли ее для создания би-лиодигестивных анастомозов по типу операций Dogliotti и Long-mire в настоящее время у больных с рубцовыми стриктурами желчных протоков не производят. Использование наружных свищевых ходов для создания билиодигестивных анастомозов в связи с ненадежностью последних также потеряло свое значение.
Таким образом, каркасное дренирование остается неотъемлемой частью реконструктивных операций при рубцовых стриктурах желчных протоков. Без него можно обойтись лишь в тех случаях, когда ширина созданного анастомоза составляет не менее 15 мм. Даже при естественном сужении анастомоза в 2 раза сохраняется нормальный желчеотток. В остальных случаях операции, выполняемые без каркасного дренирования, могут вызывать рецидив заболевания.
Из 241 реконструктивной операции без дренирования выполнено 132 (54,8%) вмешательства, с дренированием по Saypol—14 (5,8%), по Smith — 53 (22%), на нисходящем дренаже — 38 (15,8%). Причем 20 (8,3%) операций выполнено с созданием бесшовного анастомоза на дренаже с баллончиком и 1 (0,4 %) — на сетчатом каркасе из танталовой проволоки.
Без каркасного дренирования выполнены в основном операции, при которых для создания билиодигестивного анастомоза использовали двенадцатиперстную кишку, что составило 59,1 % по отношению ко всем операциям без дренирования. Техника выполнения таких операций более простая, ширина анастомозов достигает 15 мм и более, двенадцатиперстную кишку сшивали в основном с дистальными отделами желчных протоков, которые в меньшей степени подвержены грубому рубцеванию. Следует отметить, что билиодуоденальные анастомозы менее склонны к рубцовому сужению, чем билиоеюнальные, и это следует всегда учитывать при выборе метода реконструкции. Остальные (49,9 %) операции без дренирования имели характер билиоеюнальных, но ширина анастомоза составляла не менее 10—15 мм.
Применение каркасных дренажей оказалось необходимым при выполнении 45,2 % реконструктивных операций. Основным критерием являлась невозможность создания анастомоза шириной более 10 мм, точной адаптации слизистых оболочек кишки и желчных протоков, особенно при повторных операциях в связи с Рубцовыми изменениями старых анастомозов, выраженным рубцовым процессом в области окружающих анастомоз тканей.
Как уже отмечалось, бужирование не является самостоятельным методом лечения рубцовых стриктур желчных протоков, однако оно может быть применено при рубцовых стриктурах билиодигестивных анастомозов как исключение у больных с выраженными билирубинемией и явлениями холестатического гепатита, когда на операции обнаруживается лишь сужение до 2—3 мм, но в связи с застоем желчи и вторичным холелитиазом наблюдается клиническая картина полной непроходимости желчных протоков. В этих случаях следует промыть протоки через вскрытую кишку вблизи анастомоза, расширить отверстие бужами и выполнить дилатацию анастомоза до ширины не менее 10 мм. После этого через просвет анастомоза устанавливают управляемый дренаж для последующего проведения сеансов дилатации на протяжении 1—1,5 года. Бужирование применено нами лишь у 7 (2,9 %) больных с неблагоприятными результатами оперативного лечения рубцовых стриктур и поздно поступивших для повторных вмешательств.
Результаты реконструктивных операций. Непосредственные результаты операций, как правило, хорошие. По нашим данным, послеоперационная летальность составляет лишь 5,7 %. В послеоперационный период под воздействием интенсивной терапии быстро снижается содержание билирубина в крови, восстанавливается функция печени и исчезают явления печеночно-почечной недостаточности даже у тех больных, которые неоднократно подвергались оперативным вмешательствам и операция длилась у них от 2 до 5 ч.
В ближайшие дни после операции могут наблюдаться следующие осложнения: 1) недостаточность анастомоза. Осложнение возникает редко и, как правило, поддается консервативному лечению; 2) печеночно-почечная недостаточность. Наиболее частое осложнение, которое может не проявляться клинически. Профилактика этого осложнения должна начинаться еще в дооперационый период; 3) холангит. Явление постоянное, особенно у больных, оперированных с применением каркасного дренирования. В редких случаях холангит ведет к образованию холангиогенных абсцессов печени, поэтому применение антибиотиков должно быть обязательным; 4) желудочно-кишечное кровотечение. В редких случаях возникает в результате пролежня сосуда при транспеченочном дренировании. Даже небольшая, своевременно не замеченная, кро-вопотеря у больных с холангитом, печеночно-почечной недостаточностью является грозным осложнением, иногда ведущим к смерти. В связи с этим необходим тщательный контроль отделяемого через дренаж. При появлении признаков кровотечения применяют гемостатическую терапию вплоть до удаления транспеченочного дренажа и тампонады канала гемостатической губкой; 6) обтурация одного из долевых протоков при транспеченочном дренировании. Признаками осложнения являются медленное уменьшение содержания билирубина в крови, некупирующийся холангит, появление или усиление признаков печеночно-почечной недостаточности. В этих случаях необходимы рентгенологический контроль с разведенным контрастным веществом (1:2), смещение или замена транспеченочного дренажа другим с большим количеством боковых отверстий; 7) острая язва двенадцатиперстной кишки как результат недостаточной нейтрализации кислого содержимого желудка, которая исчезает вскоре после коррекции желчевыводящих путей и функции печени, поэтому оперативное лечение следует применять лишь при наличии некорригируемого язвенного кровотечения.
Из 211 больных, которым были выполнены реконструктивные операции, умерли 12 (5,7 %). Основной причиной смерти, как и при восстановительных операциях, была печеночно-почечная недостаточность (9 больных); у 1 больной внезапно развилось профуз-ное аррозивное кровотечение из сосудов печени по ходу транспеченочного дренажа; 2 больных умерли от гнойно-септических осложнений на почве холангиогенных абсцессов печени. Все эти больные подвергались неоднократным оперативным вмешательствам, которые не давали должного эффекта, в связи с чем проводились длительные курсы консервативного лечения. Очередные вмешательства оказались поздними.
Нами изучены результаты 204 реконструктивных вмешательств в сроки от 6 мес до 14 лет (табл. 19).

Неудовлетворительные результаты наблюдались после 39 (19,1 %) операций, причем 30 (14,7 %) из них были повторными в связи с рецидивами заболевания.
Хорошие и удовлетворительные результаты получены после 165 (80,9 %) реконструктивных операций.
Результаты реконструктивно-восстановительных операций представлены в табл. 20.

Хорошие и удовлетворительные результаты составили 79,4 % (215 операций), неудовлетворительные — 20,6% (56 операций). Повторные вмешательства выполнены у 44 (16,2 %) больных в связи с рецидивами заболевания.
Среди больных, оперированных по поводу Рубцовых стриктур желчных протоков, рецидивы возникли у 34 (12,3 %). Этим больным было выполнено 78 реконструктивно-восстановительных операций, а в общем, учитывая и первую операцию, они были оперированы 112 раз, то есть каждый больной оперирован в среднем 3 раза.
У 21 больного рубцовое поражение находилось в верхней части желчных протоков, включая зону ворот печени. Наиболее часто рецидивы возникали после гепатикоеюностомии (20 больных).
Частота возникновения послеоперационных рецидивов была следующей: до 1 года — 28 случаев, от 1 года до 3 лет— 14 и после 3 лет — 2. Наиболее частое развитие рецидивов вскоре после операции объясняется погрешностями в технике оперирования и в послеоперационном лечении. Эти рецидивы наиболее опасны, так как развиваются вследствие истинного рубцового сужения, отличаются быстрым и тяжелым течением. Такие больные подлежат срочному оперативному лечению.
Через 1 год после операции к рубцовому сужению присоединяется вторичный холелитиаз. В этих случаях после восстановительных операций показаны эндоскопическая папиллосфинктеротомия и удаление замазкообразной желчи и камней с ревизией желчных протоков при помощи корзинки Дормиа и прямого промывания; после реконструктивных операций — чрескожная чреспеченочная холангиография, холангиостомия и дилатация анастомоза с последующим промыванием желчных протоков. Операцию выполняют при обнаружении стойкого сужения в области анастомоза, если электрорассечение при помощи чрескожной чреспеченочной холан-гиостомии по техническим причинам невозможно.
При рецидивах, возникающих через 3 года и более после операции, все мероприятия должны быть направлены на устранение вторичного холелитиаза, так как чаще всего он является основной причиной клинических проявлений. Оперативное лечение показано только при полном заращении анастомоза.
Причиной рецидива стриктур у 32 из 44 повторно оперированных было необоснованное кратковременное дренирование в связи с применением полууправляемых дренажей, у 11 больных — отказ от применения каркасных дренажей в связи с неправильной оценкой операционной ситуации, у 1 больного—применение скрытого дренажа, который последние 10 лет вообще не используют.
У всех больных с рецидивами произведены реоперации. У 4 больных результат остался неудовлетворительным, но от дальнейшего лечения они отказались в связи с отсутствием у них стойкой желтухи и постоянных явлений холангита, 5 продолжают лечение, у 20 получен хороший и у 5 — удовлетворительный результат.
Таким образом, хирургическое лечение больных с Рубцовыми стриктурами желчных протоков является весьма сложным и не всегда приносит успех.
Все больные с впервые выявленными Рубцовыми стриктурами подлежат раннему оперативному лечению; при рецидивах заболевания производят чрескожную чреспеченочную дилатацию, направленную как на устранение рубцового сужения, так и на лечение вторичного холелитиаза.
Оперативное лечение должно включать элементы активного вмешательства в процесс формирования анастомоза путем управляемого каркасного дренирования и баллонной дилатации. Необходимо также внедрять в практику элементы защиты анастомозов от рубцевания путем использования эндопротезов.
