
- •Часть I хирургия печени
- •Глава 1. Анатомия и физиология
- •Глава 2. Опухоли печени
- •Глава 3. Травматические повреждения печени
- •Глава 4. Абсцессы печени
- •Глава 5. Эхинококкоз и альвеококкоз печени
- •Глава 6. Непаразитарные кисты печени
- •Глава 7. Хронический гепатит, цирроз печени и синдром портальной гипертензии
- •Глава 8. Пересадка печени
- •Часть II
- •Глава 1. Анатомия и физиология
- •Глава 2. Аномалии развития желчевыводящих путей
- •Глава 3. Желчнокаменная болезнь и заболевания желчного пузыря
- •Глава 4. Непроходимость желчных протоков доброкачественной этиологии
- •Глава 5. Рак желчного пузыря и внепеченочных желчных протоков
Глава 3. Желчнокаменная болезнь и заболевания желчного пузыря
История хирургии желчнокаменной болезни и заболеваний желчного пузыря имеет почти вековую давность, однако большое количество вопросов этой сложной и многообразной проблемы остается нерешенным и до настоящего времени. Ежегодно увеличивается число больных с этой патологией. Так, по данным М. И. Лукинского и соавторов (1976), госпитализация больных с заболеваниями желчевыводящих путей в 1972 г. увеличилась по сравнению с 1964 г. в 2,6 раза. За последние 8 лет в Праге число больных, лечившихся по поводу желчнокаменной болезни, выросло на 31 %, а количество операций увеличилось на 75 % (В. Nie-derle, 1977). По данным гастроэнтерологического конгресса, (Копенгаген, 1970) в 23 европейских странах число случаев желчнокаменной болезни у взрослых в среднем выросло с 8 до 20 %. По поводу желчнокаменной болезни и заболеваний желчного пузыря
в СНГ ежегодно выполняют около 100 тыс. холецистэктомий (О. Б. Милонов, А. Д. Тимошин, 1982), в США — 500—700 тыс. Установлено, что в США около 7 % всего населения страдает холелитиазом; в 1961 г. у 15—18 % взрослых диагностирована желчнокаменная болезнь. И если в начале нашего столетия на вскрытии желчные камни обнаруживали у 4—6 % умерших, то сейчас эта цифра достигает 13,9—16 %. По данным немецких и американских авторов, таких случаев еще больше. Известно, что около 40 % больных с заболеваниями органов пищеварения составляют больные с различными формами холецистита и у 40 % лиц старше 40 лет, как правило, находят камни в желчном пузыре. Острая патология желчных путей среди всех острых хирургических заболеваний органов брюшной полости по частоте уступает лишь острому аппендициту, а иногда встречается чаще.
Желчнокаменная болезнь, как и различные заболевания желчного пузыря, наиболее часто встречается у жителей Европы, Северной и Южной Америки, реже — Азии и Центральной Африки.
Этиология и патогенез. До настоящего времени причины образования желчных камней окончательно не выяснены. Большинство исследователей выделяют 4 разновидности желчных камней: холестериновые, металлохолестериновые, холестериново-фосфатидные и фосфатидно-белковые. Некоторые исследователи делят их лишь на 2 группы — холестериновые и пигментные, не выделяя группу камней смешанного типа, так как практически все они являются смешанными. Основные составные части желчных камней — холестерин и билирубин находятся в желчи в коллоидном состоянии. При нарушении механизма удержания их в этом состоянии образуется осадок, желчь становится более концентрированной, и начинают формироваться камни.
Установлено 3 основные пути, ведущие к нарушению баланса коллоидного состояния желчи: нарушение обмена веществ, воспаление стенок желчевыводящих путей и застой желчи. Однако впоследствии было доказано, что ни застой желчи в желчном пузыре, ни воспалительные изменения в нем не играют существенной роли в образовании камней. Они выяснили, что патологическая желчь, перенасыщенная холестерином, поступает уже из печени, а в желчном пузыре лишь завершается процесс формирования камней. Эти данные были впоследствии подтверждены рядом исследователей. Таким образом, не столько заболевание желчного пузыря, сколько заболевание всего организма и в первую очередь нарушение функции печени играет роль в развитии желчнокаменной болезни. Более чем у 50 % больных с холедохолитиазом имеются явные признаки стенозирующего папиллита, способствующего не только удержанию конкрементов, мигрировавших в общий желчный проток из желчного пузыря, но и хроническому нарушению функции печени, начавшей продуцировать патологическую желчь, которая в определенных условиях дает начало камнеобразованию не только в желчном пузыре, но и в желчных протоках. Поэтому основной принцип хирургического лечения желчнокаменной болезни заключается не только в удалении желчного пузыря, но и в полной коррекции патологии желчных протоков, направленной на предотвращение застоя и воспаления, а следовательно, и на нормализацию функции печени.
Безусловно, ни одна из указанных причин сама по себе не может вызвать образование камней, играет роль только совокупность всех факторов. Как известно, у 20 % больных камни желчных путей оказываются стерильными, а у 52 % желчь не дает роста бактерий, но это еще не является свидетельством того, что процесс камнеобразования происходит без воспаления в желчевыводящих путях. То же самое можно сказать и в отношении нарушения обменных процессов, и в первую очередь обмена холестерина. Известно, что холестериновые камни обнаруживаются у многих больных, у которых установить нарушение холестеринового обмена не удается. Это можно объяснить тем, что на процесс образования желчных камней влияет не столько уровень холестерина в крови, сколько одновременное нарушение концентрации жирных кислот и несвязанных желчных солей.
Прямое отношение к образованию пигментных камней имеют обменные нарушения, связанные с повышением уровня билирубина, особенно свободной его фракции. При определенных условиях образовавшийся кальция билирубинат может выпадать в осадок, что служит толчком к началу образования пигментных камней. Количество же солей кальция в виде бикарбонатов всегда увеличивается при всех застойных и воспалительных явлениях в желчных протоках и желчном пузыре. В ряде случаев камни состоят только из этих солей. В обычных же условиях кальция карбонат в образовании камней не участвует. Известно также, что чем дольше закрыт пузырный проток, тем более массивны известковые наслоения в желчном пузыре.
Формирование самого камня, как правило, происходит из «ядра», которое чаще всего содержит частицы азота, фосфора, натрия, меди, свинца, марганца, ванадия. Последние вместе с кальцием, магнием образуют мелкие камни (Г. А. Мироненко, Г. А. Юргенсон, 1976). Постепенно на «ядро» адсорбируются путем кристаллизации металлохолестериновые или пигментные соединения, а также элементы эпителия и микроорганизмы. Само «ядро» обычно рассматривают как «полип», который формируется на стенке желчного пузыря, а затем по мере роста отпадает и становится изолированным камнем. Такой «полип» иногда можно определить рентгенологически.
Камнеобразование часто происходит у людей, страдающих сахарным диабетом, ожирением, гипертонической болезнью, гемолитической анемией. Подавляющее большинство больных желчнокаменной болезнью — люди с избыточной массой тела, 23,7% страдают гипертонической болезнью, около 32%—различными заболеваниями гемолитического характера (чаще — семейной гемоли-тической анемией).
Несомненно, что в образовании камней немаловажную роль играет нарушение функции желчного пузыря и желчевыводящих путей. Однако клиницистам известны и такие явления, как отсутствие камней в длительно существовавшем гипотоничном или ди-скинетичном желчном пузыре, а также наличие их в нормально функционирующем пузыре. Образовавшийся камень уже сам является причиной дальнейших нарушений функции или полной закупорки желчевыводящих протоков. Значение гипертонии сфинктера печеночно-поджелудочной ампулы или папиллостеноза в образовании камней в желчном пузыре и общем желчном протоке до конца не выяснено. Остаются неясными и причины самостоятельного образования камней в желчных протоках — факт, который в настоящее время является неоспоримым, хотя у подавляющего большинства больных наличие камней в протоках — это результат проскальзывания их из желчного пузыря. «Растут» они в общем желчном протоке, как и в желчном пузыре, вследствие воспаления, застоя желчи, нарушения обмена холестерина и билирубина. Образование и рост камней осуществляется непрерывно толчками.
Большой интерес представляют данные, посвященные роли инфекции в образовании желчных камней.
Точки зрения по этому вопросу в разные периоды изучения проблемы существенно отличались друг от друга. Так, Aschoff (1909) считал, что желчнокаменная болезнь в асептических условиях начинается с образования холестериновых камней. Дальнейшему росту их способствует вспышка инфекции. Проведенные позже микроскопические и бактериологические исследования стенки желчного пузыря, камней и желчи в аэробных и анаэробных условиях показали, что аэробные бактерии имеются у 14,3 % больных, а анаэробные — у 2,5 % (Р. А. Иванченкова и соавт., 1985; X. X. Мансуров и соавт., 1985; I. Maki и соавт., 1982).
Ю. М. Дедерер и соавторы (1983) приводят схему начальных этапов литогенеза, в которой одно из центральных мест среди индуцирующих факторов занимает анаэробная инфекция.
По форме различают желчные камни в виде тутовых ягод (31 %); чаще они холестериновые, очень быстро увеличиваются и наблюдаются преимущественно у женщин. Граненые (6 %) камни, чаще холестерин-пигментноизвестковые, наблюдаются в основном у мужчин, имеют меньшую тенденцию к росту. Смешанные конкременты могут иметь вид тутовых ягод или быть яйцеобразной формы (W. Hess, 1961).
Судить о природе желчных камней можно уже по обзорным рентгенограммам. Так, холестериновые камни не контрастируются. Камни, содержащие известь, дают контрастную тень. Желчные камни, состоящие из холестерина с небольшими примесями известковых солей (это в равной мере относится и к камням с гранями в виде тутовых ягод), могут самостоятельно разрушаться, а также растворяться под воздействием различных веществ.
При появлении в желчном пузыре первых, даже небольших, камней организм стремится избавиться от них путем выталкивания в общий желчный проток и затем в двенадцатиперстную кишку. В ряде случаев это удается, пока камни имеют очень малые размеры, но уже одно прохождение их по желчным путям вызывает тяжелый приступ печеночной колики, которая наблюдается у 30—40 % всех больных. В момент прохождения камня через сфинктеры желчевыводящих путей резко нарушается функция желчного пузыря, он не опорожняется и при наличии в нем инфекции начинает воспаляться, а пребывание камня в пузырном протоке и полная закупорка последнего вскоре приводят к серьезным осложнениям. Кратковременная закупорка протока после прохождения камня ведет к быстрому восстановлению функции желчного пузыря. После прохождения камня или возвращения его в желчный пузырь колика прекращается.
Вопрос о том, можно ли считать отхождение камней самоизлечением желчнокаменной болезни, остается спорным и до настоящего времени. Наш многолетний опыт лечения больных с желчнокаменной болезнью показывает, что самостоятельно или под воздействием холеретических или холекинетических средств желчные конкременты действительно могут почти безболезненно выходить из желчного пузыря и желчных протоков, однако это относится лишь к тем случаям, когда камень имеет величину не более просяного зерна и отсутствуют патологические изменения в пузырном протоке или в большом сосочке двенадцатиперстной кишки. Более крупные камни иногда могут выходить из желчного пузыря, проходить через пузырный проток и попадать в кишечник под воздействием сильных холекинетических средств, но процесс этот сопровождается тяжелейшими приступами печеночной колики, желтухой, явлениями гепатита, резким отеком, деформацией и расширением всех желчевыводящих путей. У больного может даже развиться острая печеночная недостаточность. В связи с этим изгнание конкрементов диаметром более 1 мм, то есть уже видимых рентгенологически, является недопустимым методом лечения.
Таким образом, проблема лечения желчнокаменной болезни в настоящее время остается преимущественно хирургической и затрагивает два основных аспекта: лечение заболеваний желчного пузыря и желчных протоков, а также лечение различных осложнений желчнокаменной болезни, вызывающих непроходимость.
Исходя из этого, мы изложили тактико-технические аспекты лечения всех форм холецистита и вопросы хирургического лечения непроходимости желчных протоков как самостоятельных форм ее проявления, так и в результате осложненного течения холецистита.
С 1959 по 1990 г. под нашим наблюдением находились 8640 больных с различными заболеваниями желчевыводящих путей доброкачественного характера. У 5608 (64,8%) из них были различные формы воспаления желчного пузыря, в основном различные формы желчнокаменной болезни, в связи с чем они оперированы, у 3572 (35,2%) больных — другие заболевания желчевыводящих путей, или органов панкреатодуоденальной зоны, оставшиеся или возникшие после удаления желчного пузыря (постхолецистэктомической синдром).
Холецистит является широко распространенным заболеванием. Частота его составляет 1,4 на 1000 человек взрослого населения (А. А. Кривицкий, А. А. Коврова, 1979). Болеют холециститом лица любого возраста, преимущественно женщины.
Холецистит встречается в виде двух клинических форм: острой и хронической. Среди наблюдаемых нами больных 1140 (25,7%) были с острым холециститом и 4168 (74,3 %) с хроническим. Как острый, так и хронический процесс может развиваться или на фоне желчнокаменной болезни (острый и хронический калькулезный холецистит), или без нее (острый и хронический «бескаменный» холецистит). Известно, что «бескаменным» холециститом болеют чаще в более молодом возрасте (30—45 лет), в то время как частота обнаружения камней увеличивается с возрастом. «Бескаменный» холецистит, как и калькулезный, встречается у женщин в 2— 3 раза чаще, чем у мужчин.
Этиология и патогенез. Хроническое воспаление желчного пузыря поддерживается желчными камнями, «бескаменный» холецистит чаще всего является осложнением дискинезии желчных путей, паразитарной инвазии, неспецифической и специфической инфекции (туберкулеза, сифилиса). Общим для всех холециститов является участие банальной инфекции, хотя инфицированная желчь бывает лишь у 33 % больных; степень инфицирования возрастает до 81 % при возникновении осложнений в виде желчнокаменной болезни (С. А. Шалимов и соавт., 1992).
Независимо от формы воспаления хронический холецистит может сопровождаться приступами печеночной колики, что характерно для калькулезного холецистита, а также периодически обостряться, что также чаще бывает при локализации камней в желчном пузыре. Периодически возникающее острое воспаление под воздействием лечебных мероприятий затихает, либо деструктивные изменения в стенках желчного пузыря прогрессируют. В случаях затихания процесса восстанавливается свободный отток
желчи. В желчном пузыре сохраняется несколько более развитый фиброзный слой с образованием между мышечными пучками соединительной ткани. В ряде случаев деструктивные изменения поддерживают постоянное хроническое воспаление желчного пузыря, вызывая периодическое обострение. Способствуют этому в первую очередь камни желчного пузыря и наличие микроорганизмов. Сморщивание желчного пузыря в результате грубых деформирующих рубцов наряду со склеротическими изменениями пузырного протока приводит к нарушению нормального желчетока и прогрессированию хронического воспаления.
Острое воспаление желчного пузыря, по мнению многих исследователей, является осложнением хронического процесса (В. В. Виноградов, П. И. Зимин, 1977, и др.). Поэтому обострение хронического холецистита лечат, как и острый холецистит.
Этиологические моменты, способствующие развитию острого холецистита, разнообразны.
Клинические и экспериментальные исследования (П. М. Шорлуян, В. В. Шапошников, 1968; Э. И. Гальперин, 1969; В. В. Виноградов, С. И. Левина, 1970; Г. Н. Антоненков, В. И. Кочиашвили, 1973; С. С. Сорокин, А. С. Сорокин, 1981) показали огромную роль сосудистых изменений в стенке желчного пузыря, которые обычно связаны с общим поражением сосудов, наблюдающимся при атеросклерозе, гипертонической болезни и легочной гипертен-зии, а также с хроническими воспалительными изменениями в стенке желчного пузыря. Причем отмечено, что сосудистые изменения могут обусловливать даже резкие деструктивные изменения желчного пузыря в виде гангрены и перфорации.
Причиной острого холецистита является также застой желчи в пузыре в результате блокады шеечной части его или пузырного протока камнем, воспаленными тканями или опухолью. В тех случаях, когда во время операции обтурирующий камень не находят, считают, что он уже успел выйти в общий желчный проток или возвратился в широкую часть желчного пузыря (Д. Л. Пиковский, 1964; В. В. Виноградов, 1970; Б. А. Королев, Д. Л. Пиковский, 1971). Одной закупорки пузырного протока еще недостаточно для развития острого воспаления. Как показали исследования М. И. Кузина и соавторов (1980), вначале процесс развивается как асептический в связи с обструктивными или вазомоторными нарушениями, обусловленными нейровегетативными влияниями. У 6—27 % больных острый холецистит бывает «бескаменным». Вместе с тем, нарушение оттока желчи из пузыря является практически одной из главных и наиболее частых причин острого холецистита.
Какова же роль инфекции в возникновении острого холецистита? У подавляющего большинства больных с острым воспалением желчного пузыря в желчи обнаруживается микрофлора. Через 1 сут от начала лечения острого холецистита ее обнаруживали у 35 % больных, а через 3 сут —у 80% (G. Altmeier, 1981). Причем у 58 % больных выявлена кишечная палочка, у 18 % —сочетание кишечной палочки с другими возбудителями. Однако, согласно другим исследованиям (Н. J. Jarvinen, 1980), бактериемию, вызванную микроорганизмами, аналогичными содержащимся в желчном пузыре, в первые 24 ч после острого приступа обнаружили у 63 % оперированных, а через 11 сут и позже — у 31 %.
Отмечено (Г. Г. Караванов, С. Л. Рачкевич, 1976), что при калькулезном холецистите инфицированная желчь встречается чаще. Однако у 27,8 % больных желчь остается стерильной даже при наличии флегмонозных и гангренозных форм воспаления желчного пузыря. Следовательно, вначале имеет место асцитический некротический процесс, а затем присоединяется инфекция, что усугубляет его течение и ведет к тяжелым осложнениям.
В последнее время большое внимание стали уделять аллергическому генезу острого холецистита (А. М. Ногаллер, С. И. Смирнова, 1970; А. А. Аскаров и соавт., 1974; Ю. П. Стрельцов, 1977). По данным М. В. Даниленко и соавторов (1975), аллергическую природу острого холецистита удалось установить у 35 % больных.
Появились работы о влиянии на развитие острого воспаления желчного пузыря различных химических агентов. Так, S. Jodahe и соавторы (1977) обнаружили в лизосомах эпителия желчного пузыря фосфоролипазу, активность которой возрастает при блокаде желчного пузыря, что приводит к развитию первично-воспалительного процесса на субклеточном уровне. Подобное действие на стенку желчного пузыря могут оказывать и попадающие в полость желчного пузыря ферменты поджелудочной железы (Т. В. Шаак, 1974; Е. А. Собещанская и соавт., 1977; Э. А. Акса-баров, Т. П. Белозерова, 1977, и др.). Известен и тот факт, что присутствие ферментов поджелудочной железы в желчи нормально функционирующего желчного пузыря не ведет к каким-либо патологическим изменениям. Как справедливо отмечает Т. В. Шаак (1974), разрушающее действие ферментов возможно лишь при наличии застоя желчи.
Таким образом, выделить единую причину возникновения острого холецистита невозможно. Желчные камни, застой желчи, инфекция, сосудистые расстройства, аллергические реакции, действие химических агентов — все эти факторы в определенной ситуации могут способствовать развитию острого воспаления. В основном же возникновение острого холецистита связано главным образом с закупоркой выхода из пузыря камнем, застоем желчи, а также вспышкой инфекции, даже кратковременной.
Классификация. Основываясь на клинико-морфологических характеристиках различных форм воспаления желчного пузыря, мы разработали следующую классификацию.
I. Хронический холецистит.
1. Первично-хронический холецистит.
2. Хронический рецидивирующий неосложненный холецистит.
3. Хронический рецидивирующий холецистит, осложненный:
а) нарушением проходимости желчных протоков;
б) септическим холангитом;
в) облитерирующим холангитом;
г) панкреатитом;
д) гепатитом и билиарным циррозом печени;
е) водянкой желчного пузыря;
ж) склерозированием желчного пузыря;
з) околопузырным хроническим абсцессом;
и) хронической эмпиемой желчного пузыря.
II. Острый холецистит.
1. Простой (катаральный, инфильтративный, язвенный).
2. Флегмонозный.
3. Гангренозный.
4. Перфоративный.
5. Осложненный:
а) желчным перитонитом (без видимой перфорации);
б) околопузырным инфильтратом;
в) околопузырным абсцессом;
г) механической желтухой;
д) абсцессом печени,
е) септическим холангитом;
ж) острым панкреатитом.
Патологическая анатомия. В результате частых обострений хронического воспалительного процесса последний распространяется на близлежащие органы и даже на переднюю брюшную стенку, что приводит к образованию между ними плотных спаек, а в ряде случаев и плоскостных сращений. При разъединении таких спаек и сращений часто обнаруживаются прикрытие перфорации, микроабсцессы. Стенка желчного пузыря становится плотной, толстой (до 1 см). Серозный покров в спайках тусклый, местами покрыт сальником. Слизистая оболочка частично заменена рубцами, иногда с изъязвлениями. Нервные волокна в стенке желчного пузыря подвергаются дегенеративным изменениям, в толще стенок образуются множественные невромы. В силу обширных рубцовых изменений желчный пузырь иногда приобретает форму песочных часов.
В большинстве случаев камни в желчном пузыре располагаются свободно. В некоторых случаях воспалительный процесс приводит к рубцовому сморщиванию желчного пузыря и камни полностью выполняют пузырь, блокируя поступление в него желчи. Желчный пузырь становится функционально и рентгенологически «отключенным».
Желчный пузырь, содержащий камни и инфицированную желчь, представляет собой постоянный источник инфекции. У ряда больных острая закупорка пузырного протока или шейки желчного пузыря при известных условиях принимает хроническое течение и ведет к значительному увеличению объема пузыря. Содержимое его приобретает буровато-серый или зеленоватый цвет, с большим количеством микроорганизмов. Постепенно билирубин из желчи всасывается и она становится прозрачной, а порой и
стерильной, но иногда, в связи с выпадением большого количества кальция карбоната и накопления масс слущенного эпителия, содержимое желчного пузыря приобретает молочно-белый цвет и ошибочно может быть принято за гной. Вопрос в этих случаях решается микроскопией.
В ряде случаев жидкость, наполняющая желчный пузырь при его отключении, представляет собой продукт жизнедеятельности слизистых желез пузыря, но это не «белая желчь», которую обнаруживают в печеночных и общем желчном протоках при их длительной закупорке, являющаяся секретом печени, хотя она и не содержит желчных пигментов (Н. С. Макоха и соавт., 1976, и др.). Образовавшаяся водянка желчного пузыря может существовать длительное время, ничем себя не проявляя. Смещаемость образо-вания ограничена. Стенка такого пузыря тонкая, исчезают складки слизистой оболочки.
Однако лишь у 10 % больных с закупоркой шейки желчного пузыря и пузырного протока образуется водянка или эмпиема (W. Hess, 1961), у остальных камень возвращается в просвет пузыря. При многократных закупорках хронический процесс прогрессирует. Постоянное воспаление приводит к утолщению стенок желчного пузыря, их склеротическому и фиброзному перерождению с образованием рубцовосморщенного пузыря. Длительное хроническое воспаление в ряде случаев ведет к полной облитерации желчного пузыря, независимо от наличия в нем камней. Атрофический желчный пузырь резко уменьшается в размерах и почти полностью погружается в печень, стенки его становятся очень плотными. Обнаружить такой пузырь можно случайно во время операции или при рентгенологическом исследовании из-за скопления в нем кальцинированной желчи. Существует и гипертоническая форма омелотворения желчного пузыря, когда он достигает величины детской головки. Полное обызвествление или омелотво-рение встречается очень редко (А. Ф. Греджев, 1956).
Как вспышки воспалительного процесса, так и прохождение самого конкремента по пузырному протоку вызывают рубцово-атрофические изменения, приводящие к истончению его стенок, в ряде случаев, наоборот, к расширению просвета, но иногда и к полной его облитерации.
Длительно существующие воспалительные изменения стенок желчного пузыря ведут к рубцовым деформациям в пузырно-гепатикохоледохеальном пространстве. В отдельных случаях желчный пузырь плотно срастается с печеночным протоком и идентифицировать пузырный проток невозможно. Иногда при значительных рубцовоатрофических изменениях пузырного протока последний исчезает вовсе, и шейка пузыря непосредственно соединяется с общим желчным протоком меньшим или большим отверстием.
В ряде случаев при подобных изменениях между желчным пузырем и общим желчным протоком образуется соустье, через которое камни могут непосредственно попадать в общий желчный проток. Отсутствие пузырного протока в результате воспалительных явлений создает неожиданную, а порой и опасную ситуацию во время холецистэктомии.
При остром воспалении желчного пузыря, обусловленном в первую очередь нарушением оттока желчи, возникает резкий отек его стенок с постепенным повышением внутрипузырного давления до 400—500 мм вод. ст. (Ю. М. Дедерер, Т. Г. Устинов, 1985). Объем желчного пузыря может увеличиваться до 100 см3. Пузырь становится гиперемированным, цианотичным. Серозная оболочка его тусклая, матовая, покрыта фибрином. Слизистая оболочка ярко-красная, субсерозная оболочка разрыхлена. Желчь через несколько дней становится белого цвета.
В последующие дни воспалительный процесс может протекать по-разному. Если острый процесс купируется полностью самостоятельно или с помощью консервативных мероприятий, то все явления затихают и могут больше не повторяться; в противном случае процесс приобретает хроническое течение. У ряда больных уже с самого начала заболевания воспаление прогрессирует. Стенки желчного пузыря полностью инфильтрируются гноем, на слизистой оболочке появляются изъязвления, в полости пузыря — гной. Желчный пузырь увеличивается в объеме, стенки его еще больше утолщаются, в них образуются мелкие абсцессы. Серозный покров покрывается желтыми фибринозными отложениями. За счет пе-рихолецистита в процесс вовлекаются соседние органы и ткани, брюшина набухает, становится гиперемированной, вокруг желчного пузыря нередко образуется плотный инфильтрат. В воспалительный процесс вовлекаются печень и поджелудочная железа. Описанная картина наблюдается при флегмонозном холецистите или эмпиеме желчного пузыря. При наличии маловирулентной микрофлоры и длительном блоке пузырного протока эмпиема желчного пузыря может превращаться в его водянку.
При дальнейшем прогрессировании острого воспалительного процесса флегмонозный холецистит или острая эмпиема может переходить в гангренозную форму, однако это бывает довольно редко. Обычно встречается частичный некроз стенок на более или менее ограниченном участке, чаще в области дна у места давления камня. Описан и уникальный случай гангренозного холецистита с одновременной частичной гангреной печеночно-желчного протока. Однако тотальный некроз желчного пузыря — явление чрезвычайно редкое. Встречается он при завороте пузыря, имеющего брыжейку, когда полностью прекращается питание его стенок (А. Л. Лупинский, 1975; С. А. Ясинский, И. М. Бучковский, 1976; А. П. Бурдин, 1976, и др.). Тромбоз пузырной артерии также может привести к полному некрозу, если пузырная артерия является единственным источником питания. Чаще в этих случаях наблюдается частичный некроз треугольной формы.
Некротические изменения стенок желчного пузыря при гангренозном холецистите, особенно в тех местах, где на стенку оказывает давление камень, могут вести к перфорации. Она встречается у 8,3 % больных с острым холециститом (В. С. Савельев и соавт., 1989).
Наибольшую опасность представляет перфорация в свободную брюшную полость с быстрым развитием разлитого гнойного перитонита. Перфорация может ограничиться также образованием абсцессов под печенью, диафрагмой и в других местах. При тесной спайке желчного пузыря с другими органами в результате перихо-лецистита может произойти перфорация в соседние органы (печень, желчные протоки, желудок, двенадцатиперстную и ободочную кишки). Содержимое абсцесса, в том числе и камни, мигрирует через образовавшееся отверстие — внутренний желчный свищ. Частота обнаружения подобных свищей составляет, по данным различных авторов, 0,3—5 % среди всех операций на желчных путях (А. В. Вельский и соавт., 1978; И. Н. Миронович. Ф. М. Жмудиков, 1979; С. А. Шалимов и соавт., 1984, 1990).
Различают следующие виды внутренних желчных свищей: 1) билиодигестивные, которые в свою очередь делятся на холецисто- и холедоходигестивные, 2) билиобилиарные, 3) сосудистобилиарные, 4) билиобронхиальные.
Билиодигестивные свищи составляют 66—90 % желчных свищей. Наиболее часто встречаются холецистодуоденальные свищи (70—80%), реже —холецистотолстокишечные (12—22%) и еще реже (4%)—свищи между желчным пузырем и желудком (Г. Мондор, 1940). Через образовавшееся соустье в полые органы мигрируют камни, которые в ряде случаев вызывают острую обтурационную непроходимость кишечника. Холецистодигестивные свищи в большинстве случаев и обнаруживаются во время операции по поводу такой непроходимости. Размеры обнаруженных в кишечнике камней колеблются от 0,8 до 8 см. Билиодигестивные свищи образуются редко.
Это опасное осложнение желчнокаменной болезни и ни в какой мере не является ее самоизлечением.
По данным Roux (1958), у 6—23 % больных билиодигестивные свищи образуются в результате пенетрации язв желудка и двенадцатиперстной кишки в желчный пузырь или общий желчный проток (А. Я. Фищенко, 1972; Р. А. Любин, Н. И. Бондарь, 1977; Д. Ф. Благовидов и соавт., 1978, и др.).
Имеются сообщения о довольно высокой летальности (8— 30 %) при хирургическом лечении подобных осложнений (Р. Т. Панченков, А. Н. Лежнев, 1973; А. В. Вельский и соавт., 1978).
Холецистодигестивные свищи не имеют специфических симптомов. Обычно отмечается ухудшение течения желчнокаменной болезни. Приступы тяжелой колики повторяются, прогрессирует восходящий холангит, сопровождающийся упорной лихорадкой, желтухой, кишечным кровотечением и постепенным истощением. При рентгенологическом исследовании бария сульфат задерживается в желчных протоках значительно дольше (более 6—12 ч), чем при рефлюксе, связанном с недостаточностью сфинктера пе-ченочно-поджелудочной ампулы.
Более четкое представление о характере заболевания иногда удается получить при помощи фибродуоденоскопии, позволяющей как осмотреть сам свищ, так и контрастировать желчный пузырь и желчные протоки.
Билиобилиарные свищи образуются между желчным пузырем и чаще общим печеночным протоком в результате длительно текущего воспалительного процесса. Располагающийся в шеечном отделе желчного пузыря камень вызывает пролежень между стенкой пузыря и желчного протока с образованием патологического соустья (синдром Mirizzi). Через образовавшееся отверстие камни мигрируют в желчные протоки, вызывая их механическую непроходимость. При этом часто на операции желчный пузырь оказывается рубцовосморщенным, не содержит конкрементов, в то время как все желчные протоки выполнены камнями пузырного происхождения.
Подобные осложнения не диагностируются до операции и обнаруживаются во время вмешательства по поводу холецистита или механической желтухи.
Сосудистобилиарные свищи образуются вследствие возникновения пролежня в стенке желчного пузыря и эрозии веточки пузырной артерии. Через такой внутренний сосудистобили-арный свищ кровь поступает из желчного пузыря через общий желчный проток в кишечник, и болезнь проявляется признаками кишечного кровотечения. Подобные наблюдения встречаются очень редко (Р. А. Осипенко, Б. А. Болуров, 1978; Д. В. Благови-дов и соавт., 1978; В. С. Земсков и соавт., 1979, 1985, 1989). До операции причину кровотечения можно установить лишь во время эндоскопии по наличию крови в двенадцатиперстной кишке, отсутствию в ней кровоточащей язвы и выделению крови вместе с желчью через большой сосочек двенадцатиперстной кишки. На операции в этих случаях обнаруживаются переполненный кровью желчный пузырь, расширенные желчные протоки. Холецистэкто-мия является радикальным методом лечения и желчнокаменной болезни, и кишечного кровотечения.
Спонтанные наружные желчные свищи являются очень редким осложнением желчнокаменной болезни. Их образование связано с прорывом флегмонозного желчного пузыря в переднюю брюшную стенку. Желчные камни через эти свищи выходят наружу. Холецистэктомия является надежным методом лечения таких осложнений.
Мы наблюдали 41 больного с внутренними желчными свищами. У 30 из них были билиодигестивные желчные свищи (у 22 — холецистодуоденальные и у 8—холецистотолстокишечные), у 10 — свищи между желчным пузырем и общим печеночным протоком, у 1 больного — артериопузырный свищ. Всем больным была произведена холецистэктомия, стенки кишечника ушиты, а дефекты желчных протоков устранены с помощью различных реконструктивно-восстановительных вмешательств.
В отличие от перфорации желчного пузыря в отграниченные пространства, полые органы или наружу, перфорация в свободную брюшную полость ведет к быстрой катастрофе и заканчивается летальным исходом, если оперативное лечение невозможно в ближайшие часы после перфорации и развития желчного перитонита. Желчный перитонит встречается у 23,9 % больных (В. Н. Климов, 1978) и является тяжелым осложнением острого холецистита. Так, по данным Т. А. Малюгиной (1961), из 107 больных с желчным перитонитом, поступивших в тяжелом состоянии, умерли 65 %, а из 53 больных, поступивших в удовлетворительном состоянии и в состоянии средней тяжести, умерли 11 %. В последние годы летальность при подобных осложнениях снизилась до 12,3 %. В 84 % случаев желчный перитонит является осложнением острого, чаще калькулезного, холецистита и в 16 % — следствием травматических повреждений или осложнений, развившихся после операции (Т. А. Малюгина, 1961).
В литературе описан также желчный перитонит, возникающий после перфорации желчного пузыря при брюшном тифе, раке, после перфорации общего желчного протока на месте пролежня. Возможна также спонтанная перфорация общего желчного протока при остром холецистите. Еще в 1909 г. Reutier, а затем в 1910 г. Klernom и Haberer описали наблюдения больных, у которых желчный перитонит развился без видимой перфорации желчного пузыря и желчных протоков. По данным К. Walzel (1976), такой перитонит встречается у 0,2—0,6 % больных. Причины возникновения указанной патологии до конца не выяснены. Т. Фирика и В. Мунтеану (1959) установили у таких больных микроперфорацию внепеченочных желчных путей (80—91 %), общего желчного (4—5%), пузырного (4—5%), печеночных (1,1%) протоков. Авторы отмечают большую сложность отыскания мелких перфорационных отверстий в воспаленных тканях. Во время операции обращают на себя внимание отсутствие гипертензии в желчном пузыре и желчных протоках и иногда — мелкие фибринозные отложения на их стенках, укрывающие место перфорации.
Клиника, диагностика. Известно, что около 75 % лиц, страдающих желчнокаменной болезнью, не предъявляют жалоб и чувствуют себя удовлетворительно. (И. М. Тальман, 1963). Поэтому к врачу преимущественно обращаются больные с осложненными формами желчнокаменной болезни. В «бессимптомный» период могут быть различные диспептические расстройства, кратковременные болевые ощущения, которым не придают должного значения. Диспептические расстройства возникают периодически или наблюдаются постоянно. Они могут отмечаться в промежутках между приступами болезни и после единственного приступа. Неприятные ощущения обычно появляются через 15—30 мин после приема пищи и продолжаются 2—3 ч. Характерны отрыжка (частая и звучная) пищей, иногда воздухом, ощущение горечи во рту, снижение аппетита, вздутие живота, запор. При соблюдении мо-лочно-растительной диеты эти явления проходят через 1—3 дня. Боль является результатом дальнейшего прогрессирования болезни. Она локализуется одинаково часто как в надчревной области, так и в области правого подреберья. Иногда боль появляется под правой лопаткой, за грудиной, но всегда через некоторое время перемещается в область правого подреберья. Стойкая, иногда довольно сильная боль в надчревной области свидетельствует о сопутствующих изменениях в желудке. Колит проявляется болью в нижней части живота и около пупка; опоясывающая боль, возникающая в левом подреберье, характерна для панкреатита. Боль, возникающая при заболеваниях желчных путей, часто иррадиирует в правую ключицу, лопатку, плечевой сустав, гораздо реже — в левую половину грудной клетки (в область сердца и за грудину).
По характеру боли, ее интенсивности, частоте и длительности можно в определенной степени оценить и характер патологического процесса. Так, дискинезия желчных путей характеризуется распирающей, колющей, реже жгучей болью. Боль кратковременная, непостоянная. Больные отмечают общую слабость, появляются бледность кожи, холодный пот, ощущение онемения конечностей, головная боль и головокружение. Болевой приступ часто купируется самостоятельно, облегчение приносят грелка и спазмолитические средства. Вне приступа больные чувствуют себя вполне здоровыми. Часто боль провоцируется эмоциональными расстройствами.
Характер боли при желчнокаменной болезни значительно отличается: она появляется внезапно, чаще после погрешностей в диете, сильная, схваткообразная («печеночная колика»), однако вне приступа больные считают себя здоровыми. Приступ боли может длиться часами, возникает без видимых причин, нередко ночью,
сопровождается рвотой, которая, в отличие от других заболеваний пищеварительного канала, не приносит облегчения.
Хронический холецистит часто сочетается с тяжелым спастическим колитом. Всестороннее обследование позволяет у одних больных исключить, а у других выявить патологию, не связанную с заболеванием желчного пузыря. Сюда следует отнести хронический гепатит, цирроз печени, дискинезию желчных путей, а также заболевания соседних органов (язвенная болезнь желудка и двенадцатиперстной кишки, дивертикулит, дуоденостаз, дуоденит, панкреатит, грыжа пищеводного отверстия диафрагмы, болезни почек), имеющие сходную клиническую картину. Прогрессирование острого калькулозного холецистита сопровождается острой распирающей длительной болью с характерной иррадиацией, повышением температуры тела, рвотой, ощущением горечи во рту. Боль усиливается вскоре после приема пищи (жареной, жирной), газированных напитков, употребления острых приправ, при физической нагрузке, охлаждении. Возникновение «кинжальной» боли нередко свидетельствует о перфорации желчного пузыря.
Объективные клинические данные. Измерение температуры тела, осмотр и глубокая пальпация позволяют выявить ряд характерных для заболеваний печени и желчной системы симптомов, которые помогают еще до применения специальных методов поставить правильный диагноз. Так, появление температурной реакции при соответствующих жалобах больного свидетельствует о наличии воспалительных изменений в желчном пузыре. Более стойкое повышение температуры тела от субфебриль-ной до высокой (38—39 °С), сопровождающееся ознобом и появлением пота, наблюдается при осложненных формах острого холецистита.
Обращает на себя внимание желтушность кожи и склер. Появление желтухи указывает на наличие осложнения со стороны общего желчного прохода механического характера (отек и набухание в области периампулярной зоны, закупорка желчными камнями), гепатита и панкреатита. В связи с тем что почти у 7з больных с острым калькулезным холециститом обнаруживаются камни в общем желчном протоке, желтуха при остром холецистите — явление нередкое.
При осмотре кожи можно обнаружить следы расчесов, пигментацию (частое применение грелок), расширение подкожной венозной сети. Осмотр живота в положении больного лежа позволяет иногда выявить выпячивание в правом (увеличение желчного пузыря или печени) или в левом подреберье (увеличение селезенки) . Следует обратить внимание на участие различных отделов брюшной стенки в дыхании.
Характерно поведение больного, особенно во время приступа печеночной колики. Больной стонет, кричит, мечется в постели, старается прижать верхнюю половину живота подушкой, в отличие от больного с перфоративной язвой желудка, у которого давление на живот вызывает резкое усиление боли. Беспокойство сменяется относительным покоем. Лишь в том случае, когда к неутихающей колике присоединяется тяжелый воспалительный процесс, распространяющийся на брюшину, больной перестает двигаться — развивается тяжелый шок, нарастает интоксикация.
Пальпация, даже поверхностная, позволяет выявить напряжение мышц передней брюшной стенки в области правого подреберья, характерное для острого холецистита. Стойкое напряжение и положительный симптом Щеткина—Блюмберга свидетельствуют о вовлечении в процесс брюшины. Более четко выявить распространение, локализацию и степень болезненности позволяет перкуссия передней брюшной стенки кончиками полусогнутых пальцев правой кисти.
Пальпацию проводят в различном положении больного: лежа на спине, на левом и правом боку, стоя и сидя. Неизмененный желчный пузырь не прощупывается и поэтому его обнаружение (симптом Курвуазье) свидетельствует о патологии в пузырном протоке или обтурации общего желчного протока (холедохолитиаз, стеноз или рак большого сосочка двенадцатиперстной кишки, отек или рак головки поджелудочной железы). Желчный пузырь, пораженный опухолью, пальпируется в виде плотного образования в правом подреберье, но подобное образование может определяться при раке и эхинококкозе печени, а также при опухолях правой почки.
Болевые реакции в области желчного пузыря при его хроническом воспалении, выявляемые пальпацией, легли в основу ряда симптомов. Важнейшими из них являются: симптом Кера — усиление болезненности при надавливании на область желчного пузыря, особенно на вдохе; симптом Грекова—Ортнера — болезненность при поколачивании локтевой стороной кисти по правой реберной дуге, симптом Мюсси — болезненное ощущение при надавливании между проекциями на кожу ножек правой грудино-ключично-сосцевидной мышцы; симптом Мэрфи — болезненность при пальпации выпяченного живота или на глубоком вдохе.
Чем выраженнее воспалительный процесс, тем легче выявить болевые симптомы. При хроническом процессе требуется определенный навык.
Специальные методы диагностики делят на дооперационные и операционные.
Пооперационное обследование. Во всех случаях хронического заболевания желчного пузыря в первую очередь следует выяснить, связано ли оно с желчнокаменной болезнью или с другими формами воспаления. Больного обычно обследуют амбулаторно, применяя ультразвуковую эхолокацию, которая в 96 % случаев дает правильный ответ и не имеет никаких противопоказаний. Наш опыт обследования 45 000 больных полностью подтвердил эти данные.
Исследование проводили при помощи отечественного одномерного аппарата «Эхо-11», а в последние годы применяли ультразвуковой сканер фирмы «Алокка» или Toschiba.
Ошибки имели место в тех случаях, когда камни были диаметром 0,1—0,2 см и когда утолщение стенок желчного пузыря при периязвенном воспалении принимали за первичный холецистит.
Экономический анализ показал, что проведение ультразвуковой эхолокации требует меньших затрат, чем использование холецистографии, так как нередко первичная холецистохолангиография оказывается неинформативной и необходимо повторное ис-следование (В. Е. Медведев и соавт., 1989; A. Deitch, J. M. Enpel, 1980). Однако еще не все лечебные учреждения оборудованы нужной аппаратурой и поэтому остаются в силе такие методы, как обзорная рентгенография брюшной полости, пероральная или внутривенная холецистография, ретроградная холецистохолангио-панкреатография. Обзорный рентгеновский снимок брюшной полости дает возможность обнаружить камни в желчном пузыре у 10 % больных. Безусловно, это зависит не только от опыта рентгенолога и методики исследования, но и от состава самих камней. Простой рентгеновский снимок может быть информативным только при наличии камней, состоящих из большого количества извести. В этих случаях получается гомогенная тень по форме камней. Чисто пигментные и холестериновые камни тени не дают, но камни смешанного типа (имеющие примесь извести) образуют тень определенной формы. Учитывая, что известь распространяется по периферии, тень получается в виде полумесяца или кольца. Расположение камней правильной формы в виде виноградной грозди или цепочки впереди от позвоночника в боковой проекции свидетельствует о том, что они принадлежат желчному пузырю, а не мочевыделительной системе.
Еще большими диагностическими возможностями располагает холецистография, позволяющая судить не только о наличии камней в желчном пузыре, но и о его функции. Принцип исследования основан на способности печени выделять с желчью рентгеноконт-растные йодистые препараты после их перорального или внутривенного введения.
Для пероральной холецистографии используют билитраст или его аналоги — холевид и йопагност по 1 таблетке на 10 кг массы тела. Билитраст принимают вечером, за 14 ч до исследования, после чего прием пищи не разрешается. Исследование проводят на следующий день, натощак. Выполняют 2 снимка — до и после желчегонного завтрака.
Однако пероральная холецистография оказывается неэффективной у 70—80 % больных. Метод не показан при билирубине-мии 17 мкмоль/л и выше.
Внутривенная холецистохолангиография — более информативное исследование. Применяют 20 % и 50 % растворы билигноста, 30 % и 50 % растворы билиграфина форте, 50 % раствор радио-селектана, эндобил, эндоцистобил.
При внутривенной холецистохолангиографии, после предварительной пробы на переносимость йодистых препаратов (1 мл внутривенно), натощак вводят одномоментно 40 мл 20 % раствора билигноста или аналогичные препараты в соответствующих дозах. Рентгеновские снимки выполняют через 15, 30, 90 мин, а также после желчегонного завтрака.
Инфузионно-капельная холецистохолангиография позволяет добиться более высокой концентрации контрастного вещества в желчных протоках, и поэтому ее применяют после холецистэкто-мии, а также при уровне билирубина в крови более 17 мкмоль/л. Натощак вводят внутривенно капельно 20 % раствор билигноста из расчета 1 мл на 1 кг массы тела на 120—150 мл 5 % раствора глюкозы в течение 15—20 мин. При нормальной выделительной функции печени контрастирование внепеченочных желчных протоков наступает через 5—20 мин, максимальное контрастирование — через 30—60 мин, полное освобождение протоков от контрастного вещества происходит через 90 мин. При нарушениях выделительной функции печени и проходимости желчных протоков указанные сроки могут значительно удлиняться, что требует повторного выполнения ренгенограмм (В. А. Галкин и соавт., 1972; Л. Д. Линденбратен, 1980).
Противопоказаниями к внутривенной холецистохолангиографии являются острые заболевания печени и почек, декомпенсиро-ванная сердечно-сосудистая недостаточность, непереносимость препаратов йода (Э. И. Гальперин, И. М. Островская, 1964), Исследование мало информативно и, как правило, безрезультатно при содержании билирубина в крови более 34 мкмоль/л, уровне альбумина в крови менее 35 г/л, уменьшении альбумино-глобули-нового коэффициента (менее 1). В этих случаях на рентгеновских снимках контрастируются почки, так как из-за нарушения функции печени выделение контрастного вещества происходит этим путем.
Показания к внутривенной холецистохолангиографии должны быть строго обоснованы, так как, несмотря на соблюдение всех мер предосторожности, на 3000—5000 исследований бывает 1 летальный исход (D. J. Ott, D. W. Geltand, 1981).
При помощи холецистографии можно оценить как концентрационную, так и выделительную функции пузыря, а фиксирование этого процесса на пленку позволяет проследить его в динамике.
Получение тени желчного пузыря на рентгенограмме без изображения камней не исключает их наличия. У таких больных снимки необходимо производить в различных положениях тела, в период опорожнения желчного пузыря. Присутствие камней можно определить по дефекту наполнения, просветлениям, иногда создающим картину ячеистого строения желчного пузыря. У некоторых больных просветления создают пузырьки газа в кишечнике, однако они всегда находятся вне тени желчного пузыря, чего нельзя сказать о просветлениях, вызванных камнями.
Отсутствие контрастирования желчного пузыря при различных видах холецистографии («отключенный» желчный пузырь) является прямым указанием на наличие патологии и в первую очередь— желчнокаменной болезни. Однако судить о том, действительно ли имеет место «отключенный» желчный пузырь, можно лишь гогда, когда на холецистограммах имеется изображение
желчных протоков. Уточнить причину заболевания позволяет эндоскопическая ретроградная холангиография, при которой определяется четкое изображение обрыва контрастного вещества на уровне пузырного протока, а иногда контрастируется и желчный пузырь.
При наличии «отключенного» желчного пузыря ультразвуковая эхолокация позволяет в 98 % случаев правильно идентифицировать желчнокаменную болезнь. Исключения составляют лишь те случаи, где имеются выраженный гепатит, киста или опухоль печени в зоне расположения желчного пузыря, или атипичное его расположение.
Рентгеноконтрастные методы исследования помогают иногда диагностировать и хронический «бескаменный» холецистит (слабая тень желчного пузыря в результате изменений слизистой оболочки и нарушения концентрационной способности, замедление срока эвакуации, неполное опорожнение).
Нормальное изображение желчного пузыря не является признаком отсутствия хронического холецистита при соответствующей клинической картине.
Эндоскопическая ретроградная холецистохолангиопанкреатография (рис. 50) при хроническом холецистите в принципе является идеальным методом исследования, но прибегать к нему у всех больных нерационально, так как это ведет к ненужной загрузке эндоскопического рентгенкабинета, а порой небезразлично и для больного.

Указанный метод диагностики мы применяем лишь при осложненных формах хронического холецистита, учитывая клинические признаки (перемежающаяся желтуха, озноб, повышение температуры тела во время приступа или после него, приступы панкреатита в анамнезе), при неинформативности внутривенной и инфузионной холангиографии. В подобных случаях - четкое контрастирование главного протока поджелудочной железы, желчных путей и желчного пузыря значительно облегчает решение тактических задач во время оперативного вмешательства. Этот метод используют и в тех случаях, когда эхолокация, обычные методы холецистографии не дают удовлетворительных результатов, а также при непереносимости препаратов йода.
Приведенная выше унификация показаний к ретроградной холангиографии обусловлена еще и тем, что при выполнении ретроградной эндоскопической холангиопанкреатографии по этим показаниям имеется возможность превращения этого метода из диагностического в лечебный, то есть при диагностике холедохолитиаза возможно выполнение эндоскопической папиллосфинктерото-мии.
Хроматическое дуоденальное зондирование. Посредством зонда, введенного в двенадцатиперстную кишку, собирают ее содержимое и регистрируют: 1) наличие или отсутствие боли на интрадуоденальное введение 50—60 мл 33 % раствора магния сульфата (в норме исследование безболезненно); 2) время поступления пузырной желчи и длительность ее выделения (в норме пузырная желчь поступает в двенадцатиперстную кишку через 5—11 мин после введения магния сульфата и выделяется в течение 40—60 мин); 3) объем пузырной желчи (в норме 50—70 мл).
Для более четкой визуализации пузырной желчи применяют хроматическое дуоденальное зондирование. За 14 ч до исследования больной принимает 0,15—0,2 г метиленового синего в желатиновой капсуле.
Метиленовый синий выделяется печенью и обесцвечивается ею. Однако за время нахождения в желчном пузыре вновь приобретает синюю окраску, отличающую пузырную желчь от других порций желчи.
Ускоренное хроматическое дуоденальное зондирование с внутривенным введением 0,4 % раствора индигокармина предлагает Г. И. Дихтенко (1971).
Отсутствие поступления окрашенной желчи в двенадцатиперстную кишку свидетельствует о непопадании желчи в желчный пузырь.
Получение в порции В мутной, вязкой или даже зеленоватой желчи (частичное превращение билирубина в биливердин из-за повышения кислотности содержимого желчного пузыря под влиянием инфекции) в сочетании с тянущей болью в области желчного пузыря после зондирования считают достоверным признаком хронического холецистита. Для диагностики «бескаменного» холецистита кроме этого имеет значение и обнаружение в желчи хлопьев, кристалло» холестерина, желчного песка после дачи желчегонных средств, особенно если в порции А их не было, увеличение содержания лейкоцитов до 30—40 и больше в пузырной порции
Радиологическое исследование желчного пузыря наиболее информативно при использовании препаратов Тс-НIDA и Tc-PIPIDA (Г. А. Зубковский, В. И Попов, 1981; Э. П. Дупме и соавт., 1981; М. Т. Bennett и соавт., 1981).
В норме заполнение желчного пузыря происходит в течение 30 мин после внутривенного введения радионуклида. Увеличение этого интервала до 90 мин считают признаком гипофункции желчного пузыря. Отсутствие радионуклида в желчном пузыре в течение 2 ч является показателем «отклоненного» желчного пузыря,
Сцинтиграфия малоинформативна и даже может давать ложные результаты при уровне билирубина в крови более 85 мкмоль/л.
Лапароскопию применяют для диагностики острого холецистита (Ю М. Дедерер, В. И. Прохоров, 1979; С. Н. Захаров и соавт., 1980; Ю. М. Дедерер, Г. Г. Устинов, 1985; В. М. Буянов и соавт., 1989, 1990). О заболевании свидетельствуют увеличение и напряженность желчного пузыря, фиброзные напластования на его стенках, воспалительный процесс в брюшной полости, нередко с наличием экссудата.
Транспариетальная пункция желчного пузыря под контролем лапароскопа является не только диагностической, но и лечебной мерой Методика ее заключается в следующем. После пункции передней брюшной стенки в месте перехода висцеральной брюшины с желчного пузыря на печень проводят иглу внутрь пузыря и аспирируют содержимое. Мутная с хлопьями желчь, гной характерны для флегмонозного холецистита и эмпиемы желчного пузыря , «белая» или слегка окрашенная желчь свидетельствует о блоке пузырного протока. Геморрагическое, с гнилостным запахом содержимое указывает на гангренозно-язвенное поражение слизистой оболочки желчного пузыря.
После отсасывания содержимого в желчный пузырь вводят 5—10 мл 0,25 % раствора новокаина, содержащего 1—2 г мономоцина или канамицина.
Термографию для диагностики острого холецистита применяли Н. С. Орлов (1974), В. Ф. Сухарев (1977), Развитие флегмонозно-гангренозного холецистита сопровождалось резким усилением интенсивности инфракрасного излучения в области желчного пузыря.
Исследование кала. В тех случаях, когда с помощью холецистографии не удается определить наличие желчных камней, хотя приступы печеночной колики продолжаются, можно исследовать фекальные массы. Обычно это делают на протяжении 3 дней после печеночной колики путем промывания кала. Чаще обнаруживаются фасеточные мелкие камни, реже — мелкие камни округлой формы в виде конопляного зерна. Обнаружение крупных камней свидетельствует о наличии соустья желчного пузыря с пищеварительным каналом. Не следует забывать, что каловые камни, представляющие собой инкрустированные остатки пищи, медикаментов, также могут напоминать камни желчных путей, поэтому химическое исследование их на содержание холестерина и билирубина обязательно. В некоторых случаях обнаружение песка также свидетельствует о патологии желчных путей (И. М. Тальман, 1963).
Дифференциальная диагностика. При хронических формах воспаления желчного пузыря диагностическая задача значительно облегчается, так как имеется достаточно времени для проведения всех необходимых исследований. Более сложную задачу представляет диагностика острого воспаления желчного пузыря, когда хирургу приходится в сравнительно короткий срок поставить правильный диагноз, а также решить вопрос о срочности оперативного лечения. Кроме того, примерно у половины больных приходится проводить тщательную дифференциальную диагностику для исключения острой хирургической патологии других органов брюшной полости и в первую очередь острого панкреатита. W. Hess (1961) считает, что в острый период эти заболевания дифференцировать невозможно. Однако необходимость применения консервативных методов лечения при остром серозном панкреатите и оперативных — при остром холецистите и деструктивных формах холецистопанкреатита — требует установления правильного доопе-рационного диагноза.
Острый панкреатит отличается от острого холецистита более выраженной картиной шока и интоксикации. Повторные исследования мочи и крови на диастазу помогают установить правильный диагноз.
В ряде случаев при инфаркте миокарда и острой коронарной недостаточности возникает боль в области живота, как при тяжелом приступе острого холецистита. В то же время боль, возникающая во время приступа острого холецистита, иногда может
иррадиировать в область сердца и в левую половину грудной клетки. Оба заболевания могут сопровождаться характерными для холецистита изменениями со стороны белой крови, сильной тошнотой и рвотой. Электрокардиограмма помогает врачу поставить правильный диагноз.
Не следует забывать, что и такие заболевания, как пневмония, плеврит, тромбоз брыжеечных сосудов, почечнокаменная болезнь, острая непроходимость кишечника, могут давать сходную с острым холециститом клиническую картину.
Обзорный рентгеновский снимок, специальное урологическое обследование оказывают помощь в дифференциальной диагностике. Дифференциальная диагностика острого холецистита с острым аппендицитом, перфоративной язвой в ряде случаев трудна, однако проблема облегчается тем, что при всех этих заболеваниях необходимо хирургическое вмешательство.
Лечение. Существуют консервативный и оперативный методы лечения как хронических, так и острых форм воспаления желчевыводящих путей.
Консервативное лечение применяют при всех формах холецистита, хотя эффект от такого лечения различный.
Хронический калькулезный холецистит. Несмотря на довольно низкую летальность при плановых операциях, ее все же нельзя исключить полностью, кроме того, сравнительно высокий процент больных не излечивается после холецистэктомии. Все это заставляет разрабатывать эффективные методы консервативного лечения хронического калькулезного холецистита.
Впервые успешное растворение конкрементов в желчном пузыре было выполнено в клинике Мейо (1972) при помощи хенодезоксихолевой кислоты. После этого количество наблюдений стало постепенно увеличиваться. В последние годы стали применять изомер хенодезоксихолевой кислоты — уродезоксихолевую кислоту. Оба препарата подавляют синтез холестерина в печени и тем самым делают желчь нелитогенной (R- H. Dowling, 1977; В. J. Ре arlman, L. J. Schoenfield, 1978). Однако растворение уже образовавшихся камней происходит медленно.
Доза хенодезоксихолевой кислоты, необходимая для растворения конкрементов, составляет 15 мг на 1 кг массы тела; длительность лечения —6—12 мес и более (J. H. Isen и соавт., 1975; L. Thistle и соавт, 1977).
Поскольку максимальное насыщение желчи холестерином происходит в ночное время, рекомендуют не менее половины суточной дозы хенодеоксихолевой кислоты назначать на ночь (Н. I. Wies и соавт., 1980).
Потенцирование действия уродезоксихолевои кислоты достигали одновременным назначением препарата, изготовленного из неомыляющейся фракции сои, в дозе 9 г/сут (G. Kajiyama и соавт., 1981).
Накопленный опыт позволяет сформулировать критерии, по которым можно прогнозировать эффективность медикаментозного лечения, и, следовательно, определять показания к его применению (J. H. Isen и соавт., 1975; Т. Tangedahl, 1979).
Одиночные или множественные мелкие камни, плавающие в желчном пузыре, хорошая сократительная функция последнего указывают на хорошие возможности медикаментозной терапии. В противовес этому большие конкременты, плохая сократительная функция желчного пузыря или отсутствие контрастирования его по данным холецистографии резко снижают вероятность растворения конкрементов.
Установлено, что кальцифицированные, а также пигментные камни желчного пузыря устойчивы к хенодеоксихолевой кислоте (Н. J. Wies и соавт., 1980).
В процессе лечения обязателен контроль его эффективности, который осуществляют путем систематического дуоденального зондирования с определением литогенности пузырной желчи. Для правильной оценки результатов зондирования важно соблюдение следующих требований: исследование должно проводиться не ранее чем через 3 сут после холецистографии; перед зондированием необходимо голодание в течение 12 ч; верхушка дуоденального зонда должна находиться точно напротив большого сосочка двенадцатиперстной кишки, что контролируется рентгенологически; сокращения желчного пузыря вызываются внутривенным введением холецистокинина или его синтетических аналогов; темную пузырную желчь собирают отдельно от остальных порций (Т. Tangedahl, 1979).
Контроль степени растворения камней осуществляют путем повторных холецистографии.
Вместе с тем, медикаментозное растворение желчных камней сопровождается рядом побочных эффектов. Больные отмечают ухудшение аппетита, вздутие живота, иногда (до 30%)—диарею. В процессе лечения активность трансаминаз повышается в 2—3 раза по сравнению с исходными показателями, что, возможно, является результатом токсического действия литохолевой кислоты, образующейся в результате метаболизма хенодеоксихолевой кислоты (Н. J. Wies и соавт., 1980).
Соблюдение диеты с низким содержанием холестерина и большим количеством клетчатки, одновременное применение препаратов, ухудшающих всасывание холестерина, не влияют на эффект тивность лечения (Е. W. Pomare и соавт., 1976; D. P. Mahdal и соавт., 1978; Т. N. Tangedahl и соавт., 1979). Однако уменьшенние массы тела является благоприятным фактором, поэтому больным рекомендуют воздерживаться от переедания.
Ввиду токсического воздействия хенодеоксихолевой кислоты на печень плода препарат нельзя назначать беременным (А. К. Palmer, R. Heywood, 1974).
Полного растворения желчных камней с помощью медикаментозных средств удается достичь у 30—42 % больных. Лечение безуспешно при диаметре камней более 15—20 мм. Через некоторое время после лечения у большинства больных наступает рецидив заболевания, конкременты образуются вновь (Т. Tangedahl, 1979).
Описанные лизирующие агенты по своей эффективности не отвечали предъявляемым требованиям. Необходим был препарат, который растворяет ионогидрат холестерина, являющегося основным элементом многих камней. Таким препаратом является эфир октановой кислоты—монооктаноин. К. Sharp и соавторы (1983) доказали, что если камни состоят из холестерина, то они могут быть полностью растворены в течение 4—7 сут путем инфузии монооктаноина через Т-образный дренаж. Препарат вводят медленно со скоростью от 3—7 до 12 мл в 1 ч.
Суммируя изложенные данные, можно сделать заключение, что медикаментозное растворение желчных конкрементов возможно при холестериновом составе их и небольших (до 2 см в диаметре) размерах. Такое лечение может быть рекомендовано только больным с тяжелыми сопутствующими заболеваниями, у которых про-ведение оперативного вмешательства связано с высоким риском для жизни.
Растворение камней у больных калькулезным холециститом, отягощенным сопутствующими заболеваниями, при наличии холецистостомы рекомендуют также П. М. Постолов и соавторы (1988). Они используют окталгин — препарат на основе октановой кислоты, этерифицированной с первичной гидроксильной группой глицерина.
Экспериментальные исследования на животных показали достаточную литолитическую активность препарата, его низкую токсичность, отсутствие местного раздражающего, аллергенного, эмбрио-токсического, тератогенного и канцерогенного действия.
Новые возможности лечения желчнокаменной болезни неоперативным методом появились в начале 80-х годов благодаря созданию и внедрению в клиническую практику аппаратов для дистанционного дробления камней в почках. Аппараты, генерирующие акустическую ударную волну для разрушения камней, получили название ударноволновых литотрипторов. Первые литотрипторы, созданные фирмами «Wolf» (ФРГ) и «Paramedica» (США), были использованы в урологической практике для контактного разрушения камней. Дальнейшая разработка методики литотрипсии привела к созданию нового неинвазивного метода разрушения камней, при котором формирователь ударной волны размещается вне тела больного и сфокусированная на камень ударная волна проводится в организм через водную среду. Метод получил название экстракорпоральной ударноволновой литотрипсии. В результате стремления разработчиков литотрипторов улучшить их эксплуатационные характеристики и уменьшить сложность и стоимость аппаратов были созданы более совершенные системы для дистанционной литотрипсии, использующей для генерации ударных волн высоковольтный электрический разряд, пьезокерамические элементы, электромагнитные излучатели ударных волн. Для локализации камней, наведения ударной волны, а также контроля за фрагментацией в процессе процедуры в последних моделях литотрипторов используется ультрасонография. Существенным является вопрос определения показаний к литотрипсии. Важнейшими критериями отбора являются отсутствие осложнений желчнокаменной болезни при сохраненной функции желчного пузыря, наличие единичных (до 3), преимущественно холестериновых камней диаметром от 0,1 до 2,5 мм.
Отдельные хирурги (A. Darzi и соавт., 1989; М. В. Albert и соавт., 1990) считают возможным проведение литотрипсии у лиц с множественными камнями желчного пузыря.
Для профилактики билиарной обструкции и острого холангита после экстракорпоральной литотрипсии важную роль играют эндоскопическая папиллотомия и назобилиарное дренирование. Большинством исследователей признано, что противопоказаниями к литотрипсии при неосложненных формах желчнокаменной болезни являются гастродуоденальные язвы, коагулопатии, прием антикоагулянтов, ацетилсалициловой кислоты, острый панкреатит, беременность, нарушения сердечного ритма, наличие кист и сосудистых аневризм в зоне воздействия ударных волн.
Успешная фрагментация камней отмечается в 85—90 % наблюдений. Полная элиминация фрагментов камней через 12 мес наблюдается у 80—85 % больных с единичными рентгенонегативными камнями. Среди побочных эффектов литотрипсии наиболее часто встречаются кожные петехии и макрогематурия. Описаны такие осложнения, как желчная колика, острый панкреатит, механическая желтуха, связанные с миграцией камней.
Таким образом, экстракорпоральная билиарная литотрипсия является эффективным методом лечения, который требует дальнейшего клинического изучения. Залогом успешного применения литотрипсии при желчнокаменной болезни является правильное определение показаний, а также дифференцированный подход к использованию патологически обоснованной терапии.
Другие консервативные методы лечения больных с хроническим калькулезным холециститом не рекомендуются, так как они, принося временный эффект, оттягивают радикальное лечение, ведут к осложнениям со стороны магистральных желчных протоков, печени и поджелудочной железы. По тем же причинам мы не рекомендуем лечение таких больных в терапевтических стационарах. Хронический калькулезный холецистит — заболевание хирургическое и лечиться больной должен в хирургическом стационаре. Диспансерное наблюдение в до- и послеоперационный период должен вести только хирург.
Хронический «бескаменный» холецистит. В. А. Галкин (1986) различает следующие формы хронического «бескаменного» холецистита.
I. Неосложненный: а) в сочетании с гипотонусом желчного пузыря; б) в сочетании с гипертонусом желчного пузыря.
II. Осложненный сопутствующими заболеваниями смежных органов: а) панкреатитом; б) реактивным гепатитом; в) паразитарными заболеваниями; г) перихолециститом. Принципиально такие формы хронического холецистита должны лечиться только консервативно. Но, к сожалению, этот метод не всегда эффективен. Консервативное лечение заключается в назначении соответствующей диеты, холеретических и холекинетических средств, антибактериальных препаратов, физиотерапевтических процедур, минеральных вод.
Из питания следует исключить копченые, вяленые, острые и жареные блюда, консервы, колбасу, острый сыр, какао, шоколад, алкоголь. Можно употреблять продукты, обладающие желчегонными свойствами, если они не вызывают боли,— яйца всмятку, несоленое сливочное, оливковое масло, сливки, молоко, молочные продукты, мясо и свежую рыбу.
К холеретическим препаратам, увеличивающим секрецию желчи и стимулирующим образование желчных кислот, относятся дехо-лин, аллохол, холагол, холензим, холосас, олиметин, ровахол, би-лихол, биликрин, цветы бессмертника, кукурузные рыльца и целый ряд других препаратов.
К препаратам, увеличивающим секрецию желчи за счет водного компонента (гидрохолеретики), относится любая жидкость, обильный прием которой (водный удар — 1,5 л) способствует разжижению желчи, усилению ее выделения, а также гексаметилентетрамин, натрия салицилат, атофан, минеральная вода и др.
К лекарственным средствам, стимулирующим желчеотделение путем повышения тонуса желчного пузыря и снижения тонуса желчных путей (холекинетики), относятся холецистокинин, магния сульфат, питуитрин, яичные желтки, а к препаратам, способствующим расслаблению желчных путей (холеспазмолитические вещества),— атропина сульфат, платифиллина гидротартат, экстракт белладонны, холелитин, эуфиллин, бензацин, метацин, нитроглицерин, аминилнитрит и другие.
Хорошее лечебное действие оказывает дуоденальное зондирование, на курс лечения 10—12 процедур через 2—3 дня. Некоторые авторы рекомендуют сочетать дуоденальное зондирование с введением в двенадцатиперстную кишку 30—50 мл 25—33 % раствора магния сульфата, подсолнечного или кукурузного масла.
Применяют также тюбаж, предложенный Т. С. Демьяновым (1948). Он заключается в принятии натощак 1/2 столовой ложки английской соли, растворенной в 7г стакана горячей воды (или 30 мл 33 % раствора), после чего больной должен с грелкой лежать на правом боку 2—3 ч. Процедуру повторяют 1—2 раза в неделю, всего 10—15 процедур на курс лечения.
Во время обострения, протекающего с повышением температуры тела и изменением картины белой крови, показаны антибактериальные препараты. Рекомендуется жидкая пища в виде манных каш, овощных супов, картофельного пюре, нежирного молока, простокваши, чая, соков, компотов. Все продукты нужно принимать в теплом виде.
УВЧ и диатермию назначают при наличии боли. Вне приступа показано санаторно-курортное лечение.
Острый холецистит. Независимо от того, возникло острое воспаление желчного пузыря на фоне желчнокаменной болезни или без нее, лечение в первые часы после начала приступа при отсутствии перитонита должно быть консервативным. К консервативным мероприятиям относятся: 1) обезболивание (анальгин, поясничная, вагосимпатическая новокаиновая блокады или блокада круглой связки печени); 2) спазмолитические средства (но-шпа, баралгин, дроперидол, платифиллина гидротартрат, атропина сульфат, папаверина гидрохлорид); 3) антигистаминные препараты (пипольфен, димедрол, кальция хлорид, супрастин, диа-золин); 4) антибиотики (левомицетин, аминогликозиды, препараты группы цефалоспоринов); 5) холод на область желчного пузыря; 7) при наличии холецистопанкреатита — ингибиторы протеаз — фторурацил, контрикал, аминокапроновая кислота, при тяжелом состоянии — желудочная гипотермия; 8) голод; 9) дезинтоксика-ционная терапия (введение до 2—3 л изотонического раствора натрия хлорида с мочегонными средствами, гемодез, полиглюкин и другие препараты, нормализующие функцию печени и почек).
При выраженной интоксикации показан форсированный диурез 1—2 раза в сутки, если нет необходимости в экстренной или срочной операции.
Комплекс лечебных мероприятий должен быть применен сразу после поступления больного в стационар. Объем лечения зависит от тяжести воспалительного процесса, его распространенности и степени интоксикации. Поэтому лечение может быть более длительным (при неосложненных формах холецистита) или непродолжительным, но интенсивным (при осложненных формах, перитоните или сепсисе). В последнем случае лечебные мероприятия являются и предоперационной подготовкой. Проведение такого комплекса лечебных мероприятий позволяет также отличить приступ печеночной колики от острого холецистита. Приступ печеночной колики быстро купируется и у больного восстанавливается обычное самочувствие, при остром холецистите держится температура, боль из острой переходит в тупую, остаются объективные признаки острого холецистита, анализ крови продолжает ухудшаться. Если болевой синдром не купируется, а объективные признаки острого холецистита нарастают, производят операцию.
В период проведения указанных лечебных мероприятий больного обследуют, проводят обычные и специальные исследования крови и мочи, а после уменьшения болевого синдрома — ультразвуковую сканографию желчного пузыря (для решения вопроса о калькулезном генезе холецистита).
У больных пожилого возраста с высоким риском оперативного вмешательства на высоте приступа при явлениях острого прогрессирующего холецистита без явлений разлитого перитонита применен оригинальный способ консервативного лечения путем чре-скожной чреспеченочной пункции желчного пузыря под контролем лапароскопа. У 35 из 36 больных с гнойными формами холецистита, леченных этим методом, Ю. М. Дедерер и В. И. Прохорова (1979) добились резкого улучшения состояния после однократной пункции с отсасыванием содержимого и введением больших доз антибиотиков в полость желчного пузыря. У 1 больного боль усилилась, отмечалось резкое увеличение желчного пузыря, что потребовало выполнения лапароскопической холецистостомии, которую с успехом использовали еще в 1976 г. И. Д. Прудков и В. В. Ходиков для лечения 35 больных с высоким риском радикальной операции. Применение таких методов лечения позволило авторам оперировать больных в холодный период, что значительно облегчило оперативное лечение и улучшило его результаты.
В. М. Буянов и соавторы (1989) всем больным в возрасте старше 60 лет с острым холециститом выполняют экстренную лапароскопию, которая позволяет выявить осложнения, требующие экстренной операции (прободение желчного пузыря, диффузный перитонит, перивезикальный абсцесс). В дальнейшем они производят лапароскопическую декомпрессию желчного пузыря и холецистостомию. При подозрении на непроходимость пузырного и желчного протоков выполняют чреспузырную холангиографию. Наличие холедохолитиаза, стенозирующего папиллита является показанием к эндоскопической папиллосфинктеротомии, которая при гнойном холангите дополняется постоянным назобилиарным дренированием в целях санации общего желчного протока.
Авторы применили указанную тактику у 64 больных; летальность составила 4,7%. К лапароскопической холецистостомии при остром холецистите прибегали также В. И. Волоцков и соавторы (1989), А. Е. Ермолов и соавторы (1989), Н. Г. Курлат и соавторы (1989). Они утверждают, что применение лапароскопических и эндоскопических методов при остром холецистите является оптимальным способом лечения заболевания у лиц с высоким операционным риском.
Оперативное лечение применяют при всех формах воспаления желчного пузыря. Однако степень хирургической активности при этом может быть различной.
Хронический калькулезный холецистит. Обнаружение камней в желчном пузыре при наличии клиники хронического холецистита является прямым показанием к плановой операции. Вопрос о том, следует ли удалять желчный пузырь при случайном обнаружении камней в нем, например, во время рентгенологического исследования желудка, или во время операции,выполняемой не по поводу язвенной болезни, если это выполнимо по техническим соображениям, когда до этого никаких клинических проявлений желчные камни у больного не вызывали, решается по-разному. Одни хирурги в таких случаях не рекомендуют спешить с операцией и выполняют ее при появлении клиники хронического или острого холецистита, другие же предлагают оперировать больных после устранения камней, в том числе при рентгенологически доказанном «отключенном» желчном пузыре, даже если в нем не обнаружены камни при эхолокационном исследовании.
Мы утверждаем, что при выборе тактики лечения хронического калькулезного холецистита необходимо помнить о том, что чем раньше от начала появления симптомов болезни выполнена операция, тем легче ее техническое выполнение и лучше результат. Оттягивание срока оперативного вмешательства при наличии клиники хронического холецистита чревато развитием осложнений и ухудшением его результатов.
Хронический «бескаменный» холецистит. Патология желчного пузыря, не содержащего камней, мало изучена, а результаты хирургического лечения далеко не всегда благоприятны. По данным А. Б. Галицкого и соавторов (1978), хорошие отдаленные результаты получены лишь у 56 из 90 оперированных больных, а по нашим данным,— у 45 из ПО. Оперативному лечению подлежат лишь те больные, у которых при тщательном обследовании установлены органические изменения желчного пузыря (деформация, неровности контуров, перегибы) или пузырного протока (сужение, деформация, извитая форма, чрезмерное удлинение), сопровождающиеся резким нарушением функции (задержка контрастного вещества более 48 ч и характерные данные хроматического дуоденального зондирования) и стойким инфицированием. Однако и в этих случаях следует учитывать эффективность консервативного лечения, включая и санаторно-курортное. Лишь отсутствие стойкой ремиссии может явиться показанием к операции. Мы считаем, что частые болевые приступы, сопровождающиеся тяжелыми диспептическими расстройствами, связанные е вовлечением в процесс других органов гепатопанкреатодуоденальной зоны, также должны являться показанием к оперативному лечению. В последние годы все шире ставят показания к оперативному лечению хронических «бескаменных» холециститов даже в детском возрасте, учитывая возможность врожденных аномалий развития пузырного протока как причины холецистита. Miesr (1978) у 100 женщин с «бескаменным» холециститом исследовал состояние пузырного протока после холецистэктомии. Оказалось, что как само воспаление желчного пузыря и явления перихолецистита, так и приступы колики, которыми они сопровождались, обусловлены утолщением стенки пузырного протока в результате его хронического воспаления. Автор назвал это состояние синдромом пузырного протока. Результаты холецистэктомии оказались хорошими.
Принципы хирургического лечения желчнокаменной болезни. В развитии современного учения о принципах лечения больных с желчнокаменной болезнью существенное значение имеет внедрение в клиническую практику методов холецистографии и ультразвукового сканирования.
Благодаря применению рентгеноконтрастных методов исследования диагностировать желчные камни стало возможным в среднем у 1,6—2,3 % обследованных, хотя на вскрытии они выявляются в 6—16 % случаев (Б. Н. Эсперов и соавт., 1980; Ю. М. Деде-рер и соавт., 1983).
Использование ультразвукового эхотомосканирования позволяет обнаружить камни в желчном пузыре у 6,7 % обследованных, то есть практически в том же проценте случаев, что и на аутопсии (Н. Н. Малиновский, Е. А. Решетников, 1988).
Однако, по данным тех же авторов, симптоматика хронического калькулезного холецистита наблюдается только у 1/3 больных. Высокий процент бессимптомного течения заболевания послужил основой для пересмотра тактики лечения больных в хронической стадии заболевания, главным образом пожилого возраста. Придерживаясь дифференцированного подхода к определению показаний к хирургическому лечению, авторы выделили следующие группы больных с камнями в желчном пузыре со сходными принципами лечения.
1-я группа — с частыми приступами печеночной колики или с «отключенным» желчным пузырем;
2-я — с невыраженными симптомами хронического калькулезного холецистита;
3-я — без клинических проявлений, но с нарушением функций желчного пузыря и воспалением его стенки;
4-я — без клинико-лабораторных проявлений желчнокаменной болезни с наличием мелких (диаметром менее 1 см) камней;
5-я—с единичными (диаметром более 1 см) свободно плавающими камнями без клинических проявлений и без изменений биохимических показателей сыворотки крови.
Учитывая вариабельность течения желчнокаменной болезни у больных различных групп, авторы определяют очередность и «срочность» их плановой санации. В первую очередь оперативному лечению подлежат больные 1-й и 2-й групп, во вторую очередь — больные 3-й и 4-й групп. У больных 5-й группы, особенно пожилого возраста, от проведения оперативных вмешательств воздерживались и вели активное наблюдение (осмотр хирургом 2 раза в год).
К. D. Lillmoe и соавторы (1991) так дифференцируют подход к лечению желчнокаменной болезни. Больным с множественными мелкими плавающими камнями, неизмененной моторной функцией желчного пузыря, с массой тела, превышающей идеальную не более чем на 40 %, показан прием хенодезоксихолевой и уродезоксихолевой кислот. Лечению с использованием экстракорпоральной ударноволновой литотрипсии подлежат больные с калькулезным холециститом, у которых имеется хорошо визуализируемый желчный пузырь с сохраненной функцией. Экстракорпоральная литотрипсия возможна при наличии 3 камней и менее, не содержащих извести.
Пациентам с желчнокаменной болезнью и высокой степенью операционного риска показана чрескожная чреспеченочная холецистостомия с дальнейшим растворением холестериновых камней производными метилового спирта или удалением их с помощью специальных зондов.
В других случаях авторы предлагают прибегать к лапароскопической холецистэктомии, выполнение которой, по их мнению, недопустимо при беременности, остром холангите, перитоните, сепсисе, трудно корригированных нарушениях свертывающей системы крови.
Несмотря на широкое внедрение в клиническую практику лапароскопической холецистэктомии, следует указать, что хотя метод и имеет хорошую перспективу, однако для его выполнения требуются дорогостоящая аппаратура и высококвалифицированные хирурги. Повышенная вероятность повреждения желчных протоков и других структур, особенно при наличии спаек и деформаций в результате длительного воспаления, делают возможным применение этого метода только в случаях неосложненного калькулез-ного холецистита у лиц, у которых ранее не было операций на органах верхнего этажа брюшной полости и не имеющих избыточ-лной массы тела.
Острый холецистит. Вопросы показаний к хирургическому лечению острого холецистита до настоящего времени остаются предметом изучения и дискуссии.
Основные принципы тактики лечения острого холецистита, применявшиеся до последнего времени, были разработаны Б. А. Петровым в 1952 г. и нашли свое отражение в решениях VI пленума правления Всероссийского общества хирургов в 1956 г. Ведущими признаками, на основании которых проводилась дифференциация больных и выбор метода их лечения, являлись выраженность перитонита, общие симптомы интоксикации, эффективность консервативной терапии и сроки поступления от начала приступа.
Если при хронических холециститах летальность после плановых операций доведена до 0,3 %, то при острых холециститах у больных в возрасте до 60 лет она составляет 5—10 %, а у лиц старше 60 лет — 20 % и более (М. М. Ковалев и соавт., 1977; В. В. Виноградов, П. П. Зима, 1977; В. Н. Климов, 1978; А. С. Сорокин, 3. А. Топчиашвили, 1979; М. И. Кузин, 1984; А. А. Ашра-фов, 1990).
Учитывая большую разницу в летальности при плановых операциях и выполненных по экстренным или срочным показаниям, хирурги до недавнего времени стремились с помощью консервативных методов лечения перевести острый холецистит в хронический и оперировать больных в плановом порядке. Однако это приводило к оттягиванию сроков оперативного вмешательства, увеличению частоты осложненных форм и количества летальных исходов. При выполнении оперативных вмешательств в сроки более 3 дней от начала заболевания частота острых холециститов, осложненных перитонитом, воспалительными инфильтратами и деструктивными процессами, увеличивается в 2 раза. Г. Г. Караванов (1972), Л. В. Авдей и В. И. Дружинин (1977) указывают, что при выполнении оперативных вмешательств уже в первые 72 ч после острого воспаления у 80,7 % больных обнаруживаются деструктивные формы. Подобные сведения приводят и другие хирурги.
Как видно из приведенных данных, количество деструктивных и осложненных форм острого холецистита находится в прямо пропорциональной зависимости от времени, прошедшего от начала развития воспалительного процесса. Безусловно, у некоторых больных острый процесс удается купировать консервативными мероприятиями. В этих случаях деструкция желчного пузыря не прогрессирует и операцию выполняют в плановом порядке. Однако это возможно лишь в единичных случаях, когда проводимая консервативная терапия в течение 1-х суток приносит резкое улучшение, прекращается боль, нормализуются температура тела и показатели крови. Однако кажущееся затихание процесса в большинстве случаев не предотвращает развития деструктивного и тем более гнойного процесса и вынуждает больного отказаться от операции в надежде на дальнейшее улучшение. И если консервативное лечение еще приемлемо в начальной стадии развития процесса, через 24—48 ч от начала заболевания, то оно противопоказано, если с момента заболевания прошло более 48 ч. В этих случаях консервативные мероприятия применяют в качестве предоперационной подготовки.
Интересные данные получены В. В. Виноградовым и П. И. Зимой (1977) при изучении отдаленных результатов настойчивой консервативной терапии в острый период воспаления желчного пузыря. Из обследованных 244 больных через 5 лет после лечения лишь 7 % не отмечали приступов боли; у 47 % больных выявлено осложненное течение заболевания, требующее хирургического лечения.
Активная тактика при остром холецистите одобрена в решениях XIII Пленума правления Научного общества хирургов (Харьков, 1972), XIII Республиканского съезда хирургов УССР (Львов, 1976), XV объединенного пленума Всесоюзного и Молдавского научных обществ хирургов (Кишинев, 1976), Всесоюзного съезда хирургов (Москва, 1980). Однако понятие «активная тактика» не конкретизирует сроков выполнения операций у больных с острым холециститом. В понятиях «ранняя», «срочная», «неотложная», «отсроченная операция» до сих пор нет четкости. Так, В. В. Виноградов и П. И. Зима (1977), К. И. Мышкин, и Л. И. Коп (1977), Б. А. Агеев и соавторы (1977), И. М. Мороз (1977) прямо высказываются против ранних операций. В то же время П. К- Дьяченко (1975), А. Ф. Жлоба (1975), Л. В. Авдей и В. И. Дружинин (1977), Г. Г. Караванов и Г. Л. Орел (1977), А. М. Сазонов и соавторы (1978), И. С. Белый и соавторы (1979) подчеркивают эффективность ранних оперативных вмешательств и приводят достаточно убедительные данные. Б. А. Королев, Д. Л. Пиковский (1985), А. Ф. Жлоба (1975) считают, что снижение летальности при остром холецистите связано с ростом хирургической активности. Что же сдерживает активность хирурга при остром холецистите? Показатели летальности после ранних, срочных и неотложных операций (при произвольном толковании этих понятий) в сочетании с небольшим количеством оперированных больных. Так, П. В. Карман и соавторы (1979) указывают, что летальность после экстренных операций составляет 34 %, после операции по срочным показаниям — 30%, после ранних и отсроченных операций — 5— 1,7 %. Эти данные получены в результате наблюдения за 867 оперированными больными, причем экстренные операции были выполнены лишь у 42 больных, срочные — у 12, ранние — у 300 и отсроченные— у 513. Ранними автор считает операции, выполненные через 7—12 дней от начала заболевания. Поэтому неудивительно, что количество осложненных форм, по его данным, составило 45,1 %, то есть почти половину. И. С. Белый и соавторы (1979), оперировавшие 1208 больных с острым холециститом (хирургическая активность — 33%), приводят следующие данные: у 99 больных операция выполнена через 6 ч после поступления в стационар (летальность — 6,1 %), у 311 — в первые 24 ч (летальность — 5,1 %); остальные 798 больных оперированы в сроки от 3 до 20 дней (летальность — 4,9%). Наиболее частой причиной смерти был перитонит (40 % больных), то есть, несмотря на активную тактику, больные поздно оперированы. К ранним авторы отнесли операции, выполненные в 1-е сутки после поступления больных в стационар. При этом они совершенно не учитывали, сколько времени прошло от начала заболевания.
Принципиальным является установление сроков, в течение которых острый холецистит развивается как ограниченный локальный процесс и осложнения еще не успевают развиться.
В эксперименте доказано, что через 1 сут от начала заболевания происходят значительные изменения стенки желчного пузыря (диффузная инфильтрация интерстициальной ткани, гнойное пропитывание мышечного слоя), которые прогрессируют в последующие дни и вызывают осложнения со стороны как самогб желчного пузыря, так и магистральных желчных протоков, печени и поджелудочной железы (Н. М. Бондаренко, 1977).
Приведенные ранее данные указывают, что количество больных с острым холециститом, у которых выявляются патогенные микроорганизмы в желчном пузыре, резко возрастает через 3 сут и более от начала заболевания (G. Altmeier, 1981).
Изучение морфологических изменений стенок желчного пузыря показало, что флегмонозный и гангренозный холецистит в 81,3 % наблюдений развивается на 4-е сутки от начала заболевания и позже (В. В. Алипов, Л. М. Кон, 1979).
Таким образом, опасность возникновения осложнений холецистита значительно увеличивается через 3—4 сут от начала заболевания. Следовательно, операция, выполненная в первые 3 сут, способна предотвратить осложнения, и такое хирургическое лечение можно считать «ранним».
В 1-е сутки от начала заболевания в стационар поступают 22—63 %, в первые 2—3 сут — 69,3—82,5 % больных (А. Ф. Жлоба, 1975; В. Ф. Сухарев и соавт., 1980; В. А. Петров, Г. А. Зрячих, 1981; Л. И. Фоменко, М. П. Черенько, 1981; А. А. Реут, Л. С. Лебедева, 1981). Это означает, что уже в настоящее время большинство больных госпитализируют еще до развития осложнений.
Однако при отсутствии осложнений холецистита необходимо объективное подтверждение наличия желчнокаменной болезни или флегмонозно-гангренозных изменений стенки желчного пузыря, то есть признаков, указывающих на необратимость заболевания и бессмысленность консервативной терапии.
Для диагностики желчнокаменной болезни в КНИИКЭХ применяют ультразвуковую эхолокацию желчного пузыря. Исследование проводят в течение 1 сут после госпитализации больного. Информативность метода составляет 87%, достоверность -98 %.
Морфологические изменения стенки желчного пузыря можно выявить при помощи лапароскопии также в 1-е сутки после госпитализации (Ю. М. Дедерер, В. И. Прохоров, 1981), Однако мы не согласны с тактикой авторов, которые производят больным с деструктивными формами острого холецистита пункцию желчного пузыря, отсасывание содержимого, вводят антибиотики и назначают консервативную терапию до полного стихания острых явлений. Применение лапароскопической пункции желчного пузыря в лечебных целях оправдано только в тех случаях, когда острый холецистит сочетается с другими острыми заболеваниями (пневмонией, острым инфарктом миокарда и др.), и отсрочка операции вызвана необходимостью устранения сопутствующей патологии.
Больным, у которых ультразвуковая эхолокация и лапароскопия не выявили показаний к хирургическому вмешательству, но клинические признаки заболевания не полностью устранены интенсивной терапией в течение 2—3 сут, показаны холецистохолан-гиография, эндоскопическое и рентгенологическое исследования желудка и двенадцатиперстной кишки.
Необходимость такого обследования вызвана тем, что картина острого холецистита может быть обусловлена другим заболеванием. Так, язвенную болезнь желудка и двенадцатиперстной кишки, опухоль желудка мы обнаружили у 3,8 % больных, поступивших с диагнозом острого холецистита.
Существенным является вопрос о целесообразности эндоскопической ретроградной холангиографии при остром неосложненном холецистите. Значительное ухудшение общего состояния, нарастание печеночной недостаточности мы отметили у 9 больных с острым холециститом, развившимся на фоне желчнокаменной болезни, которым проводилось такое исследование. Очевидно, непосредственное нагнетание контрастного вещества в желчные пузырь и протоки приводит к резкой активации инфекции, сопровождается нарушением эвакуации желчи. Поэтому при обоснованном подозрении на желчнокаменную болезнь выполнение эндоскопической ретроградной холангиографии больным с острым неосложненным холециститом считаем противопоказанным, а если такое исследование все же проведено, то необходимо хирургическое вмешательство в ближайшие часы после него, чтобы предотвратить гнойное воспаление.
В то же время наличие острого холецистита, осложненного механической желтухой, септическим холангитом и печеночно-почечной недостаточностью, требует применения эндоскопической ретроградной холангиографии не только в диагностических, но и в лечебных целях, когда, не извлекая эндоскопа, выполняют папил-лотомию. Такую тактику мы применяем через 1—3 сут после госпитализации больного.
При этом большой сосочек двенадцатиперстной кишки рассекаем на протяжении всей суженной части. Эндоскопически и рентгенологически контролируем отхождение камней и гноя из желчных протоков. Желчные камни, не вышедшие в просвет кишки самостоятельно, фрагментируем и извлекаем при помощи петли Дормиа. Желчные протоки промываем растворами антисептиков до получения прозрачной жидкости. При выраженных симптомах гнойного холангита операцию заканчиваем установкой назоби-лиарного дренажа.
Интенсивную терапию продолжаем в течение 3—4 сут после эндоскопической папиллотомии. За это время признаки печеночной недостаточности исчезают. После нормализации общего состояния больного производим оперативное вмешательство на желчных пузыре и протоках.
Двухэтапное лечение больных, страдающих острым холециститом и холедохолитиазом, применяют В. М. Буянов и соавторы (1989), В. А. Козлов (1989), Н. Г. Курлат и соавторы (1990). Являясь оптимальным, оно не решает проблемы острого холецистита, осложненного желтухой и холангитом в основном в силу ограниченной возможности применения эндоскопических вмешательств из-за отсутствия эндоскопов с боковой оптикой. При невозможности выполнения эндоскопии с последующей санацией желчных протоков у больных с острым холециститом, осложненным механической желтухой, выполняют раннюю операцию в первые 3 сут от начала заболевания. Основной операцией является холецистэктомия с полноценной коррекцией сопутствующих изменений в желчевыводящих путях. Только у больных с тяжелыми сопутствующими заболеваниями операция на желчных протоках может быть ограничена наложением холедохостомы.
Существующее ранее мнение о том, что внутривенная холе-цистохолангиография в первые 7 сут от начала заболевания опасна ввиду токсического воздействия контрастного вещества, в настоящее время пересмотрено. Исследование выполняют' даже спустя несколько часов от начала заболевания (С. Б. Гавриленко, 1978; Д. Ф. Скрипниченко, В. И. Мамчич, 1979). Однако, учитывая преимущества ультразвуковой эхолокации, холецистографию мы выполняем на втором этапе обследования тем больным, у которых ультразвуковая эхолокация оказалась неэффективной.
Мы выделяем следующие показания к хирургическому лечению острого холецистита.
Абсолютным показанием является наличие перитонита. Оперативное вмешательство выполняем через 2—3 ч после госпитализации и проведения интенсивной терапии для коррекции водно-электролитного равновесия и устранения интоксикации.
Пальпируемый увеличенный и напряженный желчный пузырь, обнаружение желчнокаменной болезни (по данным ультразвуковой эхолокации) или деструктивных изменений стенки желчного пузыря (по данным лапароскопии) являются показаниями к хирургическому лечению в первые 48—72 ч от начала заболевания. Эти оперативные вмешательства относим к числу «ранних».
Двухэтапное лечение с выполнением эндоскопической папиллотомии в первые 48 ч после поступления в клинику показано больным, у которых острый холецистит осложнился холедохолитиазом, гнойным холангитом, печеночной недостаточностью.
В более поздние сроки хирургическое лечение проводим только тем больным, у которых при обследовании не было признаков перитонита и деструктивных изменений желчного пузыря, а желчнокаменная болезнь диагностирована при повторных исследованиях через 4—6 сут от начала заболевания, а также пожилым больным с тяжелыми сопутствующими заболеваниями, требующими предоперационной подготовки или уточнения возможности перенесения оперативного вмешательства. Выписываем из клиники только тех неоперированных больных, у которых клинически и по данным дополнительного обследования не обнаружено желчнокаменной болезни и ее осложнений, а также тех, кому оперативное вмешательство противопоказано из-за тяжелых сопутствующих заболеваний.
Внедрение разработанных показаний в практику работы клиники позволило за последние годы повысить оперативную активность при остром холецистите до 75 %. Большинство больных (80%) оперированы в первые 48 ч после госпитализации. Оперативное вмешательство проводим в дневное время квалифицированной бригадой хирургов. Одновременно обеспечиваются условия интраоперационной ревизии желчных протоков. Перечисленные обстоятельства способствовали снижению послеоперационной летальности до 1,1 %.
Вместе с тем, описанная тактика исключает многократное поступление больного в стационар, так как причина рецидивов болезни (камни желчного пузыря) устранена. Благодаря этому уменьшается и число осложненных форм холецистита, что не только улучшает чисто лечебные показатели, но и дает немалый экономический эффект.
Оперативные вмешательства при остром холецистите считаем целесообразным различать по срокам от начала заболевания — ранние и поздние, по показаниям к их выполнению — экстренные, срочные, отсроченные и плановые.
Ранними считаем операции, выполненные в первые 48—72 ч от начала заболевания, когда еще не успели развиться осложнения. Операции, произведенные в более поздние сроки, относим к поздним.
Экстренными являются операции, выполненные по жизненным показаниям сразу после поступления больного в стационар.
К срочным мы относим все остальные операции, выполняемые после курса интенсивной терапии в течение 12—72 ч с момента поступления в стационар и проведения исследований, направленных на уточнение данных о наличии желчнокаменной болезни.
Отсроченными являются операции, выполненные в течение 3— 10 сут с момента поступления в стационар, после детального обследования всех органов и систем, установления диагноза желчнокаменной болезни. Такие операции нельзя считать плановыми, так как даже спустя 8—10 дней от начала заболевания у 40—50 % больных обнаруживаются деструктивные формы холецистита (В. И. Круч, 1975; Ю. Г. Шапошников, 1983; А. А. Шалимов и соавт., 1983).
Плановыми можно назвать операции, которые выполняют через 1—3 мес после купирования острого холецистита.
Таким образом, наиболее показанными следует считать ранние и срочные операции.
Особенности хирургического лечения острого холецистита у больных пожилого возраста. Летальность при лечении острых форм воспаления желчного пузыря у больных пожилого возраста в 5—10 раз выше, чем у лиц молодого возраста (Ю. М. Панцырев и соавт., 1979). Вопрос о хирургическом лечении острого холецистита у больных пожилого возраста приобретает особое значение, если учесть, что число таких больных составляет от 22 до 64,4 % (Б. А. Агеев и соавт., 1977; А. М. Ганичкин и соавт., 1977; А. А. Ашрафов и соавт., 1989; В. М. Буянов и соавт., 1989, 1990).
Основной причиной быстрого прогрессирования острого холецистита у лиц пожилого возраста является нарушение гемоциркуляции в стенках желчного пузыря в результате тромбоэмболического поражения ветвей пузырной артерии. Такое поражение сосудов ведет к образованию очагов некроза в стенке желчного пузыря и прежде всего в слизистой оболочке. Прогрессированию процесса деструкции способствуют также атония желчного пузыря в результате значительной атрофии мышечного слоя, присоединение инфекции (С. С. Сорокин, А. С. Сорокин, 1978). В связи с первостепенным значением сосудистого фактора у больных пожилого возраста преобладает острый «бескаменный» холецистит (до 63 %, по данным А. Б. Галицкого и соавт., 1978).
В связи с резким нарушением гемоциркуляции в стенке желчного пузыря и образованием очагов некроза вплоть до тотального поражения, естественным является и преобладание гнойных, деструктивных и осложненных форм острого холецистита у больных пожилого возраста. Так, по данным А. В. Сафонова (1977), количество гангренозных форм у них в 2 раза больше, а катаральных — более чем в 2 раза меньше по сравнению с лицами моложе 60 лет. Деструктивные формы острого холецистита у больных пожилого возраста достигают 80—91,3 % (А. В. Авдей, В. И. Дружинин, 1977; К- И. Мышкин и соавт., 1979). Следует отметить, что в этом возрасте острый воспалительный процесс на фоне желчнокаменной болезни протекает так же агрессивно, как и на фоне «бескаменного» холецистита. Частота гангренозной и флегмонозной форм в сочетании с желчнокаменной болезнью составила 98,2 %, а без нее 92,1 % (А. М. Ганичкин и соавт., 1977). Однако при наличии камней в желчном пузыре острое воспаление желчного пузыря у таких больных осложняется перитонитом чаще, чем при «бескаменном» холецистите (В. Н. Климов, 1978).
Деструктивный процесс в желчном протоке развивается в первые 24—72 ч у 50—91 % больных пожилого и старческого возраста (А. В. Авдей, В. И. Дружинин, 1977; В. Н. Климов, 1978).
Немаловажным является и тот факт, что у больных пожилого возраста острый холецистит имеет ареактивное течение даже при наличии перитонита. Температура тела часто нормальная, мало изменена формула крови, отсутствуют напряжение мышц передней брюшной стенки и симптом Щеткина—Блюмберга. Все это создает определенные трудности в диагностике и оценке тяжести патологического процесса и ведет к запаздыванию госпитализации и оказанию хирургической помощи (Б. А. Королев и соавт., 1972; Е. Г. Гурова и соавт., 1975; Л. Д. Тараненко и соавт., 1976; Ю. М. Панцырев и соавт., 1990).
Учитывая изложенное, считаем холецистэктомию необходимой также в тех случаях, когда калькулезный холецистит обнаруживают во время лапаротомии, предпринятой по поводу другого заболевания.
Мнения хирургов относительно необходимости удаления желчного пузыря при «бескаменном» холецистите разноречивы. Хорошие отдаленные результаты операции получены лишь у 56 из 90 оперированных (А. Б. Галицкий и соавт., 1978). N. Т. Lygidakis (1981) сообщил о 95 % хороших результатов.
Мы считаем, что при отсутствии камней холецистэктомия показана только тем больным, у которых заболевание проявляется типичными приступами холецистита, а при обследовании выявлены удлинение пузырного протока, плохое опорожнение желчного пузыря (до 24 ч и более) и стойкое, резистентное к антибактериальной терапии инфицирование его содержимого, не поддающиеся консервативному лечению, включая санаторно-курортное, в течение не менее 3 лет. Оперативному лечению подлежат также все случаи холестероза желчного пузыря, а также подозрений на рак желчного пузыря.
Противопоказаний к хирургическому лечению больных с острыми и хроническими формами воспаления желчного пузыря мало. Опасность развития осложненных форм холецистита заставляет хирургов придерживаться активной тактики.
Болезни сердечно-сосудистой системы, других органов и систем, пожилой возраст не всегда являются противопоказанием к операции.
Среди существующих способов хирургического лечения желчнокаменной болезни и воспалительных заболеваний желчного пузыря различают следующие: 1) холецистэктомия; 2) холецистостомия с марсупиализацией и на расстоянии; 3) идеальная холецистотомия.
Холецистэктомия. Впервые удаление желчного пузыря предложил как лучший метод лечения желчнокаменной болезни Langenbuch (1982). Большую роль в разработке и усовершенствовании операции сыграл Kehr (1984, 1913). В России первым выполнил холецистэктомию Ю. Ф. Коссинский в 1886 г.
Для укладки больного на операционном столе используют круглый валик. Диаметр его составляет 10—12 см, длина равна ширине стола. Валик должен находиться на уровне Thxn, что соответствует спереди уровню мечевидного отростка. Под грудную клетку подкладывают плоскую подушку, а операционный стол слегка наклоняют вправо. В настоящее время операционные оборудованы столами с автоматическими или ручными валиками-подъемниками, поэтому нет необходимости в предварительном подкладывании валика. При низких компенсаторных возможностях дыхательной и сердечно-сосудистой систем такую укладку больного не применяют, так как она отрицательно сказывается на гемодинамике и легочной вентиляции.
При холецистэктомии применяют только общее обезболивание (эндотрахеальный наркоз с миорелаксантами).
Разрез брюшной стенки должен обеспечивать доступ ко всем органам брюшной полости, максимальное щажение тканей брюшной стенки и в первую очередь нервных веточек, а также максимально предупреждать развитие послеоперационных грыж.
Наиболее соответствует этим требованиям верхне-срединный разрез от мечевидного отростка до пупка. В случае короткого верхне-срединного расстояния мы продлеваем разрез вниз, огибая пупок справа, и заканчиваем его на 2 см ниже пупка.
Эффективность наиболее часто применяемых при холецистэктомии разрезов (косые в правом подреберье, Рио Бранко, парамедианный, верхне-срединный) изучена А. Г. Земляным (1976, 1988). По данным автора, с точки зрения предупреждения послеоперационных грыж наиболее надежным оказался верхне-срединный разрез — грыжи развились у 2 (0,8%) из 248 больных. При использовании парамедианного разреза грыжи образовались у 7 (8,4%) из 83 больных, косых разрезов — у 34 (26,6%) из 128. Согласно нашим данным, из 800 больных, которым холецистэктомия была выполнена из верхне-срединного разреза, грыжи образовались лишь у 5 (0,6%) больных, из которых 4 оперированы по поводу острого гнойного холецистита и у них было нагноение раны.
Верхне-срединная лапаротомия обеспечивает хороший обзор и свободу манипуляций на внепеченочных желчных протоках. Однако при таком доступе несколько затруднено выделение дна желчного пузыря, особенно при наличии массивного перипузырного инфильтрата и растянутого желчного пузыря. Поэтому для успешного выполнения холецистэктомии требуется не только высокое мастерство самого хирурга, но и высококвалифицированная помощь ассистентов, а также хороший наркоз с полным расслаблением брюшной стенки. При остром холецистите с выраженным околопузырным инфильтратом, особенно у тучных больных с широкой грудной клеткой, отсутствии высококвалифицированной хирургической бригады и невозможности должного анестезиологического обеспечения операции считаем допустимым и целесообразным использование правого парамедианного или косого разреза в правом подреберье по Кохеру или Федорову.
Во время операции хирург оценивает вид, форму желчного пузыря, способность его к опорожнению, определяет наличие камней и спаечного процесса, состояние окружающих органов.
Как правило, при хроническом холецистите большая часть желчного пузыря свободна от спаечного процесса и доступна как осмотру, так и пальпаторному исследованию. Рубцовая деформация, изменение цвета серозного покрова свидетельствуют о наличии воспалительных изменений. Однако иногда желчный пузырь не изменен, спаечный процесс отсутствует, а хирург сразу начинает исследовать его путем пальпации. Мы рекомендуем в таких случаях осторожно острым и тупым путем отделить желчный пузырь от окружающих органов, главным образом от сальника, поперечной ободочной и двенадцатиперстной кишок, а затем пальцами правой руки в направлении от шейки ко дну осторожно прощупать его, чтобы мелкие камни не прошли через пузырный проток в общий желчный. Если желчный пузырь очень напряжен, не следует подвергать его грубому исследованию, так как возможны разрывы, проталкивание застрявшего камня из пузырного протока в общий желчный, что может вызвать осложнения в послеоперационный период. После наложения на дно такого пузыря кисетного серо-серозного шва тонкой нитью его пунктируют иглой, соединенной с отсосом. Содержимое отсасывают, иглу извлекают и кисетный шов затягивают. Место пункции прижигают 5 % спиртовым раствором йода. В таком опорожненном от желчи пузыре легко обнаружить даже мелкие конкременты, облегчается и сама задача удаления пузыря. Пункционную холецистографию во время операции для выявления камней в желчном пузыре мы не выполняем.
Безусловно, все манипуляции на желчном пузыре надо проводить с учетом той патологии, которая была установлена до операции. Так, обнаружение желчных камней по данным дооперационных исследований исключает необходимость пальпации желчного пузыря во время операции. Если же операцию выполянют по поводу «бескаменного» холецистита, то всегда требуется осторожное и тщательное исследование желчного пузыря и определение степени опорожняемости желчного пузыря. Степень функциональных нарушений желчного пузыря можно также уточнить путем интрадуоденального введения 50—60 мл 33% раствора магния сульфата (проба Мельтцера-Лайона).
Ретроградная холецистэктомия (удаление желчного пузыря от шейки). Этот метод удаления желчного пузыря является наиболее рациональным. Он заключается в следующем. Сначала в треугольнике Callot (рис. 51) и среди элементов печеночно-дуоденальной связки выделяют пузырные проток и артерию, общие печеночный и желчный протоки, пересекают между зажимами пузырные проток и артерию, после чего желчный пузырь удаляют из его ложа.
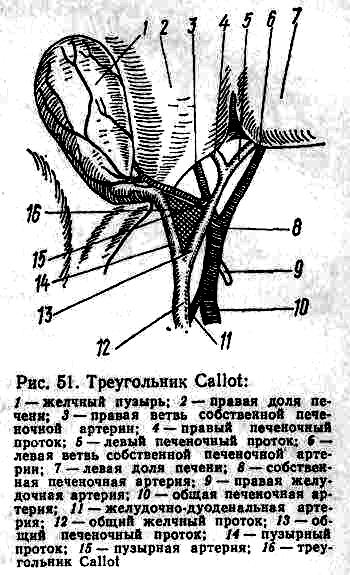
Операция имеет ряд преимуществ.
1. Сразу же после выделения пузырного протока можно проводить манометрию, холангиографию, зондирование общего желчного протока и большого сосочка двенадцатиперстной кишки. Полученные в этот период результаты наиболее достоверны, так как не нанесена большая травма и иннервация, а следовательно, и функция желчевыводящих путей, существенно не нарушены.
2. Исключаются условия для проталкивания мелких камней из желчного пузыря в общий желчный проток, что исключает возможность осложнений.
3. Пузырную артерию перевязывают до иссечения желчного пузыря. Это значительно уменьшает кровоточивость при выделении желчного пузыря из его ложа.
4. Предотвращаются случайные повреждения магистральных желчных протоков, так как выделение и пересечение пузырных протока и артерии осуществляются под визуальным контролем.
Вначале рассекают спайки между стенками желчного пузыря и окружающими органами (сальником, толстой и двенадцатиперстной кишками, желудком). Если нет твердой уверенности в том, что желчный пузырь должен быть удален, его надо захватывать не грубыми зажимами, а длинным анатомическим пинцетом. Это позволяет избежать смещения камней в сторону шейки пузыря и грубой травмы. После выделения желчного пузыря до самой шейки его захватывают в шеечной области окончатым зажимом. Легкой тракцией хирург натягивает шейку и делает надрез серозной оболочки печеночно-дуоденальной связки по ее правому краю, несколько ниже шейки желчного пузыря (рис. 52).

Жировую ткань связки раздвигают изогнутым зажимом и тупфером до тех пор, пока не станет видимым пузырный проток. Следуя по нижнему краю пузырного протока тупфером и диссектором, выделяют его до обнажения места подхода к общему печеночному протоку. Надо дифференцировать пузырный, общие печеночный и желчный протоки и место их слияния. Затем, продолжая тупо и остро препарировать в пространстве между шейкой пузыря и общим печеночным протоком, выделяют всю окружность пузырного протока. Если до операции были сомнения в наличии патологии со стороны магистральных желчных протоков (желтуха, перемежающаяся желтуха, тени желчных камней на внутривенных или пероральных холангиограммах, холангит, расширенный общий желчный проток), делают продольный надрез пузырного протока, общий желчный проток интубируют тонкой (диаметром не менее 1,5 мм) полихлорвиниловой трубкой, которую фиксируют кетгутовой лигатурой, наложенной на пузырный проток снаружи и ниже надреза. Выполняют холангиоманометрию, дебитометрию и холангиографию. Если указанных сомнений нет или имеется дооперационная ретроградная холангиограмма, пузырный проток не вскрывают. Указательный палец левой или правой руки вводят в сальниковое отверстие и пальпируют дистальный конец пузырного и общий желчный протоки между указательным и большим пальцами. Эта манипуляция необходима для обнаружения мелких камней в пузырном протоке, которые могут проскользнуть в общий желчный проток при наложении зажима на пузырный проток, особенно во время операции по поводу «отключенного» желчного пузыря. Такие камни не следует смещать в сторону желчного пузыря. Зажим накладывают ниже вклиненного камня. В тех же случаях, когда камень находится у самого места впадения пузырного протока в
общий желчный, зажимы накладывают на пузырный проток несколько выше камня, рассекают пузырный проток над камнем; после удаления камня накладывают зажим ниже разреза общего желчного протока. Если пузырный проток не содержит камней, то изогнутый зажим накладывают на него в поперечном направлении, отступя от места его впадения в общий желчный проток на 0,5—0,6 см. Второй изогнутый зажим накладывают на пузырный проток выше первого ближе к желчному пузырю. После этого можно пересечь пузырный проток между зажимами, но лучше после наложения зажимов на пузырный проток найти и пересечь между двумя зажимами пузырную артерию, так как при сохраненной артерии тракция за шейку желчного пузыря может вызвать разрыв пузырной артерии. Можно вначале найти и пересечь пузырную артерию, а потом уже выполнять манипуляции на пузырном протоке. Пересечение пузырной артерии значительно облегчает выделение пузырного протока. Искать пузырную артерию следует в треугольнике Callot. В одних случаях ее легко обнаружить, в других — ткань в области треугольника Callot состоит из плотных волокон и в ней трудно выделить сосуд. Поэтому шейку желчного пузыря приподнимают и освобождают от окружающих тканей по направлению к телу пузыря. При потягивании за шейку пузыря артерия натягивается, что значительно облегчает ее поиски. Но не всякий сосуд, который находится в треугольнике Callot, будет обязательно пузырной артерией. Надо отличать ее от правой почечной, добавочной печеночной и других аномальных сосудов и желчных протоков. Кроме того, пузырная артерия может быть двойной. Когда пузырная артерия тщательно опознана и освобождена, на нее накладывают длинный изогнутый зажим, ближе к задней стенке пузыря и параллельно с ней. Второй зажим накладывают на стенку желчного пузыря и между зажимами пузырную артерию перерезают. Культю ее перевязывают тонким капроном или шелком.
После пересечения между двумя зажимами пузырного протока и перевязки пузырной артерии можно удалять желчный пузырь. Сначала его отделяют ножницами от ложа снизу вверх. При этом по обе стороны от пузыря стараются сохранить возможно более широкие полосы брюшины, чтобы потом можно было перитонизировать печеночное ложе. Для этого скальпелем подсекают серозную оболочку по правому и левому краям желчного пузыря, начиная от шейки. У дна желчного пузыря оба разреза подковообразно соединяют, и брюшину у края печени захватывают зажимом и натягивают вверх. Маленьким тупфером или ножницами находят нужный слой и желчный пузырь выделяют из его ложа, по возможности субсерозно. При этом почти всегда обнаруживается несколько мелких сосудистых стволиков (добавочные воротные вены, реже — добавочные печеночно-пузырные протоки), которые захватывают изогнутыми зажимами и перевязывают. У большинства больных мы несколько отступаем от методики классической ретроградной холецистэктомии и после пересечения пузырных артерии и протока продолжаем выделение желчного пузыря от дна. Такая методика значительно облегчает технику операции, предотвращает надрывы ложа пузыря, серозной оболочки и «случайное» вскрытие желчного пузыря. Затем печеночное ложе пузыря покрывают марлевой салфеткой и прижимают печеночным зеркалом. Культю пузырного протока, взятую на зажим, подтягивают и тщательно препарируют до места впадения пузырного протока в общий желчный проток. При этом пересекаются все ткани вокруг пузырного протока вместе с мелкими сосудами и нервами, идущими от печеночных сплетений. Кровотечение из мелких сосудов останавливается либо самостоятельно, либо путем лигирования тонким капроном. Целью такой препаровки является оставление максимально короткой культи и пересечение нервных веточек у места перевязки культи капроновой лигатурой для предотвращения развития невромы. Просматривают проявленные к этому времени холангиограммы, и если они оказались нормальными, удаляют катетер из пузырного протока. Для этого скальпелем перерезают удерживающую его нить, катетер извлекают и в тот же момент изогнутым зажимом, который держат наготове, захватывают культю пузырного протока. Последнюю натягивают и перевязывают. Как правило, на культю протока накладывают двойную лигатуру, вначале шелковую или капроновую, а ближе к общему желчному протоку — кетгутовую. Остаток пузырного протока отсекают. При выполнении препаровки пузырного протока не следует забывать о возможных аномалиях развития самого пузырного протока и о возможных вариантах его впадения в общий желчный проток, а также о наличии дополнительных протоков, впадающих в пузырный проток. Не следует увлекаться препаровкой острым путем места впадения пузырного протока в общий желчный, так как при этом возможно случайное повреждение общего печеночного протока. Культю пузырного протока надо перевязывать только тогда, когда совершенно четко установлено отсутствие изменений в общем желчном протоке. И все же оставление излишне длинной культи следует считать технической ошибкой. Трудно согласиться с мнением некоторых хирургов о том, что длинная культя, вследствие накопления в ней желчи, расширяется и увеличивается, образуя «ложный пузырь», и что в ней реформируются камни, вызывающие рецидивы печеночной колики. Скорее следует согласиться с С. П. Федоровым (1931), который считает, что «ложные пузыри» возникают в результате неполной холецистэктомии, выполненной недостаточно опытным хирургом, и что не следует иссекать и перевязывать пузырный проток слишком близко к общему желчному, так как
в этом случае может образоваться желчный свищ (если лигатура соскальзывает) или рубцовое сужение общего желчного протока (если в лигатуру попадает часть его стенки).
Учитывая сказанное, мы рекомендуем заканчивать тщательную препаровку пузырного протока в 5—6 мм от печеночно-желчного протока с таким расчетом, чтобы его можно было надежно перевязать, причем надо следить за тем, чтобы в просвете культи не оставалось желчного камня или песка.
Перитонизация культи пузырного протока излишня и иногда даже вредна, так как она может вызвать сужение общего желчного протока, а при просачивании желчи и скоплении ее под брюшиной печеночно-дуоденальной связки развивается фиброзный перихоледохит с рубцовым сдавлением общего желчного протока. Лучше оставить перевязанную культю пузырного протока свободной и подвести к ней дренаж. Перитонизацию культи пузырного и печеночно-желчного протоков мы производим лишь при наличии свободно свисающих брюшинных листков печеночно-дуоденальной связки. Брюшинные листки сшиваем тонким кетгутом.
После этого приступают к перитонизации ложа желчного пузыря. Ложе ушивают непрерывным кетгутом вблизи культи пузырного протока, натягивая зажим, наложенный у края печени. Хирург должен убедиться в том, что первый стежок не затянут слишком туго, так как существует опасность захвата правого печеночного протока или артерии. Если края брюшины у печеночного ложа тонки и могут порваться, то можно захватить немного паренхимы печени и ткани на дне ложа, чтобы не образовалось замкнутой полости. Ложе желчного пузыря должно быть по возможности полностью перитонизировано.
У большинства больных, оперированных по поводу острого деструктивного холецистита, ложе не ушивают. Кровоточащие сосуды ложа коагулируют коагулятором или горячим воздухом.
Правое подпеченочное пространство в области культи пузырного протока, как правило, дренируют резиновой трубкой с несколькими отверстиями на конце. Выводят дренаж через отдельный прокол брюшной стенки справа, где его фиксируют к коже одним швом. Подпеченочное пространство промывают раствором антибиотиков, которые затем отсасывают. Прежде чем наложить на рану швы, большой сальник прокладывают между нижней поверхностью печени и двенадцатиперстной кишкой.
Дренирование брюшной полости после холецистэктомии обязательно при всех формах гнойного воспаления желчного пузыря, а при наличии околопузырного абсцесса необходимо дренирование двумя дренажами для постоянного промывания гнойной полости.
Марлевые тампоны мы не применяем. Наши наблюдения показали, что введение 2—3 трубчатых дренажей и активное промывание подпеченочного пространства при деструктивных формах острого холецистита с околопузырным абсцессом значительно надежнее предотвращает прогрессирование перитонита, чем попытка отграничения от брюшной полости тампонированием.
У больных с хорошо ушитым ложем желчного пузыря можно отказаться от дренирования. Отказ от дренирования имеет свои положительные стороны. У 52 больных, оперированных в клинике К.НИИКЭХ без применения дренажа, в послеоперационный период боль была менее выражена, что создавало предпосылки ранних активных движений и, следовательно, ранней выписки из стационара.
На основании собственного опыта и данных литературы мы считаем, что отказ от дренирования брюшной полости после холецистэктомии у отдельных больных может облегчить течение послеоперационного периода, сократить сроки нетрудоспособности. Такой метод оперирования допустим в следующих случаях: 1) при неосложненном холецистите; 2) при полной уверенности в хорошем ушивании ложа желчного пузыря («сухое ложе»).
Антеградная холецистэктомия состоит в удалении пузыря от дна к шейке и используется в тех случаях, когда встречаются технические трудности во время препаровки и выделения элементов в области шейки пузыря. Они могут быть обусловлены наличием анатомических вариантов или значительными Рубцовыми и инфильтративными изменениями, при которых невозможно отыскать пузырный проток. Прежде антеградную холецистэкто-мию считали методом выбора и безопасным вмешательством (И. Н. Ищенко, 1960), однако впоследствии хирурги отказались от такой оценки операции (И. М. Тальман, 1963; И. Литтман, 1954). Это объясняется тем, что при выделении желчного пузыря от дна наблюдается большая кровоточивость, чем при ретроградной холецистэктомии, так как пузырную артерию перевязывают только после выделения пузыря. Изливающаяся кровь заполняет операционное поле и затрудняет препаровку, а также выделение протоков и сосудов у шейки желчного пузыря.
Методика операции. Дно желчного пузыря захватывают окончатым зажимом. Брюшину над пузырем, в месте перехода ее на печень, надсекают скальпелем с обеих сторон. Применяют также гидравлическую препаровку путем инъекции раствора новокаина под брюшину. Обе линии разреза соединяют в области дна. После этого ножницами, маленьким тупфером или пальцем желчный пузырь выделяют из печеночного ложа, продвигаясь к шейке. Обычно такое выделение сопровождается большой кровоточивостью, потому что пузырная артерия еще не перевязана. Кровотечение останавливают прижатием марлевого тампона, наложением зажимов и лигатур на отдельные сосуды большого диаметра.
Особенно осторожно надо выделять желчный пузырь у его шейки. Пузырная артерия может быть случайно перерезана. В таком случае ее надо сразу захватить зажимом и перевязать (перерезанный сосуд сильно сокращается и уходит глубоко в печеночно-дуо-денальную связку, что существенно осложняет операцию). Подтягивая дно пузыря зажимом, рассекая ткани позади его шейки, все время пальпируя и придерживаясь стенки желчного пузыря, достигают пузырных артерий и протока. Надо тщательно отдифференцировать их, прежде чем наложить зажим и пересечь. Два длинных изогнутых зажима накладывают на пузырную артерию и между ними ее пересекают, а затем перевязывают возможно ближе к желчному пузырю, чтобы вместе с ней не перевязать печеночную артерию.
Если в шейке пузыря находится большой камень, его захватывают левой рукой, вводят указательный палец позади пузырного протока и на кончике пальца производят рассечение окружающих тканей, после чего тщательно выделяют пузырный проток. Его отжимают на 5—6 мм от общего желчного протока и пересекают. Необходимо следить за тем, чтобы вместе с пузырным протоком пересечь и общий желчный проток. Желчный пузырь удаляют, а культю пузырного протока перевязывают или двойной лигатурой (кетгутом ближе к протоку и шелковой дистальнее), или одной шелковой. Затем перитонизируют печеночное ложе пузыря, дренируют подпеченочное пространство и накладывают швы на брюшную стенку.
Атипичная холецистэктомия с предварительным рассечением стенки желчного пузыря. В особенно трудных случаях, когда инфильтраты и сращения окружают не только пузырь, но и шейку, пузырный и желчный протоки, а также при резких патологических изменениях стенки желчного пузыря типичная холецистэктомия невозможна. Усердные поиски пузырного протока в инфильтрате могут оказаться опасными, тем более, что ни осмотр, ни прощупывание часто не позволяют даже определить, где находится шейка пузыря. Поэтому, как указывает С. П. Федоров (1904), ничего не остается, как вскрыть пузырь, освободить его от содержимого и изнутри определить положение шейки.
Желчный пузырь рассекают (рис. 53) по его продольной оси и накладывают зажимы на сильно кровоточащие края раны.

В желчный пузырь вводят указательный палец левой руки и под контролем его иссекают пузырь, выделяя его ножницами или скальпелем из инфильтрата и отделяя от печени. Таким путем постепенно подходят к шейке, лигируют путем обкалывания инфильтрированную клетчатку и рассекает ее, придерживаясь стенки. Обычно вместе с клетчаткой удается перевязать и ветви пузырной артерии. В противном случае артериальную веточку захватывают зажимом и прошивают. Из просвета пузыря в пузырный и общий желчный протоки вводят пуговчатый зонд, а затем тонкую полиэтиленовую трубку для холангиографии. Ориентируясь по зонду или по данным холангиографии, выделяют, берут на зажим, пересекают и перевязывают пузырный проток и удаляют желчный пузырь.
Наиболее опасным моментом операции является выделение шейки, запаянной в инфильтрате. Позади нее находятся крупные сосуды, а сбоку, у начала пузырного протока, может быть припаян печеночный проток. Поэтому необходимо соблюдать особую осторожность: надо выделять шейку как можно ближе к стенкам пузыря и пузырного протока и оперировать под контролем введенного в полость пузыря пальца левой руки. У тяжелобольных пузырь ампутируют, оставляя шейку, слизистую оболочку выжигают или соскабливают культю протока и по возможности зашивают ложе узловыми П-образными швами.
Субсерозная холецистэктомия. Иногда двенадцатиперстную кишку невозможно отделить от желчного пузыря. В таких случаях применяют субсерозную холецистэктомию, которую в 1892 г. описал Doyen и в 1906 г.— Witzel.
Делают поверхностный надрез брюшины, покрывающей пузырь в области дна, стремясь попасть в слой между мышечной и серозной оболочками. Когда утолщенная серозная оболочка остается на соседних органах, медленно извлекают желчный пузырь. Недостатком метода является значительное кровотечение, так как пузырную артерию можно перевязать только после выделения желчного пузыря. В некоторых случаях сращения в области шейки и пузырного протока менее плотные и удается препарировать треугольник Callot.
Холецистэктомия при сморщенном пузыре. Трудность операции состоит в том, что иногда невозможно отыскать желчный пузырь. Плотные рубцовые ткани подтягивают сморщенный желчный пузырь к воротам печени и замуровывают полностью в глубоком печеночном ложе. Пузырный проток, как и вся печеночно-дуоденальная связка, укорочен, маленький желчный пузырь полностью располагается на печеночно-желчном протоке, что значительно усложняет операцию. В таком случае надо найти верхний край двенадцатиперстной кишки и общий желчный проток. Последний почти всегда утолщен, так как содержит камни. Затем пунктируют общий желчный проток и выполняют холангио-графию. Желчный пузырь удаляют только в том случае, если он содержит камни. Нередко же его оставляют на месте, ограничиваются только удалением камней и восстановлением нормального желчеоттока.
И. Н. Ищенко (1960), W. Hess (1961) рекомендуют в подобных случаях производить экстирпацию лишь освобожденной и видимой части стенки желчного пузыря и выжигание остальной части, лежащей в печеночном ложе.
Чреспеченочная холецистэктомия. В тех редких случаях, когда желчный пузырь совершенно не виден, расположен внутри паренхимы печени или к нему нельзя подойти со стороны нижней поверхности печени, Mirizzi (1957) предложил выполнять чреспеченочную холецистэктомию.
Пунктируют печень со стороны верхней ее поверхности, чтобы уточнить расположение желчного пузыря. Паренхиму печени рассекают сверху по оси желчного пузыря и обнажают его. Рассечение печени не сопровождается большим кровотечением, потому что в таких случаях паренхима в зоне пузыря склерозирована и плотна. Желчный пузырь вскрывают, удаляют его содержимое и производят холецистэктомию.
Частичная холецистэктомия (мукоклаза). Иногда главная сложность состоит в том, что желчный пузырь и особенно его шейку невозможно отделить от печени без значительного повреждения с последующим кровотечением. Поэтому вместо того чтобы после холецистэктомии оставлять сильно кровоточащую рану печени, лучше оставить на месте те участки желчного пузыря, которые приращены к ней. Ножницами и пинцетом удаляют остальные участки желчного пузыря. Около 1/3 стенки его остается на печени. Выскабливают острой ложкой или коагулируют термокаутером слизистую оболочку на оставшихся участках, смазывают их спиртовым раствором йода и поверх кладут дренаж.
Этот метод предложил Мауо (1900). В 1923 г. Pribram предложил операцию, известную под названием «мукоклаза». Она заключается в следующем. Пункцией освобождают желчный пузырь от жидкого содержимого и вскрывают от дна до шейки по передней поверхности продольным разрезом. Затем, протерев изнутри пузырь сухими салфетками и удалив камни, сгустки слизи и крови, диатермокоагулятором глубоко выжигают всю слизистую оболочку пузыря и его шейки; пузырь зашивают так, чтобы по линии швов стенки соприкасались между собой ввернутыми внутрь, покрытыми серозной оболочкой поверхностями. Пузырный проток и артерию предварительно перевязывают. Если перевязка невозможна, слизистую оболочку пузырного протока тоже выжигают. В результате этой операции на месте бывшего желчного пузыря со временем образуется фиброзный тяж.
Излечение больных возможно в тех случаях, когда иссечение пузыря острым путем очень опасно или невозможно. Однако операцию производят в исключительных случаях, так как иногда образуется карцинома в фиброзном тяже.
Холецистэктомия при водянке и эмпиеме желчного пузыря. Желчный пузырь может быть таким напряженным, что его нелегко захватить зажимом, не повредив стенку. Кроме того, большие размеры напряженного пузыря затрудняют доступ к элементам печеночно-дуоденальной связки. В таких случаях необходимо аспирировать содержимое желчного пузыря. На дно его накладывают кисетный серозный шов, В центре этого шва стенку пузыря прокалывают толстой иглой, соединенной при помощи гибкой трубки с электроотсосом. Содержимое отсасывают и в момент извлечения иглы затягивают и завязывают кисетный шов, закрывая пункционное отверстие.
При водянке или эмпиеме желчного пузыря всегда надо искать камень в пузырном протоке. Если он находится возле самого входа в общий пузырный проток и не поддается смещению, то очень трудно найти достаточно места для наложения лигатуры или введения трубки для холангиографии. В таком случае надрезают стенку пузырного протока над камнем и удаляют его.
Холецистэктомия при остром холецистите. Иссечение остро воспаленного желчного пузыря редко представляет большие трудности. Обширные рыхлые спайки легко разъединяются пальцем. Однако манипуляции необходимо производить осторожно, так как гиперемированные ткани могут сильно кровоточить.
Туго наполненный желчный пузырь надо всегда освобождать путем пункции. В некоторых случаях после вскрытия брюшной полости в области желчного пузыря обнаруживается конгломерат воспаленного, утолщенного сальника, приросшего в его стенкам. Особенно выражено сращение в области дна пузыря. Здесь сальник иногда приходится пересекать на зажимах и перевязывать, оставляя небольшой участок его на дне пузыря. Необходимо соблюдать осторожность, чтобы не повредить поперечную ободочную кишку. Перед началом отделения сальника операционное поле надо тщательно изолировать марлевыми салфетками от остальной брюшной полости, чтобы предотвратить загрязнение ее содержимым пузыря, которое может вылиться наружу из уже имеющегося перфорационного отверстия, прикрытого приращенным сальником, или возникшего при выделении тонкой или некротизированной стенки желчного пузыря. Кроме того, источником загрязнения может быть серозно-гнойная жидкость или гной, скапливающийся между печеночным ложем и желчным пузырем при гнойном пери-холецистите. Изливающуюся жидкость все время отсасывают. При случайном разрыве стенки желчного пузыря отверстие можно закрыть с помощью зажима, но если стенки некротически изменены, необходимо широко вскрыть полость пузыря, удалить все содержимое, продезинфицировать изнутри спиртовым раствором йода, умеренно туго выполнить ее сухой марлей и зашить разрез наглухо шелковыми швами, захватывая и оставленный материал. Очистив операционное поле, продолжают выделять желчный пузырь как от дна, так и от шейки. Сильно потягивать за желчный пузырь нельзя, так как можно легко оторвать его. Наибольшую опасность представляют выделение и перевязка пузырной артерии и пузырного протока в отечной печеночно-дуоденальной связке.
При удалении остро воспаленного желчного пузыря невозможно сохранить брюшинный покров его для перитонизации ложа. Остается обнаженная и иногда кровоточащая поверхность. Кровотечение можно остановить введением тампона в ложе пузыря на несколько минут. Если же в отдельных участках оно продолжается, производят электрокоагуляцию сосудов либо накладывают кетгутовые П-образные швы вокруг этих участков, захватывая фиброзную оболочку печени по обе стороны ложа. Такие швы нельзя завязывать слишком туго, иначе они прорезают паренхиму печени. Почти всегда можно остановить кровотечение, не оставляя после операции в ложе желчного пузыря марлевые тампоны или другие гемостатические средства, так как они могут вызывать развитие прогрессирующего облитерирующего холангита.
Холецистэктомия при отсутствии пузырного протока. Единичные крупные камни, располагающиеся в области шейки желчного пузыря, могут постепенно расширять пузырный проток и мигрировать в общий желчный проток, образуя полость на месте слияния пузырного протока с общим желчным и печеночным. Желчный пузырь при этом как бы превращается в дивертикул общего желчного протока.
При подозрении на такую патологию разрезают над камнем стенку желчного пузыря в месте перехода его в общий желчный проток в направлении, перпендикулярном к оси общего печеночного протока, и удаляют камень. Оставшуюся полость тщательно исследуют визуально и зондом. Обычно в ней обнаруживают 2 отверстия: вверху — общего печеночного протока, откуда поступает желчь, внизу — общего желчного протока. Если же камень находился только в шейке желчного пузыря, то из полости может быть только один ход — в пузырный проток. В сомнительных случаях не следует полагаться на данные осмотра полости. Надо ввести в нее катетер, закрыть стенку несколькими швами вокруг него и выполнить холангиографию.
Если камень, локализующийся в шеечном отделе желчного пузыря, вызвал пролежень в пузыре и в стенке общего печеночного протока и пузырный проток отсутствует вовсе, необходимо пластическое замещение дефекта с помощью петли тонкой кишки на наружном дренаже или без него в зависимости от ширины общего печеночного протока. В том случае, когда часть пузырного протока все же сохранена, пластику дефекта можно выполнить с его помощью.
Если стенка желчного пузыря жизнеспособна, при отсечении «го оставляют часть стенок и на наружном дренаже осуществляют пластическое замещение дефекта. Все эти вопросы будут подробно освещены при изложении принципов лечения непроходимости желчных протоков.
Холецистэктомия при внутренних желчных свищах. Большинство внутренних желчных свищей до операции не диагностируют. При этой патологии обнаруживаются плотные сращения желчного пузыря с поперечной ободочной и двенадцатиперстной кишками. При попытке выделить желчный пузырь неожиданно вскрывается просвет свища. Главное — своевременно обнаружить отверстие в кишке. Иногда оно остается незамеченным, так как предполагают, что надорван желчный пузырь. Поэтому при непреднамеренном вскрытии желчного пузыря тщательно исследуют ближайший отдел кишки. Обнаружив свищ, полностью отсекают его от кишки. Отверстие в желчном пузыре временно закрывают швом или зажимом, а кишку (поперечную ободочную или двенадцатиперстную) препарируют и по краю свищевого отверстия иссекают узкую полоску ее стенки в пределах
здоровых тканей. Зашивают кишку в поперечном направлении двухрядным швом.
Попытка разделения желчного пузыря и кишки при пузырно-кишечном свище нередко приводит к повреждению серозного покрова кишки на значительном протяжении. Последующая перитонизация может сузить просвет кишки. Кроме того, необходимо помнить, что сращение может быть обусловлено прорастанием опухоли желчного пузыря в кишку.
При выявлении пузырно-кишечного свища мы производим клиновидную резекцию кишки в пределах здоровых тканей, не разделяя самого свища. Участок стенки кишки, вовлеченный в свищ, удаляем вместе с желчным пузырем. Целость кишки восстанавливаем путем наложения швов.
Операция по поводу пузырно-кишечного свища, в силу создавшихся анатомических особенностей, может потребовать выполнения нестандартного вмешательства. Так, мы оперировали больную, у которой на фоне острого флегмонозного холецистита был обнаружен пузырно-дуоденальный свищ с дефектом стенки кишки размерами 3,5x6 см. Ушивание кишки было невозможным, поэтому решено было закрыть дефект за счет желудка. Из верхнего края свищевого отверстия по передней поверхности двенадцатиперстной кишки с переходом на привратник и антральный отдел желудка произведен разрез длиной около 7 см. Двенадцатиперстная кишка и желудок сшиты по типу гастродуоденостомии по Finney. Установлен зонд для постоянной аспирации желудочного содержимого. Послеоперационный период протекал без осложнений.
Следует помнить о возможном выпадении через свищевое отверстие из желчного пузыря в просвет кишки камней, которые впоследствии могут вызывать непроходимость кишечника. Их может быть несколько и они могут находиться в различных отделах кишечника. Такие камни, особенно при наличии больших свищевых отверстий, должны быть найдены и удалены. После этого холецист-эктомию продолжают одним из описанных способов.
Холецистэктомия после хо л ец и сто с то м и и. В свищевой ход вводят 1—2 % спиртовой раствор метиленового синего или бриллиантового зеленого, тампонируют и наружное отверстие зашивают. Кожный разрез проводят так, чтобы он веретенообразно окаймлял наружное отверстие свища. При рассечении последующих слоев брюшной стенки иссекают желчный ход, по возможности оставляя его связанным с дном желчного пузыря. Выполняют лапаротомию. Разделяют сращения между краем печени и брюшной стенкой. После этого желчный пузырь обычно становится достаточно подвижным и его можно удалить одним из типичных методов.
Холецистэктомия при синдроме портальной гипертензии. Особенности оперативного вмешательства в условиях портальной гипертензии связаны с повышенной кровоточивостью. Мельчайшие сосуды печеночно-дуоденальной связки, которые обычно пересекают во время выделения пузырного и общего желчного протоков, становятся источником значительного кровотечения. Вместе с кровью из отечных тканей поступает тканевая жидкость, что еще более затрудняет манипуляции хирурга. Повышенное давление и снижение свертывания крови способствуют большой кровопотере. Кроме того, обычно незаметные мелкие вены печеночно-дуоденальной связки при синдроме портальной гипертензии значительно увеличиваются в диаметре, что препятствует быстрой идентификации пузырных артерий и протока.
В связи с перечисленными особенностями холецистэктомию в условиях портальной гипертензии должен выполнять высококвалифицированный хирург. Обязательным требованием является тщательная поэтапная остановка кровотечения из мелких сосудов электрокоагуляцией, из более крупных — лигированием.
Осложнения после холецистэктомии. Несмотря на тщательно разработанные показания к этой операции, технику операции, послеоперационное ведение и профилактику послеоперационных осложнений, избежать технических ошибок, опасных ситуаций и осложнений после операции очень трудно, тем более, что в последние годы эту операцию стали выполнять и хирурги, не имеющие достаточного опыта в хирургии желчевыводящих путей.
Все осложнения можно разделить на 2 группы: 1) возникающие во время операции; 2) развивающиеся в послеоперационный период.
Осложнения, возникающие во время операции, являются самыми опасными. И если опытный хирург, как правило, быстро находит оптимальный выход из создавшегося положения, то малоопытный теряется даже в несложных ситуациях, которые возникают почти у каждого 3—4-го больного.
Среди осложнений, возникающих во время операции, можно выделить следующие: 1) отрыв или повреждение пузырной артерии; 2) повреждение печеночной артерии; 3) повреждение воротной вены; 4) отрыв и непреднамеренная перерезка пузырного протока; 5) повреждение общего печеночного протока; 6) вскрытие двенадцатиперстной или ободочной кишки.
1. Отрыв или повреждение пузырной артерии. Это осложнение встречается наиболее часто, но при правильной тактике не представляет опасности. Если пузырная артерия обрывается или выскальзывает из зажима после пересечения, то центральная культя ее может уйти глубоко в толщу печеночно-дуоденальной связки под печеночный проток. Самая частая ошибка состоит в том, что хирург пытается вслепую захватить сосуд зажимом. Это, как правило, приводит к повреждению печеночного протока или печеночной артерии.
При повреждении пузырной артерии ее захватывают зажимом только в том случае, если она ясно видна. В противном случае отыскивают артерию путем препаровки. Для этого выделяют общий печеночный проток несколько выше, отпрепаровывают серозный покров печеночно-дуоденальной связки влево, чтобы обнажить место отхождения пузырной артерии от правой печеночной. От пузырной артерии надо отличать правую печеночную, перевязка которой грозит ишемическим некрозом правой доли печени. Необходимо также всегда помнить об анатомических вариантах отхождения пузырной артерии и учитывать то обстоятельство, что примерно в 20 % случаев пузырная артерия начинается вне треугольника Callot. Если кровотечение обильное, на короткое время (не более чем на 15—30 мин ввиду возможности развития гиповолемического шока) зажимают печеночно-дуоденальную связку вначале пальцами, а затем мягким кишечным зажимом. Для этого указательный палец левой руки или одну браншу зажима заводят в сальниковое отверстие. Пережатие печеночно-дуоденальной связки приводит к немедленной остановке кровотечения. Представляет большую опасность обкалывание (пришивание) кровоточащего участка вместо наложения зажима и лигатуры. Лишь при отрыве пузырной артерии от печеночной на рану накладывают шов атравматической иглой так, чтобы не сузить ее просвет.
2. Повреждение печеночной артерии. При сложных холецистэктомиях может быть повреждена правая или собственная печеночная артерия. Левая и общая печеночная артерии находятся далеко от опасной зоны и практически никогда не повреждаются. Следует иметь в виду, что перевязка общей печеночной артерии обычно не связана с большим риском, так как артериальное кровоснабжение печени при этом может оставаться удовлетворительным благодаря наличию коллатералей (желудочные, желудочно-сальниковые и панкреатодуоденальные артерии).
Учитывая сказанное, при повреждении собственной или правой печеночной артерии следует накладывать сосудистый шов по типу «конец в конец». Для этого вначале, при возникновении сильного артериального кровотечения, зажимают печеночно-дуоденальную связку, а затем тщательно отпрепаровывают место повреждения. Если наложить шов не удается, то жизнь больного в опасности.
3. Повреждение воротной вены. Если во время холецистэктомии повреждена воротная вена, то необходимо сначала сдавить печеночно-дуоденальную связку рукой, а затем мягким кишечным зажимом попыпаться восстановить непрерывность сосуда наложением сосудистого шва по типу «конец в конец» либо при помощи протеза. Если это невозможно, отток крови из портальной системы необходимо обеспечить наложением портокавального, спленоренального или мезентерикокавального анастомоза. От наложения такого анастомоза можно воздержаться только в том случае, если перевязка воротной вены не сопровождается подъемом портального давления выше 25 мм вод. ст., что бывает при существовании естественных портокавальных анастомозов вследствие имеющихся нарушений проходимости воротной вены. Давление при этом измеряют при помощи катетеризации вены брыжейки тонкой кишки. При отсутствии коллатералей перевязка воротной вены приводит к смертельному исходу в течение ближайших часов вследствие нарушения гемодинамики и гиповолемического шока.
4. Отрыв и непреднамеренная перерезка пузырного протока. При сильном потягивании за желчный пузырь во время антеград-ной холецистэктомии возникает опасность отрыва пузырного протока. Непреднамеренная перерезка пузырного протока может иметь место при грубых патологоанатомических изменениях в области шейки желчного пузыря. В подобных случаях крайне трудно найти культю пузырного протока, так как она сокращается и уходит глубоко в печеночно-дуоденальную связку. Несмотря на трудности, культю пузырного протока надо найти и перевязать, а при обрыве ее у места впадения в общий желчный проток дефект стенки протока ушить атравматичным шовным материалом 4/0, 5/0, а если проток тонкий — поперечно. Поиски пузырного протока может облегчить введение раствора метиленового синего в общий желчный проток после пункции его. Вводимый под небольшим давлением красящий раствор выделяется через стенки протока, что облегчает его обнаружение. Определенную помощь может оказать также интраоперационная холангиография после пункции желчных протоков. Как правило, холангиограмма дает необходимые сведения о положении культи пузырного протока. Данные манометрии ничего не говорят, пока раскрыта культя пузырного протока.
5. Повреждение общего печеночного и общего желчного протоков — довольно частое и тяжелое осложнение. Даже после его устранения операция уже не гарантирует хороших отдаленных результатов. Если же хирург не заметил своей ошибки, то это осложнение вызывает опасные последствия. К сожалению, такие ошибки допускают не только малоопытные, но и известные хирурги. Так, по данным Kehr (1913), подобные осложнения имели место у 20 (1 %) из 2000 оперированных. Мы наблюдали его у 3 (0,1 %) из 2916 больных, которым была выполнена холецистэктомия. Еще в 1930 г. 3. Т. Кисель нашел в литературе описание 83 случаев непреднамеренных операционных травм общего печеночного протока. К сожалению, отдельные хирурги скрывают подобные случаи. Многие хирурги, не имея большого опыта, пытаются сами устранить повреждения, что в ряде случаев ведет к развитию рубцовых стриктур желчных протоков и необходимости выполнения сложных, порой неоднократных оперативных вмешательств для восстановления магистрального желчеоттока.
Если повреждение распознано во время операции, то его можно легко и надежно устранить. Наиболее часто повреждение общего печеночного протока происходит в тех случаях, когда при неожиданном кровотечении из пузырной артерии хирург пытается вслепую захватить сосуд инструментом.
Другой механизм повреждения стенок магистральных желчных протоков состоит в следующем. Если пузырный проток идет параллельно главному печеночному протоку, то разделяющая их шпора на значительном протяжении состоит лишь из одной слизистой оболочки. При попытке отделить пузырный проток от общего печеночного до устья и возникает большая опасность повреждения. В то же время такой пузырный проток можно оставить на месте. Не следует опасаться развития «синдрома культи пузырного протока», если вместе с ним будут удалены участки шейки желчного пузыря.
Общий печеночный проток может быть поврежден при неосторожных попытках выделения пузырного протока спирального типа. В подобных случаях можно не только ранить, но и перерезать печеночный или общий желчный проток и этим чрезвычайно осложнить операцию. Поэтому если при выделении пузырного протока не удается определить место перехода его в желчный проток, то лучше сначала отсечь пузырный проток у самой шейки; выполнить холецистэктомию и только после этого приступить к иссечению пузырного протока. Kehr (1913) и С. П. Федоров (1931) зондом, введенным в пузырный проток, определяют направление его и, рассекая постепенно стенку протока, доходят до места впадения его в общий желчный проток.
Даже при относительно легко выполняемой холецистэктомии могут быть пересечены аномальные печеночные протоки, впадающие в желчный пузырь или пузырный проток.
При экстирпации сморщенного желчного пузыря, при коротком пузырном протоке или ущемлении камня в нем хирург может отсечь несколько вытянутую часть боковой стенки общего желчного протока, предполагая, что отсекает пузырный проток. Подвижный общий печеночный проток при натягивании желчного пузыря может деформироваться и тогда лигатура закрывает его просвет. Если это осложнение во время операции остается незамеченным, то в послеоперационный период развивается желтуха. При подозрении на перевязку общего желчного протока следует сразу же, в течение 6—7 дней, раскрыть рану и снять лигатуру. Ранняя повторная операция необходима при повреждении желчных протоков или соскальзывании лигатуры с культи пузырного протока и обильном истечении желчи.
При антеградной холецистэктомии, когда операция протекает легко и быстро, общий желчный проток не широкий, а потягивание за желчный пузырь осуществляется сильно, то печеночно-желчный проток отслаивается от клетчатки печеночно-дуоденалыюй связки, оттягивается вправо, перегибается под углом, и нижняя его часть принимает направление пузырного протока. Тогда легко может случиться, что хирург, увлеченный быстротой операции, вместо пузырного протока выделит и пересечет общий желчный проток. В особенности это бывает, когда круглый камень застрял в шейке пузыря и пузырный проток антеградно доступен гораздо труднее, чем полагают.
Одной из самых опасных является ситуация, при которой крупный желчный камень находится в месте слияния пузырного протока с печеночным и общим желчным. Такой камень постепенно расширяет пузырный проток и перемещается в общий желчный проток. Если хирург не осознает всей опасности, то он неизбежно пересечет общий желчный проток. Дело в том, что при попытке ретроградной холецистзктомии у нижнего полюса камня хирург может обнаружить тонкий желчный проток и, полагая, что это пузырный проток, перерезает его. Только подходя к верхнему полюсу камня, он начинает понимать, что перерезанный тонкий проток в действительности был общим желчным. Но тогда уже восстановить целость общего желчного протока весьма сложно. При боковом ранении печеночно-желчного протока можно попытаться зашить отверстие в стенке или дренировать через него проток наружу. Если же проток перерезан поперек, то остается только наложить циркулярный шов по типу «конец в конец» или сделать гепатикодуодено- или еюностомию. При отсутствии условий для выполнения операций в проксимальный (печеночный) конец вставляют наружный дренаж. Операцию, направленную на восстановление магистрального желчеоттока, выполняет специалист-гематолог или больного транспортируют в специализированное отделение. Если пузырный проток закупорен камнями, мешающими изолировать место впадения его в печеночно-желчный проток, то их пытаются протолкнуть в пузырь или удаляют путем цистэктомии.
Методика восстановления проходимости желчных протоков после их повреждения описана в следующей главе. Если повреждение протоков произошло, восстановительная операция должна быть выполнена в течение 2—4 сут.
6. Вскрытие двенадцатиперстной или ободочной кишки. Если случайное вскрытие кишечника замечено во время операции, то оно не представляет никакой угрозы, отверстие в кишке закрывают двумя слоями швов.
Осложнения, возникающие в послеоперационный период, в значительной мере влияют на количество летальных исходов, а также на ближайшие и отдаленные результаты. Среди них встречаются осложнения, связанные с холецистэктомией, с лапаротомией и с обострением или возникновением новых патологических состояний.
I. Осложнения, связанные с холецистэктомией. К ним относятся: 1) желчные и другие перитониты; 2) внутрибрюшное кровотечение; 3) наружное желчеистечение; 4) механическая желтуха; 5) абсцесс брюшной полости.
Перитонит является самым тяжелым осложнением холецист-эктомии. По данным различных авторов, он встречается у 2,7 % оперированных (В. В. Виноградов и соавт., 1972, 1978; С. А. Кац и соавт., 1977).
Причинами перитонита являются надпеченочные, подпеченочные и поддиафрагмальные абсцессы (чаще возникают при остром гнойном и деструктивном холецистите), несостоятельность культи пузырного протока, незамеченные повреждения общего печеночного и аномальных желчных протоков, желчеистечение из ложа пузыря при недостаточно тщательном его ушивании, гнойное воспаление послеоперационной раны с образованием абсцессов в предбрюшинной клетчатке, а также не поддающееся лечению гнойное воспаление брюшной полости, имеющееся до операции и прогрессирующее, несмотря на предпринятое вмешательство и устранение основного очага инфекции. Причинами перитонита могут быть также не замеченные во время операции ранения тонкой и толстой кишок.
Желчный перитонит развивается исподволь, не имеет ярко выраженной клинической картины. Постепенно, в течение 10—16 ч, а иногда 1—2 сут нарастают явления общей интоксикации и признаки динамической непроходимости кишечника. Отмечается тахикардия (не более ПО ударов в 1 мин). Язык сухой, обложен. Живот вздут, однако брюшная стенка не напряжена, симптом Щеткина—Блюмберга слабо положительный. Диагноз устанавливают по обнаружению желчи в отделяемом из дренажа наряду с прогрессированием клинической симптоматики.
Во время операции по поводу желчного перитонита, развившегося после холецистэктомии, обязательной является ревизия желчных протоков в целях уточнения их целостности и проходимости. Необходимо наружное дренирование общего желчного- протока, так как поиск мелких аномальных желчных протоков или незначительных дефектов стенки магистральных желчных протоков не всегда бывает успешным, а ушивание их в инфильтрированных тканях не обеспечивает полной остановки желчеистечения. В то же время создание оттока желчи из протоков наружу одновременно с широким дренированием подпеченочного пространства и брюшной полости надежно предотвращает прогрессирование перитонита. Для дренирования брюшной полости применяют трубчатые дренажи, которые в послеоперационный период используют для проведения фракционного перитонеального диализа. В подпеченочное пространство вводят не менее 2 дренажей.
Не менее тяжелым осложнением является внутрибрюшное кровотечение, которое встречается после холецистэктомии у 0,06— 0,3 % больных (В. М. Греднев, 1975; В. В. Виноградов и соавт., 1978), а после релапаротомий — у 9 % (А. С. Сорокин, Н. Н. Кузнецов, 1979). Источниками кровотечения могут быть мелкие сосуды ложа желчного пузыря, соскальзывание лигатуры с культи пузырной артерии, повреждения даже мелких веточек печеночной артерии, идущих вдоль общего желчного протока, кровотечение из сальника после его отделения от пузыря острым путем, а также из рыхлых тканей забрюшинного пространства при мобилизации двенадцатиперстной кишки. Самым сложным является диагностика такого кровотечения, развивающегося в первые часы после операции, когда еще не прошло действие наркотических средств. Иногда не помогает и дренаж, оставленный в брюшной полости, так как он может быть закрыт сгустками крови. Иногда не обращают внимания и на выделение небольшого количества жидкости (50—100 мл), окрашенной кровью, так как нередко в конце операции в брюшную полость вливают 200—300 мл изотонического раствора натрия хлорида с антибиотиками, который окрашивается кровью и изливается через дренаж. В связи с этим мы применяем раствор антибиотиков лишь для промывания подпеченочного пространства и брюшной полости (если в этом есть необходимость), а затем отсасываем его электроотсосом. Правильно и своевременно диагностировать кровотечение в брюшной полости в послеоперационный период можно лишь путем тщательного наблюдения за гемодинамическими изменениями в организме, начиная с первых часов после операции, за цветом кожи и видимых слизистых оболочек путем исследования в динамике количества гемоглобина и эритроцитов, а также насыщенности кровью жидкости, поступающей через дренаж из брюшной полости. Установление внутрибрюшного кровотечения после холецистэктомии требует срочной релапаротомий.
Причины возникновения желчеистечения из брюшной полости после холецистэктомии те же, что и возникновения желчного перитонита (несостоятельность культи пузырного протока, повреждение общего печеночного протока, недостаточная герметизация ложа желчного пузыря), но при перитоните желчь преимущественно поступает в свободную брюшную полость, а при желчеистечении она начинает выделяться через дренаж, находящийся в правом подпеченочном пространстве. Желчеистечение — это лучший исход осложнения, но желчь может поступать и в брюшную полость, тогда желчеистечение по дренажу является признаком именно желчного перитонита. Такое желчеистечение может впоследствии привести к формированию наружного желчного свища.
Желчеистечение свидетельствует о наличии желчной гипертензии, не устраненной во время операции в связи с незамеченными органическими изменениями желчных протоков, или временной, возникшей в результате спазма сфинктера большого сосочка двенадцатиперстной кишки как ответной реакции на операцию удаления желчного пузыря, либо после исследования желчных протоков зондом. Тем не менее спешить с повторным вмешательством, если нет явлений перитонита, не следует. Необходимо лишь вести строгое наблюдение за состоянием больного, учитывать количество истекаемой желчи и вводить достаточное количество спазмолитических средств. Не следует торопиться и с выполнением чрездре-нажного рентгеноконтрастирования. Такое исследование можно применить через 10 дней и только в том случае, если желчеистечение не имеет тенденции к уменьшению. В том случае, если желчеистечение не прекращается и рентгенологически обнаружена причина его, повторное вмешательство должно быть выполнено не ранее чем через 3—4 мес. В этот период следует применить все средства консервативной терапии, направленной на устранение причины желчной гипертензии.
Желчеистечение после холецистэктомии — явление нередкое, но в большинстве случаев оно кратковременное (3—5 дней) и не требует специального лечения. Мы наблюдали подобное осложнение у 20 (0,7%) больных и лишь у 1 (0,03%) потребовалось срочное вмешательство.
Механическая желтуха является редким осложнением, свидетельствующим либо о перевязке магистральных желчных протоков, либо об ущемлении не замеченного во время операции камня в ампуле большого сосочка двенадцатиперстной кишки (в этих случаях желтуха возникает на 1—2-е сутки после операции). Самым надежным является прямое контрастирование желчных протоков при помощи эндоскопической ретроградной или чрескожнои чреспе-ченочной холангиографии с одновременной (при необходимости) папиллотомией. Обтурационная желтуха является показанием к срочной операции. В тех случаях, когда желтуха развивается медленно (на 3-й — 4-е сутки после операции) и не сопровождается выраженной билирубинемией, требуются специальные методы исследования для уточнения ее этиологии и дальнейшей тактики. При этом обычно диагностируют гепатит, плавающий камень общего желчного протока, холангит.
Абсцессы брюшной полости образуются главным образом после операций по поводу острого гнойного холецистита. Мы наблюдали подобное осложнение у 8 (0,3 %) больных, потребовавшее повторного хирургического вмешательства. Следует отметить, что подобные осложнения возникают в основном при позднем вмешательстве по поводу острого холецистита и небрежной технике оперирования при.хронических холециститах (негерметичное ушивание ложа желчного пузыря, недостаточно тщательный гемостаз и др.).
II. Осложнения, связанные с лапаротомией. Обычно они не влияют ни на летальность, ни на отдаленные результаты, хотя в значительной степени сказываются на продолжительности пребывания больного в стационаре. К таким осложнениям относятся нагноение послеоперационной раны, лигатурные свищи, эвентрация и послеоперационные грыжи.
Нагноение раны встречается в основном после операций по поводу гнойного и деструктивного холецистита у больных с выраженной подкожной основой и у лиц пожилого возраста. По данным В. В. Виноградова и соавторов (1978), подобные осложнения наблюдаются в 5 % плановых и экстренных операций. После операций по поводу острого холецистита частота нагноений раны увеличивается до 8,5 % (А. К. Шмаус, В. Векнер, 1978). Среди оперированных в нашей клинике по поводу острого и хронического холецистита подобные осложнения составили 2,1 % (60 больных). Лечение нагноения раны не представляет больших трудностей, но следует отметить, что чем раньше начато дренирование раны (путем разведения ее краев и введения резиновых полосок) при наличии инфильтрата, тем раньше исчезает воспалительный процесс и значительно уменьшается гнойное расплавление тканей.
Образование лигатурных свищей является не столько опасным, сколько тягостным для больного осложнением. Процесс начинается обычно после выписки больного из стационара с появления одного или нескольких инфильтратов по ходу послеоперационного рубца. Затем инфильтрат превращается в абсцесс, который нередко вскрывается самостоятельно, и с гноем выделяются лигатуры. В некоторых случаях абсцесс вскрывает хирург и удаляет зажимом лигатуру из глубины раны. После удаления лигатуры наступает быстрое заживление. Однако у ряда больных нагноение начинается в месте расположения нескольких лигатур и не все они легко отходят или удаляются хирургом, периодическое нагноение длится месяцами. В таких случаях длительного лечения проводить не следует. Если в течение 1 мес с процессом справиться нельзя, то свищ следует иссечь в пределах здоровых тканей, под контролем зрения удалить с апоневротического шва в пределах образовавшейся раны все лигатуры, а рану либо оставить открытой, либо ушить редкими швами в зависимости от выраженности гнойного процесса. Раннее иссечение лигатурных свищей предотвращает образование больших гнойных гранулем и распространение процесса на всю послеоперационную рану.
Эвентрация является довольно редким осложнением холецистэктомии и встречается главным образом у лиц пожилого возраста (1,6 %, по данным С. А. Кац и соавт., 1977), но составляет (А. С. Сорокина, Н. Н. Кузнецова, 1979) почти все релапаротомий, выполняемых по поводу осложнений после операций на желчевыводящих путях.
С тех пор как при холецистэктомии начали применять верхнесрединную лапаротомию, частота послеоперационных грыж уменьшилась до 0,6—0,8 %. Следует отметить, что всякого рода нагноения, лигатурные свищи являются прямой предпосылкой к образованию грыж, поэтому их профилактика является и профилактикой образования послеоперационных грыж. Прямых указаний на связь шовного материала с образованием грыж нет, но мы считаем, что материал, которым сшивают апоневроз, должен быть не толстым, а прочным. Обычно используют капрон; расстояние между швами не должно превышать 0,6 см. Как оказалось, раннее вставание после операции не влияет на расхождение швов апоневроза, но поднятие тяжести в течение первых 6 мес имеет прямое отношение к образованию послеоперационных грыж.
III. Осложнения, связанные с обострением или возникновением новых патологических состояний со стороны различных органов и систем, нередко ведут к летальным исходам. К ним относятся осложнения со стороны сердечно-сосудистой системы, легких, печени и почек, поджелудочной железы, желудка и двенадцатиперстной кишки.
Осложнения со стороны сердечно-сосудистой системы в виде сердечно-сосудистой недостаточности, тромбоэмболии легочной артерии, инфаркта миокарда, обострения хронического тромбофлебита нижних конечностей встречаются преимущественно у лиц пожилого возраста и чаще при остром холецистите. В среднем они составляют 1,9 % к числу оперированных (В. В. Виноградов и соавт., 1978), около 30 % всех летальных исходов после холецистэктомии по поводу острого холецистита (В. П. Котельников, 1975) и 20 % после операций на желчевыводящих путях (А. С. Сорокина, Н. Н. Кузнецов, 1979).
Осложнения со стороны легких наблюдаются в виде одно- или двустороннего воспаления легких, долевых инфарктов, плеврита. В 4,2 % случаев они являются причиной летальных исходов (В. П. Котельников, 1975) и у 2,9 больных наблюдаются в послеоперационный период (В. В. Виноградов и соавт., 1978).
Осложнения со стороны печени и почек в виде печеночно-почеч-ной недостаточности чаще всего возникают при гнойных и деструктивных формах острого холецистита, особенно осложненных местным или общим перитонитом. Они являются одной из основных причин летальных исходов (В. Н. Климов, 1979), составляющих 20—81 % (В. П. Котельников и соавт., 1975; Л. В. Авдей, В. И. Дружинин, 1977).
Основной мерой профилактики печеночно-почечной недостаточности является ранняя госпитализация и раннее оперативное лечение больных с острыми формами холецистита, особенно лиц пожилого возраста.
Осложнения со стороны поджелудочной железы у больных с неосложненными формами холецистита встречаются редко (в 0,4 % случаев, по данным В. В. Виноградова и соавт., 1978). Чаще наблюдается обострение хронического панкреатита, имевшего место еще до операции. Тяжелый панкреонекроз развивается в единичных случаях (В. П. Котельников и соавт., 1975). Мы не наблюдали панкреонекроза лишь только после холецистэктомии, но при наличии клинических или операционных данных, свидетельствующих об обострении хронического панкреатита, сразу же проводили комплекс профилактических и лечебных мероприятий, направленных на устранение воспаления поджелудочной железы.
Осложнения со стороны желудка и двенадцатиперстной кишки проявляются в виде желудочного или кишечного язвенного кровотечения. По данным В. В. Виноградова и соавторов (1978), они встречаются в 0,3 % случаев. Мы наблюдали такие осложнения у 3 больных, поэтому язвенную болезнь, обнаруженную до операции или во время нее, лечим одновременно, выполняя проксимальную селективную ваготомию и другие вмешательства.
Летальность. Послеоперационная летальность при остром холецистите составляет 0,5—12,3 %, причем при неосложненных формах она равна 0,5 %, а при перфоративном холецистите— 12,8 %.
Мы располагаем опытом хирургического лечения 1440 больных с острым холециститом. Послеоперационные осложнения имели место у 140 (9,8 %), летальные исходы — у 1,2 %. Наиболее часто развивались осложнения у больных с гнойными и деструктивными формами острого холецистита, что свидетельствовало о позднем их оперативном лечении.
Послеоперационная летальность при хроническом холецистите составляет, по данным литературы, 0,2 %. Осложненные формы хронического холецистита значительно увеличивают летальность за счет дополнительных вмешательств, вызывающих в послеоперационный период печеночно-почечную недостаточность, панкреонекроз, кровотечения, тяжелые осложнения со стороны сердечно-сосудистой и легочной систем.
Из 4168 оперированных нами по поводу хронического холецистита больных осложнения в послеоперационный период развились у 55 (3,7 %) больных; 27 (0,67 %) больных умерли. У 1546 больных наряду с холецистэктомией была выполнена холедохолитото-мия и трансдуоденальная папиллосфинктеротомия. Летальность в этой группе больных составила соответственно 2,9 % и 2,5 %.Таким образом, общая летальность составила 1 %
Реабилитация больных, оперированных по поводу желчнокаменной болезни и заболеваний желчного пузыря. При обследовании 975 больных, перенесших холецистэктомию в сроки от момента операции до 2 лет, оказалось, что пребывание каждого больного в стационаре составило в среднем 17,8 дня. На пребывание в стационаре мало влиял тот факт, в какой фазе холецистита выполнена операция — в острой или хронической. Длительность пребывания больных в стационаре находилась в прямой зависимости от наличия осложненной формы холецистита, осложнений в послеоперационный период и возраста больного. В основном увеличивался срок пребывания в стационаре больных с осложнениями со стороны поджелудочной железы (острый панкреатит, панкреонекроз), операционной раны (нагноение), легких и сердца (пневмония, плеврит, инфаркт миокарда).
Большинство оперированных (893, или 91,6 %) приступили к работе через 2 мес, остальные (8,4 %) продолжали болеть до 3— 6 мес. Длительность реабилитации у этих больных объяснялась наличием гепатита (11%)> панкреатита (28%), обострений хронических заболеваний легких и сердца (18,3 %), лигатурных свищей (12,2%), длительно не рассасывающихся инфильтратов послеоперационной раны (10,5 %). Трудоспособность была восстановлена через 4 мес у 954 (97,8 %) больных, через 6 мес — у 969 (99,4%).
В то же время, несмотря на восстановление трудоспособности, медицинская реабилитация наступила через 6 мес лишь у 40 % из них, остальные 60 % предъявляли жалобы на периодическую боль в правом подреберье, недомогание, соблюдали диету, периодически принимали спазмолитические и желчегонные препараты. Лишь через 1 год медицинская реабилитация достигла 80 %.
Таким образом, медицинская реабилитация значительно отстает от трудовой, а это указывает на недостаточное изучение данной проблемы.
Отдаленные результаты обычно оценивают через 2 года после операции. Мы проанализировали исходы лечения у 768 больных, перенесших холецистэктомию в сроки от 2 до 10 лет. В эту группу не вошли больные, у которых холецистит был осложнен частичной или полной непроходимостью желчных протоков. Результаты оценивались как хорошие при отсутствии жалоб, имевших место до операции или возникших после нее и связанных с вмешательством; как удовлетворительные при наличии некоторых жалоб, имевших место до операции (диспептические явления, чувство тяжести в области печени и др.), но не требующих стационарного лечения; как плохие при наличии постоянных жалоб и объективных данных, требующих стационарного консервативного или оперативного лечения.
Хорошие отдаленные результаты получены у 670 (87,2%), больных, удовлетворительные — у 71 (9,2%), неудовлетворительные — у 27 (3,5%). Две первые группы больных — это практически здоровые люди; 3,5 % обследованных 3-й группы, хотя и сохраняют работоспособность, но продолжают болеть: 6 переведены на инвалидность, 5 оперированы повторно (3 — по поводу сте-нозирующего папиллита через 6, 7 и 9 лет после первой операции), 14 больных периодически лечатся по поводу хронического рецидивирующего панкреатита (10 из них были ранее оперированы по поводу «бескаменного» хронического холецистита).
Таким образом, основная масса больных, оперированных по поводу острого и хронического холецистита, не осложненного непроходимостью желчных протоков, оказалась практически здоровой и составляет 96,5 %.
Наши данные мало отличаются от сведений других хирургов, которые наблюдали удовлетворительные и хорошие результаты у 85—90,3 % больных, а плохие — у 4,8—9 %. Все хирурги подчеркивают, что чем раньше от начала заболевания выполнена операция, тем лучше результаты лечения.
Несмотря на довольно благоприятные результаты хирургического лечения, ряд больных продолжают жаловаться на приступы желчной колики, тупую боль в области печени, лихорадку, диспептические и другие расстройства. Во многих случаях эти явления не связаны с произведенной операцией, а иногда не имеют отношения к патологии печени и желчевыводящих путей. Тем не менее эта проблема остается хирургической и связана, по мнению P. Mallet-Guy и соавторов (1970), с допущенными ошибками, а именно с недостаточной диагностикой, неполноценным хирургическим лечением или несовершенной техникой операции. Лишь у 0,2 % больных они связывают эти явления с отсутствием желчного пузыря.
Количество неизлеченных после холецистэктомии больных, по данным различных авторов, колеблется в широких пределах— от 5 до 64 % и в среднем составляет 30 %. В последние годы оно значительно уменьшилось и составляет, по нашим данным,— 2,3 % (67 из 2916 оперированных, а по данным литературы,— 1,7— 11,3 % (Д- Л. Пиковский, К. С Житников, 1978).
По мнению большинства хирургов, стойкие жалобы после холецистэктомии, которые следует рассматривать как патологическое состояние организма, могут появляться как через несколько месяцев, так и через несколько лет в зависимости от причин, их вызывающих. Патологические состояния, возникшие через 10 лет после холецистэктомии, уже рассматривают как не имеющие к ней отношения.
Термин «постхолецистэктомический синдром» (ПХЭС) предполагает болезнь, связанную с удалением желчного пузыря. На самом деле под этим термином понимают ряд патологических состояний, часто имеющих различный патогенез, или заболевания, симулирующие ПХЭС.
Нами обобщен опыт лечения 3572 больных с ПХЭС в клинике КНИИКЭХ за период 1971—1987 гг. Более 85 % больных первично оперированы в других лечебных учреждениях. Возраст больных от 16 до 79 лет. Около 62 % из них были трудоспособного возраста, однако более 40 % пациентов в связи с операцией утратили трудоспособность и были вынуждены изменить характер трудовой деятельности или стали инвалидами.
Причины ПХЭС устанавливали с помощью различных методик инструментального исследования больного. Последовательность их выполнения определялась клинико-лабораторной семиотикой. Рациональное применение инструментальных методов исследования позволило у 57 % больных выявить причину ПХЭС на этапе поликлинического обследования.
Основными методиками являются двухмерная ультразвуковая эхография, внутривенная инфузионная, ретроградная, эндоскопическая и чрескожная чреспеченочная холангиография, фистулохолангиография, которые можно использовать изолированно или в комбинации. Высокоинформативны интраоперационные контрастная холангиография и ультразвуковое исследование. Достаточно полную информацию можно получить с помощью компьютерной томографии.
Обследование больного начинаем, как правило, с применения более простых и безопасных методов. Клинико-лабораторные и инструментальные методы дооперационного исследования далеко не всегда помогают выявить причины ПХЭС. Так, полное совпадение данных до- и интраоперационного обследования зарегистрировано только у 75,4 % больных, оперированных с целью устранения патологических состояний, вызывающих ПХЭС. Следовательно, решающее значение в дифференциальной и особенно топической диагностике указанных патологических состояний имеют интраоперационные исследования.
Анализ данных клинико-лабораторных и инструментальных исследований позволил установить ведущие причины и разработать рабочую классификацию ПХЭС, согласно которой различают:
1. ПХЭС, обусловленный изменениями, не корригированными при холецистэктомии, к которым относятся остаточный холедохолитиаз, стенозирующий папиллит, тубулярный стеноз общего желчного протока на почве хронического панкреатита, стеноз и киста желчного протока, паразитарные заболевания желчных протоков, камни внутрипеченочных желчных протоков, механические нарушения проходимости двенадцатиперстной кишки, обусловленные высоким стоянием дуоденальноеюнального изгиба и артериомезентериальной непроходимостью. Такой вид ПХЭС выявлен у 1805 (51 %) больных.
2. ПХЭС, обусловленный изменениями, возникшими в результате оперативных вмешательств: ятрогенными повреждениями желчных протоков, рубцовыми стриктурами и деформациями желчевыводящих путей с нарушением оттока желчи, деформацией двенадцатиперстной кишки с нарушением моторики и эвакуации ее содержимого, остаточным желчным пузырем, инородными телами желчных протоков (нити, иглы, протезы, фрагменты дренажей), рефлюкс-холангитом после трансдуоденальной сфинктеропластики и холедоходуоденостомии, невриномами пересеченных нервов общего желчного протока. Обнаружен у 671 (19 %) больного.
3. Поражение органов гепатопанкреатодуоденальной зоны, связанное с длительным течением холецистита: хронический холангиогепатит, хронический билиарный панкреатит, перихоледохеальный лимфаденит, внутрипеченочные и околопеченочные абсцессы, холангиогенный сепсис. Диагностировано у 635 (17 %) больных.
4. Органические и функциональные заболевания других органов и систем, не связанные с патологией желчного пузыря и его удалением, симулирующие ПХЭС: грыжа пищеводного отверстия диафрагмы, язвенная болезнь желудка и двенадцатиперстной кишки, хронический гастродуоденит, колит, опухоли желудка и кишечника, нефроптоз, почечнокаменная болезнь и хронический пиелонефрит, солярит, гипоталамический синдром, астеновегетативный синдром, психопатия, истерия, абдоминальный ишемический синдром, деформирующий спондилоартроз, опухоли печени, желчных протоков и поджелудочной железы, гипо- и гипертония большого сосочка двенадцатиперстной кишки, гипокинезия двенадцатиперстной кишки, рефлюкс-гастрит, дискинезии желчных протоков и большого сосочка двенадцатиперстной кишки. Обнаружены у 461 (13 %) больного.
С учетом выявленных причин избиралась дальнейшая тактика лечения. До 1980 г. методом выбора при лечении остаточного хо-ледохолитиаза являлась холедохотомия, которую в зависимости от сопутствующей патологии и степени дилатации желчных протоков завершали наложением глухого шва на общий желчный проток, наружным дренированием его, трансдуоденальной сфинктероплас-тикой или супрадуоденальной холедоходуоденостомией. Начиная с 1980 г. основным методом лечения остаточного холедохолитиаза и стенозирующего папиллита является эндоскопическая папилло-сфинктеротомия. Произведено 1390 эндоскопических папиллосфинктеротомий. Летальность составила 2,6 %. Относительно высокая летальность обусловлена тем, что метод применили больным с холедохолитиазом, осложненным гнойным холангитом и обтурационной желтухой, которым из-за тяжести состояния корригирующие операции на большом сосочке двенадцатиперстной кишки ранее не производили, а объем операции ограничивался холедохотомией и дренированием общего желчного протока. Эндоскопическая папиллосфинктеротомия в сочетании с назобилиарным дренированием и интрахоледохеальным введением антибиотиков способствовала улучшению результатов лечения больных, однако послеоперационная летальность повысилась, причем у 81 % больных летальные исходы были обусловлены прогрессированием печеночной недостаточности и гнойного холангита и только у 15 % связаны непосредственно с выполнением вмешательства.
У большинства больных после эндоскопической папиллосфинктеротомии наступило стойкое выздоровление. Указанная операция трудно выполнима после резекции желудка по Бильрот-П, а также при наличии больших околососочковых дивертикулов; 4 таким больным произведено электрорассечение сфинктера путем чрес-кожного чреспеченочного проведения папиллотома.
Причем у больных с особо крупными камнями применена поэтапная тактика оперативного лечения, основанная на интраопе-рационной литотрипсии с помощью аппарата «Байкал-2» или механического устройства с последующим удалением фрагментов камней через дренаж либо путем эндоскопической папиллотомии. При этом через культю пузырного протока или холедохотомный разрез вводили зонд диаметром 3,5—4 мм. Подводили электрод до соприкосновения с камнем. Аппаратом «Байкал-2» создавали ультразвуковой, а при его неэффективности — электрический разряд в жидкой диэлектрической среде, который разрушал камень.
Преобладание остаточного холедохолитиаза и патологии дис-тального отдела общего желчного протока среди причин ПХЭС является основанием для пересмотра отдельных критериев их до- и интраоперационной диагностики. Так, остаточный холедохолити-аз и стенозирующий папиллит у 12,5 % больных не сопровождался желтухой, а диаметр общего желчного протока был более 1 см. Исходя из этого, следует дифференцированно применять до- и интра-операционные методы исследования для оценки состояния вне-,и внутрипеченочных желчевыводящих путей даже при оперативных вмешательствах по поводу неосложненного хронического холецистита. Помимо традиционных осмотра и пальпации желчных протоков, необходимо чаще прибегать к зондированию их и большого сосочка двенадцатиперстной кишки при помощи катетеров Фогарти, а также к интраоперационному ультразвуковому исследованию, которое значительно облегчает диагностику холедохолитиаза.
Тубулярный стеноз общего желчного протока явился показанием к выполнению супрадуоденальной холедоходуоденостомии у 103 больных (летальность 2 %). У 10 больных с дуоденостазом и резкой деформацией двенадцатиперстной кишки выполнена холе-дохоеюностомия (летальных исходов не было).
Другие, более часто встречающиеся причины ПХЭС — киста желчного протока и механическое нарушение проходимости общего желчного протока — требуют применения патогенетически обоснованных оперативных вмешательств (наложения цистодигестивных анастомозов при кистозном поражении желчевыводящих путей, а также выполнения операции типа низведения двенадцатиперстно-тощекишечного изгиба по Стронгу при его высоком стоянии или дуоденоеюностомии по Робинсону при III степени дуоденостаза).
Наиболее сложной и ответственной задачей является коррекция рубцовых стриктур желчных протоков. Из 329 больных у 309 (94%) рубцовые стриктуры желчных протоков возникли в результате ятрогенных повреждений, не корригированных при первичной операции. Поэтому любое ятрогенное повреждение протоков во время полостной операции должно рассматриваться как хирургическая ошибка, ведущая к тяжелым последствиям. В случаях ин-траоперационного повреждения протоков необходимо раннее восстановление их целости путем наложения билио-билиарных или билиодигестивных анастомозов. Угроза рубцевания создаваемых для восстановления пассажа желчи соустий после иссечения Рубцовых стриктур заставляет прибегать к оставлению в просвете анастомозов каркасных дренажей на период всей фазы репаратив-ного процесса. С помощью дилатации анастомозов пластмассовым раздувным дилататором удается в 2,2 раза уменьшить продолжительность каркасного дренирования, что значительно облегчает социальную, трудовую и медицинскую реабилитацию больных. Иногда добиться успеха можно путем дилатации стенозированных, наложенных ранее анастомозов из закрытого чрескожного чреспеченочного доступа.
Среди инородных тел желчевыводящих путей наиболее часто встречаются нити, используемые при внутрипротоковых манипуляциях. В целях профилактики осложнений целесообразно уменьшить число диагностических холедохотомий, использовать прецизионную технику, лазерный и плазменный скальпели, а также сверхтонкий шовный материал с прогнозируемыми сроками рассасывания.
Ведущее значение в профилактике гнойно-септических осложнений, обусловливающих ПХЭС, имеет раннее (за 38 ч до операции) введение антибиотиков, преимущественно цефалоспоринового ряда, в оптимальных дозах, а также рациональная антибактериальная терапия во время операции и после нее, предусматривающая комбинацию оптимальных видов препаратов и путей их введения (эндолимфатическое, в общий желчный проток, внутритканевое, внутривенное).
Особенно сложным оказалось изучение состояния моторно-эвакуаторной функции двенадцатиперстной кишки. В клинике обследованы 210 больных с ПХЭС без органической патологии желчных протоков. Для выявления нарушений моторики двенадцатиперстной кишки использовали дуоденокинезиографию, поэтажную мано-метрию, гастродуоденоскопию, релаксационную дуоденографию, которую иногда сочетали с мезентерикографией.
Нарушения моторики двенадцатиперстной кишки у большинства больных были функциональными и не сопровождались значительным изменением ее эвакуаторной функции. Патогенетически значимыми нарушениями являлись дуоденальная гипертензия, приводящая к желчной и панкреатической гипертензии, хроническому панкреатиту и холангиту, гипокинезия двенадцатиперстной кишки, гипер- и гипотония большого сосочка двенадцатиперстной кишки, дискинезия желчных протоков и большого сосочка двенадцатиперстной кишки.
Функциональная дискинезия двенадцатиперстной кишки и ее большого сосочка хирургической коррекции не требует. Показаниями к операции являются декомпенсированный функциональный дуоденостаз, тяжелая форма восходящего холангита и рефлюкс-гастрита, не поддающиеся консервативной терапии. Способ хирургической коррекции выбирают с учетом причин и степени выраженности нарушений моторно-эвакуаторной функции двенадцатиперстной кишки, характера и тяжести обусловленных ими осложнений. Методом выбора при лечении указанных тяжелых форм нарушений является дуоденоеюностомия по Робинсону, резекция желудка по Ру, подпривратниковая дуоденоеюностомия. При декомпенсированном дуоденостазе производим резекцию дилатированной нефункционирующей нисходящей части двенадцатиперстной кишки с последующим анастомозированием ее с тощей кишкой для восстановления естественного пассажа пищи.
Таким образом, уменьшению числа больных с ПХЭС способствуют своевременное, до развития осложнений, выполнение операции по поводу желчнокаменной болезни, унификация показаний к применению различных методов до- и интраоперационного исследования желчевыводящих путей, а также рациональная тактика холецистэктомии с коррекцией выявленной патологии органов панкреатодуоденальной зоны.
Холецистостомия. Впервые эту операцию выполнил Petit в 1743 г. Вначале операция получила широкое применение, но после того как Langenbuch (1884) доказал преимущества холецистэктомии, была почти полностью оставлена. В конце 20-х годов наступило возрождение холецистостомии, а в настоящее время показания к этой операции вновь ограничены, однако почти все хирурги в определенной ситуации ее применяют. По данным различных авторов, холецистостомия составляет от 0,4 до 25 % всех операций, выполняемых на желчном пузыре. В основном холецистостомию производят у больных пожилого и старческого возраста с высоким риском операции, по жизненным показаниям и в особо критических ситуациях.
Основной операцией при остром холецистите является холецистэктомия с полноценной коррекцией сопутствующих изменений в желчевыводящих путях. И лишь у больных пожилого и старческого возраста с тяжелыми сопутствующими заболеваниями операцию в первые 3 сут целесообразно заменить менее травматичным вмешательством — декомпрессией желчного пузыря, которая может быть выполнена под контролем лапароскопии, ультразвукового исследования, компьютерной томографии, а при отсутствии необходимой аппаратуры и инструментария - наложением холецистостомы. Еще более сдержанное отношение к холецистостомии при хроническом калькулезном холецистите
Мы выполнили холецистостомию у 2 больных старческого возраста с острым холециститом и крайне высоким риском операции в связи с тяжелым общим состоянием, быстрым увеличением инфильтрата в области желчного пузыря и нарастанием интоксикации. Жизнь больных была спасена, но у обоих остался полный наружный желчный свищ. От повторной операции больные отказались. Через год у 1 больного свищ закрылся и он умер без операции от печеночно-почечнои недостаточности на фоне механической желтухи, судьба второго больного неизвестна
Еще 3 больным мы выполнили чреспеченочную холецистостомию в целях декомпрессии желчных путей при атипичном ушивании культи двенадцатиперстной кишки. Ближайшие и отдаленные результаты операции хорошие.
Повторные вмешательства для ликвидации стойкого свища возникшего вследствие холецистостомии, выполненной по поводу острого холецистита в других лечебных учреждениях, мы произвели у 19 больных. Причинами возникновения свища были холецисто- и холедохолитиаз, индуративный панкреатит
Таким образом, на основании данных литературы и своего опыта операций на желчном пузыре и желчных протоках, мы пришли к выводу, что холецистостомия в подавляющем большинстве случаев является лишь симптоматической мерой, и для излечения больных, как правило, требуется повторная операция — удаление желчного пузыря.
Более оправдана холецистостомия при остром воспалении желчного пузыря, у пожилых людей, ослабленных тяжелыми сопутствующими заболеваниями. Если желчный пузырь окружен деревянистым инфильтратом или наступила перфорация его с образованием местного абсцесса, то выполнение холецистэктомии опасно для жизни. При таких условиях лучше ограничиться холецистосто-мией.
Патофизиологические и терапевтические последствия холецистостомии зависят от состояния желчевыводящих путей.
При эмпиеме и остром холецистите холецистостомия немедленно устраняет гнойный очаг. Однако полного излечения не наступает. К тому же, самостоятельно стома закрывается не всегда. При закупорке пузырного протока образуется слизистый свищ, а иногда отделяемое содержит примесь желчи вследствие наличия аномальных печеночно-пузырных протоков. Кроме того, холецистостомия при непроходимости пузырного протока не позволяет добиться декомпрессии магистральных желчных путей, в просвете
которых при эмпиеме желчного пузыря у 40 % больных содержатся камни.
Наиболее частыми показаниями к холецистостомии в прошлые годы были механическая желтуха и холангит. Но если ее производят при полной непроходимости на уровне терминального отдела общего протока (камень, опухоль), то больной теряет всю желчь, а нередко и весь панкреатический сок. Желтуха проходит, но вследствие большой потери воды и электролитов состояние больного не улучшается и он не в состоянии перенести повторную операцию. Поэтому надо по возможности избегать холецистостомии при полной закупорке желчных протоков: при закупорке камнем почти всегда возможна холедохолитотомия, при карциноме лучше произвести одномоментную радикальную операцию или наложить внутренний холецистоэнтероанастомоз.
При отсутствии закупорки пузырного протока холецистостомия устраняет механическую желтуху, но холангит мало поддается лечению. Дренаж в большинстве случаев недостаточен, так как холангиту сопутствует воспалительное сужение пузырного протока. Кроме того, после закрытия холецистостомы может наступить обострение холангита, так как существует низко расположенное препятствие оттоку желчи.
В прошлые годы холецистостомию применяли при дискинезиях желчного пузыря. Последующие наблюдения показали, что наружный дренаж желчного пузыря при дискинезиях дает положительных эффект, но как только удаляют дренаж и холецистостома закрывается, снова появляются жалобы. Однако в ряде случаев, когда диагноз во время операции остается неясным, вполне оправдана «диагностическая холецистостомия». Послеоперационные рентгеноманометрические исследования позволяют уточнить диагноз и выбрать правильное лечение. Холецистостомия с тонким дренажем при анатомически здоровом желчном пузыре безвредна и не вызывает впоследствии развития свищей. Опыт отдельных хирургов показал, что при наличии гепатита без сопутствующего холецистита временный наружный дренаж желчного пузыря благоприятно действует на дальнейшее течение болезни.
Таким образом, холецистостомия является простой, непродолжительной, хорошо переносимой операцией, которую применяют даже при плохом общем состоянии больного, и в этом ее преимущество. Холецистостомия является также методом симптоматической терапии и потому почти всегда представляет собой первый этап хирургического лечения. В этом состоит ее недостаток.
Показаниями к холецистостомии являются: значительные воспалительно-инфильтративные изменения в области желчного пузыря и печеночно-дуоденалыюй связки у ослабленных больных с высоким риском операции, когда хирург не уверен, что сможет быстро идентифицировать общий желчный и пузырный протоки, пузырную артерию для выполнения холецистэктомии и наружного дренирования общего желчного протока;
необходимость временной декомпрессии желчных протоков (при атипичном, недостаточно надежном ушивании двенадцатиперстной кишки, при гепатите и др.) у больных без признаков холецистита и патологии желчных протоков;
как критерий целесообразности холецистэктомии у больных с хроническим «бескаменным» холециститом.
Техника операции. Операцию приходится производить из такого же разреза, что и холецистзктомию. Это обусловлено, с одной стороны, тем, что решение выполнить холецистостомию чаще всего принимают в ходе самой операции на желчевыводящих путях; с другой стороны, даже если с самого начала думают о наложении свища, все же необходимо хорошо исследовать желче-выводящие пути, поджелудочную железу и соседние органы, а иногда опорожнить гнойные скопления вокруг пузыря. Лишь в редких случаях у тяжелобольных ограничиваются минимальным вмешательством— опорожнением и наружным дренированием желчного пузыря. Операцию производят под местной анестезией из короткого продольного разреза над пальпируемым дном желчного пузыря. Примерно 2/3 разреза должно проходить выше и 7з — ниже дна пузыря, так как после опорожнения пузырь уменьшается в размерах и его дно смещается кверху.
Типичная холецистостомия. После обнажения желчного пузыря так же, как и при холецистэктомии, отделяют припаянные к нему органы и разделяют сращение так, чтобы обнажить пузырь, его шейку и печеночно-дуоденальную связку. Брюшину, покрывающую пузырный и общий печеночный протоки, не рассекают, но протоки тщательно исследуют путем их ощупывания. Для пузырного протока такого исследования вполне достаточно, но мелкие камни в общем желчном протоке обнаружить трудно. Все же отсутствие в анамнезе указаний на желтуху позволяет у большинства больных исключить камни желчного протока. Далее обращают внимание на инфильтраты и увеличенные лимфатические узлы в области шейки пузыря и желчного протока. Как и при любой другой операции на желчевыводящих путях, обязательно прощупывают поджелудочную железу. Затем, прежде чем вскрыть желчный пузырь, тщательно отграничивают салфеткой его дно, чтобы предупредить возможное инфицирование брюшной полости содержимым желчного пузыря. Салфетки закладывают в определенном порядке: снизу они должны покрывать поперечную ободочную кишку и ее брыжейку, слева — желудок и двенадцатиперстную кишку, сверху и справа — отграничивать поддиафрагмальное пространство и правый боковой канал. Кроме того, при незаросшем сальниковом отверстии закладывают марлевый тампон, чтобы закрыть доступ в сальниковую сумку.
После того как желчный пузырь обложен со всех сторон, на дно его на достаточном расстоянии от поверхности печени накладывают серозный кисетный кетгутовый шов. Как можно более толстой иглой, соединенной посредством резиновой трубки с отсасывающим аппаратом, прокалывают желчный пузырь в центре кисетного шва и опорожняют его. Затем иглу извлекают, но кисетный шов еще не затягивают. Отверстие в месте протока расширяют скальпелем или ножницами. Наконечником отсасывающего аппарата удаляют остатки жидкости. Все камни и детрит удаляют с помощью корнцанга и ложечек. При наличии множественных мелких камней в полость пузыря вводят полоску марли и при извлечении ее удаляют все камни, которые остались незамеченными. Когда все содержимое из полости пузыря эвакуировано, его сли-знстую оболочку смазывают спиртовым раствором йода. Затем в желчный пузырь вводят указательный палец левой руки и тщательно исследуют его просвет до шейки и начала пузырного протока, чтобы убедиться в отсутствии камней, которые могут препятствовать оттоку желчи. Особое внимание надо уделить поискам и удалению камней из шейки и пузырного протока. Если камни не удается извлечь пальцем, корнцангом или ложечкой, то пальцами правой руки, введенными в брюшную полость, стараются вытолкнуть их обратно в пузырь и удалить. Если и эта манипуляция не удается, то накладывать холецистостому не следует, а нуж-но выполнить холецистэктомию.
Мочеточниковым катетером или катетером Фогарта, введенным в просвет желчного пузыря, проверяют проходимость пузырного протока.
После этого начинают создавать стому. Через отверстие в дне пузыря достаточно глубоко (на 5—7 см) вводят в его просвет катетер Петцера крупных размеров с дополнительными боковыми отверстиями или обычную резиновую трубку диаметром 1 см с 2—-3 боковыми отверстиями. Дренажную трубку укрепляют в пузыре кисетным швом, стараясь ввернуть края разреза внутрь. Затем чтим же швом обвязывают дренаж вблизи желчного пузыря, чтобы удержать катетер на желаемом уровне и облегчить вворачивание внутрь стенки желчного пузыря при наложении следующего кисетного шва.
Второй кисетный шов накладывают вокруг первого и завязывают, надавливая на дренажную трубку, чтобы ввернуть внутрь серозную оболочку желчного пузыря.
Если стенка желчного пузыря резко утолщена или частично некротизирована, то ввернуть внутрь дно желчного пузыря кисетными швами оказывается невозможным. Поэтому желчный пузырь следует перитонизировать вокруг трубки отдельными швами, укрепляя катетер одним или двумя швами. Перед закрытием брюшной полости надо убедиться в том, что дренажная трубка находится в просвете пузыря, то есть, что поступает его содержимое, так как трубка может проскользнуть между слизистой и мышечной оболочками. От стенки желчного пузыря до брюшной стенки катетер окутывают сальником и укрепляют его швами с таким расчетом, чтобы после извлечения дренажа канал был сформирован из сальника.
При зашивании париетальной брюшины желчный пузырь цир-кулярно у места вхождения дренажной трубки подшивают отдельными кетгутовыми швами к ее краям, чтобы уменьшить опасность просачивания содержимого пузыря в брюшную полость. Для прочности желчный пузырь несколькими швами прикрепляют к апоневрозу задней стенки влагалища прямой мышцы живота. Эти швы не должны проникать в просвет пузыря. Надо следить также за тем, чтобы не было перекрута шейки и натяжения желчного пузыря. Нельзя подшивать желчный пузырь к мышцам и коже, так как впоследствии может образоваться незаживающий губовидный свищ. Затем послойно зашивают разрез брюшной стенки до дренажа. Дренаж прикрепляют к коже одним или двумя шелковыми швами, чтобы он не сместился. Как правило, дренажная трубка должна оставаться в желчном пузыре 2—3 нед.
Если вокруг желчного пузыря имеется выраженный воспалительный процесс или существует опасность загрязнения брюшной полости, то в подпеченочное пространство перед закрытием брюшной полости через отдельный прокол брюшной стенки вводят дренаж из трубки, окутанной перчаточной резиной.
Холецистостомия при перфорации желчного пузыря. Если обнаруживается перфорационное отверстие в области дна желчного пузыря, то его можно использовать для наложения холецистостомы. В этом случае тщательно очищают гнойную полость в области пузыря, удаляют выпавшие в нее камни. Затем перфорационное отверстие расширяют путем иссечения его некротических краев и опорожняют желчный пузырь. Наложить кисетный шов в таких случаях бывает нелегко из-за хрупкости стенки пузыря, поэтому нужно соблюдать особую осторожность. Далее операцию осуществляют обычным способом.
Мы считаем, что при перфорации желчного пузыря во всех случаях необходимо выполнять холецистэктомию.
Идеальная холецистостомия (холецистостомия, холецистендиз). Операция заключается во вскрытии желчного пузыря, удалении камней и зашивании его с погружением в брюшную полость. Операцию предложил Wells в 1874 г. McBurney назвал ее идеальной холецистостомией, так как она восстанавливает нормальные физиологические отношения. Однако впоследствии оказалось, что после этой операции часто возникают рецидивы. С. П. Федоров (1933) писал, что для выполнения идеальной холецистостомии должно быть стечение особо благоприятных обстоятельств: воспалительные изменения стенок пузыря должны быть, ничтожны, пузырный проток не изменен и свободно проходим, а в пузыре — одиночные или в малом количестве большие камни.
крайне редко. Пожалуй, единственным заболеванием, при котором достаточно удалить камни и наложить шов на желчный пузырь является врожденная гемолитическая желтуха. При этом заболевании камни образуются в здоровом пузыре. После их удаления желчный пузырь нормально функционирует, но рецидивы все же вероятны, если не будет устранено нарушение обмена веществ. После спленэктомии новые камни не образуются.
Л. А. Шалимов (1969) предложил выполнять идеальную холе-цистостомию у больных с ожирением одновременно с выключением из пищеварения 1/3 тонкой кишки в расчете, что с потерей массы тела исчезнут условия для образования камней. После операции у тех 3 больных спустя 3—4 года рецидива камней не обнаружено, состояние хорошее.
Техника холецистостомии по С. П. Федорову состоит в следующем.
Так как пузырь обычно свободен от сращений и хорошо подвижен, его без труда выводят за пределы раны брюшной стенки, делают разрез на дне, опорожняют, удаляют камни и обследуют полость пальцем. Надо быть абсолютно уверенным в отсутствии Камней общего желчного протока и в хорошей проходимости пу-.чырного протока. Разрез пузыря ушивают двумя рядами швов топкой кишечной иглой. Первый ряд швов накладывают тонким кетгутом, второй (серо-серозный) — тончайшим капроном или шелком. Манипуляции на желчном пузыре должны быть предель-по щадящими, на стенку его ни в коем случае нельзя накладывать зажимы, при наложении швов избегать повреждения слизистой оболочки. После зашивания его полностью погружают вместе с печенью в брюшную полость и наглухо зашивают разрез брюшной стенки.
Холестероз. Впервые особую форму поражения желчного пузыря, при которой слизистая оболочка по виду напоминает землянику, описал Aschoff в 1905 г., а затем McCarty в 1910 г.
В дальнейшем было установлено, что пятнышки светло-желтого цвета, которые возвышаются над поверхностью слизистой оболочки величиной с булавочную головку, а реже и несколько больше, являются отложением эфиров холестерина и нейтральных жиров. Не всегда эти изменения видимы на глаз, в ряде случаев жировые образования определяются только при микроскопическом исследовании в эпителии и в подслизистом слое. Такой желчный пузырь описывают под разными названиями: «рыбьечешуйчатый желчный пузырь», «крапчатый желчный пузырь», «липоидоз желчного пузыря», «холестеатоз», «земляничный желчный пузырь», «холестероз желчного пузыря».
Считают, что в основе развития холестероза лежит нарушение жирового обмена. Больные с холестерозом желчного пузыря обычно страдают ожирением, а содержание холестерина в крови у них находится у верхних границ нормы. Из местных факторов играют роль дискинезии желчного пузыря с тенденцией к застою желчи, дисхолия, а также нарушение лимфообращения в стенке желчного пузыря (Н. Н. Малиновский, О. Д. Федорова, 1975). Способствующими факторами являются также воспаление и наличие камней. Таким образом, холестероз может быть самостоятельным заболеванием и сочетаться с желчнокаменной болезнью. Последняя форма заболевания встречается в 3—4 раза чаще. Холестерозом желчного пузыря болеют преимущественно женщины в возрасте 30—65 лет.
Среди оперированных по поводу хронического «бескаменного» холецистита холестероз обнаружен у 12,2 %. По данным сборных статистики, при патологоанатомических исследованиях 13 686 трупов холестероз обнаружен в 10 %.
Практически поставить диагноз холестероза до операции невозможно. Клиническое течение холестероза напоминает течение желчнокаменной болезни. Имеет некоторое значение повышенное содержание холестерина в крови, наличие кристаллов холестерина в порции В и нарушение эвакуаторной функции пузыря. Показанием к операции являются клинические данные, характерные для хронического холецистита. Холецистэктомия является пока единственным эффективным способом лечения больных с холестерозом.
Циститит, или болезнь шейки желчного пузыря. У места соединения шейки желчного пузыря и пузырного протока расположены клапан и сфинктер Люткенса, которые подвержены влиянию функциональных и морфологических изменений, происходящих в желчевыводящих путях. Эта область является регулятором наполнения и опорожнения желчного пузыря, что имеет огромное значение в патологии всех желчевыводящих путей, на говоря о самом желчном пузыре. А. Нана и соавторы (1960), Roux и соавторы (1961) установили, что нарушения в этой области имеют всегда органический характер и обычно сочетаются с наличием камней.
По данным О. Б. Милонова и соавторов (1980), В. В. Вахидова и соавторов (1987), циститит составляет от 14 до 30 % всех хронических холециститов.
По данным В. В. Вахидова и соавторов (1989), при этом заболевании выявляются аденоматоз, гипертрофия клапана Генстера, воспалительный отек и склероз слизистой оболочки. Нередко им сопутствует удлиненный и извитой пузырный проток, а также разрастание фиброзной ткани вокруг вклинившихся мелких камней.
Важное значение имеет дифференциальная диагностика дискинезии желчного пузыря и «шеечного» холецистита. Основой диагностики являются данные инфузионной капельной холеграфии, при которой определяются кардинальные признаки циститита — удлиненный пузырный проток, запаздывание опорожнения желчного пузыря (более 24 ч), а также «отключенный» желчный пузырь в сочетании с ультразвуковым исследованием, которое выявляет утолщение стенок желчного пузыря и уплотнение шейки. При данной патологии мы выполняем холецистэктомию с тщательным иссечением шейки желчного пузыря. Результаты операции обычно благоприятные.
Заворот желчного пузыря может произойти только в том случае, если он охвачен по всей окружности брюшиной и имеет подобно брыжейки (аномалия наблюдается примерно в 4—5 % наблюдений). Способствует завороту свисание пузыря, наличие в нем камней, переполнение его желчью и снижение эластичности тканей. Заворот происходит на 360°, а иногда на несколько оборотов вокруг продольной оси и вокруг шейки. В этих случаях нарушается кровообращение в пузыре и происходит полное или частичное омертвение его. Чаще заворот желчного пузыря бывает у женщин в возрасте 60—80 лет.
Клинические признаки — резкая боль в правом подреберье, напряжение мышц передней брюшной стенки, больше справа, рвота, задержка стула, газов. Иногда пальпируется напряженный желчный пузырь.
Диагноз ставят во время холецистэктомии. Сначала раскручивают желчный пузырь, чтобы не повредить втянутой в ножку завороченной части общего печеночного и общего желчного протоков, затем производят холецистэктомию. При своевременной операции исход благоприятный.
Туберкулез желчного пузыря представляет довольно редкую патологию. Впервые описан Simmonds в 1908 г. Поражение легких и других органов отмечается не всегда. Протекает под маской желчнокаменной болезни, часто с ней сочетается, иногда трактуется как «отключенный» желчный пузырь при рентгенологическом исследовании. Мы наблюдали лишь 1 (0,8 %) больного с подобной патологией, которая протекала на фоне «бескаменного» холецистита. При подозрении на туберкулез желчного пузыря или бациллоносительство показана холецистэктомия.
Сифилис желчного пузыря чаще встречается в сочетании с сифилитическим поражением печени. У большинства больных лечение специфическое.
Бруцеллез желчного пузыря — заболевание редкое, протекает как хроническое воспаление желчного пузыря.
Паразитарные заболевания желчевыводящих путей. Аскаридоз. В настоящее время описано около 93 случаев аскаридоза печени и желчевыводящих путей. Это заболевание является, как правило, осложнением аскаридоза кишечника.
Опыт операций на желчевыводящих путях показал, что аскариды попадают из кишечника через большой сосочек двенадцатиперстной кишки в общий желчный проток, а оттуда проникают в желчный пузырь и печеночные протоки. Количество их может быть различным. Чаще они локализуются в общем печеночном протоке и реже — в желчном пузыре и внутрипеченочных желчных ходах. В ряде наблюдений в ядрах желчных камней обнаруживались яйца аскарид. Проникновение паразитов чаще наблюдается при недостаточности сфинктера печеночно-поджелудочной ампулы.
Клинически аскаридоз желчевыводящих путей проявляется приступами печеночной колики с явлениями выраженного холангита и желтухой. Диагноз устанавливают на основании обнаружения яиц аскарид в желчи при дуоденальном зондировании, а также в пунктате во время операции. Оперативное лечение заключается в холецистэктомии и ревизии общего желчного протока. Некоторые авторы рекомендуют производить наружное дренирование общего желчного протока, которое способствует отхождению найденных во время операции аскарид. Во избежание рецидива заболевания проводят курс противоглистного лечения.
Лямблиоз. Наиболее частым местом обитания лямблий является двенадцатиперстная кишка, но встречаются лямблии и в ободочной кишке, где они инцистируются и в таком виде могут быть обнаружены в кале. Обнаружить же сами лямблии можно только при поносе.
Возможность проникновения лямблий в желчевыводящие пути в настоящее время окончательно установлена. В желчном пузыре наблюдается их обитание даже в тех случаях, когда их не находят в желчных протоках, что подтверждается обнаружением лямблий в удаленном желчном пузыре. Пребывание лямблий в желчевыводящих путях вызывает упорные холангиты и холециститы.
В диагностике лямблиозного холецистита ведущее место занимает дуоденальное зондирование и обнаружение лямблий в порции В. Иногда для этого требуется неоднократное зондирование. Обнаружение лямблий лишь в дуоденальном содержимом не может служить основанием для установления диагноза лямблиозного холецистита. В ряде случаев лямблиоз сочетается с желчнокаменной болезнью, часто лямблии в желчном пузыре обитают вместе с бактериями.
Установление диагноза лямблиозного холецистита не является показанием к холецистэктомии, так как лямблии остаются в желчных протоках и болезнь продолжается.
Лечение должно быть в первую очередь консервативным. Наиболее распространенным средством является акрихин, который назначают по 0,1 г 3 раза в сутки в течение 10 дней, затем делают перерыв на 5 дней и снова применяют препарат в течение 5 дней. Такой курс лечения повторяют 1—2 раза. При обнаружении лямблий через 2—3 мес курс лечения повторяют. После повторного лечения лямблии обычно исчезают. Лечение сочетают с одновременным многократным промыванием двенадцатиперстной кишки раствором магния сульфата. Применяют также осарсол по 0,25 г 4 раза в сутки.
При явлениях острого холецистита показана операция.
Под нашим наблюдением находились 3 больных с лямблиозным холециститом, оперированных в связи с выраженной картиной острого холецистита.
Актиномикоз желчевыводящих путей — редкое заболевание, связанное с проникновением грибов в желчные протоки из кишечника через большой сосочек двенадцатиперстной кишки у лиц с ослабленным иммунитетом (Д. A. Hadley и соавт., 1981). Скопление друз может симулировать злокачественную опухоль. Диагноз устанавливают после микроскопического исследования друз. Лечение заключается в холецистэктомии, наружном дренировании общего желчного протока и проведении специфической терапии.
Описторхоз, или заражение двуусткой. Печеночная двуустка и ее разновидности — сибирская и кошачья двуустки являются паразитами, которые вызывают хронический ангиохолит, гепатит, цирроз печени. Печеночная двуустка относится к плоским червям-сосальщикам. Промежуточным хозяином является речная рыба. В пищеварительный канал человека цисты паразита попадают с водой, а зародыш из кишечника проникает в печень и желчевы-водящие пути. Пребывание паразита проявляется приступами печеночной колики, нередко сопровождающимися желтухой. В большинстве случаев паразит является операционной находкой. Пребывание паразита часто сочетается с обнаружением в желчном пузыре камней и гноя, сам же паразит может находиться в расши-. ренном желчном пузыре. Длительное пребывание его в желчных протоках ведет к их хроническому склеротическому поражению, особенно в области большого сосочка двенадцатиперстной кишки, и закупорке описторхозным «детритом» (слущенным эпителием, живыми и мертвыми паразитами, продуктами их жизнедеятельности). Все это вызывает холестаз, желчную гипертензию, острый холецистит, холангит и при отсутствии эффекта от обычной консервативной терапии заставляет прибегать к оперативному лечению. Специфическое лечение описторхоза заключается в применении эметина или хлоксила, но оно не всегда эффективно в связи с возникающими осложнениями холестатического характера, особенно если описторхоз сочетается с желчнокаменной болезнью (40,5 %, по данным А. М. Третьякова и соавт., 1979, 1985), и особенно с холелитиазом (18 %, по данным тех же авторов).
Применяющиеся оперативные вмешательства в основном на-
правлены на устранение желчной гипертензии (холецистостомия, билиодигестивные анастомозы, дренирование общего желчного пузыря, холецистэктомия).
Эхинококкоз желчевыводящих путей. Чаще всего встречается эхинококкоз желчного пузыря. Наружные желчные протоки вовлекаются в процесс вторично. Встречается подобное поражение в 0,5—3,3 % случаев заболевания желчевыводящих путей.
Прорыв эхинококковой кисты в желчные протоки сопровождается приступом печеночной колики, тошнотой, рвотой, желтухой, ахоличным стулом, обострением холангита с высокой лихорадкой и ознобом. Нередко наблюдается закупорка желчных протоков, протекающая с явлениями холангита и холецистита.
Диагностика иногда облегчается указанием на наличие у больного эхинококкоза печени или операции по этому поводу, обнаружению в испражнениях обрывков хитиновой оболочки и дочерних пузырей. В большинстве же случаев устанавливают диагноз холецистита или холедохолитиаза.
Наличие септического холангита, гепатита, часто множественного поражения печени делают прогноз очень серьезным. Летальность при этой патологии высокая.
Лечение оперативное, направлено на восстановление свободного оттока желчи, ликвидацию паразита и хорошее дренирование гнойной полости. Для этого необходимо вскрыть общий желчный проток, удалить дочерние кисты, обрывки тканей эхинококка и затем дренировать его. Нередко производят и холецистэктомию, а при поражении желчного пузыря удаление его становится неотъемлемой частью, оперативного вмешательства. Если позволяет общее состояние больного, одномоментно производят и дренирование кисты печени или ее удаляют. Некоторые хирурги ограничиваются дренированием кисты и через нее налаживают отток желчи, считая, что этого достаточно для полного выздоровления.
