
- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
- •Теории кинетики Теория бинарных (активных) соударений
- •4. Число активных столкновений
- •6. Константа скорости
- •2. Поясняющая схема.
- •1. Достоинства
- •2. Схема Линдемана (1922г.)
- •3. Отсутствие принципиальных различий в механизме би- и мономолекулярных реакций.
- •Теория переходного состояния (активированного комплекса)
- •1. Основная идея теории
- •2. Поверхность потенциальной энергии
- •3. Анализ диаграммы
- •4. Координата реакции
- •Основные идеи вывода
- •2. Квантово-статистическая форма уравнения так (тпс)
- •3. Константа скорости мономолекулярного распада активированного комплекса
- •1. Уравнения так в термодинамической форме
- •2. Энтальпия активации, ее связь с энергией активации
Основные идеи вывода
а) Активированный
комплекс находится в равновесии с
молекулами исходных веществ,
![]()
б) Скорость реакции – скорость распада активир. комплекса (скорость его прохождения через потенциальный барьер)
1)![]() ,
где
,
где
![]() время
жизни переходного состояния
время
жизни переходного состояния
2) Время,
необходимое для прохождения потенциального
барьера, т.е. плоской вершины перевала
(время жизни активированного комплекса)
определяется как
![]() :
:
![]() протяженность
потенциального барьера,
протяженность
потенциального барьера,
![]() средняя скорость
одномерного движения ком-
средняя скорость
одномерного движения ком-
плекса через плоскую вершину потенциального барьера
в) Активированный комплекс рассматривается как обычная молекула, в которой отсутствует 1 колебательная степень свободы. Вместо нее появляется дополнительная внутренняя поступательная степень свободы вдоль координаты реакции
2. Квантово-статистическая форма уравнения так (тпс)
![]()
![]() ,
,
![]() трансмиссионный
коэффициент
трансмиссионный
коэффициент
![]() ,
,
![]() - для неадиабатных реакций
- для неадиабатных реакций
3. Константа скорости мономолекулярного распада активированного комплекса
Константа скорости
мономолекулярного распада активированного
комплекса с образованием продуктов
реакции
![]() не содержит никаких признаков
индивидуальности химического процесса
и
не
зависит от типа реакции и от природы
реагирующих веществ, тогда как константа
скорости реакции
не содержит никаких признаков
индивидуальности химического процесса
и
не
зависит от типа реакции и от природы
реагирующих веществ, тогда как константа
скорости реакции
![]() зависит от типа реакции и природы
реагирующих веществ.
зависит от типа реакции и природы
реагирующих веществ.
Как отмечалось скорость реакции определяется скоростью мономолекулярного распада АК, т.е.
![]() ,
,
Между АК и исходными
реагентами устанавливается равновесие
![]()
Выражая из этого
уравнения концентрацию
![]() АК
имеем:
АК
имеем:
![]() Но
Но
![]()
Откуда![]() .
.
![]() же зависит
от природы реагентов реакции
же зависит
от природы реагентов реакции
А значит и также зависит от природы реагентов.
С другой стороны:
![]() ,
откуда
,
откуда
![]()
![]()
Термодинамический аспект теории переходного состояния
1. Уравнения так в термодинамической форме
а)
![]()
![]() ,
,
![]()
![]() ,
где
,
где
![]()
![]()

но
![]()
![]()
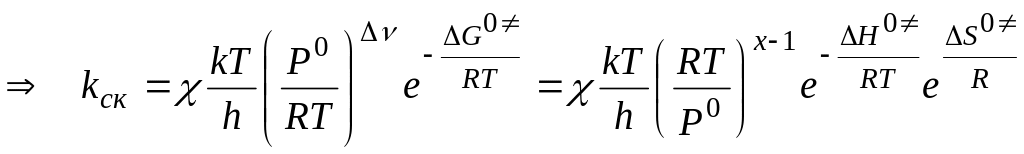 ;
;
где
![]() ,
,![]() ,
,![]() -
в стандартном состоянии
-
в стандартном состоянии
![]() ,
,
б)
Выражения
![]() для реакций различных порядков
для реакций различных порядков
мономолекулярные реакции,
 :
:

бимолекулярные реакции,
 :
:
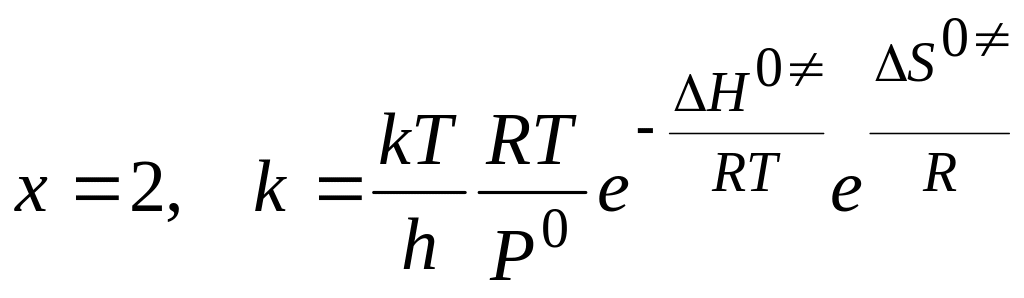
в) Размерность константы скорости
![]()
![]()
![]()
2. Энтальпия активации, ее связь с энергией активации
а)
![]()

![]()
![]() ,
но
,
но
![]()
б)
По уравнению Аррениуса
![]()
Сопоставление дает
![]()
![]()
Окончательно
![]()
3. Введение в кинетическое уравнение теории.

а)
мономолекулярная реакция
![]()
б)
бимолекулярная реакция
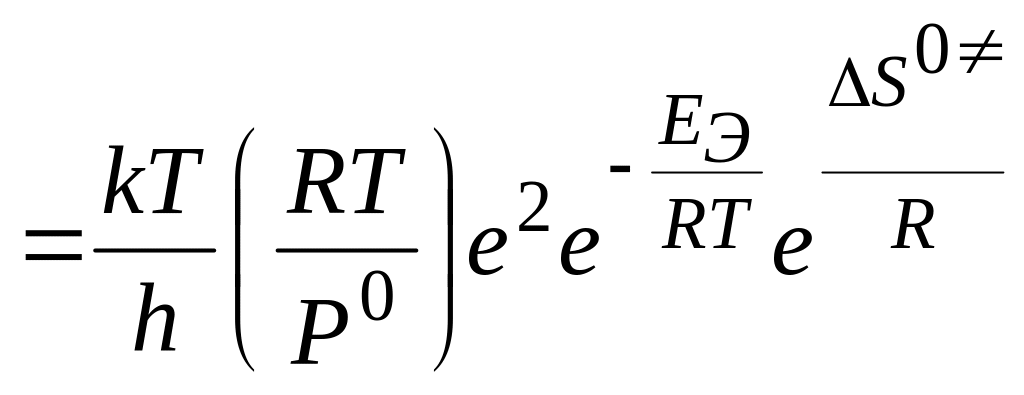
4. Истолкование предэкспоненциального множителя в рамках ТАК.
а)
Уравнение Аррениуса:
![]()
ТБС:
![]() ,
,
![]()
![]()
ТАК:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
в)
![]() -
энтропийный фактор:
-
энтропийный фактор:
![]()
![]() -нормальные р-ции
-нормальные р-ции
![]() ,
,
![]()
Достоинства и недостатки ТАК (ТПС).
Цель любой теории кинетики – расчет скорости (константы скорости) реакции на основании сведений о простейших свойствах (молекулярных константах) реагентов без использования экспериментально определяемых кинетических характеристик р-ций.
1. Достоинства.
а) Через построение поверхности потенциальной энергии показаны пути теоретического расчета энергии активации и константы скорости химической реакции
б) Объяснение смысла - как вероятностного фактора
в) Становится ясным понятие пути (координаты) реакции.
2. Недостатки.
а) Расчет практически возможен только для простейших реакций.
б) Довольно относительная справедливость ряда допущений при выводе.
