
- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
- •Теории кинетики Теория бинарных (активных) соударений
- •4. Число активных столкновений
- •6. Константа скорости
- •2. Поясняющая схема.
- •1. Достоинства
- •2. Схема Линдемана (1922г.)
- •3. Отсутствие принципиальных различий в механизме би- и мономолекулярных реакций.
- •Теория переходного состояния (активированного комплекса)
- •1. Основная идея теории
- •2. Поверхность потенциальной энергии
- •3. Анализ диаграммы
- •4. Координата реакции
- •Основные идеи вывода
- •2. Квантово-статистическая форма уравнения так (тпс)
- •3. Константа скорости мономолекулярного распада активированного комплекса
- •1. Уравнения так в термодинамической форме
- •2. Энтальпия активации, ее связь с энергией активации
2. Поверхность потенциальной энергии
а) Все 3 атома обоих реагентов располагаются по одной прямой
б)
![]() - пространственная (объемная) диаграмма
- пространственная (объемная) диаграмма

 Потенциальная
энергия взаимодействующей системы в
каждый момент течения реакции, очевидно,
является функцией межатомных расстояний
реагирующих частиц. Поэтому 1-ым шагом
теории явилось построение зависимости
– в плоскости откладывают оси
Потенциальная
энергия взаимодействующей системы в
каждый момент течения реакции, очевидно,
является функцией межатомных расстояний
реагирующих частиц. Поэтому 1-ым шагом
теории явилось построение зависимости
– в плоскости откладывают оси
![]() ,
перпендикулярно -
,
перпендикулярно -
![]() .
Получаем пространствен-ную (объемную)
диаграмму.
.
Получаем пространствен-ную (объемную)
диаграмму.
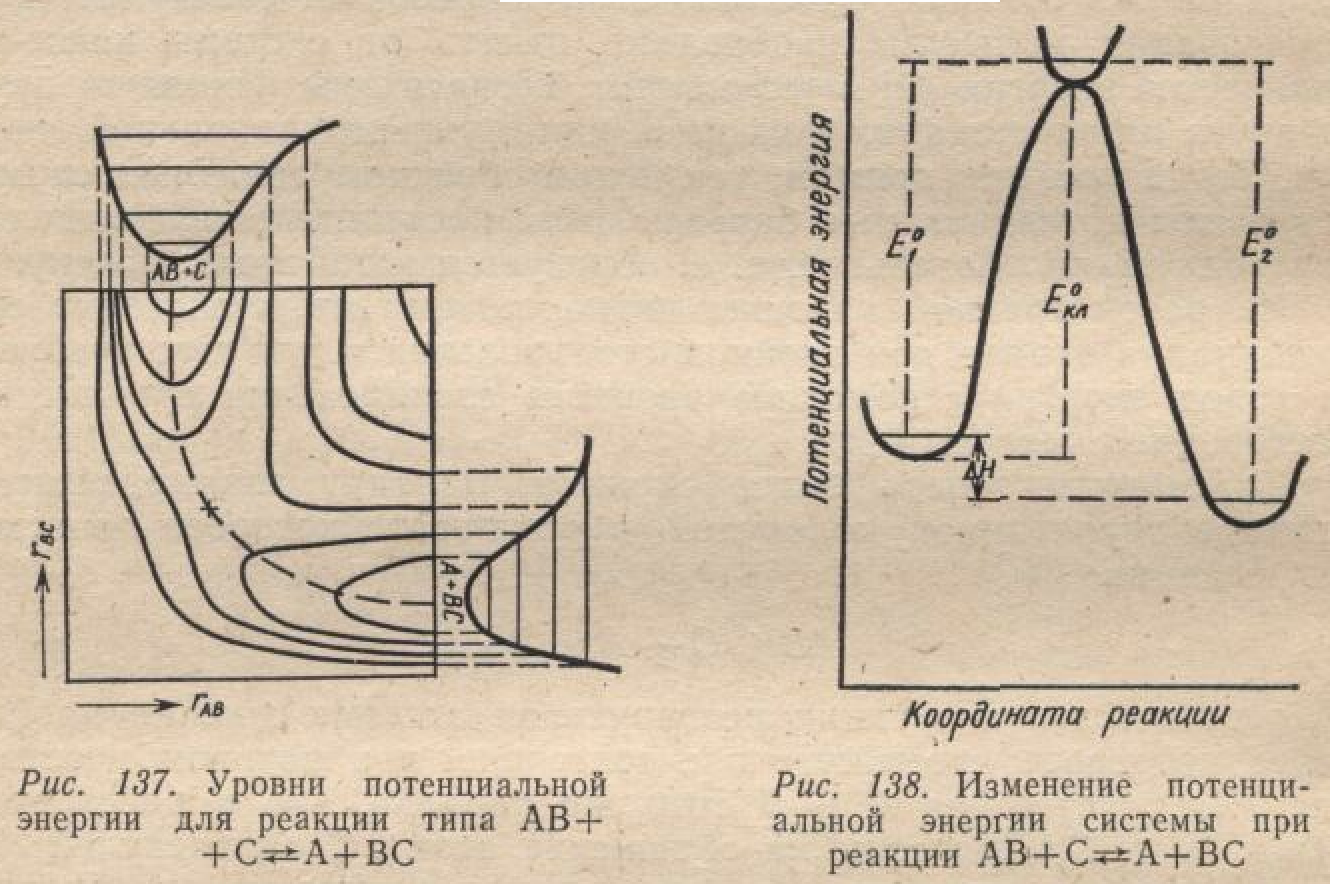
в) Каждому состоянию системы, т.е. тому или иному взаимному расположению атомов реагирующей системы, отвечает вполне определенное значение , т.е. точка на поверхности потенциальной энергии. Т.о. элементарный акт химического превращения может быть представлен как перемещение точки по поверхности потенциальной энергии.
г) Изображение
![]() поверхности
и хода реакции на плоскости.
поверхности
и хода реакции на плоскости.
Из-за очевидных трудностей изображения такой объемной диаграммы, обычно, используют плоскостную диаграмму.
1) сечение поверхности равноудаленными горизонтальными плоскостями,
2) проецирование контуров сечений на плоскость подобно тому, как это делается в топографии при нанесении рельефа местности на карту – система изоэнергетических линий (густота линий свидетельствует о крутизне склона)
3) изображение диаграммы на плоскости
3. Анализ диаграммы
а) Две долины исходных веществ и продуктов реакции, разделенных перевалом, крутой склон и плоское плато
б)
Положения, отвечающие состояниям:
![]() ,
,
![]() ,
,
характеристика разных полей диаграммы
4. Координата реакции
а) Представление химического взаимодействия и как перемещение системы из ущелья исходных реагентов в ущелье продуктов реакции по поверхности потенциальной энергии
б) Энергетически наиболее выгодный путь – по дну 1-го ущелья через перевал и по дну второго ущелья - координата реакции
Определение. Координата реакции – совокупность наиболее вероятных межатомных расстояний в реагирующей системе при ее переходе из исходного в конечное состоя-ние, отвечающая минимальным энергетическим затратам.
в)
![]() - активированный
комплекс –
точка, отвечающая наибольшей энергии
при движении системы вдоль координаты
реакции. Неустойчивость комплекса при
движении вдоль координаты реакции и
устойчивость в отношении любого другого
направления.
- активированный
комплекс –
точка, отвечающая наибольшей энергии
при движении системы вдоль координаты
реакции. Неустойчивость комплекса при
движении вдоль координаты реакции и
устойчивость в отношении любого другого
направления.
5. Профиль пути реакции.
а) Сечение поверхности потенциальной энергии по пути реакции
б) Диаграмма профиля пути реакции и ее анализ.
построение профиля пути реакции,
истинная энергия активации – минимальная энергия, которой должна обладать исходная система сверх своей нулевой энергии, чтобы в ней произошло химическое превращение
![]()
6. Задачи, решаемые построением зависимости
а) Принципиальная возможность расчета энергии активации
б)
Определение характеристик активированного
комплекса![]()
Вывод основного уравнения теории
