
- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
- •Теории кинетики Теория бинарных (активных) соударений
- •4. Число активных столкновений
- •6. Константа скорости
- •2. Поясняющая схема.
- •1. Достоинства
- •2. Схема Линдемана (1922г.)
- •3. Отсутствие принципиальных различий в механизме би- и мономолекулярных реакций.
- •Теория переходного состояния (активированного комплекса)
- •1. Основная идея теории
- •2. Поверхность потенциальной энергии
- •3. Анализ диаграммы
- •4. Координата реакции
- •Основные идеи вывода
- •2. Квантово-статистическая форма уравнения так (тпс)
- •3. Константа скорости мономолекулярного распада активированного комплекса
- •1. Уравнения так в термодинамической форме
- •2. Энтальпия активации, ее связь с энергией активации
4. Число активных столкновений
а) Пусть активными
являются молекулы с энергией >
![]() ,
тогда их число определяется по е-теореме
Больцмана:
,
тогда их число определяется по е-теореме
Больцмана:
![]()
б) Если суммарная
энергия сталкивающихся молекул больше
энергии активации (![]() ),
то происходит химическое взаимодействие.
),
то происходит химическое взаимодействие.
Такие соударения называются активными, а число активных соударений соответствует скорости химической реакции
![]()
![]()
![]()
![]()
5.
Уравнение скорости
реакции в
общепринятых единицах,
![]() .
.
а)
Связь концентраций
и
:
![]()
б)
![]()
![]()
6. Константа скорости
а)
![]()
![]()
![]()
![]() ,
,
б)
![]()
![]() ,
,
![]()
![]()
в)
фактор соударений = предэкспоненциальный
множитель
![]()
7. Случай разных молекул:
а)
![]() ;
;
![]() ;
;
![]() ,
,
б)
![]()
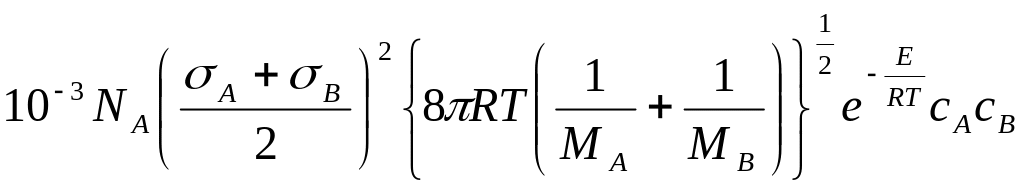

![]()
Стерический фактор.
1. Сопоставление теории и эксперимента
1)
![]()
![]()
![]() ,
,
2)
![]() ,
,
![]()
3)
для большинства реакций
![]()
2.
Стерический фактор,
![]() .
.
Христиансен, 1924г:
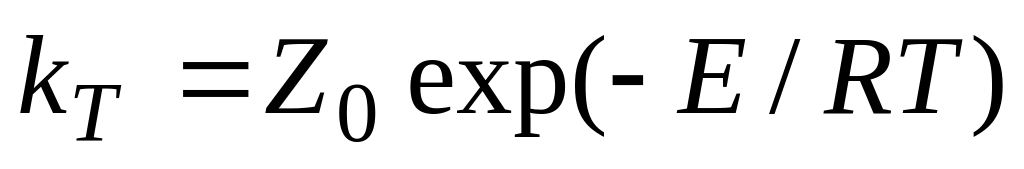 ,
,
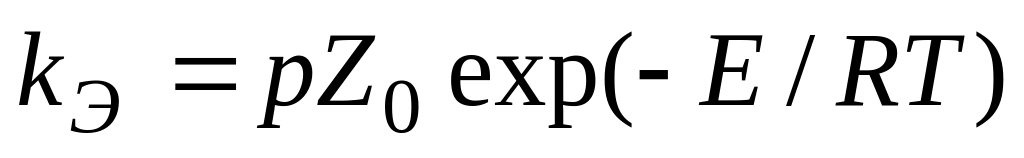
обычно
 ,
быстрые реакции
,
быстрые реакции
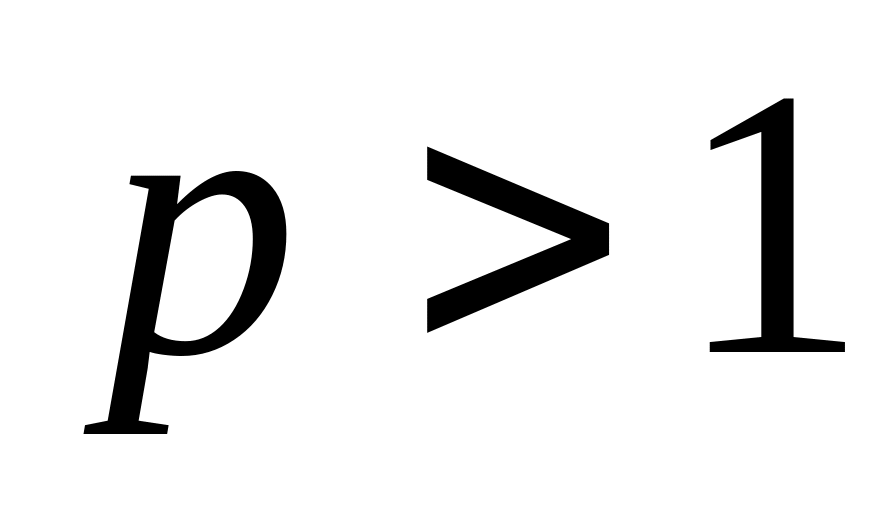
смысл стерического фактора - величина, определяемая пространственной взаимной ориентацией сталкивающихся молекул (первое объяснение).
Энергия активации.
1.Энергия
активации
– это
минимальное значение суммарной
кинетической энергии (в расчете на
![]() ),
которой должны обладать сталкивающиеся
молекулы, чтобы соударение между ними
привело к химическому взаимодействию.
Реакцию вызывает не полная кинетическая
энергия взаимодействующих частиц, но
составляющая этой энергии на линию,
соединяющую центры сталкивающихся
молекул.
),
которой должны обладать сталкивающиеся
молекулы, чтобы соударение между ними
привело к химическому взаимодействию.
Реакцию вызывает не полная кинетическая
энергия взаимодействующих частиц, но
составляющая этой энергии на линию,
соединяющую центры сталкивающихся
молекул.
2. Поясняющая схема.
Сопоставление уравнения ТБС и уравнения Аррениуса
1.
Предэкспоненциальный множитель,
![]() .
.
2. Соотношение между энергиями активации по ТБС и Аррениусу.
а)
![]()
![]()
б)
![]() ,
,
![]()
![]()
в)
![]()
![]() .
.
Достоинства и недостатки ТБС
1. Достоинства
а) Вскрыла природу активных молекул и механизм активации
б) Дала формулу, обосновывающую уравнение Аррениуса
в) Дала подход к расчету предэкспоненциального множителя.
2. Основные недостатки теории.
а) Необходимость введения стерического множителя, физи- ческий смысл которого не очень ясен
б) Не дает путей
расчета энергии активации (использует
![]() ).
).
Мономолекулярные реакции в ТБС. Схема Линдемана
1. Трудности при теоретической интерпретации.
а) Объяснение путей активации
б) Истолкование причин изменения порядка мономолеку-лярной реакции с 1го на 2ой при низких давлениях
(термическое
разложение:
![]() )
)
1)
![]() 2)
2)
![]() .
.
2. Схема Линдемана (1922г.)
а) Основные положения, выдвинутые Линдеманом
1) активация – бимолекулярная
2) разделение во времени актов бимолекулярной активации
и мономолекулярного превращения. Это время необхо-димо для сосредоточения энергии на разрываемой связи
3) возможность дезактивации активной частицы
б) Стадийная схема химических превращений.
1.
![]() Активация:
Активация:
![]()
2.
![]() Дезактивация:
Дезактивация:
![]()
3.
![]() Медленная:
Медленная:
![]()
2 первых процесса поддерживают равновесную концентрацию
активных молекул, а 3ий - определяет скорость реакции.
в) Применение
метода (квази)стационарных концентраций
![]()
1)
![]()

2) Скорость реакции:

г) Анализ полученного соотношения.
давления (концентрации) средние и высокие
Дезактивация
высокая,
![]() .
Тогда
.
Тогда
![]()
![]()
![]()
давления (концентрации) низкие
Большинство
активных молекул успевает прореагировать,
![]() ,
,
![]()
![]()
![]()
3) промежуточные
концентрации - переход от
![]() к
к
![]() .
.
