
- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
- •Теории кинетики Теория бинарных (активных) соударений
- •4. Число активных столкновений
- •6. Константа скорости
- •2. Поясняющая схема.
- •1. Достоинства
- •2. Схема Линдемана (1922г.)
- •3. Отсутствие принципиальных различий в механизме би- и мономолекулярных реакций.
- •Теория переходного состояния (активированного комплекса)
- •1. Основная идея теории
- •2. Поверхность потенциальной энергии
- •3. Анализ диаграммы
- •4. Координата реакции
- •Основные идеи вывода
- •2. Квантово-статистическая форма уравнения так (тпс)
- •3. Константа скорости мономолекулярного распада активированного комплекса
- •1. Уравнения так в термодинамической форме
- •2. Энтальпия активации, ее связь с энергией активации
Зависимость скорости химической реакции от температуры
Зависимость
![]() определяется влиянием температуры на
константу скорости реакции
определяется влиянием температуры на
константу скорости реакции
1. Скорость реакции,

 .
.
2.
Анализ уравнения
![]() ,
,
![]()
3.
Зависимость
![]()
![]()
Правило Вант-Гоффа
1.
Приближенное правило – температурный
коэфф Вант-Гоффа (![]() )
)
![]()
2.
Вывод уравнения
![]() .
.
а)
![]()
б)
![]()
![]() ;
;

3.
Приближенный характер зависимости
![]() .
.
Уравнение Аррениуса
1. Формальное обоснование
а)
![]()
![]() ;
;
б)
![]() ,
,
![]()
в)
Аррениус показал, что
![]() ,
Откуда
,
Откуда
![]() .
.
Физический смысл энергии активации
1. Представление об энергетическом барьере химической реакции.
а)
энергии исходных
![]() и конечных
и конечных
![]() веществ,
веществ,
![]() .
.
б )
Энергетическая
диаграмма химической реакции
)
Энергетическая
диаграмма химической реакции
Преодаление
энергетич. барьера требует затраты
энергии
![]() .
.
Обратный
переход -
![]() .
.
в)
![]()
![]()
2. Определение
а) Энергия активации – некоторое избыточное количество энергии, которой должны обладать молекулы исходного вещества в расчете на 1 моль (по сравнению со средней энергией), чтобы при столкновении эти молекулы вступили в хим. взаимодействие
б)
![]()
в) Энергия активации - функция природы реагирующих частиц.
1)
валентнонасыщенные молекулы
![]() сотни
сотни
![]()
2)
рекомбинация атомов и радикалов -
![]()
3)
валентнонасыщенные + ненасыщенные
![]()
Экспериментальные методы расчета энергии активации
1.
![]()
2.
Анализ уравнения Аррениуса,
,
![]()
3. Аналитический метод
![]()
![]()
4.
Графический метод,
![]()
![]() ,
,
![]() ,
т.к.
,
т.к.
![]()
5. Экспоненциальная форма уравнения Аррениуса
![]()
6. Эффективная энергия активации
а) четкий смысл для элементарных процессов,
б)
![]() ,
,
![]() и
и
![]()
Тримолекулярные реакции
Падение скорости тримолекулярных реакций с ростом т-ры
 ,
,

![]()
Схема Траутца:
![]() ,
,
![]()
 >
>
 .
.
Теории кинетики Теория бинарных (активных) соударений
Экспериментальные факты
1. Каждое ли столновение молекул приводит к хим. взаимодействию?
![]()
реакции должны были бы протекать со скоростью взрыва
 ,
,
но скорость
реакции
![]() .
.
3. Резкое увеличение скорости реакции в присутствии катализатора
Основные положения теории бинарных соударений (ТБС)
1. К химическому взаимодействию приводят столкновения только
активных молекул (эффективные столкновения).
2. Активные молекулы не есть некая особая модификация исходных молекул. Активные молекулы возникают в результате бинарных столкновений неактивных молекул за счет статистического перераспределения энергии между сталкивающимися молекулами. Активные молекулы представляют собой, т.о., частицы, обладающие избыточным запасом энергии, достаточным для преодоления энергетического барьера реакции.
3. Акт превращения исходных веществ в продукты совершается лишь в момент столкновения активных молекул и протекает мгновенно.
4. Чтобы лучше
понять природу возникновения активных
молекул рассм. распределение молекул
по скоростям (Максвелл)
![]() .
.
На оси
ординат – доля молекул, скорости которых
лежат в пределах от
![]()
![]() до
до
![]() ,
на оси абсцисс – скорость молекул
.
,
на оси абсцисс – скорость молекул
.
 Активными
являются все молекулы, скорость которых
больше некоторого предела:
Активными
являются все молекулы, скорость которых
больше некоторого предела:
![]() .
.
С повышением температуры доля активных молекул (заштрихованная область) резко возрастает.
Вывод кинетического уравнения ТБС
Чтобы молекулы могли прореагировать, они должны столкнуться друг с другом. Как мы отмечали выше, не каждое столкновение приводит к реакции, но только столкновения активных молекул, т.е. молекул обладающих достаточным запасом энергии. В качестве первого шага получим сначала выражение для числа столкновений всех молекул между собой в единицу времени, а затем число активных соударений, что и будет отвечать скорости химической реакции
1. Прежде всего отметим, что для энергетики взаимодействия важны не абсолютные величины скорости (энергии) сталкивающихся молекул, но их относительные скорости
![]()
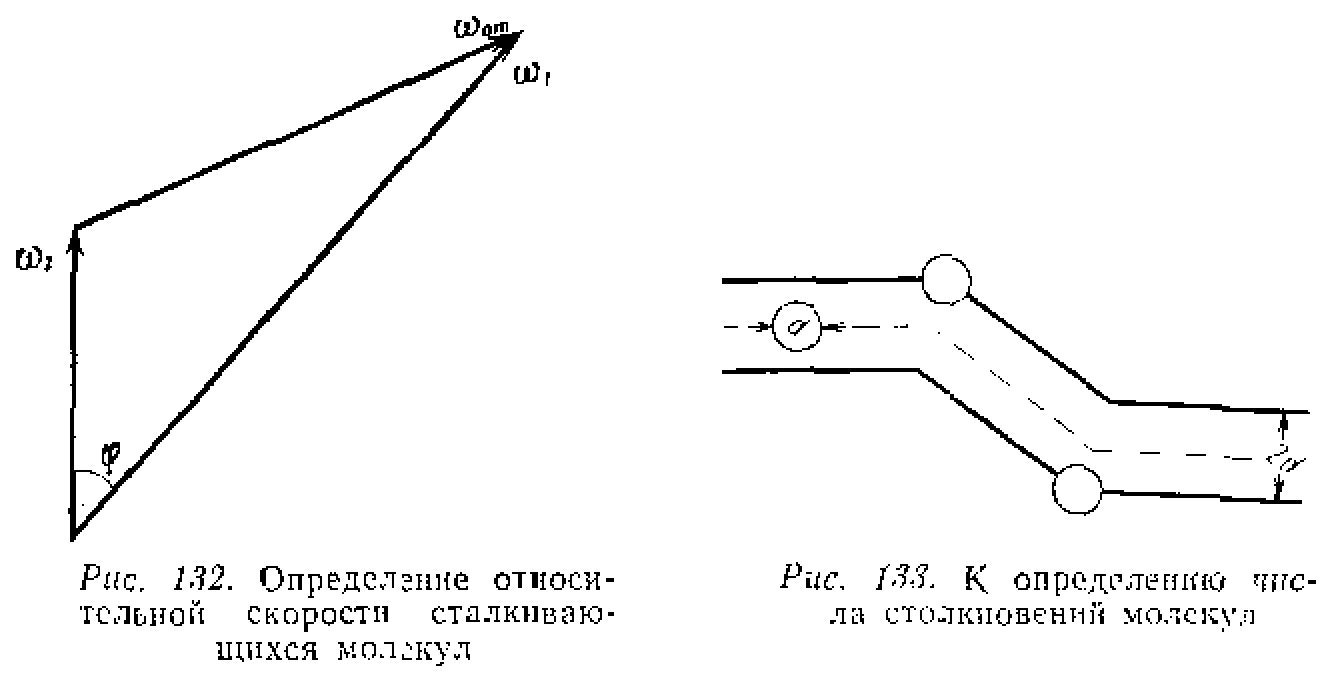
![]()
![]() ,
,
![]()
![]()
![]()
Значение
![]() с равной вероятностью может быть как
положительным, так и отрицательным,
т.е. угол
с равной вероятностью может быть как
положительным, так и отрицательным,
т.е. угол
![]() и
и
![]() .
Поэтому
.
Поэтому
![]() и
или
и
или
3. Подсчет числа столкновений (случай одинаковых молекул)
а) Соударение происходит, если центры движущихся молекул
оказываются
друг от друга на расстоянии
![]() их диаметру.
их диаметру.
б) Исследуемая молекула движется, а остальные неподвижны.
Средняя
арифмет. скорость
движения,
![]()
в)
Общее
число столкновений
в единицу времени молекулы
А со всеми
другими молекулами будет равно числу
молекул, находящихся в выпрямленном
цилиндре с поперечным сечением
![]() и длиной, равной относительной скорости
движущейся молекулы.
и длиной, равной относительной скорости
движущейся молекулы.
Если концентрация
молекул
![]() ,
то
,
то
![]() ,
,
![]()
г)
Поскольку каждую из
![]() молекул мы учитываем дважды общее число
столкновений всех молекул в
молекул мы учитываем дважды общее число
столкновений всех молекул в
![]() за
за
![]() равно
равно
![]() ,
,
![]() ,
,
где
![]() -
газокинетический (эффективный) диаметр
соударения
-
газокинетический (эффективный) диаметр
соударения
