
- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
- •Теории кинетики Теория бинарных (активных) соударений
- •4. Число активных столкновений
- •6. Константа скорости
- •2. Поясняющая схема.
- •1. Достоинства
- •2. Схема Линдемана (1922г.)
- •3. Отсутствие принципиальных различий в механизме би- и мономолекулярных реакций.
- •Теория переходного состояния (активированного комплекса)
- •1. Основная идея теории
- •2. Поверхность потенциальной энергии
- •3. Анализ диаграммы
- •4. Координата реакции
- •Основные идеи вывода
- •2. Квантово-статистическая форма уравнения так (тпс)
- •3. Константа скорости мономолекулярного распада активированного комплекса
- •1. Уравнения так в термодинамической форме
- •2. Энтальпия активации, ее связь с энергией активации
2. Интегральные методы определения порядка реакции
а) метод подбора уравнений
аналитический – суть метода состоит в подстановке
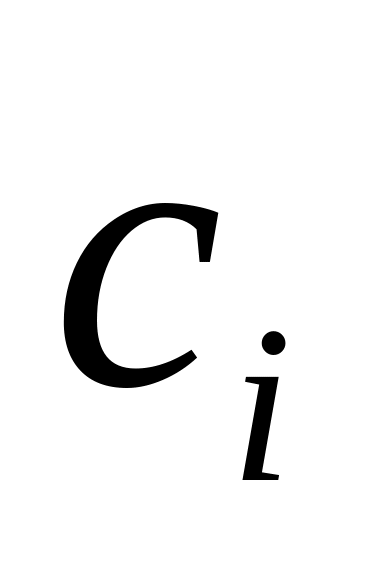 реа-гирующего в-ва для различных моментов
времени от начала р-ции в кинетические
ур-ния различных порядков (1го,
2го
, 3го
и т.д ). Искомым является тот порядок,
для которого наблюдается постоянство
(неизменность) значения константы
скорости реакции при различных
концентрациях
реа-гирующего в-ва для различных моментов
времени от начала р-ции в кинетические
ур-ния различных порядков (1го,
2го
, 3го
и т.д ). Искомым является тот порядок,
для которого наблюдается постоянство
(неизменность) значения константы
скорости реакции при различных
концентрациях
графический – состоит в нахождении такой функции концентрации от продолжительности реакции, которая имела бы линейный характер:
![]() ,
,
![]() ,
,
![]() ,
.
,
.
б)
метод Оствальда-Нойеса – использует
зависимость
![]() :
:
![]()
3. Дифференциальные методы Вант-Гоффа
а)
Аналитический метод – по двум значениям
![]() при двух
при двух
![]()
1) по одной кинетической кривой -
![]()

2) по 2ум
начальным концентрациям -
![]()

по значениям средних скоростей

б) Графический вариант метода Вант-Гоффа
![]() ,
,
![]() .
.
Сложные реакции
Введение.
Сложные реакции – многостадийные химические процессы, включающие ряд послеловательно и (или) параллельно протекающих химических превращений.
Принцип независимости (сосуществования) отдельных стадий
а) В основе кинетического изучения сложных реакций лежит принцип независимости протекания элементарных реакций – постулат химической кинетики.
Согласно ему, если в системе одновременно протекают несколько элементарных химических реакций, то каждая из них идет независимо от остальных, а скорость ее прямо пропорциональна концентрациям реагирующих веществ, т.е. подчиняется основному постулату хим. кинетики.
б) Конечное изменение концентрации данного вещества является результатом всех независимо протекающих элементарных реакций, в которых оно принимает участие, неважно как: как исходное вещество или как продукт реакции.
в) Данный принцип является всеобъемлющим. Сопоставление опытных данных с теоретическими уравнениями для обратимых, последовательных и других реакций показывает справедливость этого принципа.
Типы сложных реакций.
а) обратимые (двусторонние), б) параллельные, в) последователь-
ные (консекутивные), г) сопряженные
Обратимые реакции 1го порядка.
1.
![]() ,
,
![]()
Скорость реакции.
а)
![]() ,
,
б)
![]() ,
,
в)
![]() .
.
Вывод уравнения
 .
.2ое уравнение – константа равновесия
 .
.Смысл
 ,
,

Определение
 и
и
 из системы 2ух
уравнений.
из системы 2ух
уравнений.Кинетические кривые
 и
и
 .
.
Г рафическое
представление для случая
рафическое
представление для случая
![]() ,
т.е. когда концент-рация продукта при
равновесии < конц-ции исходного вещества
,
т.е. когда концент-рация продукта при
равновесии < конц-ции исходного вещества
Параллельные реакции
Понятие – реакции, в ходе которых одни и те же исходные вещества одновременно реагируют в двух или более направлениях с образованием различных продуктов.
2.
![]() Пример:
Пример:
![]()
![]()
3. Скорость реакции
а)
![]()
б)
![]()
в)
![]() ,
где
,
где
![]()
![]()
4.
Вывод уравнения
![]()
5.
2ое
уравнение:
![]() или
или
![]() постоянство состава
постоянство состава
продуктов в любой момент времени течения реакции.
Скорость процесса в целом определяется наиболее быстрой из
 реакций. Пусть
реакций. Пусть


Кинетические кривые
 для всех реагентов,
для всех реагентов,
 .
.
Графическая интерпретация.
Последовательные реакции
Определение – реакции, протекающие через ряд последовательных стадий с образованием более или менее устойчивых промежуточных веществ (гидролиз этилового эфира янтарной кислоты)
Общая схема:

![]()
Скорость реакции по каждому реагенту
а)
![]()
б)
![]()
в)
![]()
Решение уравнений
а)
![]() ,
,
![]() ,
,
![]()
б)
![]()
![]()
в)
![]()
Г
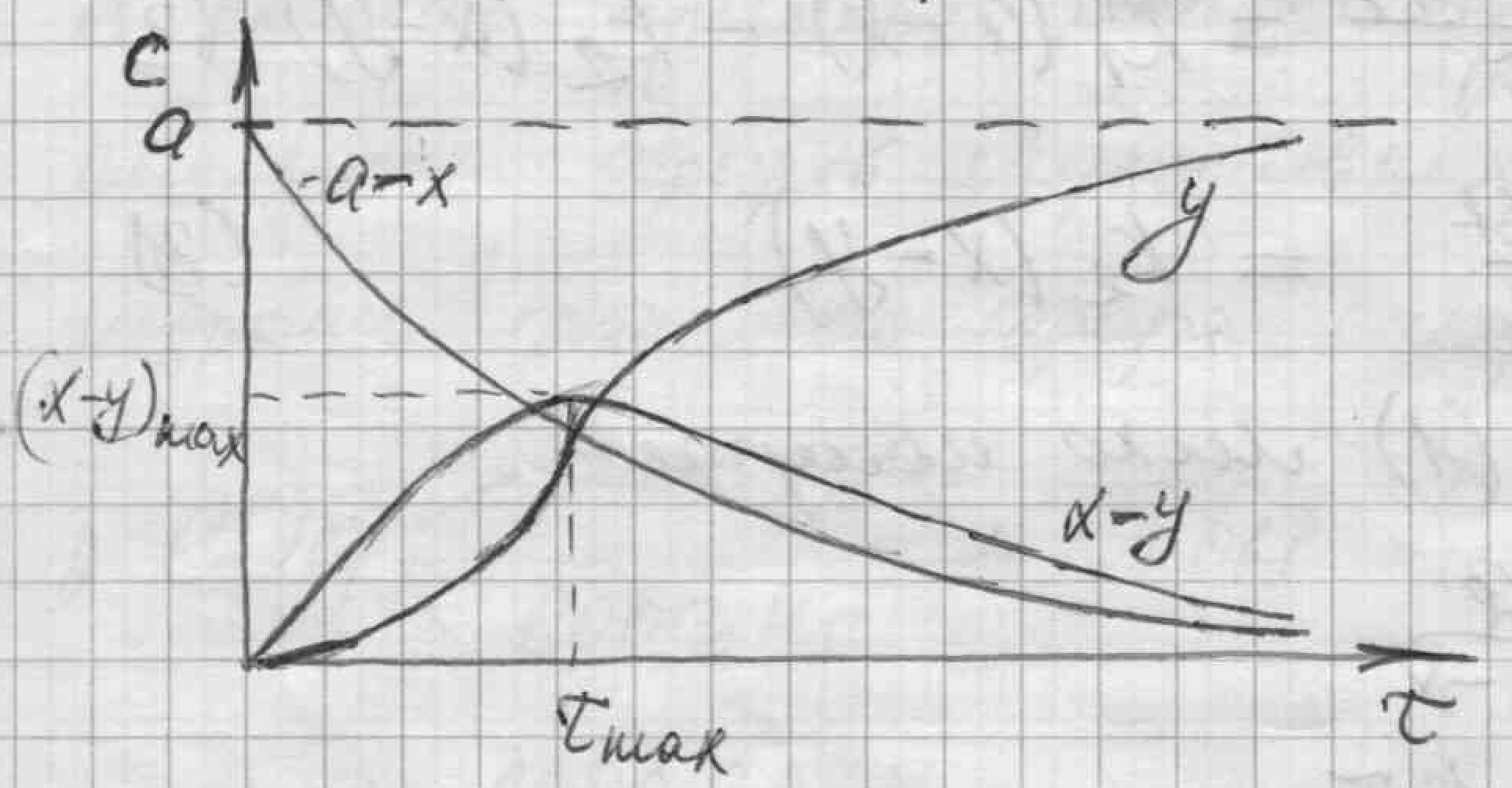 рафическая
интерпретация кривых
для реагентов
рафическая
интерпретация кривых
для реагентов
 .
.
Вещество А
Зависимость для вещества А:
- падает по экспоненте
Вещество В
Время достижения максимальной концентрации вещества
 :
:
а)
![]() ,
,
б)
![]()
![]() , где
, где
![]()
в)
![]() ,
если
,
если
![]() ,
то с
,
то с
![]()
т.е., чем больше при данном тем скорее достигается максимальная концентрация промежуточного вещества B
Максимальный выход вещества :

но
![]() ,
,
Тогда
![]()
Далее
![]()
![]()
![]()
Окончательно
![]()
![]()
Анализ уравнения п.8.
а)
![]() ,
,
![]()
![]()
промежуточное вещество В устойчиво
б)
![]()
промежуточное вещество В неустойчиво
Вещество С
10.
S-образная
форма кривой продукта реакции
![]()
![]() ,
т.е.
,
т.е.
![]()
индукционный период
 - время разгона реакции
- время разгона реакции
Принцип лимитирующей стадии химического процесса
