
- •Лекция № 1 задачи и методы аналитической химии
- •Современные проблемы аналитической химии:
- •Основная литература:
- •Дополнительная литература
- •Классификация методов анализа
- •Лекция №2 химическое равновесие в реальных системах
- •Лекция № 3 комплексные соединения в аналитической химии
- •Устойчивость вкс
- •Лекция № 4 органические реагенты в химическом анализе
- •PH образования гидроксидов
- •Лекция №5 кислотно-основные реакции
- •Лекция №6 буферные растворы
- •Лекция №7 метрологические основы аналитической химии
- •Лекция № 8
- •Основные понятия химической метрологии
- •Лекция 9
- •Экстракция
- •Лекция № 10 гравиметрический метод анализа
- •Типы соосаждения
- •Способы уменьшения соосаждения:
- •Лекция 11 пробоотбор и пробоподготовка
- •Лекция № 12 титриметрические методы анализа
- •Первичные и вторичные стандарты
- •Лекция 13 обсуждение кривой титрования
- •Кривая титрования многоосновных кислот
- •Титрование многокислотных оснований
- •Титрование смесей кислот
- •Лекция № 14
- •Лекция №15 тема: фиксирование тэ в методе кислотно-основного титрования
- •Лекция №16 индикаторные погрешности титрования
- •Лекция № 17 осадительное титрование
- •Лекция № 18
- •Классификация металлиндикаторов
- •Интервал перехода окраски индикатора
- •6. Пример определения Ca и Mg при совместном присутствии
Лекция №7 метрологические основы аналитической химии
План:
Основные этапы анализа. Метод и методика.
Аналитический сигнал: а) полезный аналитический сигнал; б) аналитический сигнал фона.
Основные понятия химической метрологии.
Классификация погрешностей анализа: а) абсолютная и относительная погрешность; б) систематические, случайные погрешности и промахи.
Способы оценки правильности анализа: метод «введено-найдено», использование стандартных образцов, сопоставление с другими методами.
Оценка воспроизводимости анализа.
Статистическая обработка результатов анализа:
а) генеральная совокупность;
б) закон нормального распределения (ЗНР) случайных погрешностей;
в) t-распределение;
г) среднее арифметическое, дисперсное, стандартное отклонение, относительное стандартное отклонение;
д) графическое изображение t-распределения;
е) доверительный интервал.
8. Проверка однородности результатов анализа. θ-критерий.
9. Сравнение дисперсий (F-критерий) и средних (t-критерий) двух методов анализа.
10. Аттестация аналитических лабораторий.
11. Основные характеристики метода анализа: а) чувствительность; б) избирательность.
Химический анализ представляет собой сложный многостадийный процесс, включает следующие этапы:
а) выбор метода и схемы анализа;
б) отбор пробы;
в) пробоподготовка;
г) непосредственно определение;
д) статистическая обработка результатов анализа.
Метод – краткое определение принципов, положенных в основу анализа.
Методика – подробное описание всех условий и операций проведения анализа.
Рассмотрим гравиметрический метод
Метод основан на определении массы соединения, содержащего анализируемый компонент. В методику анализа входит описание условий осаждения (pH, температура, количество и концентрация осадителя), способ отделения осадка от раствора, условия промывания осадка, перевод определяемого вещества из осаждаемой формы в гравиметрическую.
После отбора пробы и подготовки пробы к анализу, приступают непосредственно к химическому анализу, т.е к обнаружению и определению компонента. Для обнаружения компонента используют аналитический сигнал. При определении количества компонента измеряют величину аналитического сигнала. Затем рассчитывают содержание анализируемого компонента используя функциональную зависимость: аналитический сигнал – концентрация:
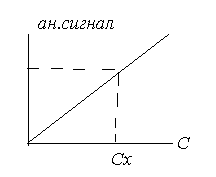
Различают полезный аналитический сигнал и аналитический сигнал фона.
Полезный аналитический сигнал представляет собой функцию содержания определяемого компонента.
Аналитический сигнал фона обусловлен примесями в растворителях, реактивах, а также шумами приборов. Для учета аналитического сигнала фона проводят холостой опыт. Измеряют аналитический сигнал пробы, несодержащей анализируемый компонент. Затем измеряют аналитический сигнал пробы, содержащей исследуемый компонент. По разности определяют полезный аналитический сигнал, используя градуировочный график.
Обычно проводят не одно определение, а несколько параллельных определений (3-5). Затем определяют среднее арифметическое
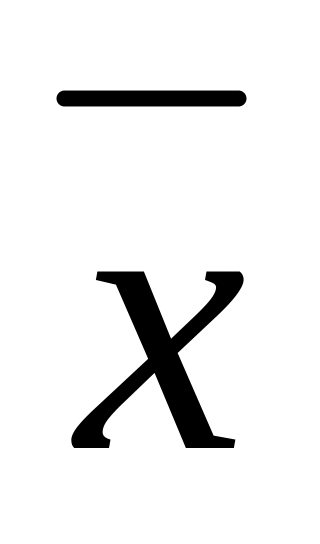 .
Когда истинное содержание определяемого
компонента не совпадает со
,
возеикает погрешность. Отклонение
среднего результата от истинного
содержания компонента называется
правильностью анализа. разброс
результатов параллельных определений
относительно среднего арифметического
называется воспроизводимостью анализа.
.
Когда истинное содержание определяемого
компонента не совпадает со
,
возеикает погрешность. Отклонение
среднего результата от истинного
содержания компонента называется
правильностью анализа. разброс
результатов параллельных определений
относительно среднего арифметического
называется воспроизводимостью анализа.По способу вычисления различают абсолютную и относительную погрешности. Абсолютная погрешность – разность между средним результатом и истинным содержанием. D = - M
Относительная
погрешность –
отношение абсолютной погрешности к
истинному результату
![]()
По характеру проявления различают систематические, случайные погрешности и промахи. Систематические погрешности вызваны постоянно действующей причиной, их можно выявить и устранить из результатов анализа, они имеют постоянный знак.
Систематические погрешности имеют следующую классификацию:
а) методические погрешности, обусловленные методикой определения;
б) инструментальные погрешности обусловлены применяемыми приборами.
в) погрешности, связанные с применяемыми реактивами. По степени чистоты реактивы имеют несколько квалификаций: техн., очищ., чистые, ч.д.а., х.ч., о.с.ч., спектрально чистые.
г) индивидуальные погрешности связаны с индивидуальными особенностями работающего аналитика.
Случайные погрешности возникают в результате неконтролируемых изменений в процессе эксперимента. Случайные погрешности нельзя измерить, их можно оценить методами математической статистики.
Промахи – грубые погрешности, они должны быть выявлены и исключены из результатов анализа.
Правильность характеризуется абсолютной и относительной погрешностью. Почему правильность не оценивают по величине абсолютной и относительной погрешности? (т.к. обычно истинное содержание компонента неизвестно). Для оценки правильности анализа используют следующие приемы:
метод «введено-найдено»;
2) независимый метод;
Метод стандартных образцов.
Метод «введено-найдено» имеет две разновидности:
а) точно известное количество определяемого компонента вводят в матрицу образца, не содержащего определяемого компонента;
б) точно известное количество определяемого компонента добавляют к образцу, содержащему определяемый компонент (метод добавок).
Рассмотрим первую разновидность метода. Готовят искусственную смесь, состоящую из Cu, Zn, Al. В эту матрицу вводят точно известное количество Ni – x1. Проводят анализ и определяют содержание Ni- 2.
Относительную
погрешность определяют по формуле:
![]()
Если D небольшая, то метод считается правильным.
Недостатками этого метода являются:
а) не учитывается, что сплав имеет более сложный состав, чем искусственная смесь;
б) нужно провести пробоотбор и пробоподготовку.
Метод добавок
В этом случае анализируют не искусственную смесь, а сам сплав. Берут навеску сплава, его растворяют в кислоте и определяют содержание никеля - 1. Точно такое же количество навески растворяют и вводят точно известное количество Ni –xдоб. Проводят анализ образца с добавкой и находят содержание никеля 2. Разность ( 2 - 1) – экспериментально найденная добавка (x).
Погрешность рассчитывают по формуле:
![]()
Анализ считается идеальным, если x совпадает с xдоб. Результаты считаются правильными, если D невелика. Метод является более точным.
Независимый метод
При использовании этого метода необходимо соблюдать 2 условия:
а) выбранный для сравнения метод должен дать правильный результат;
б) должен принципиально отличаться от изучаемого метода.
Например, при определении содержания никеля в латуни комплексонометричесим методом для сравнения используют гравиметрический метод. Содержание Ni, определенное гравиметрическим методом, берется за истинное.
