
- •Лекция № 1 задачи и методы аналитической химии
- •Современные проблемы аналитической химии:
- •Основная литература:
- •Дополнительная литература
- •Классификация методов анализа
- •Лекция №2 химическое равновесие в реальных системах
- •Лекция № 3 комплексные соединения в аналитической химии
- •Устойчивость вкс
- •Лекция № 4 органические реагенты в химическом анализе
- •PH образования гидроксидов
- •Лекция №5 кислотно-основные реакции
- •Лекция №6 буферные растворы
- •Лекция №7 метрологические основы аналитической химии
- •Лекция № 8
- •Основные понятия химической метрологии
- •Лекция 9
- •Экстракция
- •Лекция № 10 гравиметрический метод анализа
- •Типы соосаждения
- •Способы уменьшения соосаждения:
- •Лекция 11 пробоотбор и пробоподготовка
- •Лекция № 12 титриметрические методы анализа
- •Первичные и вторичные стандарты
- •Лекция 13 обсуждение кривой титрования
- •Кривая титрования многоосновных кислот
- •Титрование многокислотных оснований
- •Титрование смесей кислот
- •Лекция № 14
- •Лекция №15 тема: фиксирование тэ в методе кислотно-основного титрования
- •Лекция №16 индикаторные погрешности титрования
- •Лекция № 17 осадительное титрование
- •Лекция № 18
- •Классификация металлиндикаторов
- •Интервал перехода окраски индикатора
- •6. Пример определения Ca и Mg при совместном присутствии
Лекция № 3 комплексные соединения в аналитической химии
План:
Определение комплексных соединений (КС), тип связи, строение, координационное число, характеристика комплексообразователя (на самостоятельное изучение).
Классификация комплексных соединений (самостоятельное изучение).
Термодинамическая и кинетическая устойчивость КС.
Константы образования (устойчивости) КС.
Расчет равновесной концентрации и молярной доли компонента. Конкурирующие реакции комплексообразования.
Функция образования.
Хелаты (внутрикомплексные соединения-ВКС).
3. Термодинамическая устойчивость характеризует возможность образования комплекса и превращения его в другое КС.
Кинетическая устойчивость характеризует устойчивость комплекса во времени. В зависимости от скорости обмена иногда образуются инертные или лабильные комплексы.
Лабильные комплексы – это такие комплексы, в которых обмен лиганда происходит очень быстро и равновесие устанавливается в течение времени меньше 1 мин.
Инертные комплексы – это такие комплексы, в которых обмен лиганда происходит очень медленно и равновесие устанавливается в течение времени больше 1 мин или даже в течение суток.
s- и p- элементы образуют лобильные комплексы, d-элементы – инертные комплексы.
Для КС характерны два типа диссоциации: по типу сильного электролита (по внешней координационной сфере) и по типу слабого электролита (по внутренней координационной сфере).
[Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
4. Образование и диссоциация комплекса происходит ступенчато. Устойчивость КС количественно характеризуется константой образования β.
M
+ L ↔ ML
![]()
ML
+ L ↔ ML2
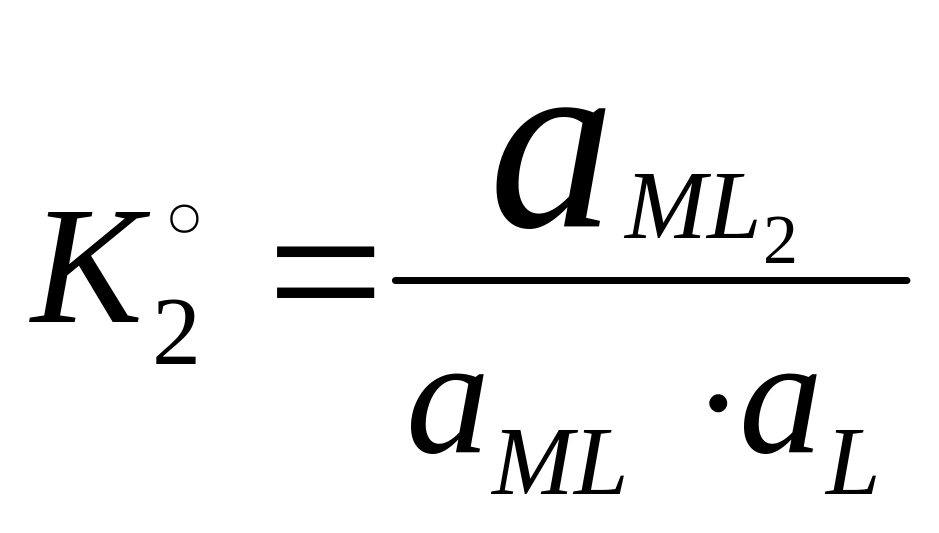
MLn-1
+ L ↔ MLn
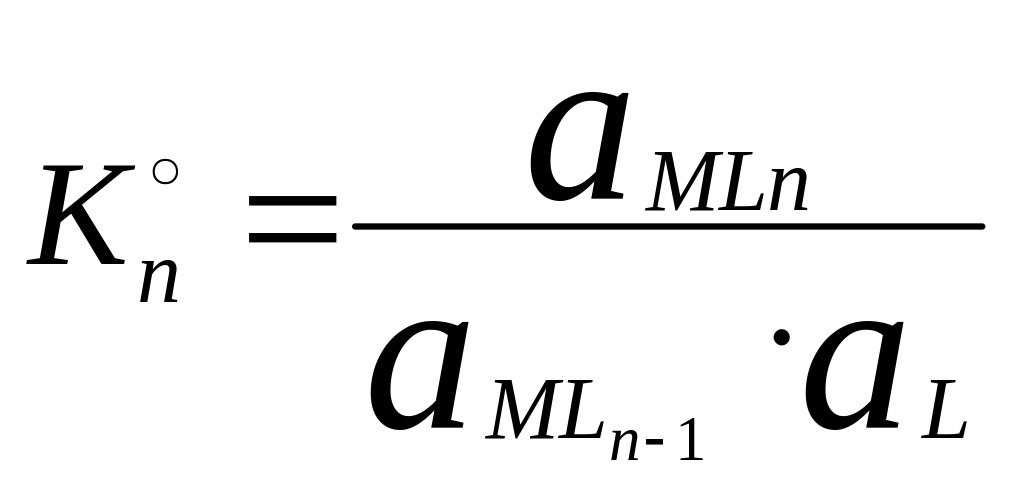
В справочниках приводятся суммарные константы образования, которые представляют собой произведение ступенчатых констант образования.
![]()
![]()

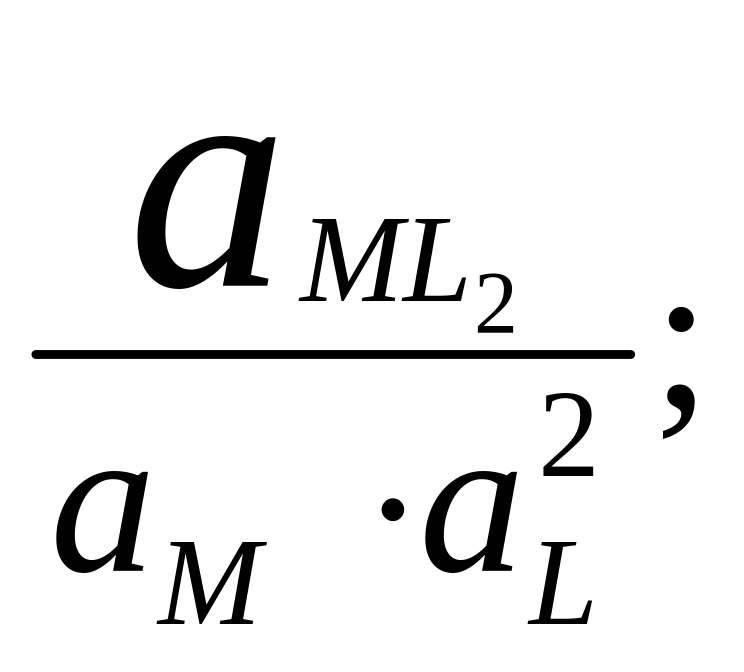
![]()
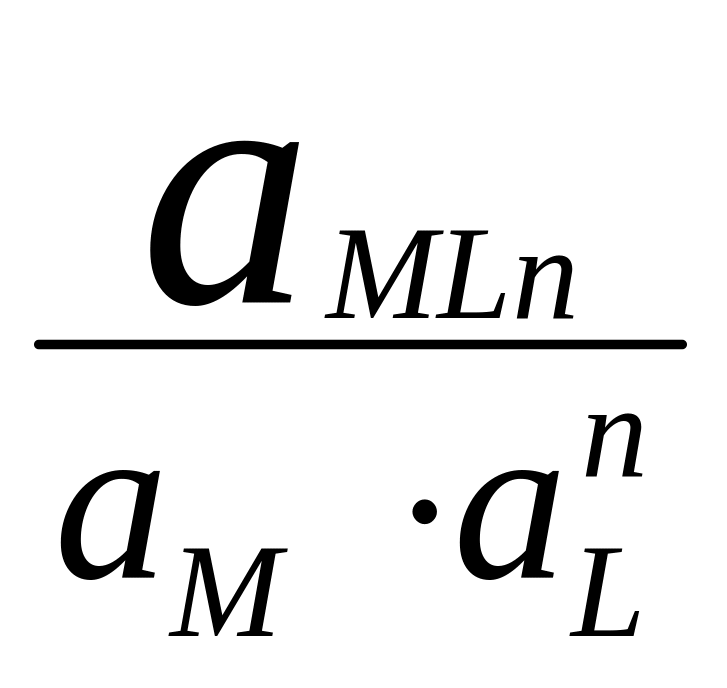
![]() не
зависит от активности компонентов и
комплексных частиц, зависит от природы
и температуры. Активность комплексных
частиц редко известна, поэтому чаще
пользуются концентрационной константой
образования (βn).
не
зависит от активности компонентов и
комплексных частиц, зависит от природы
и температуры. Активность комплексных
частиц редко известна, поэтому чаще
пользуются концентрационной константой
образования (βn).
Найдем связь между и βn:
![]()
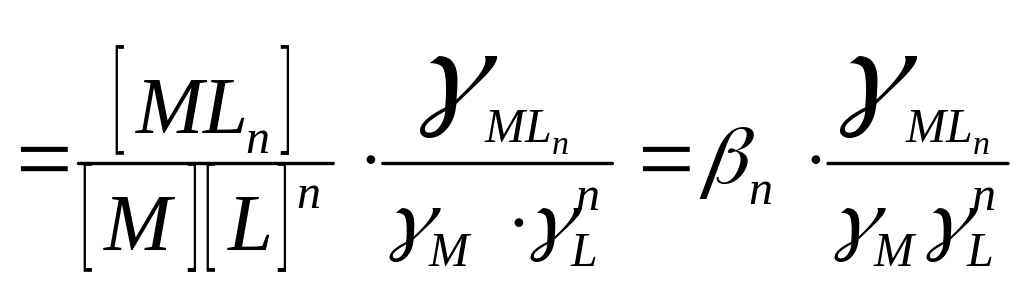
βn зависит от природы, температуры, I.
При
протекании конкурирующих реакций с
участием комплексообразователя или
лиганда равновесие в растворе комплексных
соединений характеризуется условной
константой устойчивости (![]() ).
).
![]() [MLn]
выражаем из
[MLn]
выражаем из
![]() и подставляем
и подставляем
![]()
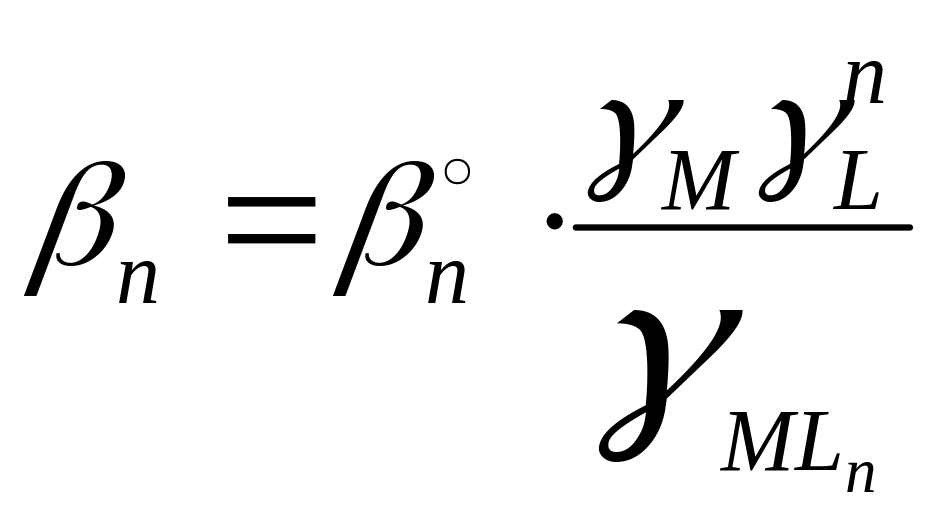 отсюда
отсюда
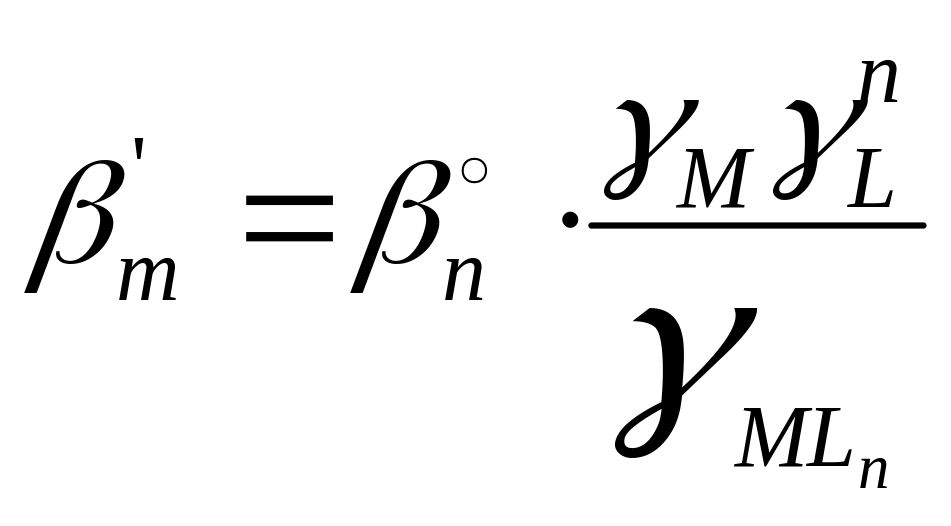
![]()

![]()
Пример. Рассчитать равновесную концентрацию ионов Ag+ в 0,001 М растворе нитрата серебра, содержащем 2М аммиака.
В присутствии аммиака протекают конкурирующие реакции комплексообразования:
Ag+ + NH3 ↔ Ag(NH3)+
Ag+ + 2NH3 ↔ Ag(NH3)2+
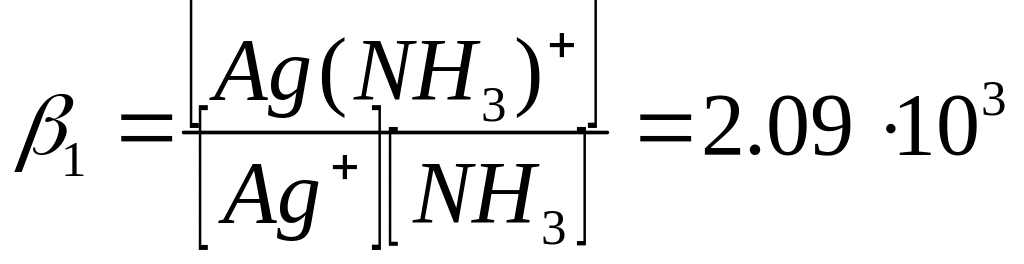
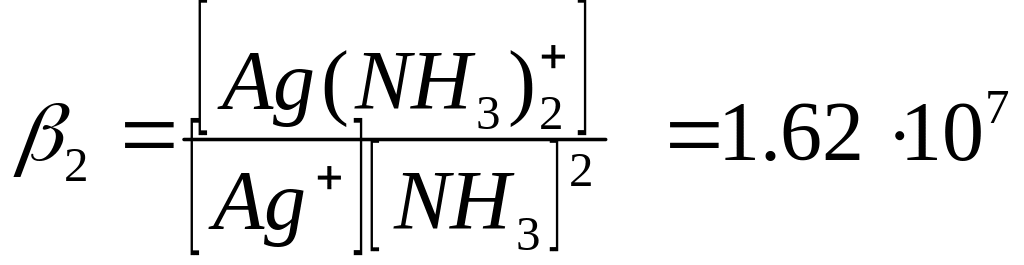
Запишем уравнение материального баланса:
СAg+ = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+]
Концентрации [Ag(NH3)+] и [Ag(NH3)2+] выражаем из констант устойчивости β1 и β2 и подставляем в уравнение материального баланса:
[Ag(NH3)+] = β1∙[Ag+] + [NH3]
[Ag(NH3)2+] = β2∙[Ag+] + [NH3]2
СAg+ = [Ag+] + β1[Ag+] + [NH3] + β2[Ag+] + [NH3]2 = [Ag+] (1+ β1[NH3] + β2[NH3]2)
Определяем [Ag+] :
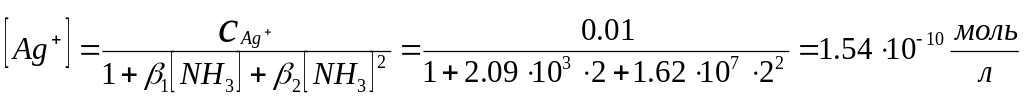
Находим
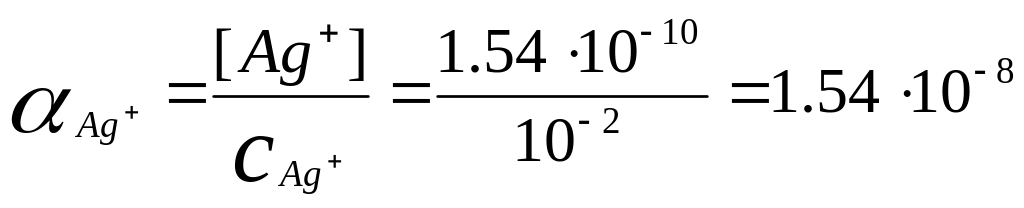
Чем сильнее α-коэффициент отклоняется от 1, те более прочным является образующийся комплекс.
Важной характеристикой реакции комплексообразования является функция образования (
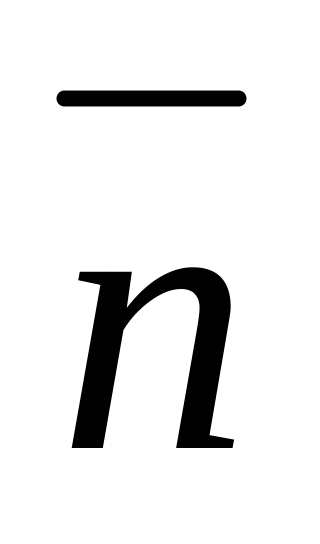 ).
).
Функция
образования (
)
– это среднее число лигандов, приходящиеся
на один ион металла в комплексе. По
физическому смыслу
![]() является средним лигадным числом.
является средним лигадным числом.![]()
меняется от 0 до максимального значения координационного числа N. Если Сα =[α], =0, нет комплексообразования; если =N, то в растворе существует только один комплекс; если имеет дробное значение, то в растворе присутствует несколько комплексов, имеющихся различный состав.
Хелаты – это циклические соединения. К хелатам относятся внутрикомплексные соединения (ВКС). Каждое ВКС является хелатом, но не каждый хелат является ВКС.
ВКС – это соединения, в которых ион металла связан с лигандами одновременно двумя типами связи: донорно-акцепторной и валентной.
ВКС – это хелат, в котором замыкание цикла сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла.
Органическое соединение содержит две группы: солеобразующую и комплексообразующую. Донорно-акцепторная связь образуется за счет комплексообразующей группы. Валентная - за счет солеобразующей группы. К солеобразующим группам относятся: -OH, -COOH, =N-OH
Основные комплексообразующие группы: |
Примеры |
─N= (третичный азот) |
комплексон III |
=N─H (иминогруппа) |
дифенилкарбазид |
─N=N─ (азогруппа) |
ЭХЧТ |
─N=O (нитрозогруппа) |
α-нитрозо-β-нафтол |
=N-OH (оксимная группа) |
диметилглиоксим |
>C=Oт (карбонильная группа) |
ализарин |
>C=S (тиогруппа) |
дитизон |
Комплексообразующие и солеобразующие группы должны быть расположены в молекуле органического соединения в орто-положении, чтобы не было стерических затруднений при образовании комплекса.
