
- •Лекция № 1 задачи и методы аналитической химии
- •Современные проблемы аналитической химии:
- •Основная литература:
- •Дополнительная литература
- •Классификация методов анализа
- •Лекция №2 химическое равновесие в реальных системах
- •Лекция № 3 комплексные соединения в аналитической химии
- •Устойчивость вкс
- •Лекция № 4 органические реагенты в химическом анализе
- •PH образования гидроксидов
- •Лекция №5 кислотно-основные реакции
- •Лекция №6 буферные растворы
- •Лекция №7 метрологические основы аналитической химии
- •Лекция № 8
- •Основные понятия химической метрологии
- •Лекция 9
- •Экстракция
- •Лекция № 10 гравиметрический метод анализа
- •Типы соосаждения
- •Способы уменьшения соосаждения:
- •Лекция 11 пробоотбор и пробоподготовка
- •Лекция № 12 титриметрические методы анализа
- •Первичные и вторичные стандарты
- •Лекция 13 обсуждение кривой титрования
- •Кривая титрования многоосновных кислот
- •Титрование многокислотных оснований
- •Титрование смесей кислот
- •Лекция № 14
- •Лекция №15 тема: фиксирование тэ в методе кислотно-основного титрования
- •Лекция №16 индикаторные погрешности титрования
- •Лекция № 17 осадительное титрование
- •Лекция № 18
- •Классификация металлиндикаторов
- •Интервал перехода окраски индикатора
- •6. Пример определения Ca и Mg при совместном присутствии
Лекция № 18
Выводы по кривой титрования
Скачок на КТ зависит от константы образования комплексоната металла. Чем больше константа образования комплексоната металла, тем больше скачок на КТ. Если константа образования меньше чем 107, скачок pMe практически исчезает и титрование становится невозможным.
Скачок на КТ зависит от концентрации титруемых растворов. Чем больше концентрация титруемых растворов, тем больше скачок на КТ.
Скачок на КТ зависит от pH раствора, при котором ведется титрование. Выбирают такое значение pH, при котором образующийся комплексонат был бы устойчивым. Минимальное значение pH, при котором Ca2+ можно определить, равно 8. При pH≈6 скачок на КТ практически исчезает.
величина скачка на КТ зависит от α-коэффициента. Чем больше αMe и
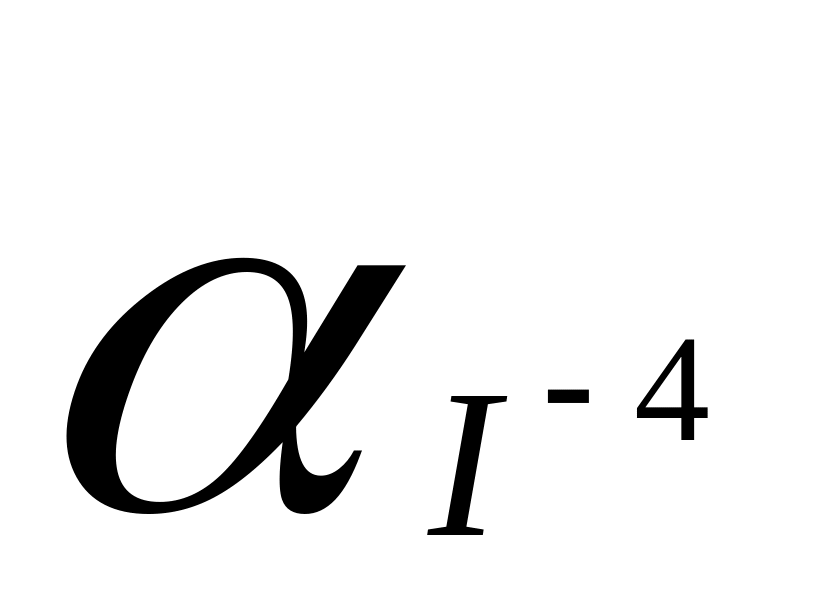 ,
тем больше скачок.
,
тем больше скачок.
Для фиксирования ТЭ в комплексонометрии применяют металлиндикаторы, которые реагируют на изменение концентрации иона металла.
Металлоиндикаторы – это красители, образующие окрашенные комплексы с ионами металла в определенных значениях pMe.
К металлоиндикаторам предъявляются ряд требований:
а) окраски комплексоната металла и индикатора должны контрастно отличаться друг от друга;
б) комплекс металла с индикатором д.б. менее устойчивым, чем комплекс металла с комплексоном. Разница в устойчивостях комплекса должна составить примерно 2-4 порядка βMY/βMInd ≤ 104;
в) индикатор должен взаимодействовать с ионом металла более чувствительно и избирательно.
Рассмотрим индикатор ЭХЧТ, который представляет собой трехосновную слабую кислоту:
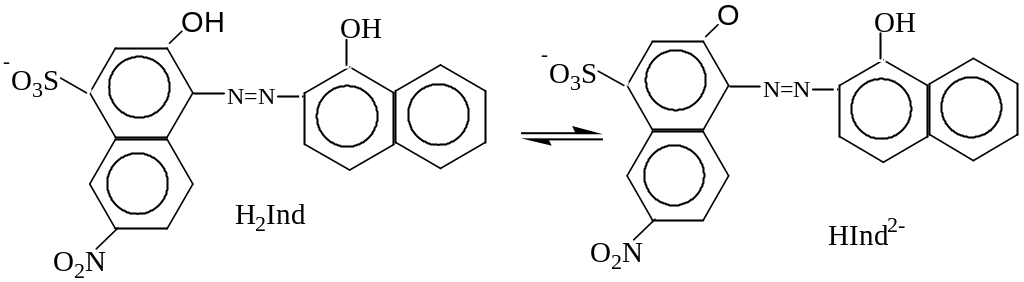

H2Ind- ↔ HInd2- ↔ Ind3-
pH=0-6 6.3-11.2 >11.2
а) К раствору, содержащему ионы металла до начала прибавления титранта, добавляют индикатор ЭХЧТ, при этом часть ионов металла связывается в комплекс с ЭХЧТ, имеющий малиновую окраску, часть ионов остается несвязанной.
Me +Ind ↔ MeInd
б) Далее к этому раствору добавляют титрант-комплексон III, происходит реакция:
Me + ЭДТА = МеЭДТА, изменение окраски пока не происходит.
в) продолжаем прибавлять титрант, когда уже ионы металла связались в комплекс. Вблизи ТЭ при прибавлении титранта происходит разрушение комплекса металла с индикатором. И в ТЭ мы наблюдаем появление в растворе свободного индикатора.
Me + ЭДТА = МеЭДТА + Ind
Классификация металлиндикаторов
1.Азоиндикаторы или азокрасители.
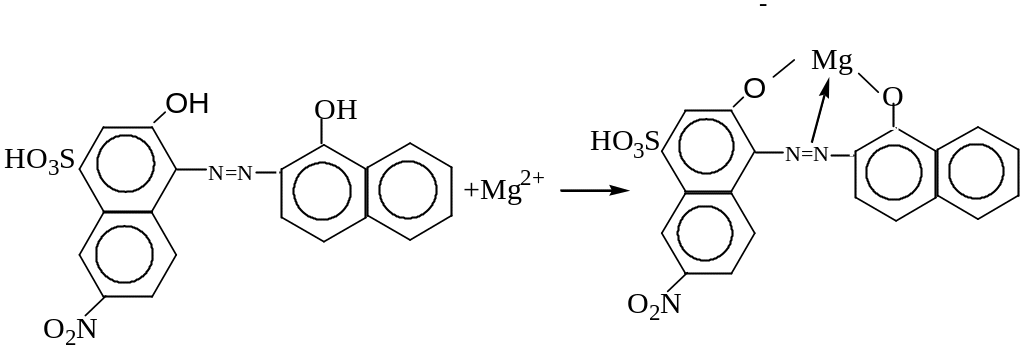
К ним относится ЭХЧТ, его используют в красильной промышленности и для определения общей жесткости воды. ЭХЧТ более чувствительный индикатор на Mg2+, чем на Ca2+. С ионом Ca2+ дает плохой индикаторный переход. Сумма Ca и Mg хорошо титруется с ЭХЧТ. При титровании в первую очередь с комплексоном связываются Ca2+ из-за большей устойчивости комплексоната Ca2+, и только после того, когда в растворе не будут ионы Ca2+ , с комплексоном связываются ионы Mg2+. Индикатор реагирует с ионом Mg2+ и переход окраски будет отчетливый.
Комплекс ЭХЧТ с Mg2+:
Азокрасители. С атомом азота в гетероцикле. К ним относится пиридилазонафтол.
(ПАН).
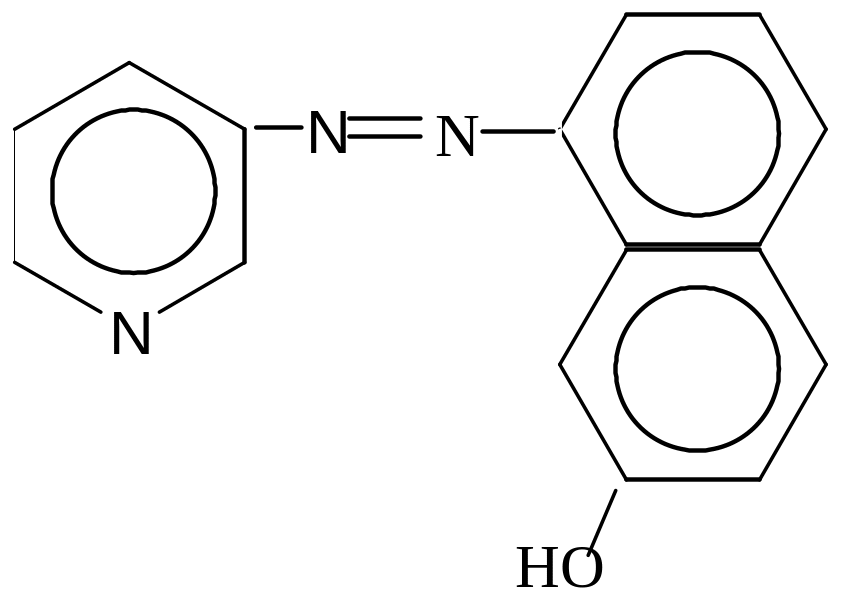
С этим индикатором можно работать как в кислых, так и в щелочных средах.
При pH от до можно определять Cu, Zn. Cd. При pH=- можно определять Fe3+, Bi3+ в присутствии цинка. Переход окраски из красной в желтый. Комплексы окрашены в красный цвет.
Фталеинкомплексоны или фталеиновые соединения.
Ксиленоловый оранжевый также относится к трифенилметановым красителям. Сам индикатор желтый, комплексы его фиолетового цвета. Применяется для определения Bi (pH=1-3), Th (pH=1.7-3.5), Pb, Cd, Zn (pH=5-6).
Метилтимоловый синий применяется как для определения элементов в кислой (0-6,5) среде, так и в щелочной среде (11.5-12.5). Изменение окраски раствора из синей в светло-серую (в щелочной среде), в кислой –из синей в желтую.
Флуорексон. Сам индикатор в щелочной среде окрашен в розовый цвет, комплекс кальция с флуорексоном обладает зеленой флуоресценсией. В ТЭ происходит гашение флуоресценции и мы наблюдаем появление розового окрашивания.
4. Прочие индикаторы. К ним относятся мурексид, дитизон, ализарин и др.
Мурексид – аммонийная соль пурпурной кислоты. Изменение окраски раствора из ярко розовой в фиолетовую, переход не очень отчетливый. Используется для определения Ca при pH=12-12,5. мурексид также используют при комплексонометрическом определении никеля.
