
- •4. Ионно-молекулярное равновесиепри диссоциации воды. Ионное произведение н2о. Влияние температуры на к. Водородный показатель рН.
- •6.Ионно-молекулярное равновесие при гидролиле. Различные случаи гидролиза солей. Совместный гидролиз.
- •9. Теория индикаторов. Кислотно-основные индикаторы. Фенолфталеин, лакмус, метилоранж. Переход окраски индикатора (интервал рН).
- •12. Закон Рауля. Температуры кипения и замерзание растворов.
- •17. Общая характеристика растворов. Качественные и еоличесткенные характеристики растворови процессов растворения. Перекристаллизация.
- •18.Растворы. Взаимная растворимость жидкостей. Растворимость твёрдых веществ в жидкостях.
- •19. Химическая кинетика. Гомогенные и гетерогенные реакции. Зависимость скорости реакций от различных факторов.
- •20. Скорость химической реакции. Уравнение скорости. Порядок реакции. Влияние темпер. На скорость реакции. Правило Ван-Гоффа. Уравнение Аррениуса.Молекулярно-кинетическая теория газов.
- •22. Катализ и катализаторы. Изберательность и селективность катализаторов. Влияние катализаторов на энергию активации химической рекции.
- •23.Кинетический вывод закона действующих масс. Константа химического рвновесия.
- •25.Взаимосвязь между константами химического равновесия.
- •26.Химическое равновесие и химическая термодинамика. Обратимые и не обратимые реакции. Направление протикания химической реакции.
- •31. Основные понятия и химические законы. Эквивалент, определение сложных веществ. Закон Авагадро и следствие из закона.
- •33.Основные классы химических соединений и связь между ними.
- •36 Основные типы химических реакций . Овр, их классификация.Ионно-электронный метод уравнивания овр.
- •44.Энтальпийный и энтропийный факторы протекания процесса. Термодинамический анализ возможности протекания процесса. Смещение хим. Равновесия. Принцип Ле Шателье.
- •45. Электродный потенциал. Стандартный электродный потенциал. Выводы относительно ряда стандартных электродных потенциалов. Гальванический элемент и его работа.
- •46.Уравнение Нернста. Ов потенциалы. Расчёт изменения стандартного изобарно-изотермического потенциала в реакции из эдс гальванических элементов.
- •48. Электролиз. Последовательность разрядки ионов на катоде и аноде соответственно. Электролиз с растворимым анодом.
- •49.Законы Фарадея. Электроз с растворимым и нерастворимыманоидом.
- •50. Электролиз. Понятие потенциала разложения. Расчёт эдс поляризации. Перенапряжение. Применение эленктрохимических процессов в технике.
- •52. Принцип Паули, правило Хунда, правило Клечковского. Электронные конфигурации атомов.
- •53. Периодический закон и строение атомов элемента. Современная формулировка периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •54. Основные положения теории Бутлерова. Теория химической связи по Косселю и Льюису. Современные представления теории химической связи. Особенности ковалентной связи.
- •55.Метод валентных связей. Представление о …. Связях. Гибридизация. Типы гибридизации.Строение молекул в рамках метода вс
- •57. Гибридизация, типы гибридизации. Метод Гиллеспи.
- •59. Квалификация комплексные соеденения.
- •66. Строение атома. Теория квантовой механики (Бор). Планетарная модели (Зоммерфельда, Резерфорда, Бора)
- •70.Энтропия и термодинамическая вероятность. Изменение энтропии системы, её связь с изменением объёма.
55.Метод валентных связей. Представление о …. Связях. Гибридизация. Типы гибридизации.Строение молекул в рамках метода вс
.
 связь
и
связь
и
 связь
связь
Связь, образованная перекрывание атомных орбиталей по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется связью.
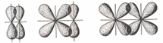
Связь, образованная перекрывание атомных орбиталей по линии, соединяющей ядра соответствующих атомов, называется связью. связь обычно охватывает 2 атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.

При наложении связи на связь образуется двойная связь, например в молекулах этилена, диоксида углерода и др.
При наложении двух связей на связь образуется тройная связь, например в молекулах азота, ацетилена и др.
Гибридизация атомных орбиталей. Типы гибридизации. Гибридизация атомных орбиталей – изменение формы некоторых атомных орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. гибридизация осуществляется тогда, когда в образовании связей данного атома участвуют электроны разного типа.
Наиболее распространены следующие типы гибридизации:
1.sp3-гибридизация. Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые гибридные орбитали, оси которых расположены под углом 109,50 друг к другу. sp3-гибридизация имеет место в молекулах NH3, Н2О и во всех предельных углеводородах.
2.sp2-гибридизация. Одна s-орбиталь и две p-орбитали превращаются в три одинаковые гибридные орбитали, оси которых расположены под углом 1200 друг к другу. sp2-гибридизация имеет место в молекулах BF3, AlCl3, а также во всех этиленовых и ароматических углеводородах.
3.sp-гибридизация. Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые гибридные орбитали, оси которых расположены под углом 1800 друг к другу. sp-гибридизация имеет место в молекулах BeH2, BeF2, CO2, а также во всех ацетиленовых углеводородах.
57. Гибридизация, типы гибридизации. Метод Гиллеспи.
Гибридизация атомных орбиталей – изменение формы некоторых атомных орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. гибридизация осуществляется тогда, когда в образовании связей данного атома участвуют электроны разного типа.
Наиболее распространены следующие типы гибридизации:
1. sp3-гибридизация. Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые гибридные орбитали, оси которых расположены под углом 109,50 друг к другу. sp3-гибридизация имеет место в молекулах NH3, Н2О и во всех предельных углеводородах.
2.sp2-гибридизация. Одна s-орбиталь и две p-орбитали превращаются в три одинаковые гибридные орбитали, оси которых расположены под углом 1200 друг к другу. sp2-гибридизация имеет место в молекулах BF3, AlCl3, а также во всех этиленовых и ароматических углеводородах.
3.sp-гибридизация. Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые гибридные орбитали, оси которых расположены под углом 1800 друг к другу. sp-гибридизация имеет место в молекулах BeH2, BeF2, CO2, а также во всех ацетиленовых углеводородах.
58. Химия комплексных соединений и общее сведения о них. Химическая связь в комплексных соединениях.Изомерия комплексных соединений.
Химическая связь - электростатическое взаимодействие двух атомов, осуществляемое путем обмена электронами. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару – поделенная пара. При сближении атомов валентные электроны одного атома начинают притягиваться к ядрам другого атома и, наоборот, валентные электроны второго атома притягиваются к ядрам первого. Главный результат образования химической связи – уменьшение общей энергии системы ядер и электронов, а достигается этот результат путем совместного использования электронов разными ядрами. Электронная плотность между атомами, образующими химическую связь, увеличивается. При образовании химической связи атом стремится завершить внешний уровень и приобрести электронную конфигурацию инертного газа, отдавая или принимая электроны. В зависимости от того, как происходит обмен электронами, различают следующие виды химической связи: ковалентную (полярную и неполярную), ионную, водородную, металлическую (связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ- металлов).
Основные черты химической связи:
1.снижение общей энергии системы по сравнению с суммарной энергией изолированных частиц, из которых это система состоит.
2.перераспределение электронной плотности в области химической связи.
Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами. Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).Не обладает направленностью и насыщенностью.
Ковалентная связь - связь, осуществляемая за счет образования общих электронных пар, принадлежащих обоим атомам. Общая пара электронов может быть получена двумя способами: 1) каждый из атомов отдает в общее пользование по одному электрону (обменный механизм); 2) один атом отдает в общее пользование два электрона, а другой ни одного (донорно-акцепторный механизм).
Направленность – обуславливает пространственную структуру молекул, т.е. их геометрию (форму).
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Вследствие насыщаемости связей молекулы имеют определенный состав: H2, CH4, H2S, HCl.
Полярность связи характеризует степень смещения общей электронной пары к одному из атомов. Ковалентную связь, образованную одинаковыми атомами называют неполярной, а связь образованную разными атомами – полярной.
Валентный угол (угол между связями) – угол между линиями, соединяющими химически связанные атомы. Валентные углы в разных молекулах могут изменяться от 600 до 1800.
Кратность (порядок) связи – число электронных пар, участвующих в образовании связи. Для обычных ковалентных связей это число может быть равно 1,2 или 3.
