
- •Бийский технологический институт (филиал)
- •Содержание
- •1 Теоретическая часть
- •1.1 Водородный показатель
- •1.2 Вычисление рН в растворах кислот и оснований
- •1.3 Буферные растворы
- •1.4 Гидролиз солей
- •2 Экспериментальная часть
- •3 Задачи для самостоятельной работы
- •3.1 Ионные уравнения
- •3.2 Диссоциация кислот и оснований. Буферные растворы
- •Варианты задач для самостоятельной работы
- •4 Теоретические вопросы к коллоквиуму по теме «Растворы»
- •Приложение а
- •Литература
1.2 Вычисление рН в растворах кислот и оснований
При решении ряда различных задач часто возникает необходимость расчета рН (и рОН) растворов кислот, оснований и т.д. Можно вывести формулу для расчета характера среды различных электролитов.
а) Растворы сильных кислот. В водных растворах ионизация сильных кислот протекает полностью. Поскольку из каждой молекулы сильной кислоты в растворе возникает один ион водорода, то концентрация ионов Н3О+ (или Н+) численно равна общей концентрации кислоты, исходя из степени диссоциации, равной единице:
[Н3О+] ≈ Ск или [Н+] ≈ Ск,
и следовательно,
рН = – lgСк.
ПРИМЕР: Вычислите рН 0,05 М раствора HCl.
РЕШЕНИЕ: [Н+] = Ск = 0,05 моль/л,
рН = – lg0,05 = 1,3.
б) Растворы сильных оснований. В растворах сильных и, следовательно, полностью ионизированных оснований концентрация ионов ОН– зависит от концентрации растворенного основания
[ОН–] ≈ Сосн, рОН = -lg Сосн.
По значению рОН можно определить рН раствора этого основания
![]() ,
,
рН = 14 – рОН (при 25°С).
ПРИМЕР: Вычислить рН и рОН раствора NaOH с концентрацией 0,05 М.
РЕШЕНИЕ: [ОН–] = Сосн = 0,05 моль/л, рОН = – lg 0,05 = 1,3,
рН = 14 – 1,3 = 12,7.
в) Растворы слабых кислот. Для вычисления рН раствора слабой кислоты, кроме концентрации кислоты, необходимо знать ее константу диссоциации ( ).
HAn + Н2О ↔ Н3О+ + An– или HAn ↔ Н+ + An–
 или
или
 ,
,
где [Н+] = [An-];
[HAn] ≈ СHAn (если степень диссоциации кислоты не превыша- ет 5 %).
Тогда уравнение примет вид
![]() .
.
![]() .
.
Для расчета рН раствора слабой многоосновной кислоты, где диссоциация по первой ступени протекает заметно лучше, чем по следующим, и концентрация ионов Н+, образующихся на первой ступени намного выше:
![]() ,
,
где
![]()
![]() константа
диссоциации по первой ступени.
константа
диссоциации по первой ступени.
ПРИМЕР
1: Вычислить рН 0,05 М раствора
цианистоводородной кислоты (HCN),
константа диссоциации которой 6,2![]() 10-10.
10-10.
РЕШЕНИЕ:
![]()
![]() .
.
ПРИМЕР
2: Вычислить рН 0,05 М раствора угольной
кислоты,
![]() = 4,5
10-7.
= 4,5
10-7.
РЕШЕНИЕ:
![]() ,
,
![]() .
.
г) Растворы слабых оснований. Вычисление рН растворов слабых оснований базируется на том же рассуждении, что и для слабых кислот.
ВОН ↔ В+ + ОН–
![]() ,
,
т.к. [В+] = [ОН-], а [ВОН] = Сосн,
![]() ,
,
![]() ,
,
 .
.
ПРИМЕР:
Вычислите рН 0,05 М раствора гидроксида
аммония (![]() ).
).
РЕШЕНИЕ:![]()
![]() .
.
1.3 Буферные растворы
Во многих химических реакциях желательно поддерживать рН раствора относительно постоянным на протяжении реакции, в которой ионы водорода поглощаются или образуются. А при разбавлении водой растворов сильных кислот или оснований или при добавлении к ним эквивалентных количеств щелочей или кислот рН меняется очень резко.
Несколько иначе ведут себя растворы слабых кислот или слабых оснований, к которым добавили их одноименные соли. Например, смеси растворов CH3COOH и CH3COONa или NH4OH и NH4Cl. При разбавлении этих растворов или при добавлении к ним небольших количеств кислот или щелочей величина рН их изменяется незначительно. Такие системы получили название буферных растворов, или буферных смесей.
Регулирующий механизм буферных растворов основан на смещении равновесия в растворах слабых кислот или оснований при добавлении к ним их солей. Предположим, в растворе имеется смесь слабой кислоты HAn и ее соли МеAn. Соль в отличие от кислоты ионизируется полностью, создавая в растворе высокую концентрацию ионов An¯ – анионов кислоты. Наличие анионов кислоты сильно сдвигает равновесие ионизации кислоты в сторону образования молекул кислоты
МеAn ↔ Ме+ + An¯
НAn ↔ Н+ + An¯ (α – очень мала).
В таком растворе находится большое число неионизированных молекул кислоты, анионов соли и незначительное число ионов водорода.
![]() ,
,
откуда
![]() .
.
Повышение концентрации Н+-ионов, вызванное добавлением сильной кислоты, приведет к связыванию их анионами соли в неионизированные молекулы кислоты:
Н+ + An– → HАn
Повышение концентрации ОН¯-ионов, вызванное добавлением сильного основания, приведет к смещению равновесия по следующей схеме:
НAn + ОН¯ → Аn¯ + Н2О
При этом и в том и в другом случае рН растворов практически не меняется.
Те же рассуждения можно применить и к буферному раствору, образованному слабым основанием и его солью, например, аммонийному буферному раствору:
![]() .
.
Почти
неизменным остается значение рН буферных
растворов и при разбавлении их водой,
так как соотношение ![]() или
или ![]() при разбавлении остается постоянным.
при разбавлении остается постоянным.
ПРИМЕР
1: Вычислите рН ацетатного буферного
раствора, полученного сливанием равных
объемов 0,01 М раствора CH3COOH
и
0,01 М раствора CH3COONa
(![]() =
1,8
10-5).
=
1,8
10-5).
РЕШЕНИЕ:
![]() .
.
![]() .
.
ПРИМЕР 2: Вычислите рН ацетатного буферного раствора, содержащего по 1 моль/л кислоты и соли, после добавления к 1 л раствора 0,1 моль HCl.
РЕШЕНИЕ: Если к 1 л буферного раствора прибавить 0,1 моль HCl, то согласно равновесию
CH3COONa + HCl ↔ CH3COOH + NaCl
Число молей CH3COONa уменьшается, а число молей CH3COOH увеличивается на 0,1 моль. В этом случае: Ск-ты = 1 + 0,1 = 1,1 моль, Ссоли = 1 – 0,1 = 0,9 моль. Тогда
![]() .
.
![]() .
.
Свойства буферных растворов:
малая чувствительность к разбавлению;
практически неизменное рН при добавлении умеренных количеств сильных кислот и оснований;
концентрация ионов Н+ в таких растворах зависит от
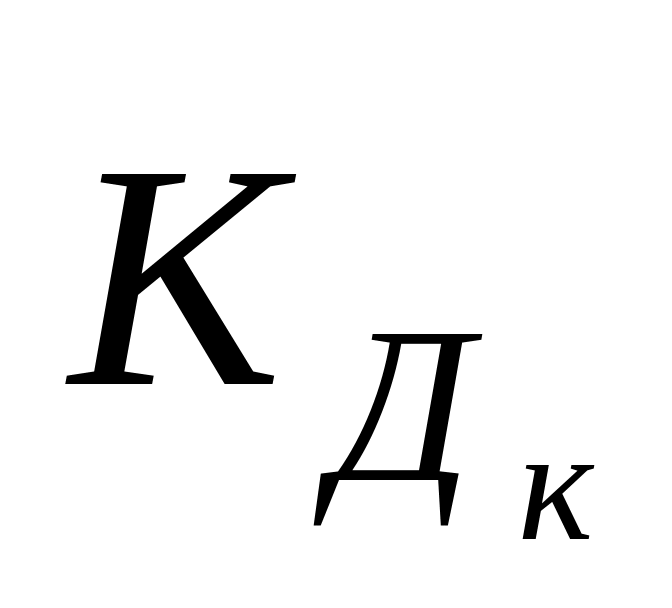 или
или
 и соотношений
или
.
и соотношений
или
.
Всякая буферная смесь сохраняет постоянство рН при добавлении небольшого количества кислоты или щелочи, т.е. обладает определенной буферной емкостью.
Буферной емкостью называют предельное количество сильной кислоты или щелочи определенной концентрации, которое можно прибавить к одному литру буферного раствора, чтобы значение рН изменилось на единицу.
Примеры буферных растворов представлены в таблице 2.
Таблица 2 – Буферные растворы
Компоненты буферных систем |
Название буфера |
рН |
Диапазон буферного действия |
НСООН и НСООNa |
Формиатный |
3,7 |
2,7–4,7 |
CH3COOH и CH3COONa |
Ацетатный |
4,7 |
3,7–5,7 |
NaH2PO4 и Na2HPO4 |
Фосфатный |
6,8 |
5,9–8,0 |
NH4OH и NH4Cl |
Аммонийный |
9,2 |
8,2–10,2 |
NaHCO3 и Na2CO3 |
Карбонатный |
≈10 |
9,2–11,0 |
