
- •1.Механическое движение. Система отсчёта. Относительность механического движения.
- •11.Гармонические колебания.Уравнение гармонического колебания. Фаза колебаний.
- •15.Распространение колебательного движения в упругой среде. Поперечные и продольные волны. Скорость распространения волн и её связь с длиной волны и периодом (частотой) колебаний .
- •16.Основные положения молекулярно-кинетической теории. Диффузия . Силы молекулярного взаимодействия.
- •19.Размеры и массы молекул атомов.Число Авогадро.Количество вещества.Моль.
- •20.Давление газа. Единици давления.Манометры.
- •21.Основное уравнение молекулярно-кинетической теории газов. Понятие вакуума. Идеальный газ.
- •34.Процесс кипения жидкости. Температура кипения.
- •35.Зависимость температуры кипения жидкости от внешнего давления. Перегретый пар и его использование в технике.
- •36.Водяной пар в атмосфере.Абсолютная и относительная влажность воздуха.
- •37.Приборы для определения влажности воздуха.
- •38.Характеристика жидкого состояния вещества. Поверхностный слой жидкости.Поверхностное натяжение.
- •39.Явление смачивания и несмачивания. Капилярные явления. Явления капилярности в быту,природе,технике.
- •40.Характеристика твёрдого состояния вещества (стр92).Кристаллы.Виды кристаллических структур.
- •41.Плавление и кристаллизация. Изменение объёма и плотности при плавлении и кристаллизации.
- •42. Линейное и объёмное расширение тел.
- •43.Значение теплового расширения тел в природе и технике.
- •44.Электризация тел. Закон сохранения электрического заряда.
19.Размеры и массы молекул атомов.Число Авогадро.Количество вещества.Моль.
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода. Мr = (m0) : (m0C / 12) где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть 1 а.е.м. = 1,660 * 10-27 кг
Многие опыты показывают, что размер молекулы очень мал. Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. NA = 6,02 * 1023 моль-1
Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12.
20.Давление газа. Единици давления.Манометры.
Давление-физическая
величины равная отношению силы F
действующей на элемент поверхности
нормально к ней к площади S
этого элемента

Единица давления в СИ- паскаль (1 Па = 1 Н/м2)
Манометры- рибор, измеряющий давление жидкости или газа. Принцип действия манометра основан на уравновешивании измеряемого давления силой упругой деформации трубчатой пружины или более чувствительной двухпластинчатой мембраны, один конец которой запаян в держатель, а другой через тягу связан с трибко-секторным механизмом, преобразующим линейное перемещение упругого чувствительного элемента в круговое движение показывающей стрелки.
21.Основное уравнение молекулярно-кинетической теории газов. Понятие вакуума. Идеальный газ.
![]() ,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (
,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (![]() в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Вакуум- состояние газа при котором средняя длина свободного пробега молекул λ сравнима с размерами сосуда L в котором заключен газ.
Низкий вакуум
λ<< Lэф
Kn < или = 5∙10-3
Давление 105…102 Па (103…100 мм рт.ст.)
Средний вакуум
λ ≥ Lэф
5∙10-3 < Kn < 1.5
Давление 102…10-1 Па (100…10-3 мм рт.ст.)
Высокий вакуум
λ > Lэф
Kn ≥ 1.5
Давление 10-1…10-5 Па (10-3…10-7 мм рт.ст.)
Сверхвысокий вакуум
λ >> Lэф
Kn >> 1.5
Давление 10-5 Па и ниже (10-7…10-11 мм рт.ст.)
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
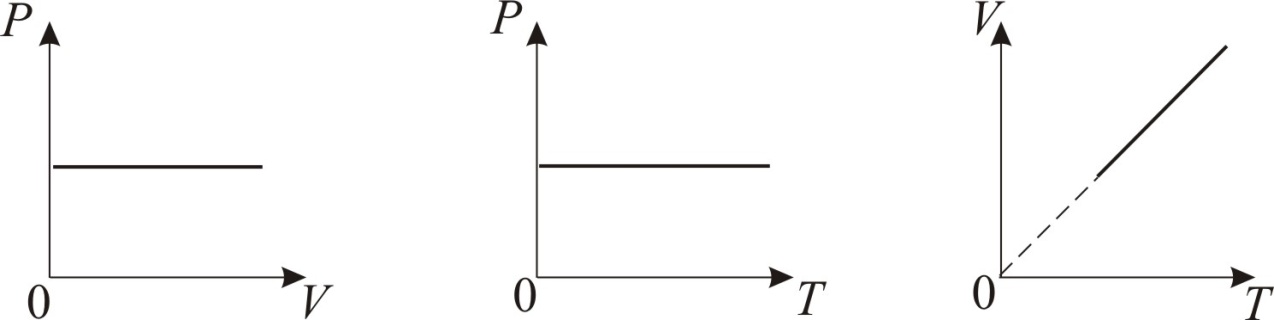
22.Изохорический процесс. Закон шарля. График изохаричесского процесса.
Процесс протекающий в газе при котором объём остаётся постоянным называется изохорным.
Давление газа данной массы при постоянном объёме возрастает линейно с увеличением температуры(з. Ш.). pt=pо (1+t),
где t — температура по шкале Цельсия, pо — давление газа при t=0° C, pt — давление газа при температуре t, — коэффициент давления, для идеальных газов a=1/273.
Закон Шарля можно сформулировать и следующим образом: для данной массы газа отношение давления газа к его температуре постоянно, если объем газа не меняется: P/Т=const, если V=const и m=const.

23.Абсолютный нуль температур. Термодинамическая шкала температур.
Если
изохору продолжить в область отрицательных
температур то в точке пересечения с осю
абсцисс имеем P
= P0(1
+![]() ·t)=0
Отсюда температура, при которой давление
идеального газа обращается в нуль, t =
–273°С (точнее,–273,16°С). Эта температура
выбрана в качестве начала отсчета
термодинамической шкалы температур,
которая была предложена английским
ученым Кельвиным. Эта температура
называется нулем Кельвина (или абсолютным
нулем).
·t)=0
Отсюда температура, при которой давление
идеального газа обращается в нуль, t =
–273°С (точнее,–273,16°С). Эта температура
выбрана в качестве начала отсчета
термодинамической шкалы температур,
которая была предложена английским
ученым Кельвиным. Эта температура
называется нулем Кельвина (или абсолютным
нулем).
Термодинамическая шкала температур была предложена английским учёным Кельвином. За начало отсчёта на этой шкале принята температура нуль Кельвина (0К). Нуль кельвина- это предельная температура при которой давление идеального газа равна нулю.Температура ниже 0К невозможна 0К- это самая низкая температура в природе.Зф единицу температуры по термодинамической шкале принят кельвин(К) 1К=1С.
24.Изотермичесский процесс. Закон Бойля-Мариотта.График изотермичесского процесса.
Процесс при котором один из параметров остаётся постоянным а два других изменяются называется изопроцессом(ненадо наверно).Процесс при котором температура остаётся постояннойназывается изотермичесским.
Давление газа данной массы(m=const) при постоянной температуре изменяется обратно пропорционально его объёму.(закон).Произведение давления газа на объём для данной массы газа при постоянной температуре есть величина постоянная pV=const

25.Изобаричесский процесс.Закон Гей-Люссака.Графикизобаричесского процесса.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и постоянном объеме идеального газа.
Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const
26.Изменение внутренней энергии при теплообмене и механичесской работе.
При сжатии газа его внутренняя энергия увеличивается за счёт совершения поршнем механической работы.При расширении газа его внутренняя энергия уменьшается преврашаясь в механичесскую энергию движущегося поршня.(механичесскаяработа)
Теплота и работа являются не видом энергии а формой её передачи они существуют лишь в процессе передачи энергии.(теплообмен).
27.Уравнение Клапейрона.Уравнение Менделеева-Клапейрона.
Произведение давления газа данной массы на его объём пропорционально термодинамической температуре(ещё стр 39).
P · V = (m / M) · RT где m - масса газа, М - молекулярная масса, р - давление, V - объем, Т - абсолютная температура в градусах Кельвина, R - универсальная газовая постоянная. Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Клайперона-Менделеева получается объединенный газовый закон.
28.Первое начало термодинамики.
Количество
теплоты сообщённое телу идёт на увеличение
его внутренней энергии и на совершение
телом работы над внешними телами
![]() .
Это закон сохранения и превращения
энергии. Если в замкнутой системе
состоящей из нескольких тел имеющих
первоначально различные температуры
происходит теплообмен то никакой работы
внутри системы не совершается(закон
сохранения энергии).
.
Это закон сохранения и превращения
энергии. Если в замкнутой системе
состоящей из нескольких тел имеющих
первоначально различные температуры
происходит теплообмен то никакой работы
внутри системы не совершается(закон
сохранения энергии).
29.Применение первого начала термодинамики к изопроцессам.(54стр)
Изменение внутренней энергии идеального газа при изохорном процессе пропорционально изменению его температуры дельта U=mcv ΔT.
Работа при изобарном расширении равна произведению давления газа на увеличение его объёма A=p ΔV.
При изотермическом нагревании вся теплота сообщённая газу расходуется на работу газа против внешних сил Q=A.
30.Адиабатный процесс.
Процесс происходяший без теплообмена с окружающими телами.При адиабатном процессе работа совершается только за счёт изменения внутренней энергии газа ΔU+A=0 или A=- ΔU.
31.Тепловые двигатели.КПД тепловых двигателей.
A - работа, произведённая двигателем за цикл; Q- количество теплоты, полученное двигателем от нагревателя за цикл; Q- количество теплоты, переданное двигателем холодильнику за цикл; Часто КПД выражают в процентах:
Коэффицент
полезного действия определяется лишь
температурами нагревателя и холодильника
и не зависит от рода рабочего вещества.


Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Любой тепловой двигатель работает по замкнутому циклу.
32.Испарение. Конденсация.(67стр)
Явление перехода вещества в пар называется парообразованием. В природе парообразование происходит в виде испарения и кипения Парообоазование с открытой поверхности жидкости называется испарением.
В результате хаотического движения над поверхностью жидкости молекула пара попадая в сферу действия молекулярных сил вновь возврашается в жидкость(конденсация).Конденсация и парообразвание происходят только в процессе обмена энергией между окружающей средой и веществом.
33.Насышенный пар и его свойства.Критическое состояние вешества.
Пусть жидкость находится в замкнутом сосуде из которого откачан воздух. Вначале число молекул испарившихся из жидкости растёт но чем больше число молекул пара тем больше молекул конденсируется. Если за одно и тоже время число испаряющяхся и конденсирующихся молекул пара одинаково то число молекул пара над жидкостью будет оставаться постоянным.Такое состояние называют динамическим равновесием пара и жидкости. Пар находящийся в динамическом равновесии с жидкостью называют насыщенным.
Свойства-Давление насыщенного пара над свободной поверхностью жидкости при постоянной температуре не зависит от объёма.№Давление насыщенного пара не зависит от его объёма но зависит от температуры.
Плотность насыщенного пара с возврастанием температуры увеличивается плотность же большинства жидкостей при нагревании уменьшается(из-за их расширения).С ростом температуры значение этих плотностей сближаются и при некоторой температуре определённой для каждого вещества становятся равными.При этой температуре исчезает разница между жидким и газообразным состояниями.Такое состояние называют критическим а температуру при которой оно наступает – критической.
