
- •Глава 10. Основы теории строения металлов
- •10.1. Кристаллическое строение металлов
- •Типы элементарных ячеек металлов
- •Параметры элементарных ячеек
- •10.2. Дефекты кристаллической решетки и их влияние на свойства металлов
- •10.3. Методы исследования структуры металлов
- •10.4. Механические свойства металлов
- •10.4.1. Механические свойства, определяемые при статических нагрузках
- •10.4.2. Механические свойства, определяемые при динамических нагрузках
- •10.4.3. Механические свойства, определяемые при переменных нагрузках
Глава 10. Основы теории строения металлов
10.1. Кристаллическое строение металлов
Для понимания свойств материалов и умения управлять ими необходимо учитывать, какие силы удерживают частицы в твердых телах.
Различают следующие основные типы связей: ионную, ковалентную, молекулярную, металлическую. Соответственно имеется четыре типа кристаллических решеток: ионные, атомные, полярные и металлические. Тип связи сильно влияет на механические свойства материала.
И
а б
Рис.
10.1. Кристаллическая решетка FeO:
а
– схема; б – пространственное
изображение
При нагреве соотношение ионных радиусов может изменяться, так как у неметалла он возрастает интенсивнее, чем у металла. Это приводит к изменению типа кристаллической структуры, т.е. к полиморфизму. Например, у оксида Fe2O3 при нагреве шпинельная кристаллическая решетка изменяется на ромбоэдрическую.
Энергия связи ионного кристалла по своему значению близка к энергии связи ковалентного кристалла и превышает энергию связи металлического и тем более молекулярного кристаллов. В связи с этим ионные кристаллы имеют высокую температуру плавления, модуль упругости и низкие коэффициенты сжимаемости и линейного расширения. Заполнение энергетических зон вследствие перераспределения электронов делает ионные кристаллы полупроводниками или диэлектриками.
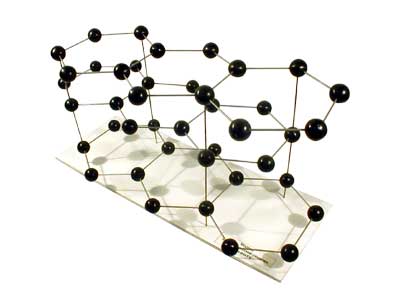
Связь в кристаллах с ковалентным типом связи осуществляется обобществлением валентных электронов соседних атомов. Их образуют элементы IV, V, VI подгруппы B Периодической системы Д.И.Менделеева: углерод, кремний, германий, сурьма, висмут и др. Прочность ковалентной связи зависит от степени перекрытия орбит валентных электронов. С увеличением перекрытия прочность связи повышается. Характерными свойствами для тел с такой связью являются малая плотность, высокая хрупкость. Ковалентная связь характеризуется направленностью, так как каждый атом вступает в обменное взаимодействие с вполне определенным числом соседних атомов. Направленность межатомных связей приводит к низкой пластичности и высокой твердости. Вследствие большой энергии связи ковалентные кристаллы характеризуются высокими температурами плавления. В качестве примера тела с ковалентным типом связи можно привести алмаз и графит (рис. 10.2).
а б
Рис.
10.2. Кристаллические решетки: а –
алмаза;
б – графита

В молекулярных кристаллах преобладает связь сил Ван-дер-Ваальса, энергия которой невелика: от 1 до 3 кал/моль, поэтому молекулярные кристаллы имеют низкие температуры плавления и испарения. Например, кристаллический йод испаряется уже при комнатных температурах. Молекулярные кристаллы – диэлектрики, так как построены из электрически нейтральных атомов (молекул), энергетические зоны которых полностью достроены.
Атомы инертных газов имеют полностью достроенные энергетические уровни и поэтому при сближении атомов обмен электронами невозможен. Возникновение сил притяжения между атомами объясняют их мгновенной поляризацией при сближении (рис. 10.3).
Аналогичные связи действуют между молекулами с насыщенными связями в кристаллах двухатомных газов H2, N2, Cl2, существование которых возможно лишь при очень низких температурах; в кристаллах J2, H2O, CO2, а также в кристаллах CH4 и других органических веществ – при нормальных условиях. Кристалл иода имеет ромбическую гранецентрированную решетку (рис. 10.4).
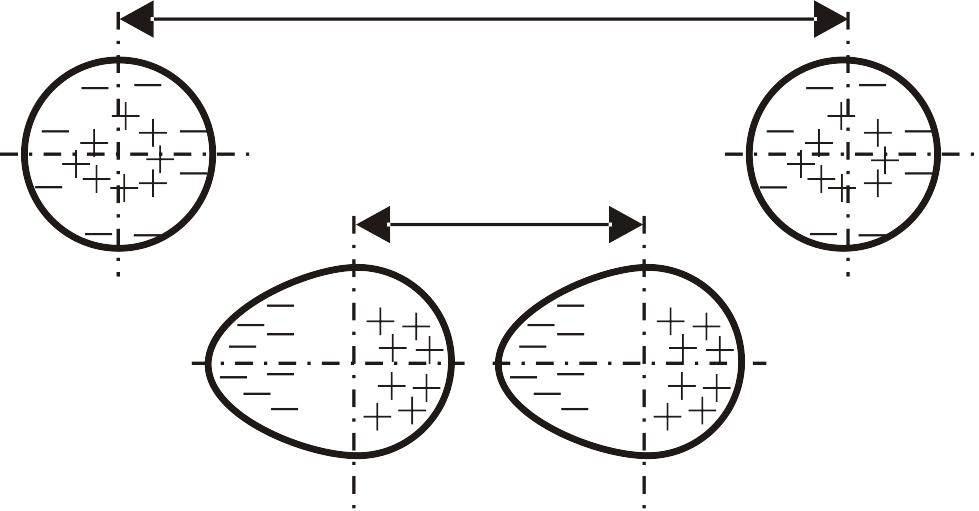
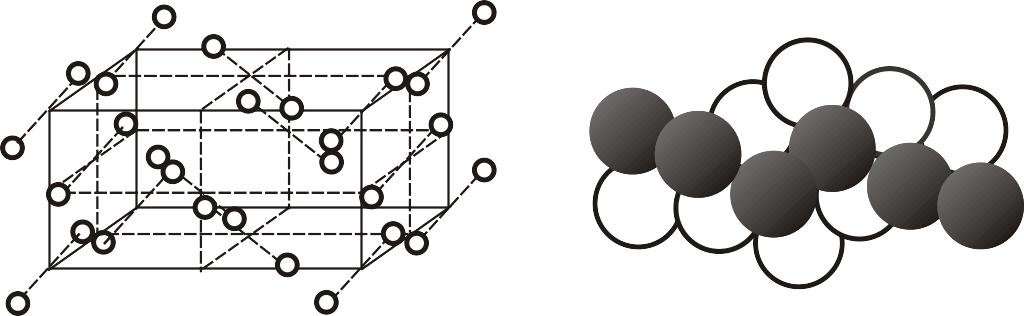
Рис. 10.3. Образование диполей при сближении атомов аргона |
а б Рис. 10.4. Кристаллическая решетка иода: а – схема; б – пространственное изображение |
В металлическом кристалле валентные энергетические зоны атомов перекрываются, образуя общую зону со свободными подуровнями. Это дает возможность валентным электронам свободно перемещаться в пределах этой зоны от атома к атому. Происходит обобществление валентных электронов в объеме всего кристалла. Все наиболее характерные свойства металлов объясняются наличием в них легкоподвижных коллективизированных электронов проводимости. Металлическая связь в отличие от остальных типов связи ненаправленная, поэтому каждый атом стремится притянуть к себе как можно больше соседних атомов (рис. 10.5). Следствием этого является высокое координационное число и большая компактность кристаллических структур металлов.
Энергия металлической связи несколько меньше, чем ковалентной, поэтому металлы, по сравнению с ковалентными кристаллами, имеют более низкие температуры плавления, испарения, но более высокий коэффициент теплового расширения. Металлы, в отличие от молекулярных кристаллов, не только не прозрачны для электромагнитных волн от самых низких частот до середины ультрафиолетовой области спектра, но и хорошо отражают излучение, т.е. обладают блеском.
Металлы имеют кристаллическое строение. При кристаллизации атомы (ионы) металлов образуют так называемую пространственную кристаллическую решетку (ПКР) – это воображаемая пространственная сетка, в узлах которой располагаются атомы или ионы, обусловливающие твердое кристаллическое тело (рис. 10.6).
z
y
x
a
b
c
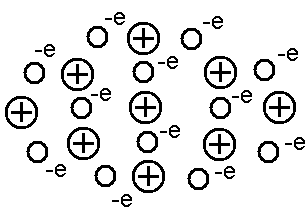

Рис. 10.5. Обобществление валентных электронов |
Рис. 10.6. Схема изображения пространственной кристаллической решетки металлов с параметрами a, b, c и , , |
Элементарный объем, выделенный из ПКР в виде параллелепипеда, называется элементарной ячейкой. Последовательное перемещение (трансляция) этого параллелепипеда вдоль направлений x, y и z и образует пространственную кристаллическую решетку металла и сплава. Вершины параллелепипеда называют узлами пространственной кристаллической решетки. С этими узлами совпадают центры тяжести элементарных частиц, из которых построен кристалл.
Пространственные кристаллические решетки полностью определяют строение кристалла и его свойства, в том числе при ОМД.
Таблица 10
Сингонии кристаллов
№ п/п |
Система (сингония) |
Ребра |
Углы |
1 |
Триклинная |
a ≠ b ≠ c |
α ≠ β ≠ γ |
2 |
Моноклинная |
a ≠ b ≠ c |
α = β = 90°; γ ≠ 90° |
3 |
Ромбическая |
a ≠ b ≠ c |
α = β = γ = 90° |
4 |
Ромбоэдрическая |
a = b = c |
α = β = γ ≠ 90° |
5 |
Гексагональная |
a = b ≠ c |
α = β = 90°; γ = 120° |
6 |
Тетрагональная |
a = b ≠ c |
α = β = γ = 90° |
7 |
Кубическая |
a = b = c |
α = β = γ = 90° |
Для описания элементарной ячейки используют шесть величин:
три отрезка a, b и c, равные расстояниям до ближайших элементарных частиц по осям координат;
три угла α, β, γ между этими отрезками.
Соотношения между этими величинами определяют форму ячейки. По форме элементарных ячеек все кристаллы подразделяют на семь систем (сингоний), которые приведены в таблице 10.1
