
- •Лекция хроническое легочное сердце Введение
- •Заболевания, приводящие к развитию хронического легочного сердца
- •Заболевания с развитием хронического легочного сердца
- •Патогенез хронического легочного сердца
- •Клиника. Диагностика
- •Дифференциальная диагностика
- •Принципы лечения хронического легочного сердца
- •Литература
Патогенез хронического легочного сердца
Переходя к рассмотрению формирования хронического легочного сердца, необходимо подчеркнуть закономерные, этиологически обусловленные различия исходных нарушений при разнообразных заболеваниях, приводящих к легочной гипертензии. Вместе с тем, первопричиной, вызывающей изменения легочной гемодинамики, следует считать альвеолярную гипоксию при нарастающей неравномерности альвеолярной вентиляции с последующей артериальной гипоксемией (рис. 1).
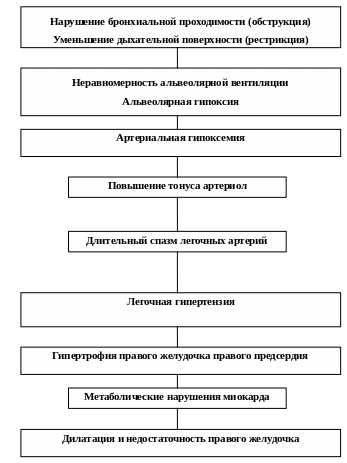
Рис. 1. Этапы формирования хронического легочного сердца при хронических неспецифическихзаболеваниях легких
Многочисленными экспериментальными и клинико-физиологическими исследованиями установлено, что уменьшение содержания в альвеолярном воздухе кислорода и увеличение содержания в нем углекислого газа приводят к повышению тонуса мелких артерий и артериол легких – это известный рефлекс Эйлера-Лильестранда. Если изменения состава альвеолярного воздуха возникают в небольшом участке легочной ткани, то наблюдается местная вазоконстрикция. В нормальных условиях данный рефлекс обеспечивает приспособление легочного кровотока к интенсивности вентиляции легких.
Если альвеолярная гиповентиляция длительно развивается в обширных отделах легких или в целом легком, то наступает генерализованное повышение тонуса мелких легочных артериальных сосудов, развивается легочная артериальная гипертензия. Повышение тонуса в артериальной системе малого круга может быть и чисто нейрогенным, т.е. наступать в результате усиления функции симпатической иннервации по отношению к сосудам малого круга, что также может вести к развитию стойкой легочной гипертензии. Важная роль в развитии указанных реакций принадлежит изменению функций эндотелия легочных сосудов, более подробно эти сведения будут представлены ниже.
Длительное повышение давления в легочной артерии приводит к гипертрофии, а с течением времени, при повторных обострениях бронхо-ле-гочной инфекции, нарастании обструкции – к дилатации и недостаточности правого желудочка.
К указанному общепатологическому механизму развития легочной гипертензии и хронического легочного сердца в разные периоды заболевания присоединяются множественные морфо-функциональные изменения бронхиального дерева, респираторного отдела и сосудов легких, клеток крови с постепенным появлением стойких нарушений вентиляции и гемодинамики:
сдавление и запустевание артериол;
изменения сосудистого, в том числе микроциркулярного вида;
гемореологические нарушения, синдром внутрисосудистого микросвертывания крови;
синдром капиллярно-трофической недостаточности;
склероз и запустевание лимфатических терминалей;
бронхо-пульмональные сосудистые анастомозы;
утомление дыхательных мышц;
изменения мукоцилиарного аппарата бронхов;
нарушение сурфактанта легких.
Следует подчеркнуть, что на ранних этапах формирования хронического легочного сердца, в условиях начальной стадии дыхательной недостаточности преобладают компснсаторно приспособительные реакции. Они обеспечиваются большой площадью альвеолярной и капиллярной поверхности легких, значительной мощностью сердечной и дыхательных мышц. Происходит перераспределение основной гемодинамической нагрузки на сосудистую систему верхних, и частично средних отделов легких. Открытие недействующих резервных сетей капилляров, расширение мелких сосудов временно обеспечивают адекватный газообмен, однако способствуют и увеличению энергетических затрат правым желудочком.
В дальнейшем при различных заболеваниях в формировании хронического легочного сердца большую роль играют разнообразные анатомические или функциональные нарушения. Прежде всего, это касается сосудистого и, в частности, микроциркуляторного русла легких. Сюда можно отнести сдавление и запустевание артериол и капилляров вследствие эмфиземы и фиброза, редукцию капиллярной сети истинную и обусловленную набуханием эндотелия, либо утолщения стенок за счет фиброза, васкулиты с пролиферацией интимы, сужением и облитерацией просвета; множественный микротромбоз. Мелкие артерии и артериолы приобретают усиленный эластический каркас, гипертрофируется их мышечный слой, появляются так называемые артерии замыкающего типа, всегда свидетельствующие о ЛГ (Есипова И.К., 1976). Вены не гипертрофируются, наблюдается их расширение и дистония венулярного отдела; развивается склероз и запустевание лимфатических терминалей. В интиме ветвей второго и третьего порядка развиваются атеросклеротические процессы, являющиеся характерным признаком легочной гипертензии. Легочный ствол постепенно расширяется.
Все эти изменения способствуют возрастанию легочного сосудистого сопротивления и повышению давления в системе легочной артерии; ведут к закономерной гипертрофии миокарда правого желудочка с постепенным истощением его энергетических возможностей. Считают, что появление клинических признаков хронического легочного сердца происходит при редукции общей площади легочных капилляров на 5-10 %, сокращение ее на 15-20 % приводит к выраженной гипертрофии правого желудочка; декомпенсированному легочному сердцу соответствует уменьшение поверхности легочных капилляров и альвеол, более чем на 30 %. (Чучалин A.Г. и соавт . 1985).
Большое значение в увеличении сопротивления кровотоку в легких и нарастании легочной гипертензии приобретают геморологические нарушения, характерные для хронической бронхо-легочной патологии. Компенсаторный эритроцитоз крови на фоне артериальной гипоксемии сочетаются часто со структурными и функциональными изменениями, которые претерпевают важнейшие клеточные элементы крови (тромбоциты, эритроциты). Наблюдаются набухание и дегрануляция тромбоцитов с высвобождением биологически активных и, в частности, вазоактивных веществ, способствующих повышению давления в малом круге кровообращения. Уменьшается количество нормальных дискоцитов, преобладают деэнергизированные формы эритроцитов с высоким содержанием холестерина на мембране, нарушается их деформируемость. Нарастают процессы агрегации тромбоцитов и эритроцитов; наряду с изменениями плазменных факторов гемостаза они становятся активными участниками развития ДВС-синдрома при дыхательной недостаточности и легочном сердце. Нарушается кислородтранспортная функция крови, в результате чего еще более возрастает гипоксия.
При повторных обострениях бронхо-легочной инфекции прогрессируют нарушения аэрогематического барьера с отеком эндотелия капилляров, изменением проницаемости, развитием переваскулярного фиброза и формированием синдрома капиллярно-трофической недостаточности.
Еще одним фактором, способствующим повышению давления в системе легочной артерии, является развитие бронхопульмональных анастомозов, возрастание внутрилегочного шунтирования.
Подчеркивая важнейшую роль редукции капиллярной и альвеолярной поверхности легких и патогенезе легочного сердца, следует упомянуть об изменениях легочного сурфактанта, который в условиях нарастающей гипоксии подвергается деградации, следствием чего является формирование ателектазов и прогрессирующая эмфизема
В формировании ХЛС у больных хроническим бронхитом важная роль принадлежит изменениям мукецилиарного аппарата бронхов, который осуществляет важнейшие функции в бронхиальном дереве – защитную и дренажную. При длительном течении заболевания реснитчатый эпителий редуцируется, развивается синдром мукоцилиарной недостаточности, проявляющийся в клинике нарастанием бронхиальной обструкции и альвеолярной гиповентиляции, гипоксемией, развитием ЛГ.
Следует отметить, что в течение последних двух десятилетий появились новые и весьма существенные данные, касающиеся патогенеза ХЛС. Повышенный интерес исследователей к этой проблеме был обусловлен несколькими моментами, требующими объяснений. Во-первых, оказалось, что степень ЛГ не всегда является ведущим фактором, определяющим дальнейшие изменения гемодинамики, нет корреляции между степенью дыхательной недостаточности (ДН) и ЛГ. У большинства больных ХОЗЛ при наличии тяжелой ДН легочная гипертензия не достигает высоких цифр, и причина декомпенсации ХЛС остается не вполне понятной.
Во-вторых, с внедрением эхокардиографических исследований появились сведения о раннем вовлечении в процесс левого желудочка с развитием его дисфункции у части больных ХОЗЛ.
В третьих, накоплены свидетельства роли ренин-ангиотензин-альдостероновой системы (РААС) в генезе ЛГ и сердечной недостаточности при ХЛС.
И, наконец, в-четвертых, установлена важнейшая poль эндотелия легочных сосудов в изменениях легочного кровообращения при ХЛС.
Важная роль эндотелия легочных сосудов в процессах сокращения и расслабления неоднократно доказана в эксперименте, в частности, на изолированных полосках легочной артерии с ее сокращением в условиях гипоксии и при отсутствии вовлечения в этот процесс эйкозаноидов, катехоламинов или ацетилхолина. В результате сделан вывод о том, что сокращение и расслабление легочной артерии непосредственно зависит от присутствия эндотелия (Mizmanian G.M. et al., 1989)
Известно, что эндотелий легких метаболизирует вазоактивные вещества (ангиотензин I, брадикинин, аденин-нуклеотиды, биогенные амины, простагландины – Е, F, арахидоновую кислоту), эти функции могут меняться в ту или иную стороны в зависимости от напряжения кислорода. В ответ на гипоксию возможно продуцирование эндотелием суживающих субстанций (эйкозаноидов, лейкотриенов) или/и уменьшение образования вазодилатирующих веществ (Gillis C.N., Pitt B.R., 1982).
В последующем было установлено, что вазодилатирующие факторы, устраняющие повышенную сосудистую реакцию, располагаются в эндотелиальных сосудистых участках и тесно связаны с их сократительными элементами (Weir Е К., 1984). Существуют убедительные данные, что синтез или высвобождение вазоактивных веществ - кальций-зависимый процесс (Peach M.J et al., 1987).
Известно, что эндотелий сосудов легких продуцирует три мощные вазодилатирующие субстанции: простациклин – продукт циклооксигеназы, эндотелий гиперполяризующий фактор и эндотелий расслабляющий фактор (ЭРФ). Основная роль в процессах вазодилатации принадлежит ЭРФ, ведущим действующим производным которого является окись азота (NO) (Palmer R.M.J. et al., 1988). Доказано, что уменьшение вазодилатации при гипоксии может быть обусловлено как снижением освобождения ЭРФ, так и уменьшением восприимчивости сосудистых гладких мышц к этой субстанции.
NO синтезируется под воздействием L-аргинина и путем ряда превращений и воздействия на циклический 3,5-гуанилат монофосфат вызывает расслабление сосудов (Johns R.A. et al., 1989, Palmer R.M.J. et al., 1988) (рис. 2).
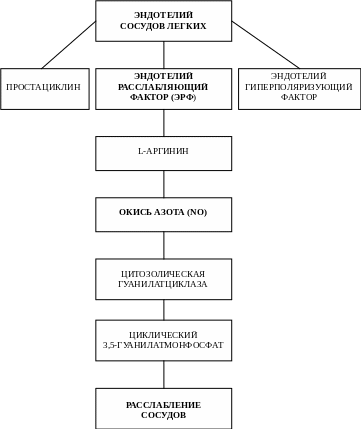
Рис. 2. Участие эндотелия сосудов легких в процессах вазодилятации в малом круге кровообращения
Достаточно 30 минут гипоксии, чтобы снизить освобождение ЭРФ из эндотелиальных клеток. Ингаляции NO, как в эксперименте, так и в клинике у больных с дыхательной недостаточностью и легочной гипертензией снижали давление в легочной артерии, увеличивали парциальное давление кислорода, на 30% уменьшали внутрилегочное шунтирование, снижалось легочное сосудистое сопротивление (Dyar O. et al., 1993; Rossaint R. et al., 1993). Таким образом, доказано существование релаксирующего фактора эндотельного происхождения в сосудистом ложе малого круга кровообращения, его зависимость от альвеолярной гипоксии и гипоксемии и его ремодулирующее влияние на гипоксемическую вазоконстрикцию.
ЭРФ, также как и простациклин, вызывают не только сосудорасширяющий эффект, но и являются ингибиторами адгезии и агрегации тромбоцитов. Кроме того, эндотелий содержит нейтральный липид – фактор, активирующий тромбоциты (Moncada S. et al., 1976; Ruan U.S., 1986).
При длительной гипоксии у больных ХОЗЛ эндотелиальные функции релаксации существенно снижаются, что служит причиной сужения сосудов легких и возникновения легочной гипертензии.
Ряд авторов ставят вопрос о том, является ли снижение продуцирования эндотелием ЭРФ или уменьшение восприимчивости сосудистой гладкой мышцы к вазодилататорам первичным или вторичным по отношению к легочной гипертензии, или это взаимозависимые процессы, создающие при длительной гипоксии порочный круг метаболических и гемодинамических нарушений (Майкл Д. Пич и соавт., 1995). Ответы на эти вопросы требуют дальнейших исследований.
Если причины гипертрофии и дисфункции правого желудочка у больных с длительной ЛГ понятны и общепризнанны, то развитие правожелудочковой недостаточности при умеренном повышении давления в малом круге кровообращения или формирование дисфункции или гипертрофии левого желудочка у части больных с ХЛС, не находят однозначного ответа. Изменения ЛЖ связывают со смещением межжелудочковой перегородки при ее гипертрофии либо дилатации ПЖ на фоне увеличения , метаболическими нарушениями в условиях гипоксии, изменениями внутригрудного давления (Перлей Е.Е., Дундуков Н.Н., 1993; Elzinga et al., 1980; Litte W.C. et al., 1984).
В настоящее время высказано мнение о существовании общего фактора, влияющего на изменение функции обоих желудочков. Установлена корреляция между насыщением и крови кислородом, фракцией изгнания ЛЖ, нарушениям функции ПЖ, с одной фиброза в левом и правом желудочках. В эксперименте получены данные о том, что рост волокон эластина и коллагена не только в миокарде, но и в сосудах легких, периферических сосудах, что способствует развитию гипертрофии и дисфункции миокарда (Archer S.L., Weir E.K., 1989) (рис. 3).
ХРОНИЧЕСКАЯ ГИПОКСИЯ
ЭНДОТЕЛИЙ ЛЕГОЧНЫХ СОСУДОВ


 ЭРВ
(NO)
ЭРВ
(NO)


А ГРЕГАЦИЯ
ГРЕГАЦИЯ
ТРОМБОЦИТОВ
Л ЕГОЧНАЯ
ГИПЕРТЕНЗИЯ
ЕГОЧНАЯ
ГИПЕРТЕНЗИЯ

ВНУТРИЛЕГОЧНОЕ
ШУНТИРОВАНИЕ
А РТЕРИАЛЬНАЯ
ГИПОКСИМИЯ
РТЕРИАЛЬНАЯ
ГИПОКСИМИЯ


СТИМУЛЯЦИЯ ФИБРОЗА

Д
 ИСФУНКЦИЯ
ПЖ И ЛЖ АКТ РААС
ИСФУНКЦИЯ
ПЖ И ЛЖ АКТ РААС


НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ
Рис. 3. Роль эндотелия легочных сосудов в развитии легочной гипертензии и хронического легочного сердца
Наконец получены важные данные о роли ренин-ангиотензин-альдостероновой системы (РААС) при хронических заболеваниях легких и легочной гипертензии. Установлено, что уровень ангиотензинпревращающего фермента (АПФ) и компонентов РААС нарастает параллельно увеличению степени гипоксии (Rose C.E.Ir/ et al., 1983). Оказалось, что не только декомпенсированное легочное сердце, но и дыхательная недостаточность без признаков нарушения кровообращения сопровождается у части больных ХНЗЛ увеличением активности РААС, причем нарастают как плазменные, так и тканевые показатели (Raff H., Levy S.A., 1986). У больных ХОЗЛ, резистентных к медикаментам и оксигенации, закономерно обнаруживают высокую активность ренина (Farbtr M.O. et al., 1984). Подобные изменения способствуют нарастанию ЛГ, стимулируют процессы фиброза в миокарде, нарушение функции желудочков.
Таким образом, с учетом приведенных выше данных в рабочем варианте определение ХЛС может быть следующим: легочная гипертензия в сочетании с гипертрофией, дилатацией правого желудочка, дисфункцией обоих желудочков сердца, возникающие вследствие структурных или функциональных изменений в легких, нарушения функции эндотелия сосудов легких и нейро-гуморальных расстройств при хронических гипоксии, вызванной патологией органов дыхания.
Учет представленных выше данных важен не только с точки зрения понимания глубинных механизмов формирования ХЛС, но и для разработки методов лечения, способных предупредить, приостановить гемодинамические расстройства.
