
- •Вопрос 1
- •Классификация липидов
- •Биологические функции липидов
- •Вопрос 2 принципы нормирования липидов в питании
- •Вопрос 3
- •Вопрос 4
- •5. Мицеллообразование
- •4. Синтез тг и фл.
- •Вопрос 5
- •Вопрос 6.
- •9) Химический состав и строение мицелл, механизм всасывания липидов.
- •Механизмы ресинтеза липидов в энтероцитах, значение.
- •4. Моноацилглицероловый путь синтеза тг и фл
- •5. Глицерофосфатный путь синтеза тг и фл
- •13. Обмен хиломикронов, значение (роль апопротеинов, печеночной и сосудистой липопротеинлипаз). Обмен хиломикронов
- •14. Биохимические причины, метаболические нарушения, клинические проявления нарушений обмена хиломикронов.
- •1. Абеталипопротеинемия (синдром Бассена-Корнцвейга)
- •Жировая ткань – белая и бурая: локализация, функции, субклеточный и химический состав, возрастные особенности.
- •Особенности метаболизма и функции бурой жировой ткани.
- •Лептин: химическая природа, регуляция биосинтеза и секреции, механизмы действия, физиологические и метаболические эффекты.
- •Особенности метаболизма белой жировой ткани
- •20.Механизм липолиза в белой жировой ткани: реакции, регуляция, значение
- •23.Подготовительная стадия b-окисления жирных кислот: реакция активации и челночный механизм транспорта жирных кислот через мембрану митохондрий – схема, регуляция.
- •Регуляция скорости β-окисления жк
- •Энергетический баланс окисления насыщенных жк с четным количеством атомов углерода
- •Энергетический баланс окисления ненасыщенных жк с четным количеством атомов углерода
- •Биохимия
- •Окисление глицерина до н2о и со2: схема, энергетический баланс.
- •Окисление тг до н2о и со2: схема, энергетический баланс.
- •Пол: понятие, роль в физиологии и патологии клетки. Перекисное окисление липидов
- •Сро: стадии и факторы инициации, реакции образования активных форм кислорода.
- •Образование активных форм кислорода
- •Аоз: ферментативная, неферментативная, механизмы. Антиоксидантная система
- •1. Ферментативная антиоксидантная система
- •2. Неферментативная антиоксидантная система
- •36. Пальмитилсинтетазный комплекс: структура, субклеточная локализация, функция, регуляция, последовательность реакций одного оборота процесса, энергетический баланс.
- •37. Реакции удлинения – укорочения жирных кислот, субклеточная локализация ферментов.
- •38. Десатурирующие системы жирных кислот: состав, локализация, функции, примеры (образование олеиновой кислоты).
- •39. Взаимосвязь биосинтеза жирных кислот с обменом углеводов и энергетическим обменом.
- •40. Гормональная регуляция биосинтеза жирных кислот и тг – механизмы, значение.
- •41.Реакции биосинтеза тг, тканевые и возрастные особенности, регуляция, значение.(лучше всего написано в красном учебнике стр 392-394,ну это все оттуда полностью)
- •42.Биосинтез холестерина: реакции до мевалоновой кислоты далее, схематично.
- •43.Особенности регуляции в кишечной стенке и других тканях биосинтеза хс; роль гормонов: инсулина, т3,т4, витамина рр.
- •44.Реакции образования и распада эфиров холестерина – роль ахат и гидролазы эхс, особенности тканевого распределения хс и его эфиров, значение.
- •45.Катаболизм хс, тканевые особенности, пути удаления из организма. Лекарственные препараты и пищевые вещества, снижающие содержание хс в крови.
- •Регуляция обмена липидов
- •1. Центральный уровень регуляции липидного обмена
- •3. Клеточный (метаболический) уровень регуляции липидного обмена
- •51. Межорганный уровень регуляции обмена липидов – понятие. Цикл Рендла, механизмы реализации.
- •53. Обмен лпонп, регуляция, значение; роль лпл, апо в-100, е и с2, лпвп
- •Обмен лпнп, регуляция, значение; роль апо в-100, в-клеточных рецепторов, ахат, блэх, лпвп.
- •55. Обмен лпвп, регуляция, значение; роль лхат, апо а и с, других классов лп
- •56.Обмен липидов в энтероцитах
- •4. Моноацилглицероловый путь синтеза тг и фл
- •5. Глицерофосфатный путь синтеза тг и фл
- •Транспорт липидов в организме
- •Нормальные значения холестерина
- •Нормальные значения
- •Обмен хиломикронов
- •Обмен β-липопротеинов
- •Обмен лпвп
- •57.Дислипопротеинемии
- •Абеталипопротеидемия
- •1. Абеталипопротеинемия (синдром Бассена-Корнцвейга)
- •2. Семейная гиперхолестеролемия (гиперлипопротеинемия типа iIа и iIв)
- •Хиломикронемия
- •Гиперхолестеролемия
- •58.Атеросклероз
- •63 Нарушения липидного обмена. Ожирение
- •1. Генетические факторы ожирения
- •2. Психологические факторы в развитии ожирения
- •3. Физическая активность
- •4. Несбалансированное питание, переедание
- •64. Лептин
- •Ожирение: механизмы взаимосвязи с сахарным диабетом и атеросклерозом.
- •Инсулинорезистентность: понятие, биохимические причины и механизмы развития, метаболические нарушения, взаимосвязь с ожирением.
- •Роль кахексина (фно-a) в развитии инсулиновой резистентности и ожирения. Кахексин (фно-)
Особенности метаболизма белой жировой ткани
Энергетический обмен низкий, преимущественно анаэробный, ткань потребляет мало кислорода. Энергия АТФ в основном тратится на транспорт жирных кислот через клеточные мембраны (с участием карнитина).
Белковый обмен низкий, белки синтезируются адипоцитами преимущественно для собственных нужд. На экспорт в жировой ткани синтезируются лептин, белки острой фазы воспаления (α1-кислый гликопротеин, гаптоглобин), компоненты системы комплимента (адипсин, комплемент С3, фактор В), интерлейкины.
Углеводный обмен. Невысокий, преобладает катаболизм. Углеводный обмен в жировой ткани тесно связан с липидным.
Липидный обмен
Жировая ткань стоит на 2 месте по обмену липидов после печени. Здесь происходят реакции липолиза и липогенеза.
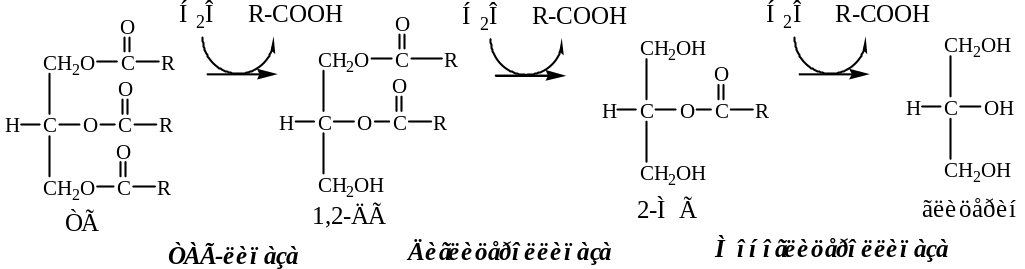
Липогенез. В жировой ткани синтез липидов идет в абсорбтивный период по глицерофосфатному пути. Процесс стимулируется инсулином.
Этапы липогенеза:
1. Под действием инсулина на рибосомах стимулируется синтез ЛПЛ.
2. ЛПЛ выходит из адипоцита и фиксируется на поверхности стенки капилляра с помощью гепарансульфата.
3. ЛПЛ гидролизует ТГ в составе липопротеинов
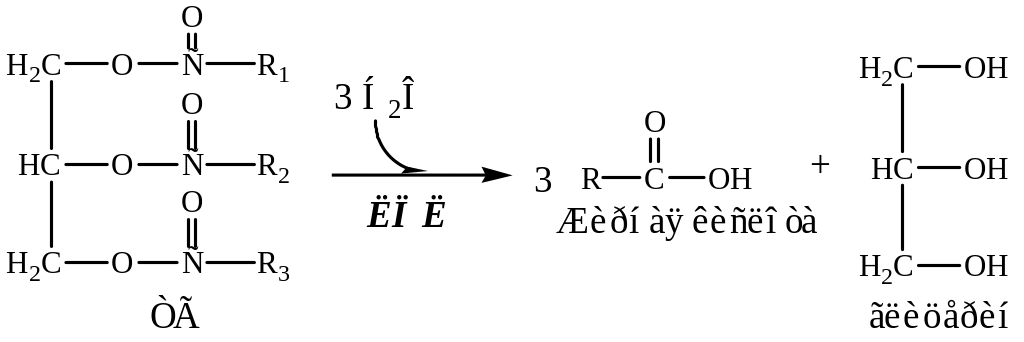
4. Образовавшийся глицерин уноситься кровью в печень.
5. Жирные кислоты из крови транспортируются в адипоцит.
6. Кроме поступающих из вне экзогенных жирных кислот, в адипоците синтезируются жирные кислоты из глюкозы. Процесс стимулируется инсулином.
7. Жирные кислоты в адипоците под действием Ацил-КоА синтетазы превращаются в Ацил-КоА.
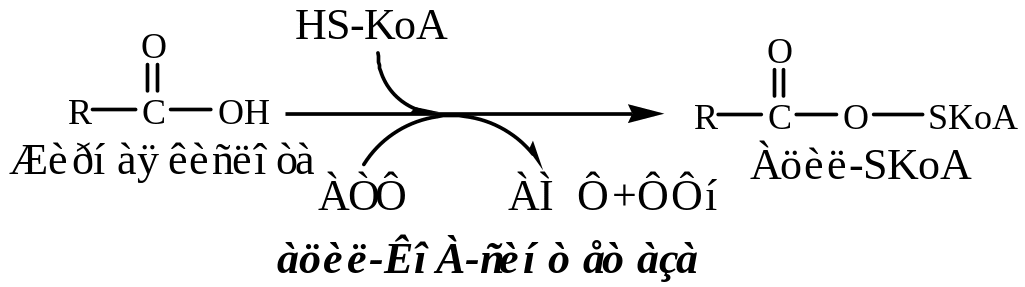
7. Глюкоза поступает в адипоцит с участием ГЛЮТ-4 (активатор инсулин).
8. В адипоците глюкоза вступает в гликолиз с образованием ФДА (активатор инсулин).
9. В цитоплазме ФДА восстанавливается глицерол-ф ДГ до глицерофосфата:
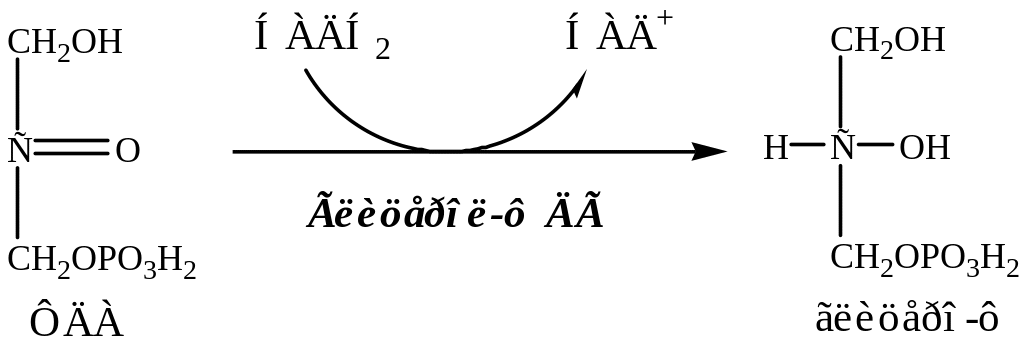
Так как в жировой ткани нет глицерокиназы, глицерофосфат образуется только из глюкозы (не может из глицерина).
10. В митохондриях глицерофосфат под действием глицеролфосфат ацилтрансферазы превращается в лизофосфатид:

11. В митохондриях лизофосфатид под действием лизофосфатид ацилтрансферазы превращается в фосфатид:

11. Фосфатид под действием фосфотидат фосфогидролазы превращается в 1,2-ДГ:

12. 1,2-ДГ под действием ацилтрансферазы превращается в ТГ:

13. Молекулы ТГ объединяются в крупные жировые капли.
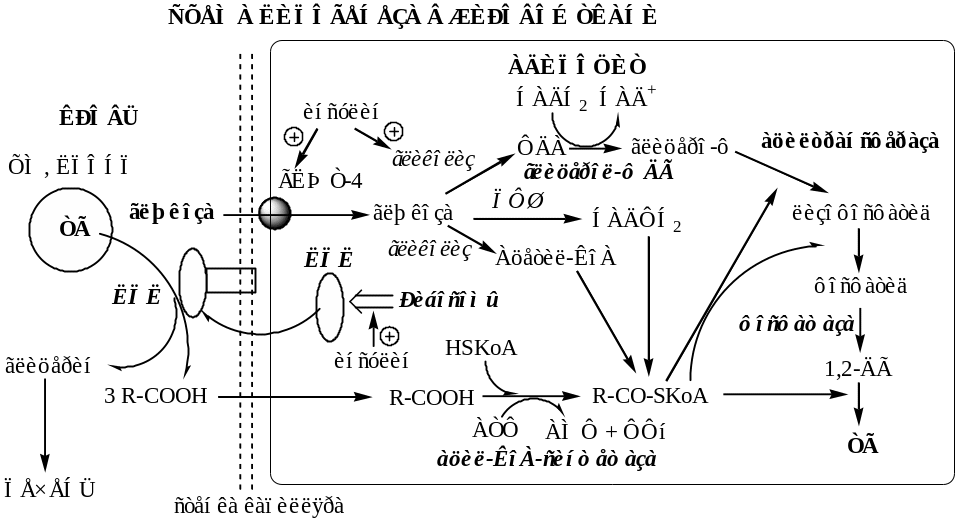
20.Механизм липолиза в белой жировой ткани: реакции, регуляция, значение
2. Липолиз. Липолиз в жировой ткани активируется при дефиците глюкозы в крови (постабсорбционный период, голодание, физическая нагрузка). Процесс стимулируется глюкагоном, адреналином, в меньшей степени СТГ и глюкокортикоидами.
В результате липолиза концентрация свободных жирных кислот в крови возрастает в 2 раза.
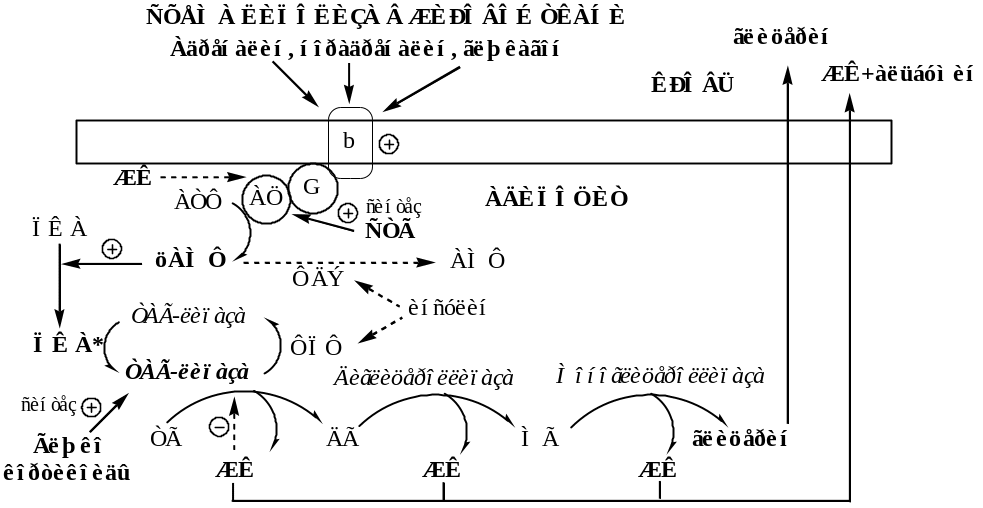
21.Механизмы регуляции липолиза – схема: роль СНС и ПСНС, их b- и a- адренорецепторов, гормонов адреналина, норадреналина, глюкокортикоидов, СТГ, Т3,Т4, инсулина и их внутриклеточных посредников, значение.
См схему Липолиза в жировой ткани!!!(выше)
Система, осуществляющая регуляцию липолиза в жировой клеточке, состоит из рецепторов на плазматической мембране клеток (альфа2-,бета2-и бетаЗ-адренорецепторы), G-белков, и гормон-чувствительной липазы. Альфа2-адренорецепторы ингибируют липолиз, а бета-рацепторы в комплексе с G-белками активируют липолиз. Регуляция липолиза осуществляется через аденилатциклазный механизм - при активации рецепторов происходит перевоплощение аденозинмонофосфата (АМФ) в повторяющийся аденозинмонофосфат (цАМФО, который, в свою очередь, активирует гормон-чувствительную липазу. Позже фермент фосфодиэстераза снова переводит цАМФ в АМФ, заблокируя таким образом липолиз
Мембрана жировой клетки обладает двумя типами рецепторов гормонов. С первыми взаимодействуют катехоламины (адреналин или норадреналин), усиливающие образование цАМФ, а значит, и липолиз, со вторыми взаимодействует инсулин, который снижает концентрацию цАМФ, противодействуя активации аденилатциклазы стимулирующими гормонами, и угнетает таким образом, липолиз. При сахарном диабете инсулиновая недостаточность приводит к бесконтрольной стимуляции внутриклеточной липазы и высвобождению большого количества ЖК из депо. Снижение концентрации глюкозы в крови при голодании подавляет выработку инсулина поджелудочной железой, что вносит свой вклад в усиление липолиза. Мозг постоянно нуждается в глюкозе, которая должна поступать с кровью. При снижении концентрации глюкозы в крови ниже критического уровня могут возникнуть тяжелые необратимые нарушения мозговых функций. При продолжительном голодании (запаса гликогена хватает ненадолго) мозг вынужден переключаться на использование бета-гидроксибутирата, образующегося в печени из жирных кислот. Тем самым запасы жира в организме позволяют сохранить в организме белки мышц, которые используются как последний источник глюкозы при голодании.)
Воздействие стресса (охлаждение, эмоции, нагрузки) мобилизует СЖК из депо либо за счет усиления секреции адреналина надпочечниками, либо способствуя высвобождению норадпреналина при стимуляции симпатических нервов, иннервирующих жировую ткань. Аденилатциклазную активность также повышают: глюкагон, адренокортикотропный гормон (АКТГ), гормон роста, гормоны щитовидной железы, вазопрессин. Тормозят липолиз: салицилаты, никотиновая кислота, РНК.
Такова биохимия углеводно-жирового обмена, эволюционно приспособленная для оптимального использования любых пищевых ресурсов. Преобдодание тех или иных процессов зависит от состава пищи, состояния и потребностей индивидуума и качественного и количественного характера запасов.
22.b-Окисление жирных кислот: кратко - история вопроса, суть процесса, современные представления, значение, тканевые и возрастные особенности.
Механизм окисления печенью жирных кислот был выяснен в начале нашего века. Он сводится к так называемому b-окислению. Окисление жирных кислот происходит до 2-го углеродного атома (b-атома). Получается более короткая жирная кислота и уксусная кислота, которая потом превращается в ацетоуксусную. Ацетоуксусная кислота превращается в ацетон, а новая b-окисленная кислота подвергается окислению с большим трудом. И ацетон и b-окисленная кислота объединяют под одним названием «кетоновые тела». Процесс окисления жирных кислот является важнейшим источником энергии в организме человека. Его значение для энергообеспечения различных органов и тканей (в первую очередь скелетных мышц и миокарда) выше, чем окислительного фосфорилирования глюкозы
Установлено, что окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза.
В 1904 г. Ф. Кнооп (F. Кnоор) выдвинул гипотезу бета-окисления жирных кислот на основании опытов по скармливанию собакам различных жирных кислот, в которых один атом водорода в концевой метильной группе (омега-углеродного атома) был замещен радикалом (С6Н5-).
Ф. Кнооп высказал предположение, что окисление молекулы жирной кислоты в тканях организма происходит в бета-положении. В результате от молекулы жирной кислоты последовательно отщепляются двууглеродные фрагменты со стороны карбоксильной группы.
Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют чётное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов, проходит через стадию масляной кислоты.
После очередного бета-окисления масляная кислота становится ацетоуксусной. Последняя затем гидроли-зуется до двух молекул уксусной кислоты. Теория бета-окисления жирных кислот, предложенная Ф. Кноопом, в значительной мере послужила основой современных представлений о механизме окисления жирных кислот.
