
- •Чем определяется скорость окисления углерода в металле.
- •3.Поверхностное и донное кипение металла
- •За счет чего может протекать реакция обезуглероживания
- •Влияние форфора на свойства стали.
- •Источники фосфора в металле
- •Условия необходимые для дефосфорации.
- •Почему эффективность дефосфорации повышается за счет скачивания шлака?
- •Технология дефосфорации.
- •Чем определяется отрицательное влияние серы?
- •В какие сульфиды связывается сера и почему?
- •Какие сульфиды наиболее опасны?
- •4. Что способствует успешной десульфурации?
- •5.Какими смесями проводится десульфурация
- •Что такое раскисление? Когда его проводят?
- •Окисленность шлака.
- •Методы раскисления.
- •Раскисление алюминием.
- •Что называют растворимостью газов в металле? Предел растворимости.
- •Какие дефекты в сталях вызывает водород?
- •Способы удаления водорода.
- •Влияние азота на свойства стали.
- •Способы выплавки низкоазотистой стали.
- •Что такое чистые стали?
- •Чем определяется влияние неметаллических включений?
- •Виды неметаллических включений. Классификация.
- •Технология производства сталей чистых по неметаллическим включениям.
Раскисление алюминием.
Алюминий является очень сильным раскислителем, его применяют при производстве спокойных сталей. Присадки алюминия в металл позволяют полностью успокоить сталь и избежать возникновения пористости слитков и отливок вследствие окисления углерода и выделения пузырьков окиси углерода.
Раскислительная способность алюминия явилась предметом изучения многими исследователями. Они встретились с рядом трудностей, обусловленных главным образом очень малыми равновесными концентрациями алюминия и кислорода, меньшими, чем допускаемые ошибки анализа. Однако тщательно проведенные исследования ряда авторов позволили достаточно надежно определить термодинамические данные реакции раскисления алюминием. Можно, например, отметить результаты обстоятельного исследования Гоксена и Чипмана. Чистое железо они расплавляли в алундовом тигле из чистой окиси алюминия в индукционной печи при непрерывном пропускании газовой смеси водяного пара и водорода контролируемого состава. Таким образом, указанные авторы применили обычную методику для определения термодинамических данных реакций взаимодействия растворенного в металле раскислителя с водяным паром или, наоборот, продукта раскисления Al2O3 с водородом.
Комбинируя полученные данные с данными реакции взаимодействия водорода с растворенным в металле кислородом получили константу равновесия реакции раскисления алюминием:
Al2O3(тв) = 2[Al] + 3[О],
Исследования показали, что величина произведения /аг/о близка к единице и приближенное значение константы равновесия можно получить, применяя вместо активностей алюминия и кислорода их концентрации. При этом
lg КAl lg [%Al]2 [%О]3 = -64 000/Т + 20,63.
Это уравнение позволяет рассчитать раскислительную способность алюминия. Например, при 1600° С [%Al]2 [%О]3 = 3,5 Х 10-14. Следовательно, уже при содержании в металле 0,005% Al в равновесии содержится всего 0,0011% О, а при содержании 0,01% Al содержание кислорода понижается до 0,0007%. В этих условиях возможность реакции окисления углерода исключается. Описанные результаты исследований относятся к случаю образования глинозема. Однако образование Al2O3 в процессе раскисления алюминием происходит лишь при избытке алюминия в зоне протекания реакции. Как показало изучение продуктов раскисления алюминием, при избытке кислорода может происходить образование герцинита (FeO X Al2O3) или расплава FeO + Al2O3 переменного состава. Образование герцинита может быть описано реакцией:
FeO-Al2O3(тв) = [Fe] + 4 [О] + 2 [Al],
lg K = lg [%O]4 [%Al]2 = -71 730/T + 23,25,
Комплексное
раскислени

Газы в сталях
Что называют растворимостью газов в металле? Предел растворимости.
Температурная зависимость растворимости газов в расплавах
Растворимостью называется его количество, переходящее в раствор с Ме при равновесии с газовой фазой при парциальном давлении 1 атм.
lnS=lnC+∆Hs/2RT
∆Hs=∆Hдисс+∆Hраств+∆Hвзаим
∆Hs-изменение энтальпии при образовании раствора газа в Ме
В зависимости от ∆Hs растворимость повышается или понижается в зависимости от температуры.
Расворимость H в Fe
H может присутствовать в различных формах
-атомарный (расположен по междоузлиям кристаллической решетки)
-атомарный (ковалентный)
-молекулярный (расположен в микропорах и трещинах)
При Тплав в жид.железе раст-ть Н=24,5 ррm, в твердом менее 7.
Коэффициент диффузии при 25С D=7*10-5 см/с2 , что соответствует скорости проникновения 20 мин за час.
1/2Н2(г)=│Н│
Кн=│%Н│/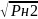
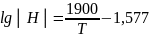
Тогда, при 1873К и давлении Н2=1атм │Н│=0,0027
Зависимость растворения водорода в жид. Fe от температуры определяется энтальпией.
Растворимость азота в железе и стали


Растворимость кислорода в железе и стали


